山西省首例TAVR联合PCI治疗病例报告
2018-05-08李彦红杨志明李俊男秦卫伟边云飞巩书文赫崇平郜玉珍黄爱玲闫慧霞
李彦红,杨志明,闫 丰,李俊男,秦卫伟,边云飞,高 奋,巩书文,赫崇平,郜玉珍,黄爱玲,闫慧霞,李 保
(山西医科大学第二医院心内科,太原 030001;*通讯作者,E-mail:libaoxys@163.com)
主动脉瓣狭窄(aortic valve stenosis,AS)是一种常见的进展性心血管疾病,随着年龄的增加患病率增加,一旦出现症状,预后很差。若不及时干预,患者中位生存期为2-3年[1]。以往重度AS的治疗需心外科开胸进行主动脉瓣置换,手术创伤和风险大,一些高危患者失去手术机会。随着心血管介入技术的不断发展,经导管主动脉瓣置换术(transcatheter aortic valve replacement,TAVR)作为一种微创的高端技术逐步开展,手术创伤小,为一些高危、极高危患者提供了很好的治疗选择。2002年Cribier等[2]实施首例人体TAVR,之后在欧美国家迅速发展。我国首例人体TAVR于2010年10月3日由葛均波等[3]实施,目前我国多省市的多家医院相继开展TAVR,积累了初步经验。我省于2017年12月3日在我院开展首例TAVR联合经皮冠状动脉内介入治疗(PCI)技术,现将病例报告如下。
1 病例介绍
现病史:患者,男性,78岁。主因“剑突下憋痛1年半,加重2月”于2017年11月29日入院。2016年5月开始间断出现活动时剑突下憋痛,伴气短,无大汗、咽部紧缩感、胸背部及左上肢放射痛等症状,持续约10-30 min左右可自行缓解,曾就诊于当地医院,诊断为冠心病,口服阿司匹林、阿托伐他汀等药物治疗,上述症状仍间断发作。近2月上述症状发作频繁,每日1-2次,多于活动时或夜间出现,无夜间阵发性呼吸困难,持续约10-20 min可缓解。
既往史:否认高血压病、糖尿病病史。慢性咳嗽、咳痰30余年。
体格检查:体温36.2 ℃,脉搏60次/min,呼吸18次/min,血压122/80 mmHg,双眼睑无水肿,颈静脉无怒张。双肺呼吸音清,未闻及干湿性啰音。心率60次/min,律齐,主动脉瓣第一听诊区可闻及3/6级收缩期喷射性杂音,向颈部传导。腹平软,肝脾肋下未触及。双下肢无水肿。
辅助检查:经胸超声心动图显示:主动脉瓣呈三窦三叶,瓣膜明显增厚、钙化,瓣环内径约24 mm,瓣口面积约0.77 cm2,收缩期血流速增快,最大流速约452 cm/s,最大压差约90 mmHg,平均压差约51 mmHg,瓣口舒张期可见少量反流,主动脉瓣重度狭窄,左室壁增厚,左室舒张末期内径47 mm,左室射血分数59%。主动脉CTA示:主动脉瓣呈三叶瓣,中度钙化,钙化主要位于无冠窦一侧,左右冠脉可见融合,瓣环及流出道水平可见钙化。瓣环内径21.7 mm×29 mm,周长82 mm,面积512.7 mm2,左室流出道18.8 mm×27.2 mm,窦部34.6 mm×34.7 mm×35.4 mm,窦管交界内径30.3 mm×31.6 mm,升主动脉38.7 mm×43.2 mm,左冠脉开口12.8 mm,右冠脉开口13 mm,左冠开口水平可见瓣叶结构,右冠开口水平未见瓣叶,主动脉全程内径无明显狭窄,全程未见明显动脉硬化及钙化斑块,双下肢动脉内径无狭窄,双侧股动脉穿刺水平未见钙化。冠状动脉造影示:左主干正常;前降支近段狭窄80%-85%,伴充盈缺损,中段狭窄40%-50%(见图1);回旋支中段狭窄50%-60%;右冠脉可见斑块。
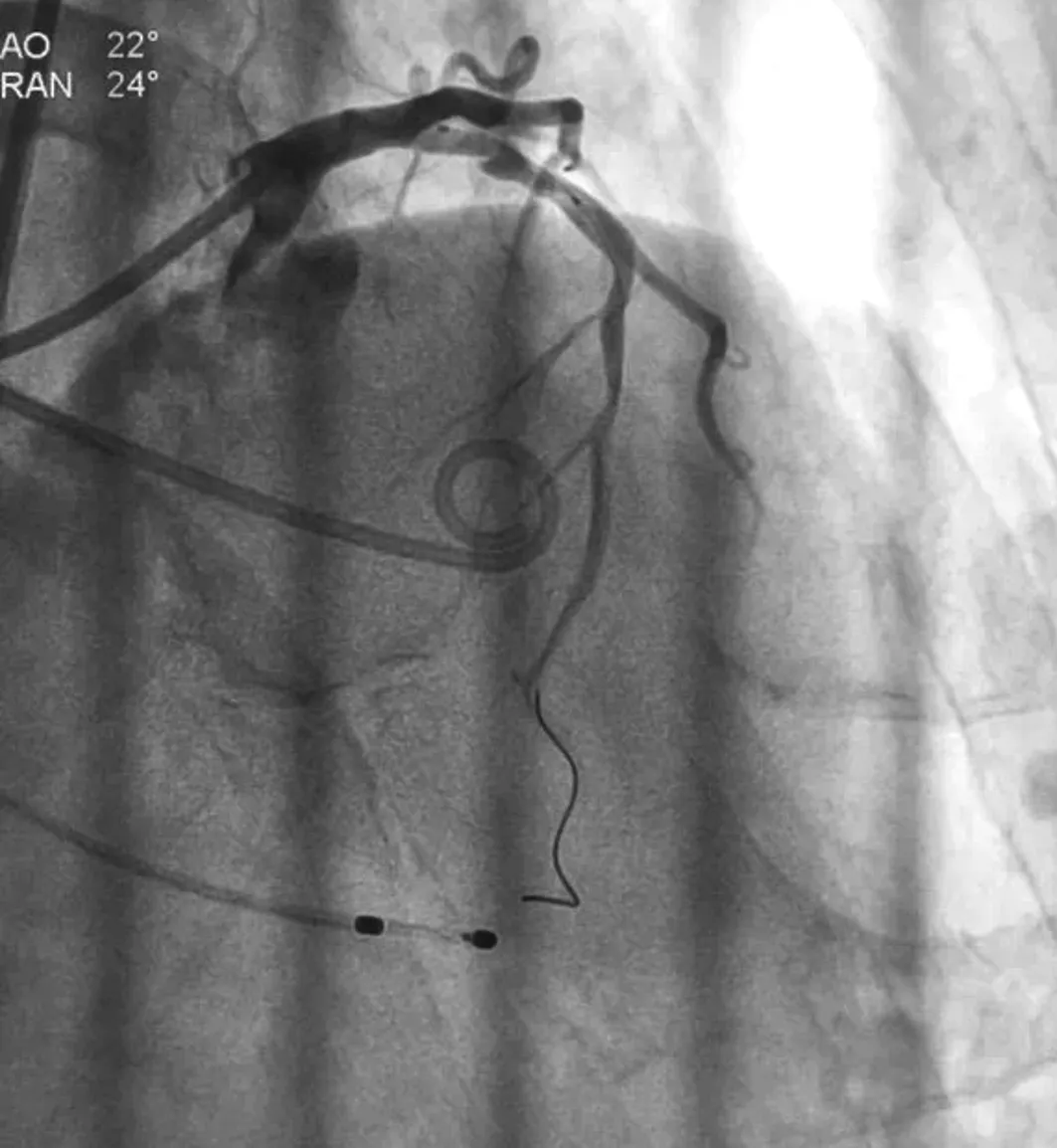
图1 PCI术前:前降支近段狭窄80%-85%,伴充盈缺损
入院诊断:重度主动脉瓣钙化性狭窄,心功能Ⅲ级,冠心病,不稳定型心绞痛。
治疗评估:①老年重度主动脉瓣钙化性狭窄;②超声示跨主动脉瓣血流速度≥4.0 m/s,跨主动脉瓣压力差≥40 mmHg,主动脉瓣口面积<0.8 cm2;③剑突下憋痛、气短症状考虑与重度主动脉瓣狭窄有关;④NYHA Ⅱ级;⑤解剖上为三叶式主动脉瓣;⑥纠正重度主动脉瓣狭窄后的预期寿命超过1年;⑦同时合并冠心病,外科手术风险大,患者及家属不同意行外科治疗,符合经导管主动脉瓣置换术(TAVR)绝对适应证,因此决定行TAVR,TAVR术前行前降支支架植入治疗。
术前准备:予阿司匹林、氯吡格雷双联抗血小板治疗,阿托伐他汀稳定斑块及纠正心功能等对症治疗;科室内讨论制定详细治疗计划;组织麻醉科、心胸外科、血管外科、超声科、手术室、呼吸科、输血科等全院相关科室会诊,就术前、术中、术后可能出现的问题制定详细应对措施及应急预案。
手术经过:根据主动脉CTA,选择左侧股动脉为主入路。全麻后消毒铺巾,分别于右侧颈内静脉行中心静脉置管、置入6F动脉鞘放置临时起搏器于右室心尖部。穿刺右侧股动脉置入7F鞘管,JR4翻山造影指导穿刺左侧股动脉,置入5F鞘管,proglide预缝合,更换10F鞘管,Amplatzer L2导管指引下直头泥鳅导丝跨瓣,沿导丝送入Amplatzer L2导管至左心室,测主动脉和左心室内的收缩、舒张和平均压分别为171/5/55和142/-7/53 mmHg。退出Amplatzer L2导管,交换为猪尾导管。将远端预塑形的super stiff导丝送入左心室。退出6F鞘管,在超硬导丝引导下缓慢将20F引导鞘管送入,鞘管内注入肝素6 000 U。经右侧股动脉7F鞘管导入EBU3.5指引导管至左冠开口,送入BMW(品牌)导丝至前降支远端,近端狭窄处予2.5 mm×16 mm球囊欲扩至14 atm(标准大气压),后置入3.5 mm×18 mm支架(FirBird2)1枚,14 atm释放,支架贴壁良好,无夹层和残余狭窄,TIMI血流3级(见图2)。经右侧股动脉导入6F Pigtail至主动脉窦底,沿super stiff导丝导入NEMED 40 mm×23 mm球囊至主动脉瓣处,180次/min快速起搏下球囊扩张,后退出球囊,经20 F鞘管送入Venus-A 26 mm瓣膜输送系统至主动脉瓣环处,行主动脉根部造影,调整输送鞘位置,使瓣膜的深度在主脉瓣瓣环水平下4 mm,然后固定输送鞘,120次/min快速起搏下开始释放瓣膜(见图3)。当确认瓣膜处于理想位置后,完全释放瓣膜(见图4)。复查主动脉造影示瓣膜位置满意,轻微瓣周漏,冠状动脉开口血流未受影响。经胸超声心动图显示瓣膜工作状态良好,轻微瓣周漏。测主动脉压力106/56 mmHg,跨主动脉瓣跨瓣压8 mmHg。撤出super stiff导丝,回撤猪尾导管至双侧股动脉分叉处,造影提示双侧股动脉未见渗血及夹层。左侧股动脉缝合,右侧股动脉闭合止血,留置临时起搏器。患者苏醒后拔除气管插管,安返CCU病房。

图2 前降支近段PCI术后
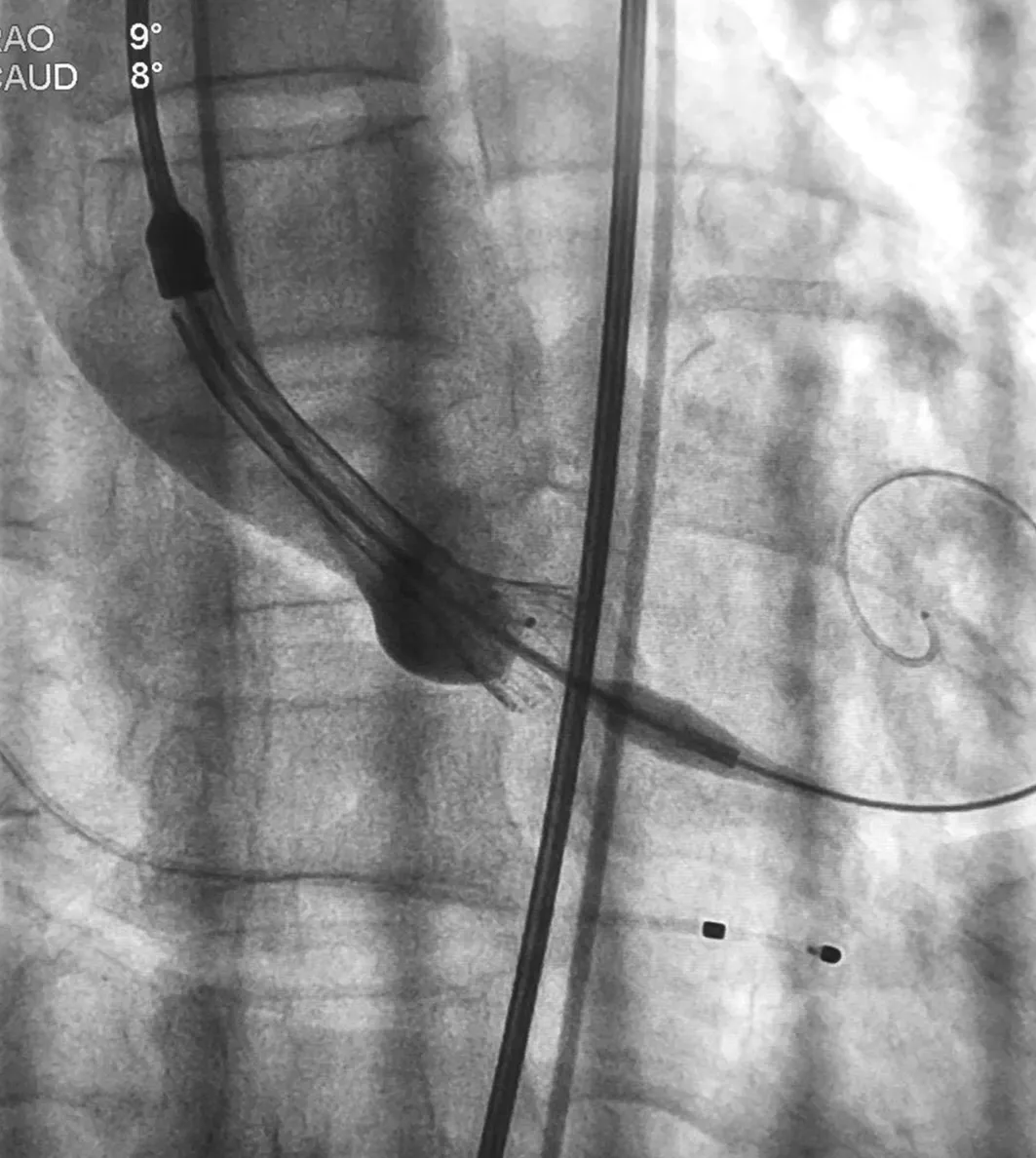
图3 TAVR术中120次/min快速起搏下开始释放瓣膜
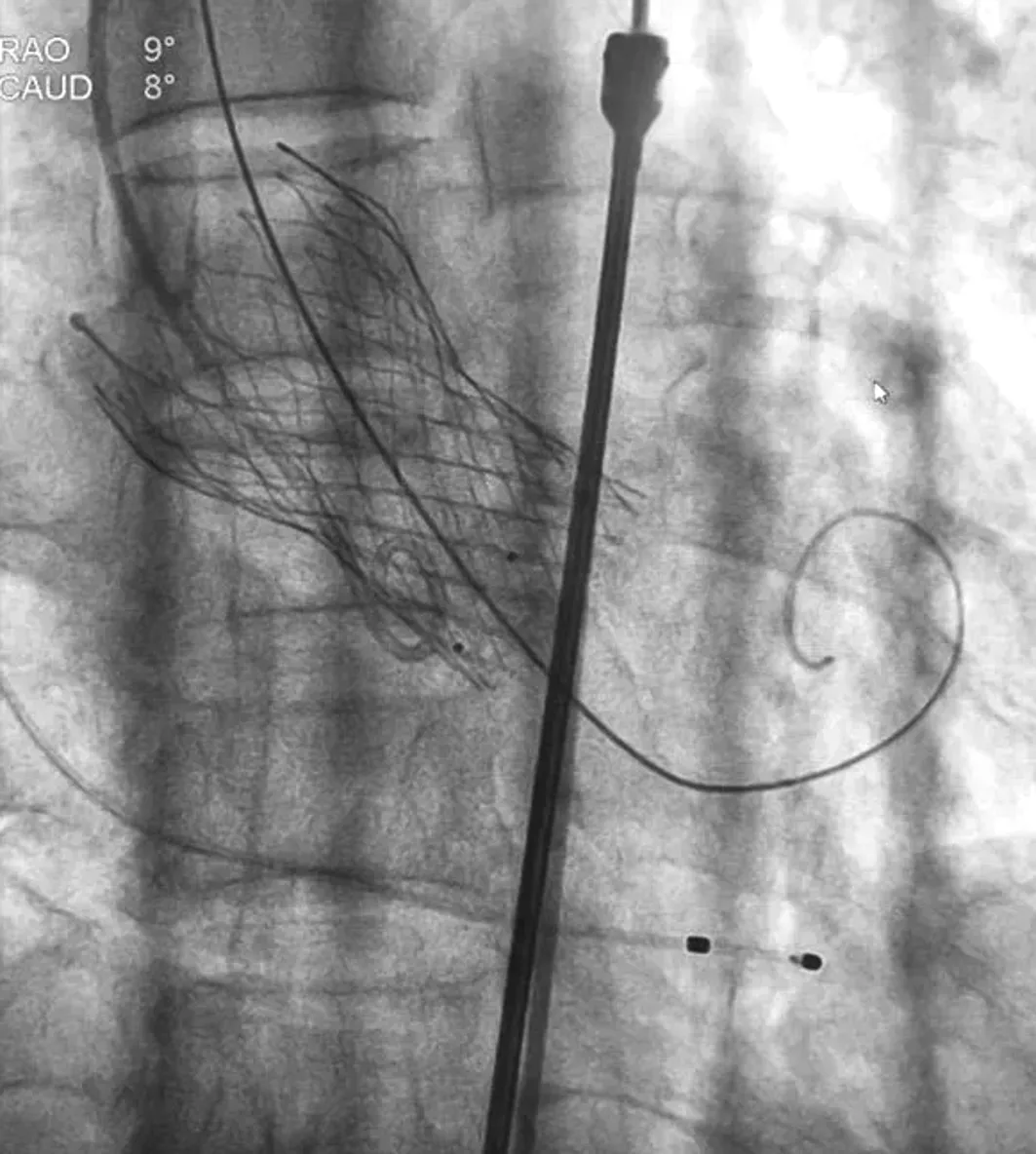
图4 TAVR术中瓣膜完全释放
术后病情:术后密切监测生命体征,严格容量管理,血液动力学稳定,无不适症状。术后第3天出现阵发性房颤,予胺碘酮转复成功,于第4天上午出现一过性黑蒙症状,心电图示窦性停搏,最长RR间歇2.94 s,完全性左束支传导阻滞(见图5),停用胺碘酮,给予地塞米松10 mg治疗后于当天下午完全性左束支传导阻滞逐渐消失(见图6),未再出现窦性停搏。术后复查超声心动图提示轻微瓣周漏,术后8 d康复出院。围手术期未发生不良心脑血管事件。
2 讨论
钙化性主动脉瓣病变又称主动脉瓣退行性变,是一组以主动脉瓣及其周围组织纤维化、硬化、钙盐沉积为主要改变的一种退行性、慢性进行性疾病,其中以主动脉瓣狭窄(AS)为主要功能损害。随着年龄的增加患病率增加。MESA(The Multi-Ethnic Study of Atherosclerosis)研究显示主动脉瓣钙化的增长随年龄增加[4]。美国2013年的一项研究显示,85岁以上人群的AS患病率达8.2%,且AS的发生率与传统的危险因素无关[5]。我国的一项对北京老年人调查研究显示[6],超声心动图检查发现瓣膜钙化发病率13.41%,年龄>75岁人群的中、重度AS患病率约2.8%,而>85岁患者的患病率接近8%。且随年龄增加,因AS导致的死亡率增加。

图5 TAVR术后第4天上午心电图:窦性停搏,最长RR间歇2.94 s,完全性左束支传导阻滞
以往重度主动脉瓣狭窄的治疗需外科开胸进行主动脉瓣置换,手术创伤和风险大。经导管主动脉瓣置换术(transcatheter aortic valve replacement,TAVR)是经导管将组装好的人工主动脉瓣置入,替代原有病变主动脉瓣,在功能上完成主动脉瓣置换的一种微创手术[7]。具有不停跳、创伤小、失血少等特点,已经成为极高危或无法耐受经胸主动脉瓣置换术患者的公认替代治疗。TAVR无直视术野,对手术指征把握、移植物尺寸的选择及术中操作依赖术前影像学评估,故对术者的技术要求极高[8]。
该例患者高龄、同时存在重度主动脉瓣狭窄和严重冠脉狭窄病变,按照TAVR手术原则,TAVR术前需处理冠脉病变。研究显示:对于高龄患者实施PCI安全、有效,可增加心肌血供,提高生存率,改善生活质量[9]。因此,在TAVR术前行前降支PCI,术后血流达TIMI 3级,无并发症发生。
目前我国TAVR技术尚处于初步阶段,术前需严格进行临床评估和影像学评估,临床评估包括:①是否需瓣膜置换;②是否为外科手术禁忌或高危;③有无TAVR手术禁忌证。影像学评估的重点为主动脉瓣膜、主动脉瓣环、升主动脉及外周动脉解剖情况,以判断是否适合TAVR及选择瓣膜型号。目前国内TAVR多使用自膨式主动脉瓣膜,一般解剖要求为:①入路血管最窄内径≥6 mm;②主动脉瓣环内径、主动脉窦宽及窦高、升主动脉内径符合瓣膜要求;③瓣环平面与躯体横断面角度合适;④冠状动脉开口高度>10 mm。该患者经严格术前评估,适合行TAVR,并选择Venus-A 26 mm瓣膜置入。
TAVR术后最常见的并发症为左、右束支传导阻滞和房室传导阻滞,90%以上的传导阻滞发生在术后1周内[7],该例患者术后第3天出现阵发性房颤,使用胺碘酮治疗,于术后第4天出现完全性左束支传导阻滞,停用胺碘酮、予地塞米松10 mg治疗后,完全性左束支传导阻滞消失,除考虑胺碘酮作用外,尚不能除外与TAVR手术有关。大多数患者TAVR术后会有轻微瓣周漏,但随着时间的延长可能减轻[7]。术中避免将瓣膜支架置入太深,避免选择直径过大的瓣膜,选择适当的、内径较小的扩张球囊,可减少上述并发症的发生。
TAVR联合PCI治疗为我省首例,此项高难度技术的顺利开展标志着我省心血管介入治疗水平跃上了一个新的台阶,将为该类患者提供更多的治疗选择。
参考文献:
[1] Leon MB,Smith CR,Mack M,etal.Transcatheter aortic valve implantation for aortic stenosis in patients who cannot undergo surgery[J].N Ensl J Med,2010,363:1597-1607.
[2] Cribier A,Ehchaninoff H,Bash A,etal.Percutaneous transcatheter implantation of all aortic valve prosthesis for calcifie aortic stenosis:first human case description[J].Circulation,2002,106:3006-3008.
[3] 葛均波,周达新,潘文志,等.经皮主动脉瓣植入术一例报道附操作要点[J].中国介入心脏病学杂志,2010,18(5):243-246.
[4] Owens DS, Katz R, Takasu J,etal. Incidence and progression of aortic valve calcium in the Multi-ethnic Study of Atherosclerosis(MESA) [J]. Am J Cardiol, 2010, 105: 701-708.
[5] Leibowitz D, Stessman J, Jacobs JM,etal. Prevalence and prognosis of aortic valve disease in subjects older than 85 years of age[J]. Am J Cardiol, 2013, 112: 395-399.
[6] 李喆,叶蕴青,王墨扬,等.75岁以上钙化性主动脉瓣狭窄患者影响其预后的危险因素分析[J].中国循环杂志,2016,31(8):780-784.
[7] 中国医师协会心血管内科医师分会结构性心脏病专业委员会,中华医学会心血管病学分会结构性心脏病学组.经导管主动脉瓣置换术中国专家共识[J].中国介入心脏病学杂志,2015,23(12):661-665.
[8] 张昊,陆清声,景在平.TAVR术前评估的介绍与进展[J].中华胸心血管外科杂志,2017,33(10):623-626.
[9] 苏显明,何亚军,张玮,等.高龄老年急性心肌梗死患者PCI治疗的安全性分析[J].山西医科大学学报,2010,41(2):142-144.
