柔嫩艾美耳球虫伴侣蛋白TCP-1亚基α的特性和功能初步分析
2018-04-25赵其平朱顺海赵宗平韩红玉
陈 婷,黄 兵,赵其平,董 辉,朱顺海,赵宗平,吕 凌,严 茗,韩红玉
(中国农业科学院上海兽医研究所 农业部动物寄生虫学重点实验室,上海 200241)
鸡球虫病是由艾美耳球虫引起的一种危害严重的全球性肠道寄生虫病,其中危害最大的是柔嫩艾美耳球虫(Eimeria tenella),常造成出血性肠炎[1],每年给全世界范围内的家禽养殖业造成的直接经济损失可达5亿英镑[2]。虽然对其防治的研究已经历了半个多世纪,但对鸡球虫病的主要防治方法仍然是利用抗球虫药进行药物预防。用于鸡球虫病防治的药物主要分为两大类:一类是离子载体类药物,包括莫能霉素、马杜拉霉素等;另一类是化学合成类药物,主要有磺胺类、酰胺类、吡啶类等。然而,调查显示随着药物的广泛使用,国内外鸡球虫对使用的大多数药物普遍出现了严重的耐药性问题[3-6],给养鸡业造成了巨大的经济损失。对其他寄生虫或细菌耐药性的研究发现,耐药株会出现部分基因突变或蛋白结构改变,如基因的上调或下调表达[7-9]、单核苷酸多态性[10]、基因的甲基化修饰[11]等,导致基因的表达发生进一步变化。对耐药性产生机制的研究很多,有报道显示一些物种或组织的耐药性与蛋白结构相关,如四个半LIM 结构域蛋白1是肝癌细胞的紫杉醇耐药相关基因[12],白念珠菌HSP90的部分关键氨基酸位点与其对抗菌药物产生耐药性有一定关系[13],而人的骨膜蛋白与人非小细胞肺癌顺铂耐药有关[14]。但关于球虫耐药性产生的分子机制却知之甚少。
为研究球虫耐药株产生的分子机制,本实验室前期成功诱导出柔嫩艾美耳球虫马杜拉霉素耐药株(MRR)和地克珠利耐药株(DZR)[15],并对MRR、DZR和柔嫩艾美耳球虫敏感株(DS)进行转录组测序,获得了2个耐药株和敏感株的差异表达基因,发现伴侣蛋白TCP-1环状复合物(T-complex protein 1 subunit alpha,CCT)亚基α(EtTCP-1α)在2个耐药株的mRNA转录明显高于敏感株。本文以柔嫩艾美耳球虫孢子化卵囊cDNA第一链为模板,PCR扩增获得EtTCP-1α基因的CDS,在原核表达系统成功表达该蛋白,分析了EtTCP-1α基因在耐药株和敏感株的表达情况,并对其分子特性和功能进行了初步分析。
1 材料和方法
1.1 实验动物、虫体和细胞 三黄鸡购自上海市奉贤区,在无球虫环境下饲养;新西兰大白兔购自上海市松江区松联动物实验场;BALB/C小鼠购自斯莱克实验动物有限公司;柔嫩艾美耳球虫上海株(敏感株)(资源号:CAAS 2111160721)于20世纪80年代分离自上海市某鸡场[16];地克珠利耐药株(资源号:CAAS 2111160821)和马杜拉霉素耐药株(资源号:CAAS 2111160921)均由敏感株通过药物诱导产生[15],保存在本实验室;经2周龄无球虫幼鸡大量繁殖,按文献[17-20]获得纯化的未孢子化卵囊(unsporulated oocysts,UO)、孢子化卵囊(sporulated oocysts,SO)、子孢子(sporozoites,SZ)和第二代裂殖子(second-generation,SM),鸡胚成纤维细胞系(chicken embryo fibroblasts,DF-1)[21]由中国农业科学院上海兽医研究所动物寄生虫病研究室保存提供。
1.2 载体和菌株 大肠杆菌TOP10、BL21购自天根生化科技(北京)有限公司,pGEM-T-easy 载体购自美国Promega公司。
1.3 主要试剂与试剂盒 DL2000(DNA Maker)、DNA胶回收试剂盒、质粒提取试剂盒、2×TaqPCR MasterMix购自上海天根生物技术有限公司;Trizol、SYBR Green、限制性内切酶EcoR I和Hind III均购于宝生物工程(大连)有限公司;T4 DNA连接酶购自美国Promega公司;DMEM、胎牛血清(Fetal bovine serum,FBS)、双抗购自美国Gibco公司;Western及IP细胞裂解液、DAPI、HIS标签抗体购自上海碧云天生物技术有限公司;FITC标记抗兔IgG、抗鼠IgG购自Jackson Immuno Research公司;PageRulerTMPrestained protein ladder购自美国Thermo scientific公司;M-MLV Reverse Transcriptase购自美国Invitrogen公司。
1.4 总RNA提取和基因的扩增 按照Trizol试剂的说明书进行操作,提取孢子化卵囊的总RNA,经1%核酸凝胶电泳及紫外分光光度计检测所提总RNA的浓度和纯度。用M-MLV反转录试剂盒和Oligo dT引物反转录得到cDNA第一链,利用Primer Premier 5.0软件设计PCR引物,PCR扩增得到TCP-1亚基α。上游引物为5'-GCGAATTCATGTGTCTGAAGTACTTCG-3'(含EcoR I酶切位点),下游引物为5'-GCAAGCT TCTATTCTCTTTCCTTGCG-3'(含Hind III酶切位点),PCR反应总体积为20 μL。用连接酶将纯化的目的片段与pGEM-T-easy载体连接,连接产物转化至E. coliTOP10感受态细胞中,37℃过夜培养后挑取白色单菌落,PCR鉴定后测序。
1.5 生物信息学分析 通过柔嫩艾美耳球虫基因序列(http://www.genedb.org/Homepage/Etenella)和NCBI上的BLAST程序(http://www.ncbi.nlm.nih.gov/BLAST/)对TCP-1亚基α基因序列进行比对和分析,利用ProtParam工具(http://cn.expasy.org/tools/protparam. html)计算编码蛋白质的理论分子量、等电点、氨基酸组成等。利用TMHMM服务器(http://www.cbs.dtu.dk/services/TMHMM-2.0/)分析编码蛋白有无跨膜结构。利用SignalP3.0在线分析软件(www.cbs.dtu.dk/services/SignalP)分析编码蛋白有无信号肽。采用Motifscan(http://myhits.isb-sib.ch/cgi-bin/motifscan)寻找氨基酸序列的功能结构域,了解目的蛋白可能的功能。
1.6 重组蛋白的表达、纯化及抗体的制备 用EcoR I和Hind III对测序正确的重组质粒pGEM-EtTCP-1α和pET-28a载体双酶切,4℃连接过夜后转化E. coliTOP10感受态细胞,PCR鉴定正确后送公司测序。用质粒小提试剂盒提取测序正确的重组质粒,命名为pET-EtTCP-1α,转化E. coliBL21进行诱导表达并超声,电泳确定重组蛋白的表达形式。对得到的包涵体重组蛋白进行切胶纯化,12% SDS-PAGE鉴定纯度,经BCA蛋白浓度测定试剂盒测定浓度后-20℃保存备用。
将重组蛋白与弗氏完全佐剂乳化,用背部皮下免疫的方法对2月龄兔子和6周龄小鼠进行初免,剂量分别为0.2 mg/只和0.05 mg/只。10 d后用弗氏不完全佐剂乳化的等量重组蛋白对动物进行4次加强免疫,每次间隔10 d。最后一次免疫后5 d收集动物血液,37℃放置2 h,4℃放置过夜,3000×g离心5 min,将血清分装并保存于-20℃。
1.7 实时荧光定量PCR(real-time fluorescence qPCR) 为研究DS、DZR和MRR的TCP-1亚基α基因的转录水平差异,提取3个虫株总RNA,分别对其去除基因组DNA、RNA纯化、反转录和cDNA产物纯化得到模板。上游引物为5'-AGTTGGAGACTGGGATTACATTTTC- 3',下游引物为5'- CGCCAGAGTCTTCGGCACCACCAAA-3'。并用18S RNA作为内参[22,23],其上游引物为5'-TGTAGTGGAGTCTTGGTGATTC-3',下游引物为5'-CCTGCTGCCTTCCTTAGATG-3',每个反应进行3次重复,用2-ΔΔCt方法计算相对表达结果[24]。并用同样的方法对TCP-1亚基α基因在虫体不同阶段的转录水平进行分析。
1.8 Western blot 重组蛋白进行SDS-PAGE,转移至PVDF膜上,5%脱脂奶粉4℃过夜封闭,用PBS洗3次,每次5 min,分别用抗子孢子血清(1∶100稀释)、HIS单抗(1∶2000稀释)和兔IgG作为一抗37℃孵育2 h,PBS洗3次后,用IRDye® 680RD驴抗鼠IgG或IRDye® 680CW羊抗兔IgG(1∶10 000稀释)避光孵育1 h,PBST洗5次后,用双色红外激光成像系统扫描。
用上述同样的方法对敏感株和耐药株TCP-1亚基α蛋白表达情况、虫体不同发育阶段表达情况进行分析。分别取适量DS、DZR、MRR及UO、SO、SZ、SM虫体,重悬于0.5 mL细胞裂解液中,加入蛋白酶抑制剂使其终浓度为1%,加入玻璃珠,放于旋涡振荡器上震动60 min,其中每震动8 min,冰浴2 min。用SDS-PAGE检测蛋白提取情况,用BCA测定各虫体蛋白浓度。将3个虫株(DS、DZR和MRR)和不同发育阶段(UO、SO、SZ和SM)的虫体蛋白进行Western blot,其中,一抗为TCP-1亚基α抗鼠血清,同时用α-tubulin单克隆抗体作为内参。
1.9 间接免疫荧光实验检测TCP-1亚基α蛋白在虫体内的分布 将细胞爬片放入6孔板内,每孔接种20万DF-1细胞,并在37℃、5% CO2培养箱中过夜培养。将新鲜提取的子孢子重悬于完全培养基,37℃孵育2 h,以1∶1比例接入细胞[21]。分别在子孢子入侵细胞后2、24、48、60、72、84 h各取出一个细胞板,4%多聚甲醛室温固定35 min,PBS洗3次,每次5 min;1% Triton X-100室温通透20 min,PBS清洗后用2%BSA 4℃封闭过夜;1∶100稀释的TCP-1亚基α蛋白抗体为一抗37℃孵育2 h,彻底清洗除去残留一抗,用1∶500稀释的FITC标记的羊抗兔IgG避光标记1 h;10 μg/mL DAPI避光标记20 min后,将细胞爬片置于滴有60 μL抗荧光淬灭剂的载玻片上,用荧光显微镜观察。用同样的方法同步处理未入侵细胞的子孢子和裂殖子。
2 结果
2.1 EtTCP-1α基因的克隆和生物信息学分析 用柔嫩艾美耳球虫敏感株孢子化卵囊提取的总RNA反转录得到的cDNA第一链为模板进行PCR扩增,凝胶电泳显示在预期大小位置出现条带。目的阶段与pGEM-T-easy载体连接转化测序后,筛选阳性克隆,并对阳性克隆进行序列测定及生物信息学分析。经BLAST比对,该序列与已知柔嫩艾美耳球虫TCP-1α基因(GenBank登录号:XM_013375671.1)的同源性达100%,与毒害艾美耳球虫(E. necatrix)TCP-1亚基α基因(GenBank登录号:XM_013584691.1)的相似率达88%。表明成功克隆获得了柔嫩艾美耳球虫TCP-1α基因,将该基因命名为EtTCP-1α。
序列分析显示该序列长度为843 bp,编码280个氨基酸,预测等电点为5.3。该基因编码的蛋白无跨膜结构域,无信号肽。蛋白质结构预测结果(图1)表明,该蛋白质含有1个cAMP和cGMP依赖的蛋白激酶磷酸化位点、4个酪蛋白激酶II磷酸化位点、4个N-豆蔻酰化位点、1个磷酸化位点、1个酪氨酸激酶磷酸化位点、1个分子伴侣分子TCP-1标签2位点、1个4Fe-4S铁氧还蛋白型硫铁结合域位点和3个TCP-1/cpn60分子伴侣家族位点。BLAST显示该蛋白含有分子伴侣蛋白超家族结构域,与EtTCP-1α蛋白同源性为100%,与毒害艾美耳球虫、卡宴环孢子虫(Cyclospora cayetanensis)、堆型艾美耳球虫(E.acervulina)、犬新孢子虫(Neospora caninum)的TCP-1/cpn60分子伴侣家族蛋白的同源性分别为85%、81%、80%和63%, 推测该蛋白属于TCP-1/cpn60分子伴侣家族。
2.2 重组蛋白的表达、纯化和多克隆抗体的制备 经0.1% IPTG、37℃诱导8 h后获得了重组蛋白His-EtTCP-1α(rEtTCP-1α),且该重组蛋白主要以包涵体形式表达。纯化后经SDS-PAGE测定,表达的蛋白分子量大约为30 kDa,与预测结果一致。
Western blots检测重组蛋白的免疫原性结果见图2。纯化的蛋白分别可以与子孢子抗兔血清、HIS标签抗体产生单一荧光条带,但是与正常兔IgG没有产生荧光条带,表明不与正常兔IgG发生反应。结果说明该重组蛋白具有良好的免疫原性和反应原性。
2.3 3个虫株TCP-1亚基α基因的转录和表达 利用qPCR方法对柔嫩艾美耳球虫DS、DZR和MRR的TCP-1亚基α基因的mRNA转录水平进行分析。结果显示,与敏感株相比,该基因在2个耐药株mRNA的转录上调(图3A)。同样,Western blot结果显示EtTCP-1α蛋白在2个耐药株(MRR和DZR)的表达明显高于敏感株(图3B)。提示EtTCP-1α可能与球虫耐药性产生有关。
2.4 柔嫩艾美耳球虫不同发育阶段TCP-1亚基α基因的转录和表达 利用qPCR对EtTCP-1α在柔嫩艾美耳球虫不同发育阶段(UO、SO、SZ、SM)mRNA的转录水平进行检测。结果显示,EtTCP-1α在4个不同发育阶段mRNA的转录水平不同,转录水平由高到底依次:SM、UO、SO、SZ,见图4A。Western blot检测该蛋白在4个不同发育阶段的翻译水平表达量由高到低依次:SM、UO、SO、SZ,与mRNA转录水平一致,见图4B。此结果可作为检测球虫耐药性时球虫发育阶段选择的依据。

图1 TCP-1亚基α基因cDNA核苷酸序列及其氨基酸序列的生物信息学分析Fig. 1 Bioinformatic analysis of EtTCP-1α cDNA and deduced amino acids
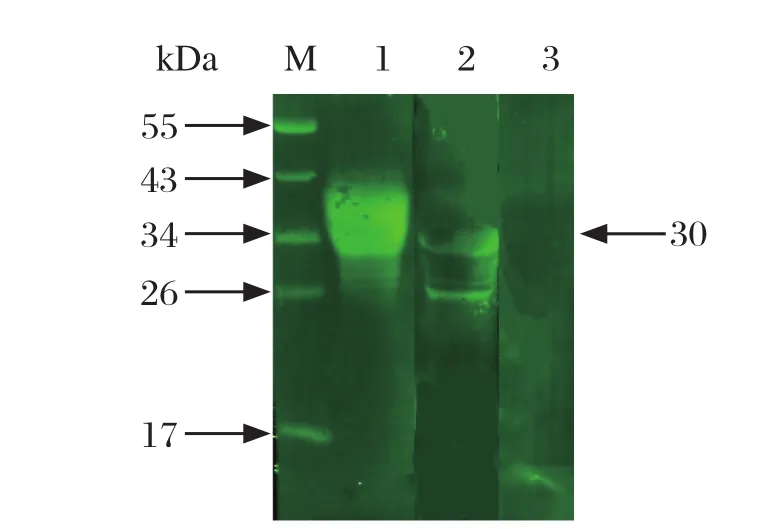
图2 TCP-1亚基α蛋白抗体的免疫源性分析Fig. 2 Immunogenicity of TCP-1 subunit α

图3 柔嫩艾美耳球虫敏感株和耐药株TCP-1亚基α基因差异表达情况Fig. 3 Transcription and protein levels of TCP-1 subunit α in different strains of E. tenella
2.5 间接免疫荧光实验 用抗重组蛋白(rEtTCP-1α)多抗血清孵育子孢子入侵DF-1细胞后不同时间段的虫体、纯化的子孢子和第二代裂殖子,通过荧光显微镜可以看到在子孢子和第二代裂殖子体内,EtTCP-1α主要分布于子孢子(图5A)和第二代裂殖子(图5B)的表面,当子孢子入侵DF-1细胞2 h后,该蛋白也主要位于虫体表面(图5C);当子孢子入侵DF-1细胞24 h后,该蛋白分布于除后端折光体外的整个虫体(图5D),且荧光强度增强;当虫体在细胞内进一步发育为未成熟裂殖体(48 h和60 h)和成熟裂殖体(72 h和84 h),该蛋白位于整个虫体(图5E~H),且荧光强度增强。表明EtTCP-1α在柔嫩艾美耳球虫裂殖体阶段表达量上升。
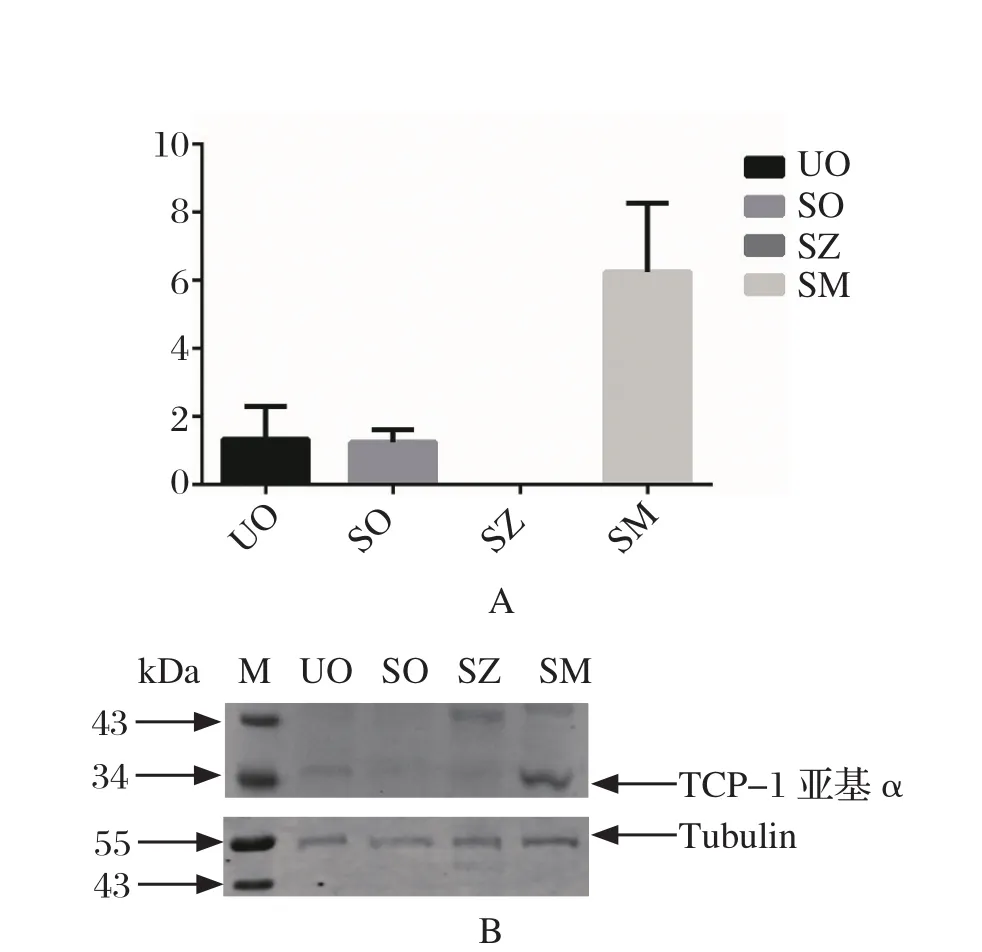
图4 柔嫩艾美耳球虫发育不同阶段TCP-1亚基α基因差异表达情况Fig. 4 TCP-1 subunit α expression at different developmental stages of E. tenella
3 讨论
了解球虫耐药性产生的机制,对球虫耐药性的检测和球虫病防治具有至关重要的意义。实验室前期通过转录组测序分析,显示EtTCP-1α基因为柔嫩艾美耳球虫耐药株和敏感株差异表达基因,表现为耐药株上调表达(log2Ratio(DZR/DS)为4.24,log2Ratio(MRR/DS)为3.28)。本实验成功克隆出柔嫩艾美耳球虫TCP-1α基因,对其进行的生物信息学分析表明,该基因的核苷酸序列与EtTCP-1α基因序列100%同源,与毒害艾美耳球虫TCP-1亚基α基因也具有较高相似性,表明该基因在艾美耳属中具有一定的保守性。蛋白BLAST显示该序列与众多原虫的该基因蛋白序列具有较高相似性,属于TCP-1/cpn60分子伴侣家族,可促进生物大分子的折叠、组装、转运及降解[25],推测EtTCP-1α可能协助柔嫩艾美耳球虫虫体蛋白翻译后的折叠和蛋白正常功能的发挥。

图5 间接免疫荧光实验检测TCP-1亚基α基因在虫体入侵DF-1细胞时的分布Fig. 5 Localization of TCP-1 subunit α in infected DF-1 cells by indirect immuno fl uorescence
曾有研究表明,有些物种耐药性的产生与蛋白的表达差异有关。如胡文霞[14]发现,在非小细胞肺癌顺铂耐药株中骨膜蛋白表达量升高。同样,研究者在对疟原虫的耐药性研究中,发现二氢青蒿素处理的伯氏疟原虫(Plasmodium berghei)和恶性疟原虫(plasmodium falciparum)的滋养体中核糖体蛋白基因显著下调[26]。在对杜氏利什曼原虫(Leishmania donovani)耐药性研究时,发现富含半胱氨酸的蛋白在具有葡萄糖酸锑抗性的杜氏利什曼原虫的虫株中过表达[27]。在本实验中,qPCR实验和Western blot实验检测了柔嫩艾美耳球虫敏感株、地克珠利耐药株、马杜拉霉素耐药株体内TCP-1亚基α的表达情况,结果表明,这三种虫株体内均有TCP-1亚基α的表达,但其表达水平不同;与敏感株相比,TCP-1亚基α基因在地克珠利耐药株、马杜拉霉素耐药株的的mRNA转录水平分别上调3倍和2倍,且蛋白表达在2个耐药株都上调,该结果与转录组测序的结果相吻合,表明TCP-1亚基α可能与球虫耐药性的产生有关。TCP-1亚基α是一种伴侣蛋白,曾有关于TCP-1基因与耐药性产生方面的研究报道。Verrills等[28]研究显示,TCP-1基因的异常会影响actin和tubulin骨架蛋白的改变,从而导致在治疗淋巴细胞性白血病时产生对长春新碱的耐药性。Tanic等[29]用N-甲基-N'-硝基-N'-亚硝基胍或6-硫鸟嘌呤诱导获得了恶性黑色素瘤耐药株,通过差异显示逆转录聚合酶链式反应(RT-PCR)方法发现TCP 1-zeta-6A为其中一个差异转录蛋白。Narayanan等[30]认为,TCP-1可以增加细胞膜的防御功能,使细胞产生对酒精的耐性。因此,推测在用药物防治球虫病过程中,EtTCP-1α可能参与了球虫对药物产生耐受性的过程。
TCP是由两个环状物组成的低聚异复合体,每个环分别由8个明显的亚基组成,是一种分子伴侣蛋白,可以帮助actin和tubulin蛋白折叠成开放式准天然构像[31],也可以协助四膜虫等生物微管骨架蛋白的组装[32-34]。TCP的异常,影响蛋白的正确折叠,甚至发展为严重的蛋白质构像病,导致胎儿唐氏综合征、阿尔茨海默病、朊病毒病等疾病发生[35]。有资料显示,宿主细胞TCP也与狂犬病毒[36]、流感病毒等病原体的侵入[37]、黏膜损伤修复[38-40]和细胞分裂[41]有一定关系。本实验所用耐药株对应的两种抗球虫药物中,地克珠利影响球虫核酸的合成,使蛋白质的翻译与折叠无法顺利进行;马杜拉霉素破坏球虫细胞膜内外渗透压平衡,影响蛋白质正常功能的发挥。球虫在长时间药物的作用下,体内的各种生理生化反应受到极大扰乱,需要合成更多的细胞因子、酶、作用底物等功能蛋白和结构蛋白,为受到影响的各种功能和反应进行补偿或替换。因此,推测球虫在药物作用下需要细胞合成更多的TCP-1亚基α,协助新合成的蛋白质正确折叠、发挥其功能,使细胞得以维持生存,从而产生耐药性。
qPCR和Western blot结果显示,TCP-1亚基α在裂殖子阶段表达量最高,间接免疫荧光实验结果也显示,在子孢子入侵DF-1细胞发育为未成熟裂殖体和成熟裂殖体后,虫体蛋白量明显升高。根据球虫生活史,我们可知裂殖子在肠上皮细胞内寄生,而未孢子化卵囊需要在体外进一步发育,这一生存方式的变化迫使球虫表达更多的蛋白以应对这种改变。此外,地克珠利主要作用于柔嫩艾美耳球虫第二代裂殖体的无性周期阶段,马杜拉霉素对子孢子和第一代裂殖体均有抗球虫活性。在球虫的入侵过程中,IL-17家族细胞因子可以在肠道黏膜内部进行监测[42],球虫入侵宿主后,宿主IL-10的表达量升高[43]。故裂殖子阶段需要储备更多TCP-1亚基α,以便为接下来的发育提供充足的原料,同时,虫体需要合成TCP-1亚基α来帮助虫体抵抗宿主细胞的免疫作用,这一结果可为TCP-1亚基α的检测阶段选择提供一定依据。子孢子入侵DF-1后,TCP-1亚基α广泛分布于虫体内部,这可能是为虫体细胞内发育积蓄原材料,为虫体蛋白合成后的折叠提供方便。TCP-1亚基α在耐药株体内明显上调,因此,在后续的研究中可将该基因用作耐药株检测的分子之一,为临床耐药性的检测和合理用药方案提供一定的基础。
[1] 索勋, 李国清. 鸡球虫病学[M]. 北京: 中国农业大学出版社, 1998.
[2] Shirley M W, Smith A L, Blake D P. Challenges in the successful control of the avian coccidia[J]. Vaccine, 2007,25(30): 5540-5547.
[3] Waletzky E. A field stram ofEimeria tenellaresistant to sulfonamides(abstr)[J]. J Parasitol, 1954, 40(2): 24.
[4] 陈兆国, 史天卫, 赵其平, 等. 鸡球虫田间混合种和柔嫩艾美耳球虫单一种的抗药性试验[J]. 中国兽医科技,2002, 32(6): 30-32.
[5] 王中宝. 安徽三个地区柔嫩艾美尔球虫耐药性分析[D].合肥: 安徽农业大学, 2013.
[6] 韩谦, 刘群, 张荣春. 山东省诸城肉鸡球虫的抗药性调查[J]. 中国兽医学报, 1999, 19(1): 40-42.
[7] 李会. 空肠弯曲菌酰胺醇类诱导耐药株与敏感株的组学比较研究[D]. 北京: 中国农业大学, 2015.
[8] 李琳, 冯帅, 汪莹, 等. 鼠伤寒沙门菌ATCC13311诱导耐药株的转录组测序和分析[J]. 中国兽医学报, 2015,35(7): 1088-1111.
[9] Garc í a-Huertas P, Me jí a-Jaramillo A M, González L,et al. Transcriptome and functional genomics reveal the participation of adenine phosphoribosyltransferase in Trypanosoma cruzi resistance to benznidazole[J]. J Cell Biochem, 2017, 118(7): 1936-1945.
[10] Pulcini S, Staines H M, Lee A H,et al. Mutations in the Plasmodium falciparum chloroquine resistance transporter,PfCRT, enlarge the parasite's food vacuole and alter drug sensitivities[J]. Sci Rep, 2015, 5: 14552.
[11] 赵嵘, 胡丽玲, 孔繁强, 等. PXR基因外显子3甲基化与肠癌细胞对5-氟尿嘧啶的耐药性相关[J]. 中国生物化学与分子生物学报, 2013, 29(1): 63-69.
[12] 周蕾, 姜妮, 周心娜, 等. 四个半LIM结构域蛋白1对人肝癌细胞紫杉醇耐药影响的研究[J]. 中国临床药理学杂志,2017, 33(12): 1135-1138.
[13] 孟靖顺. 白念珠菌HSP90 C端结构和功能的研究[D]. 上海: 第二军医大学, 2017.
[14] 胡文霞. 骨膜蛋白在非小细胞肺癌中的作用及相关机制的研究[D]. 石家庄: 河北医科大学, 2017.
[15] 韩红玉, 赵其平, 陈兆国, 等. 柔嫩艾美耳球虫地克珠利抗药株和马杜拉霉素抗药株的实验室诱导[J]. 中国兽医学报, 2004, 24(2): 138-140.
[16] 黄兵, 赵其平, 吴薛忠, 等. 柔嫩艾美耳球虫纯种的初步确定和致病性研究[J]. 上海畜牧兽医通讯, 1993(5): 18-20.
[17] Tomley F. Techniques for isolation and characterization of apical organelles fromEimeria tenellasporozoites[J].Methods, 1997, 13(2): 171-176.
[18] Shirley M W. Eimeria species and strains of chickens[M]// Coudert P, Eckert J, Braun R,et al.Biotechnology guidelines on techniques in coccidiosis research. Luxembourg City, Luxembourg: The European Commission DGXII, 1995: 9-10.
[19] Han H Y, Lin J J, Zhao Q P,et al. Identification of differentially expressed genes in early stages ofEimeria tenellaby suppression subtractive hybridization and cDNA microarray[J]. Parasit, 2010, 96(1): 95-102.
[20] Xie M Q, Gilbert J M, Fuller A L,et al. A new method for purification ofEimeria tenellamerozoites[J]. Parasitol Res, 1990, 76(7): 566-569.
[21] Jiang L L, Lin J J, Han H Y,et al. Identification and characterization ofEimeria tenellaapical membrane antigen-1 (AMA1)[J]. PLoS One, 2012, 7(7): e41115.
[22] Zhai Q, Huang B, Dong H,et al. Molecular characterization and immune protection of a new conserved hypothetical protein ofEimeria tenella[J].PLoS One, 2016, 11(6): e0157678.
[23] Wang Z, Huang B, Dong H,et al. Molecular characterization and functional analysis of a novel calcium-dependent protein kinase 4 fromEimeria tenella[J]. PLoS One, 2016, 11(12): e0168132.
[24] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod[J]. Methods, 2001, 25(4): 402-408.
[25] 聂忠清, 吴永刚, 蒙建洲. 分子伴侣的功能和应用[J]. 生命科学, 2006, 18(1): 84-89.
[26] Shaw P J, Chaotheing S, Kaewprommal P,et al.Plasmodium parasites mount an arrest response to dihydroartemisinin, as revealed by whole transcriptome shotgun sequencing (RNA-seq) and microarray study[J].BMC Genomics, 2015, 16: 830.
[27] Das S, Shah P, Tandon R,et al. Over-expression of cysteine leucine rich protein is related to SAG resistance in clinical isolates ofLeishmania donovani[J]. PLoS Negl Trop Dis, 2015, 9(8): e0003992.
[28] Nicole M V, Natalia L L, Tracy Y E L,et al. Proteomic analysis reveals a novel role for the actin cytoskeleton in vincristine resistant childhood leukemia--anin vivostudy[J]. Proteomics, 2006, 6(5): 1681-1694.
[29] Tanic N, Brkic G, Dimitrijevic B,et al. Identification of differentially expressed mRNA transcripts in drugresistant versus parental human melanoma cell lines[J].Anticancer Res, 2006, 26(3A): 2137-2142.
[30] Narayanan A, Pullepu D, Reddy P K,et al. Defects in protein folding machinery affect cell wall integrity and reduce ethanol tolerance inS. cerevisiae[J]. Curr Microbiol, 2016, 73(1): 38-45.
[31] Llorca O, Mar tí n-Benito J, Ritco-Vonsovici M,etal. Eukaryotic chaperonin CCT stabilizes actin and tubulin folding intermediates in open quasi-native conformations[J]. EMBO J, 2000, 19(22): 5971-5979.
[32] Casalou C, Cyrne L, Rosa M R,et al. Microtubule cytoskeleton perturbation induced by taxol and colchicine affects chaperonin containing TCP-1 (CCT) subunit gene expression in tetrahymena cells[J]. Biochim Biophys Acta, 2001, 1522(1): 9-21.
[33] Himmelspach R, Nick P, Schäfer E,et al. Developmental and light-dependent changes of the cytosolic chaperonin containing TCP-1 (CCT) subunits in maize seedlings,and the localization in coleoptiles[J]. Plant J, 1997, 12(6):1299-1310.
[34] Seixas C, Cruto T, Tavares A,et al. CCTa and CCTd chaperonin subunits are essential and required for cilia assembly and maintenance inTetrahymena[J]. PLoS One,2010, 5(5): e10704.
[35] Yoo B C, Fountoulakis M, Dierssen M,et al. Expression patterns of chaperone proteins in cerebral cortex of the fetus with down syndrome: dysregulation of T-complex protein 1[J]. J Neural Transm Suppl, 2001, (61): 321-334.[36] Zhang J, Ye C, Ruan X,et al. The chaperonin CCTα is required for efficient transcription and replication of rabies virus[J]. Microbiol Immunol, 2014, 58(10): 590-599.
[37] Fislová T, Thomas B, Graef K M,et al. Association of the influenza virus RNA polymerase subunit PB2 with the host chaperonin CCT[J]. J Virol, 2010, 84(17): 8691-8699.
[38] Satish L, Lo N, Gallo P H,et al. Chaperonin containing T-complex polypeptide (CCT) subunit expression in oral mucosal wounds and fibroblasts[J]. Cell Stress Chaperones, 2011, 16(6): 675-680.
[39] Satish L, Abdulally A, Oswald D,et al. Differential expression of chaperonin containing T-complex polypeptide (CCT) subunits during fetal and adult skin wound healing[J]. Cell Stress Chaperones, 2008, 13(4):527-533.
[40] Koulikovska M, Podskochy A, Fagerholm P. The expression pattern of the subunit of chaperonin containing T-complex polypeptide 1 and its substrate, alpha-smooth muscle actin, during corneal wound healing[J]. Acta Ophthalmol Scand, 2005, 83(5): 543-548.
[41] Yokota S, Yanagi H, Yura T,et al. Cytosolic chaperonincontaining t-complex polypeptide 1 changes the content of a particular subunit species concomitant with substrate binding and folding activities during the cell cycle[J]. Eur J Biochem, 2001, 268(17): 4664-4673.
[42] Del Cacho E, Gallego M, Lillehoj HS,et al. IL-17A regulatesEimeria tenellaschizont maturation and migration in avian coccidiosis[J]. Vet Res, 2014, 45: 25.
[43] Haritova A M, Stanilova S A. Enhanced expression of IL-10 in contrast to IL-12B mRNA in poultry with experimental coccidiosis[J]. Exp Parasitol, 2012, 132(3):378-382.
