猴B病毒通用核酸检测体系的建立与评价
2018-04-25马丽敏贾俊婷钟亚迪马玉媛刘兴友章金刚
马丽敏,贾俊婷,钟亚迪,范 瑞,马玉媛,刘兴友,章金刚,3
(1.河南科技学院,新乡 453000;2. 军事科学院军事医学研究院卫生勤务与血液研究所,北京 100850;3. 新乡学院,新乡 453000)
猴B病毒(Monkey B virus,即Macacine alphaherpesvirus 1)是一种人畜共患病病原,其自然宿主是猕猴,在猴群中广泛存在,多呈良性经过。人感染猴B病毒后可引起脑脊髓炎甚至致死,未经治疗死亡率高于70%[1,2]。猴B病毒是目前确定的35种非人灵长类疱疹病毒中唯一一种已知对人有致病性的病毒[3]。根据2011年我国颁布实施的实验动物微生物学等级及检测国家标准,猴B病毒已被列为普通级实验用猴应排除的病原微生物[4]。因此,建立快速、准确检测猴B病毒的方法对于相关人员暴露后的快速诊断和治疗以及对建立高质量的实验猴群都具有非常重大的意义。
现有的猴B病毒检测方法主要包括病毒分离培养、血清学检测和核酸检测。病毒分离培养是检测猴B病毒感染的金标准,但是该方法灵敏度低、耗时长,并且对操作条件要求非常高;血清学检测中,由于猴B病毒与人单纯疱疹病毒1型(Herpes simplex virus 1,HSV-1)、人单纯疱疹病毒2型(Herpes simplex virus 2,HSV-2)、非洲绿猴疱疹病毒(Simian agent 8,SA8)、及狒狒疱疹病毒(Herpesvirus papio 2,HVP-2)存在广泛的抗原交叉性,易导致猴B病毒的血清学检测结果出现假阳性[1,5];普通PCR方法需要结合限制性酶切或杂交探针等手段,步骤比较繁琐;有限的qPCR方法则无法检测猴B病毒所有基因型。
因此鉴于目前检测方法存在的问题,我们拟建立能同时检测猴B病毒5种基因型,且与HSV-1、HSV-2无交叉反应的猴B病毒通用核酸检测体系,并对其进行方法学评价。
1 材料与方法
1.1 样品 HSV-1SM44株的核酸,由中国药品生物制品检定所付瑞老师惠赠;HSV-2G株病毒液,由南京大学医学院基础部感染与免疫学教研室李尔广教授惠赠;EB病毒(Epstein barr virus,EBV)阳性定量参考品,购自达安基因股份有限公司;水痘带状疱疹病毒(Varicella zoster virus,VZV)和巨细胞病毒(Cytomegalovirus,CMV)为本实验室保存。
1.2 主要试剂和仪器 高纯度病毒核酸提取试剂盒购自Roche公司;Premix ExTaqTM(Probe qPCR)、PremixTaqTM(TaKaRaTaqTMVersion 2.0 plus dye)、pMD18-T载体和 DNA Marker DL500均购自TaKaRa 公司;CFX96TMreal-time System购自Bio-Rad公司;Gene Quant 1300紫外-可见分光光度计购自GE公司;PCR仪购自Biometra公司。
1.3 猴B病毒通用引物和探针的设计 GenBank数据库中获得猴B病毒gB基因序列有恒河猴猴B病毒(登录号:AB096160、U14664、AF533768);食蟹猴猴B病毒(登录号:KJ566591);豚尾猴猴B病毒(登录号:AF226637);日本猕猴猴B病毒(登录号:AB087737);狮尾猴猴B病毒(登录号:KY628968),利用DNAStar软件对以上序列进行比对分析,确定gB基因相对保守区域;将猴B病毒gB基因保守区域序列与HSV-1、HSV-2序列进行比对分析,选取特异性较高的区域作为检测靶序列。本研究设计能同时检测猴B病毒5种基因型的实时荧光定量PCR检测引物gB-3F、gB-3R及MGB探针gB-3P(上海基康生物技术有限公司合成),见表1。该扩增片段长度为92 bp。
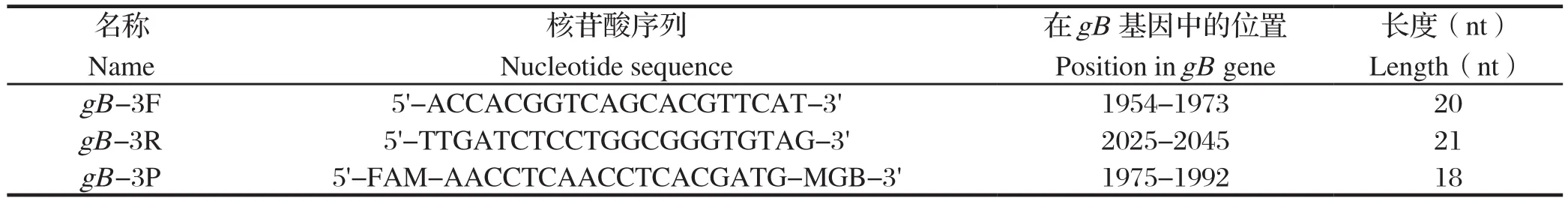
表1 猴B病毒实时荧光定量PCR检测引物及探针序列Table 1 The primers and probe sequence of the real-time fl uorescent qPCR assay for detecting Monkey B virus
1.4 猴B病毒通用核酸检测体系标准曲线的建立由中美泰和生物技术(北京)有限公司根据猴B病毒恒河猴基因型代表株E2490的gB基因序列(nt52137~54815,GenBank登录号:AF533768)进行全基因合成,并插入于PUC19载体,从而获得含gB基因重组质粒。以含gB基因重组质粒为模板,使用gB-3F和gB-3R引物进行PCR扩增,将回收的目的片段92 bp与pMD18-T载体连接,构建得到猴B病毒参考品质粒。
以一系列10倍梯度稀释的猴B病毒参考品质粒(3×107~3×102copies)为模板,进行qPCR扩增。反应体系:Premix ExTaqTM(Probe qPCR)10μL、gB-3F 1 μL、gB-3R 1 μL,gB-3P 800 nmol/μL、MgCl23 mmol/L、模板3 μL、加灭菌ddH2O至20 μL。反应条件:先95℃ 30 s;然后95℃ 5 s、58℃ 30 s,共40个循环。使用Microcal Origin 6.0软件,绘制标准曲线图。
1.5 猴B病毒通用核酸检测体系的特异性评价 使用高纯度病毒核酸提取试剂盒提取HSV-2、VZV、EBV、CMV样本的核酸。分别以猴B病毒参考品质粒、HSV-1、HSV-2、VZV、EBV、CMV核酸为模板,按照1.4所述反应体系和条件进行qPCR的特异性实验,每个样品设2个复孔,同时设无模板对照(no template control,NTC)。
1.6 猴B病毒通用核酸检测体系的通用性评价 食蟹猴猴B病毒和恒河猴猴B病毒的扩增靶序列,均与1.4中构建的参考品质粒的插入片段序列完全一致,因此以猴B病毒参考品质粒代表食蟹猴猴B病毒和恒河猴猴B病毒2种基因型。由中美泰和生物技术(北京)有限公司分别根据豚尾猴猴B病毒(nt54382~54473,GenBank登录号:KY628970)、日本猕猴猴B病毒(nt1521~1612,GenBank登录号:AB0887737)和狮尾猴猴B病毒(nt53794~53703,GenBank登录号:KY628968)代表株相应的靶序列采用qPCR扩增全基因序列,得到猴B病毒3种基因型质粒。以上述质粒为模板,按照1.4所述反应体系和条件进行qPCR的通用性实验,每个样品设3个复孔,同时设NTC。
1.7 猴B病毒通用核酸检测体系的敏感性评价 分别以一系列10倍梯度稀释的猴B病毒参考品质粒(3×108~3×100copies)作为模板,按照1.4所述反应体系和条件进行qPCR的敏感性实验,同时设NTC。
1.8 猴B病毒通用核酸检测体系的重复性评价 对猴B病毒参考品质粒进行10倍梯度稀释,取5个稀释度(3×108~3×104copies)参考品质粒作为模板,按照1.4所述反应体系和条件进行批内重复和批间重复实验,每个样品设5个复孔,同时设NTC。计算批内和批间实验中各浓度质粒的拷贝数、标准差(standard deviation,SD)及其变异系数(coefficient of variation,CV),评价猴B病毒核酸检测体系的重复性。
2 结果
2.1 猴B病毒通用核酸检测体系标准曲线的建立 分别以一系列10倍梯度稀释的猴B病毒参考品质粒(3×107~3×102copies)作为模板,按照1.4所述反应体系和条件进行 qPCR扩增。由图1可知,猴B病毒参考品质粒在3×107~3×102copies范围内线性关系良好(│r│=0.999),标准曲线方程式:y=42.542-3.209x,扩增效率E=104.9%。
2.2 猴B病毒通用核酸检测体系的特异性评价 分别以猴B病毒参考品质粒、HSV-1、HSV-2、VZV、EBV、CMV核酸为模板,按照1.4所述反应体系和条件进行qPCR扩增。由图2可知,猴B病毒参考品质粒有明显扩增,HSV-1、HSV-2、VZV、EBV、CMV、NTC均无扩增(荧光信号未达到阈值)。说明猴B病毒核酸检测体系具有良好特异性。
2.3 猴B病毒通用核酸检测体系的通用性评价 分别以猴B病毒日本猕猴、豚尾猴、狮尾猴基因型参考品质粒、构建的猴B病毒参考品质粒(代表食蟹猴、恒河猴基因型)为模板,按照1.4所述反应体系和条件进行qPCR的通用性评价。由图3可知,猴B病毒5种基因型参考品质粒均成功扩增,NTC无扩增(荧光信号未达到阈值),说明建立的猴B病毒核酸检测体系通用性良好。
2.4 猴B病毒通用核酸检测体系的敏感性评价 分别以猴B病毒3×108~3×100copies参考品质粒为模板,按照1.4所述反应体系和条件进行qPCR扩增。由图4可知,猴B病毒参考品质粒为3×100copies时无法检出,最低可检测到3×101copies即30 copies,说明建立的该核酸检测体系具有较好敏感性。
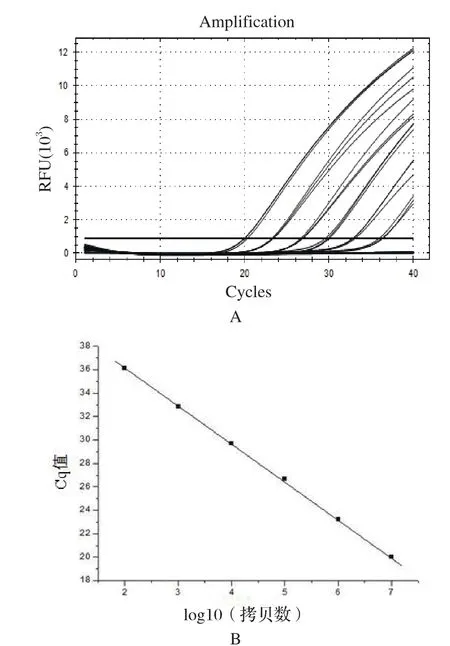
图1 实时荧光qPCR检测猴B 病毒的动力学曲线(A)和标准曲线(B)Fig.1 Dynamic curve(A)and standard curve(B)of the real-time fl uorescent qPCR assay for detecting monkey B virus DNA
2.5 猴B病毒通用核酸检测体系的重复性评价 分别以猴B病毒3×108~3×104copies浓度的参考品质粒为模板,按照1.4所述反应体系和条件进行qPCR扩增,并对重复性实验结果进行分析。由表2和表3可知,无论批内重复还是批间重复实验中,猴B病毒各浓度参考品质粒Cq值的标准偏差均低于0.5,且其变异系数(CV%)均低于2%。3×104~3×108copies浓度范围的病毒参考品质粒,批内重复实验中,其拷贝数的变异系数(CV%)中位数为11.26%(7.05%~14.48%);批间重复实验中,变异系数(CV%)中位数为10.37%(3.89%~20.21%)。
3 讨论
猴B病毒与同属于疱疹病毒科、α-疱疹病毒亚科、单纯疱疹病毒属的HSV-1和HSV-2具有高度相似性,导致针对猴B病毒的检测试剂常与HSV-1和HSV-2发生交叉反应,很大程度上影响了猴B病毒的检测特异性。

图2 猴B病毒通用核酸检测体系的特异性Fig.2 Speci fi city of the universal nucletic acid test method for detecting monkey B virus DNA
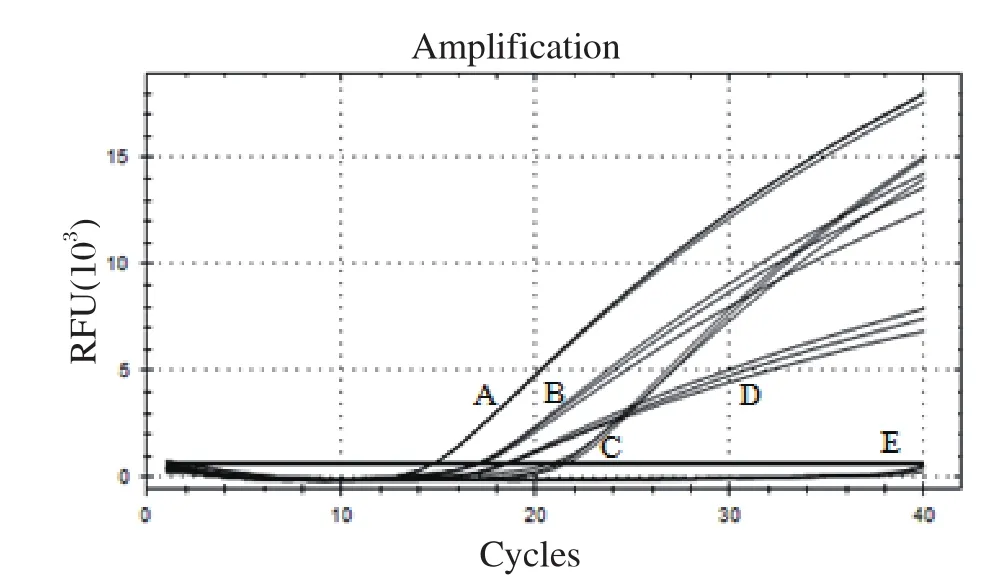
图3 猴B病毒通用核酸检测体系的通用性Fig.3 Universality of the universal nucletic acid test method for detecting monkey B virus DNA
国内外已建立了众多基于普通PCR的猴B病毒检测方法。1993年,Slomka等[6]采用巢式PCR法扩增猴B病毒US5和US6基因间非编码区部分片段,结合31mer寡核苷酸探针杂交方法对猴B病毒核酸进行检测。2008年,李晓波等[7]分别针对猴B病毒的gG基因和DNA聚合酶亚单位基因设计了一套引物,以猴B病毒为模板可扩增产生单一目的条带,而以HSV等病毒为模板进行扩增不会获得产物。然而,现有的普通PCR法都需要对扩增产物进行电泳,或结合限制性酶切、杂交探针检测等手段进行特异性鉴定,步骤繁琐,也增大了污染的几率。
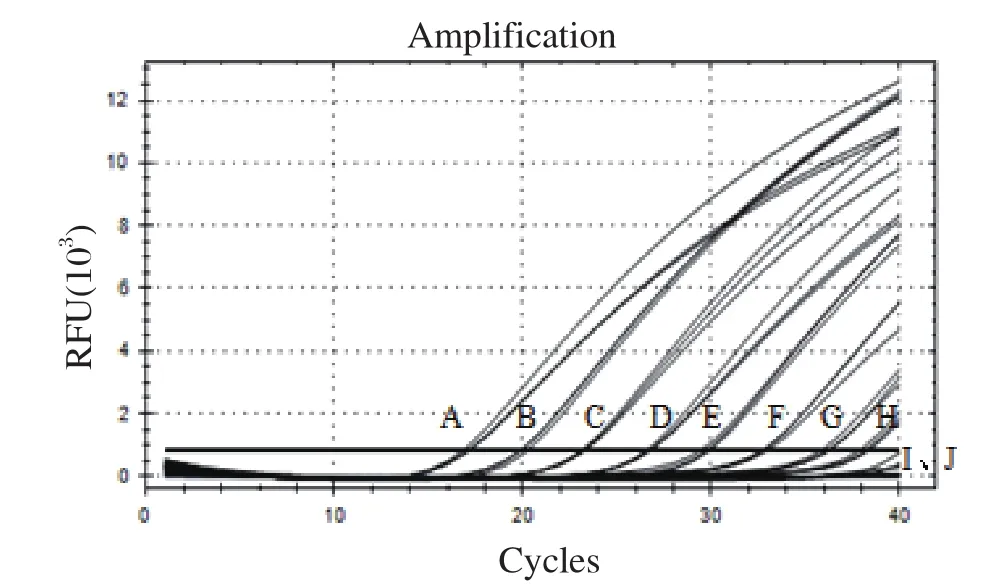
图4 猴B病毒通用核酸检测体系的敏感性Fig.4 Sensitivity of the universal nucletic acid test method for detecting monkey B virus DNA
实时荧光定量PCR法操作简便且灵敏度高[8],国外已有少量猴B病毒qPCR检测方法的报道。2003年,Huff等[9]针对分离自恒河猴的猴B病毒毒株(E2490株)gB基因设计了引物和探针,建立了猴B病毒qPCR方法,该检测体系与HVP-2、HSV-2没有交叉反应,但HSV-1是否存在交叉反应未进行评价。此外,该方法仅评估了其检测恒河猴、豚尾猴和食蟹猴来源的猴B病毒的能力,对其是否可以有效检测日本猕猴和狮尾猴来源的猴B病毒未进行验证。同年,Ludmila等[10]针对分离自恒河猴的猴B病毒毒株(E2490株)的gG基因设计检测引物和TaqMan探针,建立了与HSV等病毒均无交叉反应的特异性猴B病毒qPCR方法。但是该引物探针的设计未考虑到检测靶序列的保守性,因此该方法易造成猴B病毒核酸的漏检,并且该方法仅基于恒河猴猴B病毒一种基因型的核苷酸序列进行引物探针的设计。
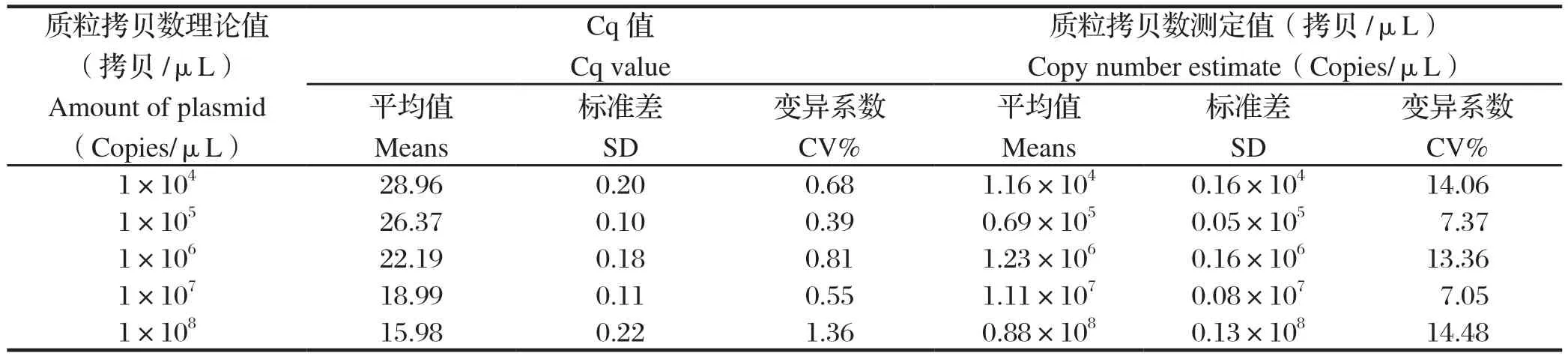
表2 猴B病毒通用核酸检测体系批内重复实验结果Table 2 Repeatability of the universal nucletic acid test method for detecting monkey B virus DNA
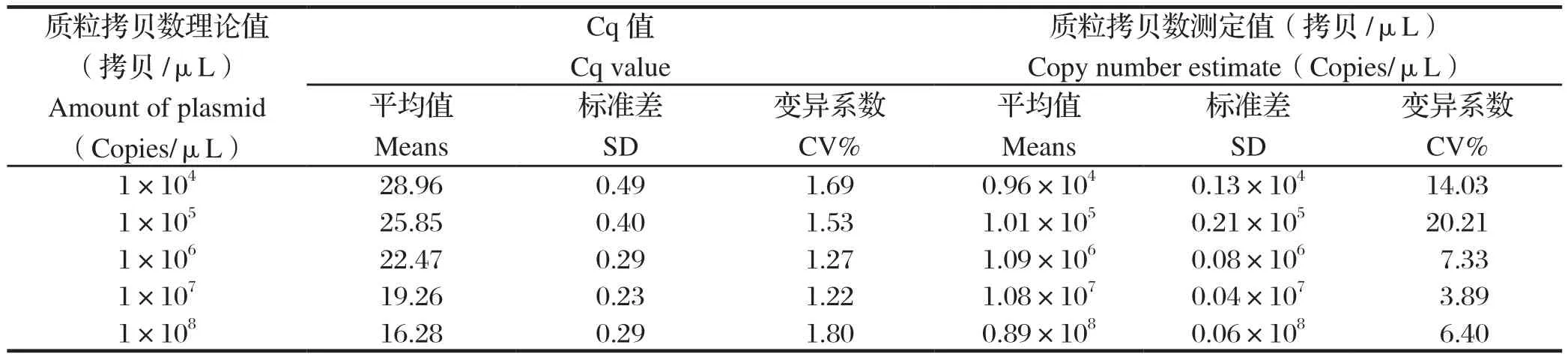
表3 猴B病毒通用核酸检测体系批间重复实验结果Table 3 Reproducibility of the universal nucletic acid test method for detecting monkey B virus DNA
关于猴B病毒的基因型分型问题迄今尚无一致意见,最初有人认为存在3种基因型[11],之后陆续有文献分别报道了猴B病毒的第4种和第5种基因型[12,13],而国内有文献认为存在3种基因型[14],也有文献认为存在4种基因型[15,16]。我们通过对猴B病毒基因型相关文献的调研[11-13,17],结合基于猴B病毒gB蛋白(UL27)、UL19蛋白的核苷酸序列系统发育分析结果,认为猴B病毒应分为5种基因型,且基因型与其宿主种系直接相关,分别为来源于恒河猴、日本猕猴、食蟹猴、豚尾猴和狮尾猴的猴B病毒。在本研究中,我们以猴B病毒相对保守的gB蛋白核苷酸序列作为检测靶标,并通过对猴B病毒5种基因型代表株gB基因进行多重比对,进一步确定gB基因相对保守区域。最后,自这些保守区域中选取特异性较高的序列设计检测引物及探针,从而实现特异性检测5种基因型猴B病毒的目的。本研究建立的检测体系较之以往报道的qPCR方法具有明显的通用性优势,方法学评价结果显示,本检测体系也具有良好的敏感性、特异性和重复性。
本研究建立的猴B病毒通用核酸检测体系,对临床猴B病毒感染病例的确诊,以及高质量猴群的建立具有重要意义。
[1] Hilliard J. Monkey B virus[M]// Arvin A, Campadelli-Fiume G, Mocarski E,et al. Human herpesviruses:biology, therapy, and immunoprophylaxis. Cambridge:Cambridge University Press, 2007.
[2] Elmore D, Eberle R. Monkey B virus (Cercopithecine herpesvirus 1)[J], Comp Med, 2008, 58(1): 11-21.
[3] Huff J L, Barry P A. B-virus (Cercopithecine herpesvirus 1) infection in humans and macaques: potential for zoonotic disease[J]. Emerg Infect Dis, 2003, 9(2): 246-250.
[4] 中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会. GB14922.2-2011实验动物微生物等级及监测[S]. 北京: 中国标准出版社, 2011.
[5] Troan B V, Perelygina L, Patrusheva I,et al. Naturally transmitted herpesvirus papio-2 infection in a black and white colobus monkey[J]. J Am Vet Med Assoc, 2007,231(12): 1878-1883.
[6] Slomka M J, Brown D W, Clewley J P,et al. Polymerase chain reaction for detection of herpesvirus simiae (B virus) in clinical specimens[J]. Arch Virol, 1993, 131(1-2): 89-99.
[7] 李晓波. 猴B病毒检测方法的建立与初步应用[D]. 北京:中国药品生物制品检定所, 2008.
[8] 蔡骁垚, 孙竹筠, 熊炜, 等. 鼠轮状病毒荧光定量PCR检测方法的建立及初步应用[J]. 中国动物传染病学报.2017, 25(5): 17-20.
[9] Huff J L, Eberle R, Capitanio J,et al. Differential detection of B virus and rhesus cytomegalovirus in rhesus macaques[J]. J Gen Virol, 2003, 84pt(1): 83-92.
[10] Perelygina L, Patrusheva I, Manes N,et al. Quantitative real-time PCR for detection of Monkey B virus(Cercopithecine herpesvirus 1) in clinical samples[J]. J Virol Methods, 2003, 109(2): 245-251.
[11] Smith A L, Black D H, Eberle R. Molecular evidence for distinct genotypes of Monkey B virus (herpesvirus simiae) which are related to the macaque host species[J].J Virol, 1998, 72(11): 9224-9232.
[12] Thompson S A, Hilliard J K, Kittel D,et al. Retrospective analysis of an outbreak of B virus infection in a colony of DeBrazza's monkeys (Cercopithecus neglectus)[J]. Comp Med, 2000, 50(6): 649-657.
[13] Ohsawa K, Black D H, Torii R,et al. Detection of a unique genotype of Monkey B virus (Cercopithecine herpesvirus 1) indigenous to native Japanese macaques(Macaca fuscata)[J]. Comp Med, 2002, 52(6): 555-559.
[14] 李晋文, 佟巍, 蔡鹃, 等. 猴B病毒抗体不同检测方法的比对[J]. 中国比较医学杂志, 2017, 27(7): 29-33.
[15] 王琼, 李维薇, 王芸, 等. 猴B病毒的现状与研究[J]. 上海畜牧兽医通讯, 2012(6): 48-49.
[16] 杨燕飞, 周洁, 高诚. 猴B病毒研究进展[J]. 动物医学进展, 2015, 36(7): 94-99.
[17] Eberle R, Maxwell LK, Nicholson S,et al. Genome sequence variation among isolates of Monkey B virus(Macacine alphaherpesvirus 1) from captive macaques[J].Virology, 2017, 508: 26-35.
