二氢睾酮联合脂肪源性干细胞对小鼠坐骨神经缺损后脑源性神经营养因子及其受体TrkB表达的影响
2018-04-08李文媛尹国华李智刚金在顺滕诚毅
王 莹 李文媛 尹国华 李智刚 金在顺 滕诚毅 孙 平
(牡丹江医学院解剖教研室,黑龙江 牡丹江 157011)
近年发现性腺类固醇激素睾酮为中枢神经系统损伤后许多病理生理改变提供广泛的神经保护和治疗作用〔1〕。睾酮可通过抑制氧化应激反应进行神经保护和防止神经元死亡,降低炎症和自由基表达,并能够加速失神经轴突再生和功能恢复〔2〕。有研究表明睾酮还能够显著促进脑源性神经营养因子(BDNF)等表达〔3〕,但其在周围神经再生的作用及其机制报道较少。我们前期研究〔4〕已证实同种异体脱细胞异体神经(ANA)能够有效桥接坐骨神经缺损,但单独使用ANA运动功能恢复效果并不理想。本研究拟将脂肪源性干细胞(ADSC)作为种子细胞植入ANA桥接坐骨神经缺损,并联合在体内具有较强睾酮活性的雄激素二氢睾酮(DHT)治疗,探讨DHT联合ADSC对坐骨神经缺损后小鼠BDNF信号通路和功能恢复的影响。
1 材料和方法
1.1细胞培养参照前期研究方法取小鼠腹部脂肪组织进行ADSC分离、培养及传代〔4〕,2 w后茜草素红染色鉴定ADSC向成骨诱导的细胞,经细胞鉴定后取第4代ADSC行PKH26(Sigma公司,美国)染色标记〔5,6〕,进行体内移植实验。
1.2动物模型30只6~8周龄C57BL/6小鼠(雄性15 只,雌性15 只),由中国医科大学实验动物中心提供,体质量18~22 g,按体质量随机分为:①ANA组:采用化学萃取脱细胞方法〔5〕制备CD1小鼠ANA,注入100 μl磷酸盐缓冲液(PBS)于ANA,桥接长5 mm坐骨神经两断端间的缺损,n=10;②ADSC组:注入等剂量ADSC(1×106个/100 μl)于ANA桥接坐骨神经缺损,n=10;③DHT + ADSC组:同ADSC组方法进行ANA桥接后,皮下给予DHT0.2 ml(含有DHT 0.8 mg密度为4.0 mg/ml的医用玉米油溶液,Sigma公司,美国)注射〔7〕,1次/d,给药1 w,n=10。3组术后28 d麻醉取材。
1.3坐骨神经功能指数(SFI)参照前期研究方法行SFI检测〔6〕,术后28 d,制备1个塑料通道(8.5 cm宽,50 cm长),底部放置一张70 g白纸,黑色墨水蘸在小鼠双侧后足从通道一端行走至另一端,每个后足印在纸面3~4个足印,检测足趾宽度(TS)、足趾长度(PL)及中间足趾宽度(ITS)。
1.4电生理检测采用经颅磁刺激MEP(tcMMEP)方法〔1〕,应用Magstim Model 200 磁刺激器(Magstim 公司,英国)和诱发电位仪(NIHON KOHDEN公司,日本)经颅磁刺激运动诱发电位观察小鼠坐骨神经损伤后发生神经传导潜伏期、传导速度及波幅改变,将电磁线圈置于颅骨激活皮层下组织诱发tcMMEP反应,探查电极置于腓肠肌肌腹,参考电极插入肌腱,接地电极插入尾巴。每只小鼠每侧均检测3次,每次间隔1 min,结果取平均值。
1.5Western印迹检测神经移植体内DNF表达及其受体TrkB术后28 d,小鼠麻醉取ANA冲洗,剥离硬膜放置干冰保存,电泳分离蛋白样品(20 μg)后转膜、封闭,加入一抗:兔抗BDNF抗体(1∶200,Sigma公司,美国)和兔抗TrkB抗体(1∶200,Sigma公司,美国),4℃过夜,加入二抗(1∶5 000)孵育1 h,使用增强化学发光检测系统(GE Healthcare公司,英国)观察蛋白印迹。
1.6免疫荧光组化染色将快速分离的ANA置于含4%多聚甲醛固定,30%蔗糖脱水,冰冻切片,常规免疫组化染色,一抗为兔抗NF200(1∶200,Sigma公司,美国),二抗为FITC(1∶200,Sigma公司,美国),荧光显微镜下观察并同时示踪PKH26标记的ADSC。每张切片400倍镜下随机选取4个视野检测光密度(IOD)值。
1.7统计学方法应用SPSS13.0软件行t检验及单因素方差分析。
2 结 果
2.1ADSC培养与分化原代培养ADSC 8 d后形成的细胞群落较为密集,ADSC呈多角形或梭形伸展,有铺路石状特征。ADSC分化诱导成骨28 d后,可见分化细胞内的钙沉积茜素红染色,见图1。
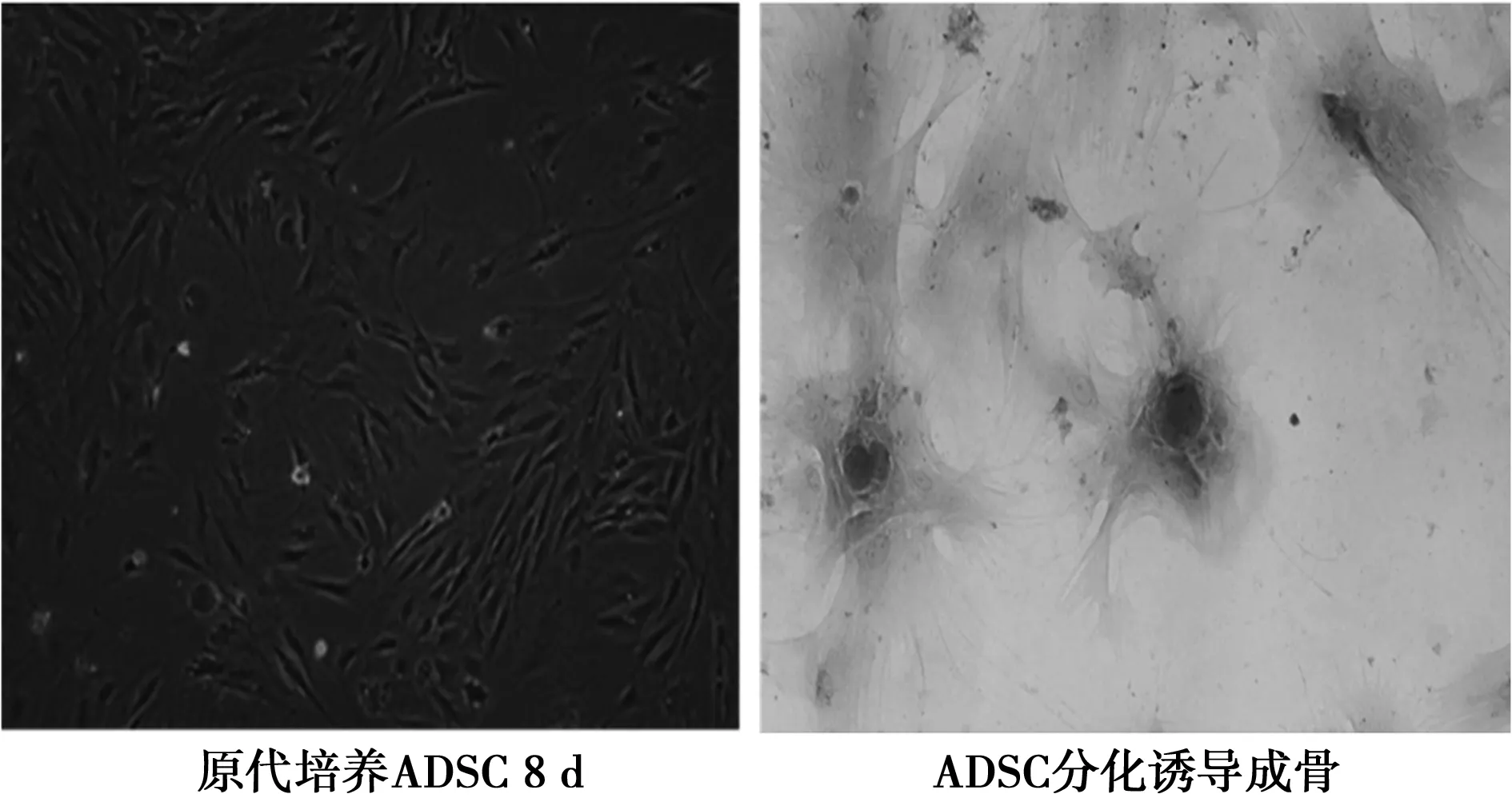
图1 ADSC培养与分化(×200)
2.2Western印迹结果DHT + ADSC组和ADSC组ANA中BDNF及其受体TrkB蛋白表达较ANA组显著增高,其中DHT+ADSC组BDNF及其受体TrkB蛋白表达显著高于ADSC组(均P<0.001),见图2,表1。
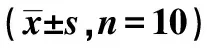
表1 各组Western 印迹蛋白相对表达
与ANA组比较:1)P<0.05;与ADSC组比较:2)P<0.05,表3同
2.3免疫荧光染色观察荧光显微镜下可见DHT + ADSC组和ADSC组在ANA中段有PKH26标记的ADSC,而DHT + ADSC组PKH26阳性表达显著高于ADSC组(t=6.715,P<0.001)。免疫荧光法染色NF200检测神经支架中段轴突生成情况,与ADSC组比较,DHT + ADSC组NF200表达显著增加(t=22.542,P<0.001),见图3,表2。
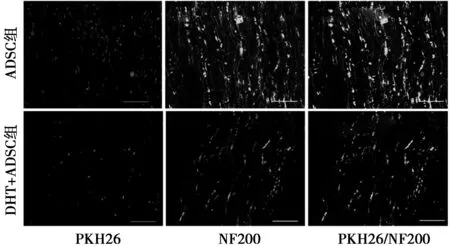
图3 术后4 w ADSC组和DHT + ADSC组神经移植体中段PKH26和NF200免疫组化荧光染色(×200)
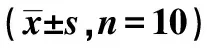
表2 各组PKH26和NF200的IOD值
与ADSC组比较:1)P<0.05
2.4SFI检测结果术后28 d,与ANA组(-72.32±6.05)和ADSC组(-68.87±7.52)比较,DHT + ADSC组SFI指数显著增高(-54.30±5.45,F=24.62,P<0.001),而ANA组与ADSC组SFI指数差异无统计学意义(P>0.05)。
2.5神经电生理检测与ANA组比较,ADSC组和DHT + ADSC组神经传导速度及波幅显著增加,而延迟期显著缩短,其中DHT+ADSC组改善神经电生理参数明显优于ADSC组 (神经传导速度:F=65.22,P<0.05;延迟期:F=14.32,P<0.05;波幅:F=19.65,P<0.05),见表3。
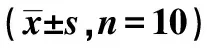
表3 各组神经电生理参数检测
3 讨 论
目前发现近端周围神经病变或完全横断的预后普遍较差,运动功能恢复缓慢。其中主要原因是适宜神经生长的微环境缺乏,轴突生长底物和神经营养因子减少及受损轴突内在生长速度太慢,导致再生轴突需较长时间连接远端失神经支配的神经、不能重新支配靶组织,其功能恢复并不理想〔8〕。
前期研究发现〔4,5〕ANA由于脱去了周围神经的细胞成分,保存了神经天然结构,具有较好的组织相容性,能够为神经缺损提供良好的神经生长微环境。而种子细胞ADSC可合成和分泌大量神经营养因子,如神经生长因子、血管内皮生长因子等,这些促进神经生长的因子表达变化提供轴突生长的营养。本研究也再次证实ADSC能够促进ANA桥接神经缺损后功能恢复,但SFI结果表明ADSC组神经功能恢复效果并不尽如人意,尽管其SFI有增高趋势,且有研究证实〔6,9〕联合治疗能够克服多种抑制神经轴突再生的因素,较单一治疗效果更为明显。在中枢神经系统中,睾酮能够促进体外培养的海马神经元存活,防止皮质锥体细胞损伤诱导的树突萎缩〔3〕,促进脑卒中后早期功能恢复,并刺激周围神经损伤后运动神经元轴突的生长〔10〕。而在周围神经系统中,睾酮能够加速面神经、舌下神经、坐骨神经轴突再生和神经切断后功能恢复〔2,11〕,但其促进轴突再生的机制尚不明确,本研究证实DHT治疗能够有效激活BDNF细胞信号,这与以往研究结果相一致〔3〕,其机制可能是BDNF的表达是通过钙依赖的信号通路进行调节,而cAMP反应元件(CRE)和cAMP反应元件结合蛋白(CREB)参与其信号通路发挥调节作用。睾酮已证实能够有效激活CRE和CREB,因此,睾酮介导cAMP信号通路能够调控和促进BDNF产生〔10〕。本研究推测DHT可能通过激活BDNF细胞信号,促进移植的ADSC增殖和存活,进而促进轴突的再生,且DHT联合ADSC能够协同促进神经功能恢复。
1Byers JS,Huguenard AL,Kuruppu D,etal.Neuroprotective effects of testosterone on motoneuron and muscle morphology following spinal cord injury〔J〕.J Compa Neurol,2012;520(12):2683-96.
2Mohammadi R,Amini K,Eskafian H.Beta methasone-enhanced vein graft conduit accelerates functional recovery in the rat sciatic nerve gap〔J〕.J Oral Maxillofac Surg,2013;71(4):786-92.
3Verhovshek T,Cai Y,Osborne MC,etal.Androgen regulates brain-derived neurotrophic factor in spinal motoneurons and their target musculature〔J〕.Endocrinology,2010;151(1):253-61.
4王莹,李文媛,张高坤,等.ChABC联合ADSC促进脱细胞同种异体神经支架移植后轴突再生的作用〔J〕.中国矫形外科杂志,2013;33(9):1870-6.
5Wang Y,Jia H,Li WY,etal.Synergistic effects of bone mesenchymal stem cells and chondroitinase ABC on nerve regeneration after acellular nerve allograft in rats〔J〕.Cell Mol Neurobiol,2012;32(3):361-71.
6Jia H,Wang Y,Tong XJ,etal.Sciatic nerve repair by acellular nerve xenografts implanted with BMSCs in rats xenograft combined with BMSCs〔J〕.Synapse,2012;66(3):256-69.
7Swallow RK,Leiser MR,Fink BE,etal.Anatomical but not functional recovery from a sciatic nerve crush is enhanced by treatment with testosterone〔J〕.Restor Neurol Neurosci,1999;15(4):297-303.
8Cartarozzi LP,Spejo AB,Ferreira RS,etal.Mesenchymal stem cells engrafted in a fibrin scaffold stimulate Schwann cell reactivity and axonal regeneration following sciatic nerve tubulization〔J〕.Brain Res Bull,2015;112:14-24.
9王莹,李文媛,李明秋,等.黄芪皂甙Ⅳ联合脂肪源性干细胞对老龄大鼠脑缺血再灌注中神经营养因子表达的影响〔J〕.中国老年学杂志,2011;31(20):3963-6.
10Meusburger SM,Keast JR.Testosterone and nerve growth factor have distinct but interacting effects on structure and neurotransmitter expression of adult pelvic ganglion cells in vitro〔J〕.Neuroscience,2001;108(2):331-40.
11Coers S,Tanzer L,Jones KJ.Testosterone treatment attenuates the effects of facial nerve transection on glial fibrillary acidic protein (GFAP) levels in the hamster facial motor nucleus〔J〕.Metab Brain Dis,2002;17(2):55-63.
