基于荧光差异双向电泳的雷帕霉素损伤人冠状动脉内皮细胞的蛋白质组学研究*
2018-03-28刘少军胡坤华
刘少军,胡坤华,钟 赟△
(1.广州医科大学附属第二医院心内科/广州心血管疾病研究所,广州 510260;2.中山大学中山医学院,广州 510089)
介入治疗正日益成为冠心病的首选治疗方式[1],安装药物洗脱支架是目前介入治疗的常规手段。临床上发现雷帕霉素在冠心病的治疗应用中具有双重性:一方面抑制血管平滑肌细胞的增殖和迁移,有效防止了介入术后的再狭窄;另一方面雷帕霉素抑制内皮细胞增殖和迁移,诱导内皮细胞损伤[2-3]。雷帕霉素延缓支架被正常内皮细胞覆盖包裹,增加血栓风险,影响远期疗效。雷帕霉素洗脱支架植入相关的支架内血栓,成为介入术后患者重要的致死、致残因素[2-4]。明确雷帕霉素诱导内皮细胞受损的具体分子机制是克服其不良反应的关键。本研究采用蛋白质组学作为筛选手段,系统探索雷帕霉素损伤血管内皮细胞作用的分子机制。
1 材料与方法
1.1材料
1.1.1试剂 雷帕霉素、硫脲、赖氨酸、二甲基甲酰胺等购自美国Sigma公司;CHAPS、甘氨酸、尿素、低熔点琼脂糖、蛋白质纯化试剂盒Clean-up Kit、定量试剂盒Quant Kit、玻璃板硅烷化剂、固相IPG干胶条、IPG buffer、三氟乙酸、荧光标记试剂盒[CyDye DIGE Flour (minimal Dye) Labelling Kit]、Deep purple荧光染料购自美国GE Healthcare公司;正丁醇购自德国Merck公司,乙腈购自美国Fisher公司,测序级胰酶购自美国Promega公司。
1.1.2仪器 等电聚焦电泳仪IPGphor Ⅲ、垂直电泳仪Ettan DALT Six System SDS、扫描仪Typhoon Trio、切胶仪Ettan Picker、酶解仪Ettan Digester、分析软件DeCyder V7.0 Software均购自美国GE Healthcare公司;MALDI-ToF-ToF质谱仪购自美国Bruker Dalton公司。
1.2方法
1.2.1人冠状动脉内皮细胞的培养和处理 参考已经报道的方法[5-6]。人冠状动脉内皮细胞HCAECs购自美国Cell Applications公司,培养按照说明书进行操作,本研究所使用的HCAECs为第4代。药物处理细胞之前,改为含0.1 % 胎牛血清且不含细胞因子的EGM-2基础培养基培养24 h。实验组为HCAECs用1 μmol/L雷帕霉素处理4 h。
1.2.2样品处理 在4 ℃预冷蔗糖缓冲液(10 mmol/L Tris,250 mmol/L sucrose)中洗涤细胞3次,去除残余培养基;每个100 mm皿中加入裂解液(7 mol/L Urea,2 mol/L Thiourea,30 mmol/L Tris,4% CHAPS)250 μL,刮下细胞并充分裂解;超声,4 ℃、12 000 g离心30 min,转移上清液,进行蛋白质纯化。蛋白质的纯化和定量严格按照2D Clean-up Kit或2D Quant Kit说明书进行。
1.2.3荧光差异双向电泳(2D-DIGE) 参照报道过的方法[7-8],采用2D-DIGE研究的标准设计,样品的荧光标记方法按照CyDye DIGE Flour Labelling Kit说明书操作。每个样品取50 μg,用400 pmol Cy2、Cy3或者Cy5 在冰浴、避光条件下标记30 min;然后用赖氨酸溶液终止反应。第一向电泳(等电聚焦)程序如下:30 V,12 h,step-n-hold;500 V,1 h,step-n-hold;1 000 V,1 h,step-n-hold;10 000 V,10 h,step-n-hold;Total 85 000 Vh。先后用DTT和IAA溶液进行两步平衡,然后进行第二向12.5%的十二烷基硫酸钠-聚丙烯酰胺凝胶电脉(SDS-PAGE)。
1.2.4凝胶扫描和差异蛋白的获取 准备制备胶2张(每胶500 μg),用Deep Purple stain kit进行制备胶的荧光染色。Typhoon Trio扫描仪对2D-DIGE 分析胶和Deep Purple制备胶的图像进行采集。DeCyder7.0软件进行差异蛋白分析,在Ettan Picker上切取差异蛋白质样品。
1.2.5蛋白质鉴定 切取的目的蛋白斑点在Ettan Digester仪器上进行胰酶酶解,然后在MALDI-ToF-ToF质谱仪上进行蛋白质的鉴定,Mascot进行数据检索。
2 结 果
2.12D-DIGE蛋白质组学研究 雷帕霉素处理后,HCAECs差异表达蛋白有85个,其中上调49个,下调36个,见图1。
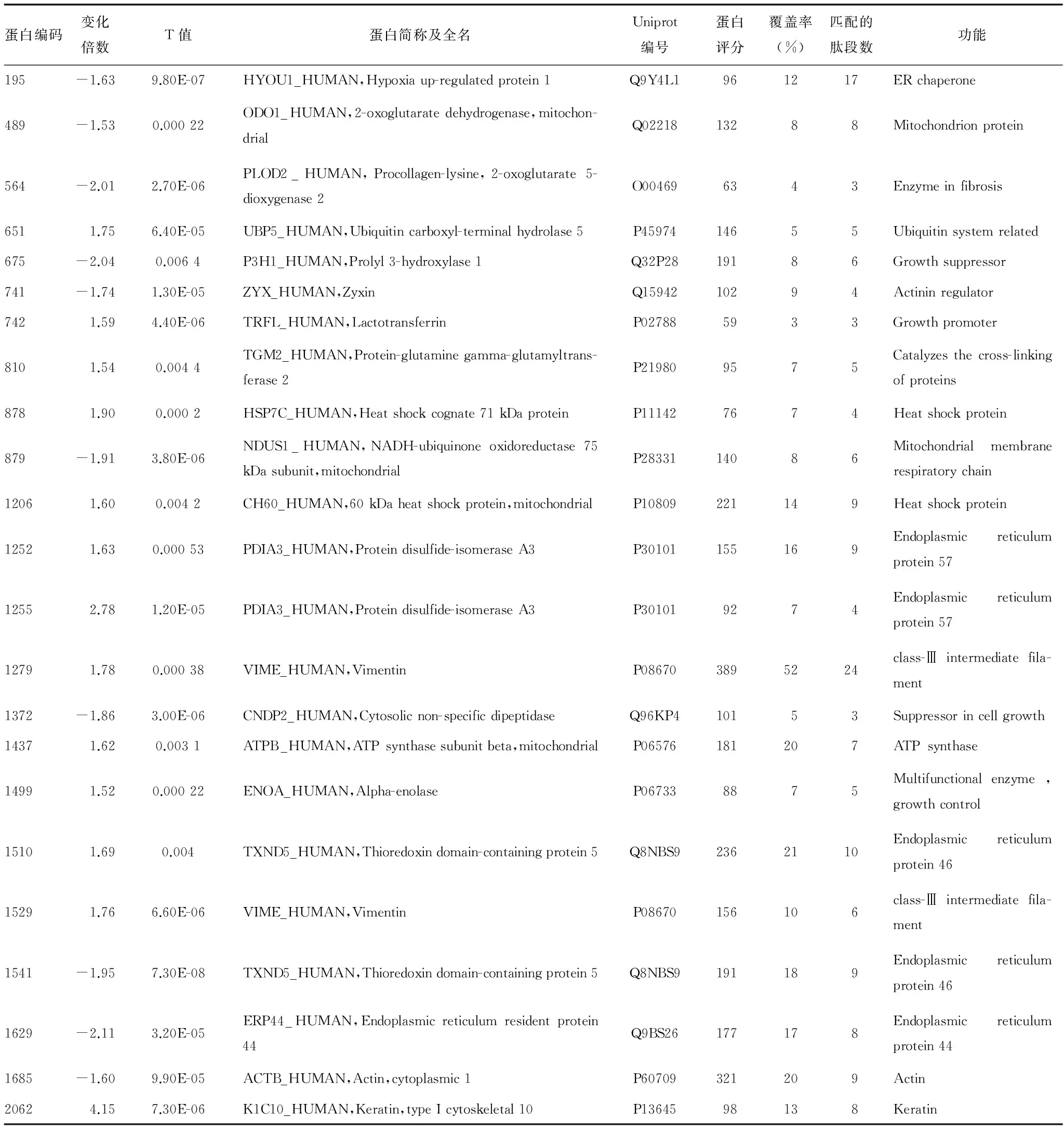
表1 2D-DIGE结合MALDI-ToF-ToF发现的差异蛋白表达
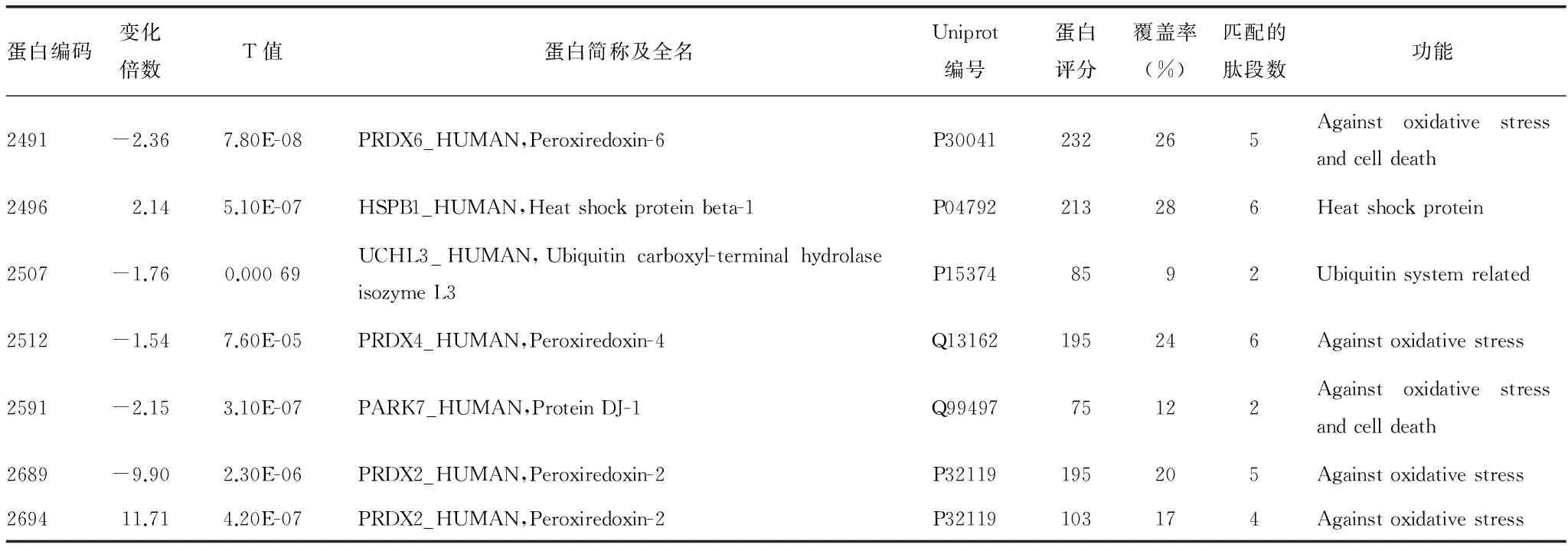
续表1 2D-DIGE结合MALDI-ToF-ToF发现的差异蛋白表达

图1 雷帕霉素诱导HCAECs损伤的2D-DIGE研究
2.2差异表达蛋白及其功能分类 挑选2D-DIGE发现的差异蛋白斑点50个,进行MALDI-ToF-ToF质谱鉴定,共鉴定出雷帕霉素诱导的HCAECs差异表达蛋白26种(不含重复的4个),见表1。主要有以下几类:内质网蛋白、线粒体蛋白、分子伴侣、结构蛋白和抗氧化蛋白等,符合细胞损伤的特征,见图2、3。
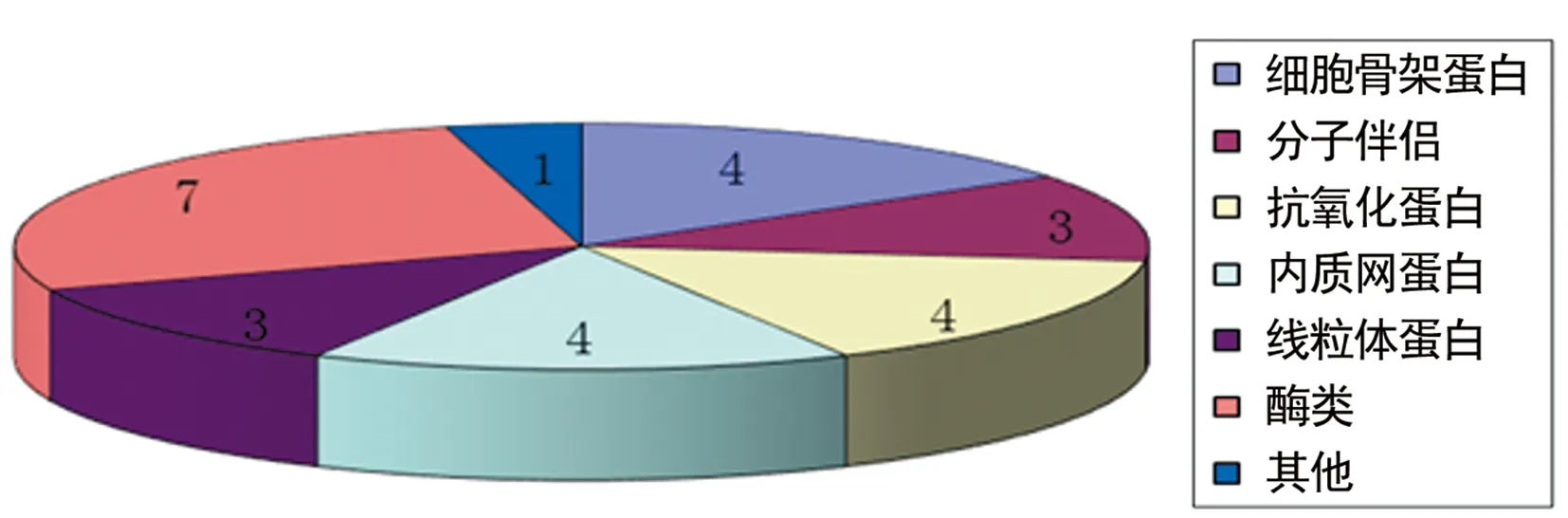
图2 雷帕霉素诱导的HCAECs差异表达蛋白的功能分类
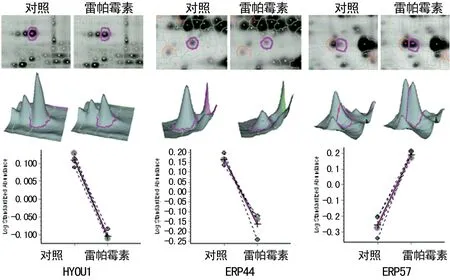
图3 雷帕霉素诱导蛋白HYOU1、ERP44和的表达变化
3 讨 论
内皮细胞功能紊乱不仅是动脉粥样硬化的关键因素之一,也是支架后血栓形成的重要原因。雷帕霉素是洗脱支架最常用的药物之一,其药理作用主要是诱导细胞周期停滞、抑制血管平滑肌细胞的增殖和迁移,从而抑制内膜增生[2-3]。雷帕霉素直接靶向并抑制丝/苏氨酸激酶mTOR,激活自噬。因此,从分子机制上来说,雷帕霉素具有阻滞细胞周期、抑制细胞的增殖和迁移,以及诱导细胞损伤的作用。
为了系统研究雷帕霉素对人冠状动脉内皮细胞作用的分子机制,笔者采用了蛋白质组学的策略,利用2D-DIGE结合MALDI-ToF-ToF的方法。本研究共发现差异蛋白斑点85个,质谱鉴定出其中的26种蛋白质。包括内质网蛋白、线粒体蛋白、分子伴侣、泛素系统相关蛋白等,符合细胞损伤的特征。本研究发现的内质网蛋白包括HYOU1(即ORP-150)、PDIA3(即ERP57)、TXND5(即ERP46)、ERP44,这几类蛋白与内质网应激相关,提示雷帕霉素损伤内皮细胞的机制之一可能是通过内质网应激。HYOU1在血管细胞中通过抑制内质网应激损伤发挥作用[9]。雷帕霉素诱导了HYOU1下调1.63倍,促使其保护效应减弱。笔者发现雷帕霉素下调了ERP44表达2.11倍,报道称干扰ERP44的表达会促发内质网应激损伤[10],而ERP57表达上调可能是一种应激性反应。已经报道雷帕霉素的靶点mTOR与内质网应激之间的关系较为复杂,存在多种形式的互相影响[11-12]。众所周知,雷帕霉素是自噬研究最常用的诱导剂。雷帕霉素诱导内质网自噬的机制之一就是mTORC1与ATG1/ULK复合物分离,
促使内质网自噬的成核和延伸[11]。内质网自噬已经成为当前研究的一个热点。雷帕霉素诱导内皮细胞内质网自噬是通过怎样的机制,也是以后值得关注和深入研究的一个方向。
[1]何薇,石元龙.急性冠状动脉综合征患者经皮冠状动脉介入治疗前后左心功能对比研究 [J].重庆医学,2015,44(25):3579-3580.
[2]ADELMAN S J.Sirolimus and its analogs and its effects on vascular diseases[J].Curr Pharm,2010,16(36):4002-4011.
[3]KHAN W,FARAH S,DOMB A J.Drug eluting stents:developments and current status[J].J Control Release,2012,161(2):703-712.
[4]龙向淑,吴强,张萍,等.症状不典型的冠状动脉药物支架内急性血栓形成2例 [J].重庆医学,2015,44(17):2447-2448.
[5]LIU S J,LIU W H,ZHONG Y,et al.Glycogen synthase kinase-3β is involved in C-reactive protein-induced endothelial cell activation[J].Biochemistry(Mosc),2013,78(8):915-919.
[6]LIU S J,ZHONG Y,YOU X Y,et al.Insulin-like growth factor 1 opposes the effects of C-reactive protein on endothelial cell activation[J].Mol Cell Biochem,2014,385(1/2):199-205.
[7]LIU W,ZHOU X W,LIU S,et al.Calpain-truncated CRMP-3 and -4 contribute to potassium deprivation-induced apoptosis of cerebellar granule neurons[J].Proteomics,2009,9(14):3712-3728.
[8]JIN S,SHEN J N,GUO Q C,et al.2-D DIGE and MALDI-TOF-MS analysis of the serum proteome in human osteosarcoma[J].Proteomics Clin Appl,2007,1(3):272-285.
[9]SANSON M,AUGÉ N,VINDIS C,et al.Oxidized low-density lipoproteins trigger endoplasmic reticulum stress in vascular cells:prevention by oxygen-regulated protein 150 expression[J].Circ Res,2009,104(3):328-336.
[10]CHANG Y,WU Y,LIU W,et al.Knockdown of ERp44 leads to apoptosis via activation of ER stress in HeLa cells[J].Biochem Biophys Res Commun,2015,463(4):606-611.
[11]KAPUY O,VINOD P K,BNHEGYI G.mTOR inhibition increases cell viability via autophagy induction during endoplasmic reticulum stress - An experimental and modeling study[J].FEBS Open Bio,2014,4:704-713.
[12]RABINOWITZ J D,WHITE E.Autophagy and metabolism[J].Science,2010,330(6009):1344-1348.
