胰岛素对大鼠胰岛β细胞VGLUT2基因表达的调控研究*
2018-03-28王树文林鸿程林荣文陈远寿
王树文,李 涛,林鸿程,杨 丰,林荣文△,陈远寿
(1.广东医科大学第二临床医学院,广东东莞 523808;2.遵义医学院生理教研室,贵州遵义 563099)
糖尿病(diabetes mellitus,DM)是一种由多种病因引起的慢性非传染性疾病,其患病率呈逐年递增趋势,已对全球居民的健康造成严重影响[1]。据国际糖尿病联盟(IDF)最新数据显示,2014年全球糖尿病估测患者达到3.87亿,其中2型糖尿病(type 2 diabetes mellitus,T2DM)占90%以上[2]。随着DM死亡人数及医疗费用支出的不断增加,DM疾病的负担已日趋严重。然而,DM具体的发病机制至今仍未完全明确,这给临床诊治带来很大困难。因此,深入研究DM发病机制对预防DM及提高其治疗效果具有重要意义。据报道,T2DM的发生、发展与胰岛素的分泌密切相关,囊泡谷氨酸转运子2(vesicular glutamate transporter 2,VGLUT2)转运谷氨酸进入胰岛素分泌囊泡的过程是胰岛素分泌的限速步骤[3-4]。由于胰岛素是临床上治疗DM的首选,所以对于胰岛素分泌机制的深入研究有利于对DM发病机制的理解。
本实验以大鼠胰岛β细胞RIN-5F作为研究对象,从胰岛素对VGLUT2基因表达调控入手,通过Real-time qPCR、Western blot、siRNA干扰等方法,观察胰岛素对VGLUT2的mRNA及蛋白表达水平的影响,阐明胰岛素信号通路中胰岛素受体(insulin receptor,IR)、胰岛素受体底物(insulin receptor substrate,IRS)与VGLUT2表达之间的关系,以期为明确DM的发生机制提供线索。
1 材料与方法
1.1材料
1.1.1实验细胞 RIN-5F由上海生科院细胞库提供。
1.1.2试剂 羊抗鼠VGLUT2多克隆抗体(美国Sigma公司);胰岛素、胎牛血清(美国Gibco公司);二喹啉甲酸(BCA)蛋白浓度测定试剂盒,一抗、二抗稀释液(碧云天生物科技研究所);IgG-辣根过氧化物酶(HRP)、IR siRNA、IRS-1 siRNA、IRS-2 siRNA、siRNA Transfection Medium、Control siRNA、siRNA Transfection Reagent(广州锐博奥公司);LipofectamineTM2000(美国Invitrogen公司)。
1.1.3仪器 7500定量PCR仪(美国ABI公司);成像仪、电泳槽(美国Bio7Rad公司);ND-1000微量核酸蛋白检测仪(美国Nanodrop公司)。
1.2方法
1.2.1培养RIN-5F (1)RIN-5F的复苏、培养、传代及冻存按照文献[5]报道方法操作。(2)细胞计数:吸取10 μL细胞悬液滴于盖片与计数板间,静置,然后镜下计算细胞总数。细胞数/mL=4大格细胞总数/4×104。
1.2.2处理RIN-5F (1)以1 mmol/L胰岛素为母液,配制不同浓度(0、50、100、200、500、1 000 nmol/L)胰岛素各15 mL;(2) 大鼠胰岛β细胞RIN-5F分装至6个培养皿及1个6孔板中;(3)用以上6种浓度胰岛素分别处理RIN-5F 30 h。
1.2.3实验分组及RNA干扰实验 首批分组为:空白组(Blank组)、LipofectamineTM2000组(Lip2000组)、Control-siRNA组、IR-siRNA组。第2批分组为:Blank组、Lip2000组、Control-siRNA组、IRS1-siRNA组及IRS2-siRNA组。根据设计组别分装RIN-5F至相应的培养皿和6孔板中,然后用不同的siRNAs处理RIN-5F。
1.2.4蛋白质的提取 收取细胞(6个培养皿),PBS洗1遍,加入RIPA细胞裂解液裂解,12 000 r/min离心30 min后取上清液即为RIN-5F的总蛋白样品,然后以BCA法测定蛋白质浓度。于样品中加入5×十二烷基硫酸钠(SDS)蛋白上样缓冲液(V/V=4∶1),水浴(100 ℃)10 min后立即置于冰中直至其完全冷却,最后按每孔5 μg蛋白量上样。
1.2.5总RNA的提取 按Invitrogen操作说明Trizol 法提取样品总RNA;RNA用变性琼脂糖凝胶电泳检测完整性[6]。吸取1 μL RNA溶液样品,测定(用NanoDrop分光光度计)260 nm及280 nm的吸光度(A)值,得到RNA浓度。RNA的A260/A280比值必须在1.8~2.0。分装样品(以20 μL为最小单位),保存(-86 ℃,1年内有效)。
1.2.6VGLUT2蛋白的测定 采用Western blot法,以β-actin为内参,洗膜结束立刻配制电化学发光(ECL)显影液,接着浸泡PVDF膜5 min,然后曝光显影(用成像系统)得出图片,通过BandScan 图像分析的软件来分析其光密度值,并计算出VGLUT2的相对含量。
1.2.7PCR引物设计 引物经Shanghai biological engineering company合成:VGLUT2上游引物5′-AGA AGG CTC CGC TAT GCG ACT G-3′,下游引物5′-ATC CTC CTG GAA TCT GGG TGA TG-3′,扩增片断长度351 bp;内参β-actin上游引物5′-TCA TGA AGT GTG ACG TTG ACA TCC GT-3′,下游引物5′-CTT AGA AGC ATT TGC GGT GCA CGA TG-3′,扩增片断长度267 bp。
1.2.8Real-time qPCR 每组4个样品cDNA,每个重复进行3个平行实验,参照Takara的One Step SYBR PrimeScriptTMRT-PCR试剂盒说明书进行反应[7]。通过v 1.4 SDS软件分析所得数据。
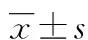
2 结 果
2.1不同浓度胰岛素对VGLUT2 mRNA和蛋白表达的影响 胰岛素浓度为100、200 nmol/L时VGLUT2 mRNA及蛋白表达均受到明显抑制(P<0.05),并且在100 nmol/L时所受抑制最明显,见图1、2。

图1 不同浓度胰岛素对VGLUT2 mRNA表达的影响
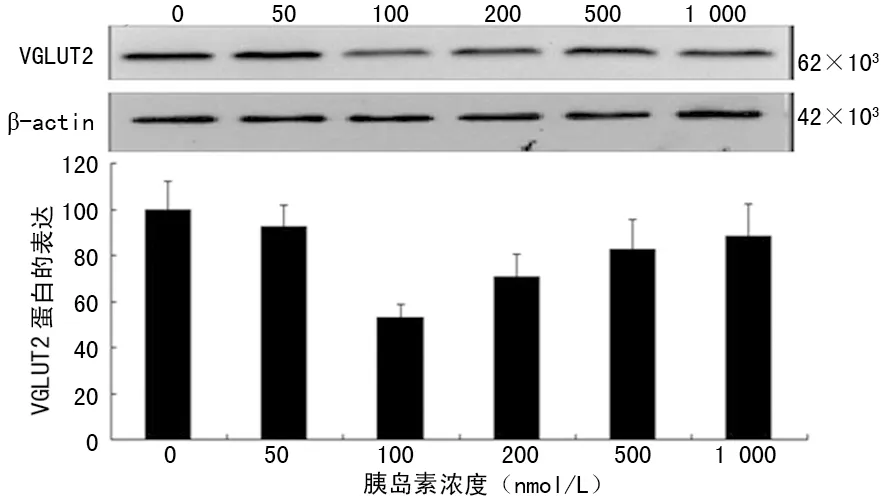
图2 不同浓度胰岛素对VGLUT2蛋白表达的影响
2.2100 nmol/L胰岛素在不同时间点对VGLUT2的mRNA和蛋白表达的调节 与0 h比较, VGLUT2 mRNA和蛋白表达在12、18、24 h均受到明显抑制(P<0.05),其中在12 h时mRNA表达受抑制最为明显,在24 h时蛋白表达受抑制最为明显,见图3、4。
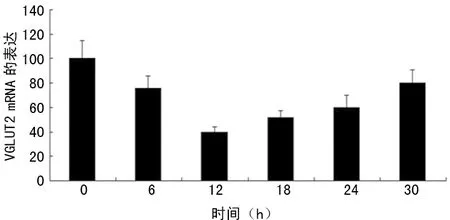
图3 100 nmol/L胰岛素在不同时间点对VGLUT2 mRNA表达的影响
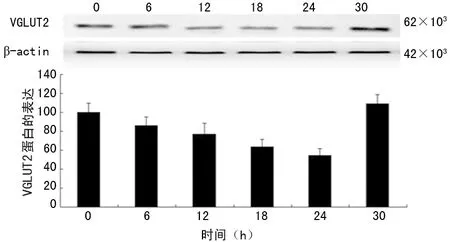
图4 100 nmol/L胰岛素在不同时间点对VGLUT2 蛋白表达的影响
2.3胰岛素信号通路的IR及IRS对VGLUT2表达的影响
2.3.1IR-siRNA干扰对IR mRNA表达的影响 与Blank组、Lip2000组、Control-siRNA组比较,IR-siRNA组IR mRNA表达受到明显抑制(P<0.05),见图5。
2.3.2IRS1-siRNA及IRS2-siRNA干扰对IRS1、IRS2 mRNA表达的影响 IRS1-siRNA组及IRS2-siRNA组与Blank组、Lip2000组及Control-siRNA组比较,IRS1、IRS2的mRNA表达均受到明显抑制(P<0.05),见图6。

图5 IR-siRNA干扰对RIN-5F细胞的IR mRNA表达的影响

图6 IRS1-siRNA和IRS2-siRNA干扰对IRS1和IRS2 mRNA表达的影响
2.3.3IR-siRNA干扰对100 nmol/L胰岛素抑制VGLUT2 mRNA和蛋白表达的影响 与Blank组、Lip2000组及Control-siRNA组比较,IR-siRNA组VGLUT2 mRNA和蛋白表达明显上调(P<0.05),见图7、8。
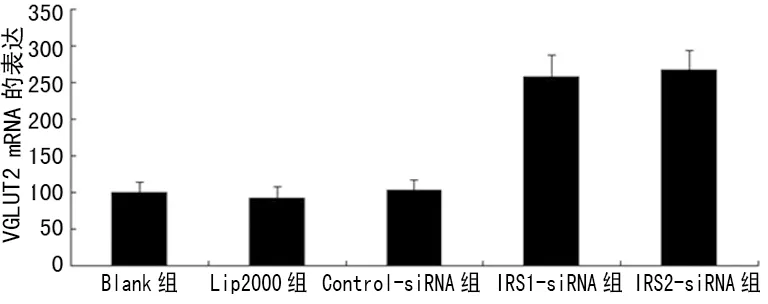
图9 IRS1/IRS2-siRNA干扰对100 nmol/L胰岛素抑制VGLUT2 mRNA表达的影响
2.3.4IRS1/IRS2-siRNA干扰对100 nmol/L胰岛素抑制VGLUT2 mRNA和蛋白表达的影响 与Blank组、Lip2000组及Control-siRNA组比较,IRS1-siRNA及IRS2-siRNA组VGLUT2 mRNA和蛋白表达明显上调(P<0.05),见图9、10。

图10 IRS1/IRS2-siRNA干扰对100 nmol/L胰岛素抑制VGLUT2蛋白表达的影响
3 讨 论
胰岛素抵抗和胰岛素代偿性分泌不足会导致T2DM的发生。明确胰岛素的分泌机制将有助于对DM病因的理解。在胰腺细胞分泌胰岛素的过程中,谷氨酸向分泌囊泡中的转运由VGLUT2完成,经过这种逆浓度梯度的转运造成的分泌囊泡内外的谷氨酸浓度差是驱动分泌囊泡向细胞膜运动的主要动力,这一步骤也是胰岛素分泌的限速步骤[8]。VGLUT2的基因表达受葡萄糖浓度的调控[9],由于胰岛素是治疗DM的首选,那么这种外源的胰岛素对于患者胰岛功能的影响是什么,目前尚不清楚。
从本实验的结果可以得知,在无糖条件下,胰岛素在特定浓度和时间点均可明显下调VGLUT2 mRNA和蛋白表达,并且其最佳浓度为100 nmol/L,最佳作用时间点为12 h(mRNA水平)和24 h(蛋白质水平)。
利用IR-siRNA、IRS1-siRNA及IRS2-siRNA分别干扰RIN-5F后,100 nmol/L胰岛素对VGLUT2基因表达的抑制明显下降。据此可以推断,在该过程中IR、IRS1及IRS2 3种参与因子发挥了重要作用。研究表明,胰岛素与IR结合后能够激活胰岛素信号通路,从而调控细胞的分化、增殖、生存及代谢[10-11]。IRS亦具有连接胰岛素信号通路中IR的功能,并且在胰岛素抵抗过程中起着举足轻重的作用[12-13]。有报道显示,IRS1和IRS2能够通过不同途径对胰岛素信号传导通路进行反馈调控进而影响胰岛素的分泌[14]。另外,胰岛素信号通路受阻,则会造成胰岛β细胞功能损伤和外周胰岛素抵抗;但值得注意的是,在T2DM发病初期,胰腺尚能通过代偿功能刺激胰岛素产生和分泌的增加,维持血糖的稳定,患者此时并未出现DM的临床症状;随着病情的进一步发展,胰腺最终会丧失代偿功能而导致T2DM的发生[15-18]。以上研究表明,在胰岛素信号通路中,VGLUT2基因是通过IR、IRS1、IRS2这3种参与因子对胰岛素的分泌进行了反馈调控。
综上所述,本实验明确了胰岛素对VGLUT2基因表达进行反馈调控的信号通路及其信号通路中参与因子(IR、IRS1、IRS2)的功能,阐明了胰岛素、VGLUT2基因及参与因子之间的关系,这将为DM发病机制的理论研究提供新的参考和为临床诊治DM提供新的思路。
[1]PASALA S K,RAO A A,SRIDHAR G R.Built environment and diabetes[J].Int J Diabetes Dev Ctries,2010,30(2):63-68.
[2]汪会琴,胡如英,武海滨,等.2型糖尿病报告发病率研究进展[J].浙江预防医学,2016,28(1):37-39.
[3]TENGHOLM A,GYLFE E.Oscillatory control of insulin secretion[J].Mol Cell Endocrinol,2009,297(1/2):58-72.
[4]陈立强.谷氨酸信号转导与胰岛素慢分泌调节机制研究进展[J].国际检验医学杂志,2011,32(3):357-359.
[5]王伟福,宁晓燕,陈晓武,等.维生素D3对胰腺癌PANC-1细胞中PTCH、Gli-1基因表达及细胞增殖凋亡的影响[J].广东医学,2016,37(6):815-819.
[6]梁敏,王海峰,王剑松,等.不同分级与分期膀胱癌人微小核糖核酸3658和人源性长寿保障基因Ⅱ型表达的变化[J].广东医学,2016,37(14):2110-2114.
[7]田戈,姜敏.Nrf2-ARE 信号通路在调节慢性阻塞性肺疾病氧化失衡过程中的作用机制[J].广东医学,2016,37(12):1808-1810.
[8]MAECHLER P,GJINOVCI A,WOLLHEIM C B.Implication of glutamate in the kinetics of insulin secretion in rat and mouse perfused pancreas[J].Diabetes,2002,51(Suppl 1):S99-102.
[9]LI T,BAI L,LI J,et al.Sp1 is required for glucose-induced transcriptional regulation of mouse vesicular glutamate transporter 2 gene[J].Gastroenterology,2008,134(7):1994-2003.
[10]RUTTER G A.Insulin secretion:feed-forward control of insulin biosynthesis?[J].Curr Biol,1999,9(12):R443-445.
[11]OHSUGI M,CRAS-MNEUR C,ZHOU Y,et al.Reduced expression of the insulin receptor in mouse insulinoma(RIN-5F)cells reveals multiple roles of insulin signaling in gene expression,proliferation,insulin content,and secretion[J].J Biol Chem,2005,280(6):4992-5003.
[12]LEIBIGER I B,LEIBIGER B,BERGGREN P O.Insulin signaling in the pancreatic beta-cell[J].AnnuRev Nutr,2008,28:233-251.
[13]唐辰义,周后德.胰岛素受体底物家族成员的结构和组织特异性与功能的关系[J].临床与病理杂志,2016,36(3):295-302.
[14]BRIAUD I,DICKSON L M,LINGOHR M K,et al.Insulin receptor substrate-2 proteasomal degradation mediated by a mammalian target of rapamycin (mTOR)-induced negative feedback down-regulates protein kinase B-mediated signaling pathway in beta-cells[J].J Biol Chem,2005,280(3):2282-2293.
[15]TSUNEKAWA S,DEMOZAY D,BRIAUD I,et al.FoxO feedback control of basal IRS-2 expression in pancreatic beta cells is distinct from that in hepatocytes[J].Diabetologia,2011,54(1):S50.
[16]DEMOZAY D,TSUNEKAWA S,BRIAUD I,et al.Specific glucose-induced control of insulin receptor substrate-2 expression is mediated via Ca2+-dependent calcineurin/NFAT signaling in primary pancreatic islet β-cells[J].Diabetes,2011,60(11):2892-2902.
[17]SIMON-SZABO L,KOKAS M,GREFF Z,et al.Novel compounds reducing IRS-1 serine phosphorylation for treatment of diabetes[J].Bioorg Med Chem Lett,2016,26(2):424-428.
[18]KANETO H.Pathophysiology of type2 diabetes mellitus[J].Nibon Rinsho,2015,73(12):2003-2007.
