miR-107靶向细胞周期蛋白E1对人非小细胞肺癌A549细胞功能的影响研究
2018-03-28刘荷英季洪健姚秋菊
刘荷英,王 辉,季洪健,姚秋菊
(上海解放军第85医院呼吸内科 200052)
肺癌是对人类健康与生命危害最大的一种恶性肿瘤,也是恶性肿瘤的首位死因,约占恶性肿瘤死因的30%[1]。其中,约80%的肺癌是非小细胞肺癌,尽管手术、放疗、化疗和靶向治疗技术在不断地提高,但是NSCLC的总体5年生存率仍小于16%[2-3]。微小RNAs(microRNAs,miRNAs)是一类长21~25个核苷酸的具有非编码功能的小RNA。miRNAs通过降解靶基因mRNA或阻遏其转录后翻译在肿瘤形成和发展中发挥着重要的作用,其可能扮演着原癌基因、抑癌基因、肿瘤转移侵袭、凋亡和耐药调节等诸多角色[4]。
近年来对miRNA在肺癌中作用的研究逐渐成为了一个热点,这对未来肺癌的诊断和治疗带来了广阔的前景[5-7]。诸多研究表明,miR-107在胶质瘤、乳腺癌、胃癌和肺癌中均表达下调[8-12]。同时研究还指出,过表达miR-107能够靶向脑源性神经营养因子(BDNF)间接调控PI3K/AKT信号通路,从而抑制非小细胞肺癌细胞的增殖和侵袭[11]。也有研究[12]指出,miR-107通过靶向CDK8增加非小细胞肺癌细胞对化疗药物顺铂的敏感性,但是对于miR-107调控非小细胞肺癌细胞周期的具体机制目前还尚未有文献详细报道。
本课题首先在非小细胞肺癌A549细胞株中上调miR-107水平研究其对细胞增殖和周期的影响,然后构建含预测靶基因 3′-非编码区(3′-untranslated region,3′-UTR)的质粒行双荧光素酶报告基因实验检测miR-107与下游靶基因的结合位点,并用实时定量逆转录PCR和Western blot检测miR-107对靶基因的mRNA和蛋白表达的影响,最后检测在非小细胞肺癌细胞中沉默靶基因的表达后对A549细胞增殖和周期的影响。本课题初步探讨了miR-107在肺癌细胞生长中的可能作用及其机制,为后续基于miRNA的肺癌临床生物治疗的新靶点开发提供实验依据。
1 材料与方法
1.1材料 人非小细胞肺癌A549细胞和HEK293T细胞购自中国科学院上海生命科学研究院细胞资源中心;miR-107模拟物、抑制模拟物和阴性对照模拟物(上海吉玛公司);小干扰RNA(small interfering RNA,siRNA)和阴性对照siRNA(上海锐博生物);DMEM培养基和胎牛血清(美国Gibco公司);青-链霉素(上海吉诺生物科技有限公司);TRIzol和lipofectamine2000(美国Invitrogen公司);噻唑蓝(MTT)和碘化丙锭(PI,美国Sigma公司);二甲基亚砜和结晶紫(申能博彩生物技术有限公司);双荧光素酶报告基因检测试剂盒(美国Promega公司);抗体细胞周期蛋白E1(CCNE1)和β-actin(美国Abcam公司);Synergy2多功能酶标仪(美国BioTek公司);FCASCalibur 流式细胞仪(美国BD公司);7900HT荧光定量仪(美国ABI公司);Odyssey蛋白分析成像系统(美国LICOR公司)。
1.2方法
1.2.1细胞培养和转染实验 A549和HEK293T细胞加含10%胎牛血清和1%青-链霉素的DMEM培养液,置于37 ℃、CO2体积分数为5%的培养箱中培养。在倒置光学显微镜下观察细胞生长情况,待单层细胞生长达到80%融合时,用0.25%胰蛋白酶消化传代,取对数生长期的细胞用于后续实验。将处于对数生长期的A549细胞按每孔3×105接种到6孔板内,培养细胞融合度为40%~50%时进行细胞转染,转染步骤参照lipofectamine2000转染试剂说明书,转染培养5 h后换成正常培养基。实验分组:脂质体+miR-107模拟物过表达组(OV-miR-107组),脂质体+miR-107抑制模拟物下调组(KD-miR-107组)和脂质体+阴性对照模拟物组(NC组)。siRNA的细胞转染方法同上,3条CCNE1的siRNA靶序列分别为siRNA-1:5′-CGC ACG AGA TCT ACG ACA T-3′,siRNA-2:5′-ACA ATC GGA TGA TGA TTA A-3′,siRNA-3:5′-GCA GCA GCA TCT AGT ACC T-3′。
1.2.2实时定量逆转录PCR 按照Trizol试剂说明书提取细胞中总RNA。参照Takara公司PrimeScript RT-PCR kit说明书反转录成cDNA,然后进行实时荧光定量PCR反应。CCNE1上游引物5′-TTT CAG GGT ATC AGT GGT G-3′,下游引物5′-ACA TGG CTT TCT TTG CTC-3′;GAPDH上游引物5′-AAG GTC GGA GTC AAC GGA TT-3′,下游引物5′-CTG GAA GAT GGT GAT GGG ATT-3′。反应条件为:94 ℃ 5 min;94 ℃ 20 s,57 ℃ 45 s,72 ℃ 45 s,扩增30个循环;94 ℃绘制熔解曲线。实验设3个平行复孔,所有样品重复检测3次。
1.2.3MTT检测细胞增殖 实验组和对照组A549细胞消化重悬计数,以每孔5 000个分别接种入96孔板。然后分别于24、48、72、96和120 h进行如下操作:每孔加入20 μL MTT溶液(5 mg/L),继续培养4 h。吸弃上清,每孔加入150 μL二甲基亚砜,置摇床上低速振荡10 min,使结晶物充分溶解。在酶联免疫检测仪测量490 nm处各孔的光密度(OD)值。实验每组设6个复孔,重复3次。
1.2.4流式细胞实验检测细胞周期 转染36 h后细胞消化重悬离心,每管计数1×106个细胞, PBS洗涤2次;加入预冷70%乙醇4 ℃固定过夜;离心去上清,PBS清洗后加入0.05 g/L PI 50 μL,室温避光染色30 min,流式细胞仪检测细胞周期。
1.2.5双荧光素酶报告基因实验 应用在线生物信息预测软件对hsa-miR-107可能作用的靶基因进行预测,选择的原则是该基因具有物种保守性。预测结果显示,miR-107 靶向结合CCNE1 3′-UTR。构建含有CCNE1 3′-UTR的psiCHECK-2载体质粒。将HEK293T细胞接种于12孔板上,细胞密度为80%~90%进行转染。实验分组:质粒+miR-107模拟物+脂质体(miR-107组);质粒+NC模拟物+脂质体(NC组)。转染30 h后终止培养,PBS洗2次,每孔细胞加入100 μL的裂解缓冲液,室温轻微振摇15 min,收集细胞裂解液于干净的EP管中;在白色不透光的96孔板加入20 μL样品,加入100 μL的LARⅡ液,立刻测荧光值;将板拿出,继续在孔中加入100 μL Stop Glo Reagent液,迅速吹打均匀,再测值。最后将所得到的数据标准化后进行分析。
1.2.6Western blot检测CCNE1蛋白表达 将细胞用预冷的PBS 洗涤2次,RIPA 裂解液裂解细胞,用BCA蛋白浓度测定试剂盒定量蛋白。取每孔20 μg蛋白进行10% 十二烷基硫酸钠-聚丙烯酰胺凝胶电脉(SDS-PAG),将电泳分离后的蛋白转移至硝酸纤维素膜;5%脱脂奶粉溶液室温下封闭1 h,加入1∶1 000稀释的单克隆抗体CCNE1和β-actin(内参照)抗体,4 ℃反应过夜;PBST洗膜3次,加入1∶1 000稀释的二抗,室温反应30 min;PBST 洗膜3次,应用Odyssey激光成像系统检测蛋白条带。实验重复3次。
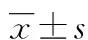
2 结 果
2.1过表达miR-107对细胞增殖的影响 转染48 h后,OV-miR-107组较KD-miR-107组和NC组明显抑制细胞的增殖(P<0.05),浓度25~100 nmol/L呈较为明显的剂量依赖性,浓度超过100 nmol/L后OV-miR-107对细胞增殖的抑制能力基本保持稳定,后续实验采用100 nmol/L的浓度。细胞经100 nmol/L浓度转染后,在不同时间点OV-miR-107组较KD-miR-107组和NC组对细胞增殖能力的抑制呈现明显的时间依赖性(P<0.05),在72 h时抑制细胞增殖能力最明显,见图1。
A:不同浓度模拟物转染48 h后各组OD值;B:miR-107过表达模拟物转染浓度为100 nmol/L时,不同时间点OD值
图1过表达miR-107对细胞增殖的影响

A:OV-miR-107组;B:KD-miR-107组;C:NC组;D:各组细胞周期占比情况
图2过表达miR-107对细胞周期的影响
2.2过表达miR-107对细胞周期的影响 细胞转染36 h后,OV-miR-107组、KD-miR-107组和NC组细胞G0G1所占比例分别为(68.880±0.175)%、(40.830±0.271)%和(46.160±0.182)%,差异有统计学意义(P<0.05)。OV-miR-107组细胞S期及G2M期所占比均少于KD-miR-107组和NC组(P<0.05),见图2。
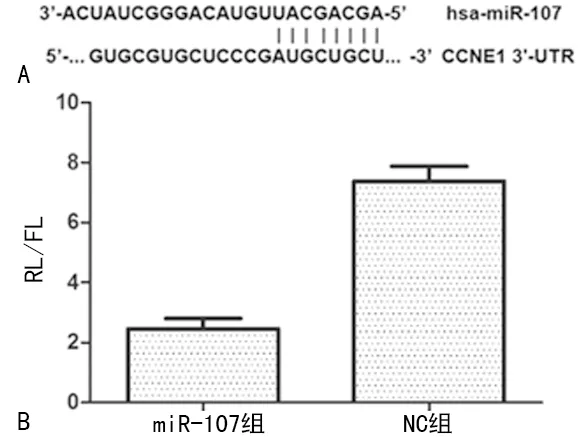
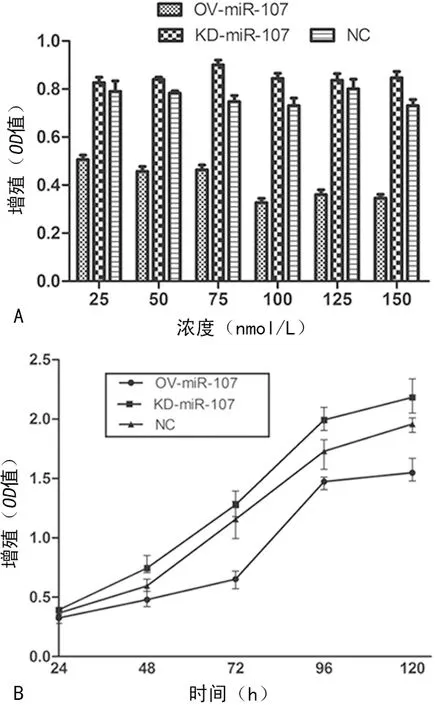
图3 双荧光素酶报告基因检测miR-107与CCNE1 3′-UTR的结合位点
2.3过表达miR-107对细胞CCNE1 mRNA和蛋白表达的影响 生物信息学网站显示CCNE1的3′-UTR区域246~253 bp是miR-107的结合位点,miR-107组海肾荧光素酶(RL)/萤火虫荧光素酶(FL)值小于NC组(P<0.05),见图3。miR-107组CCNE1 mRNA和具体数值蛋白表达水平均较NC组低,见图4。
2.4siRNA转染后细胞CCNE1 mRNA表达 siRNA转染36 h后,参照阴性对照组,转染靶向CCNE1的3条siRNA的CCNE1 mRNA表达水平均明显降低(P<0.05)。3条siRNA中,siRNA-2的siRNA沉默效果最好,其干扰效率达到(82.0±0.3)%,后续实验采用siRNA-2,见图5。
A:实时定量逆转录PCR检测CCNE1 mRNA表达;B:Western blot检测CCNE1蛋白表达
图4过表达miR-107对细胞CCNE1 mRNA和蛋白表达的影响
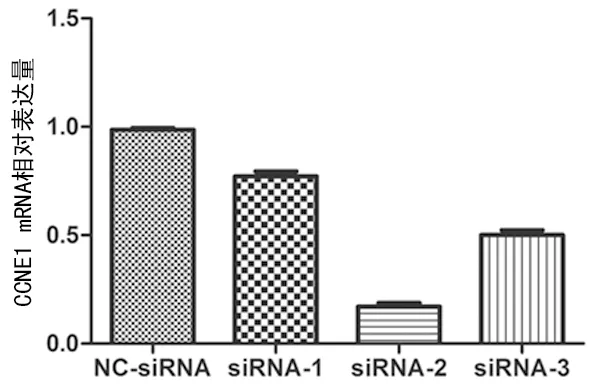
图5 转染siRNA后各组细胞CCNE1 mRNA表达
2.5CCEN1 siRNA对细胞增殖和周期的影响 siRNA转染后24 h,NC-siRNA组和siRNA-2组对细胞的增殖抑制无明显区别,但在48、72和96 h,siRNA-2组对细胞增殖的抑制明显强于NC-siRNA组(P<0.05)。siRNA转染36 h后,siRNA-2组细胞G0G1期所占比例明显高于NC-siRNA组,而siRNA-2组细胞S期和G2M期细胞占比明显低于NC-siRNA组(P<0.05),见图6。
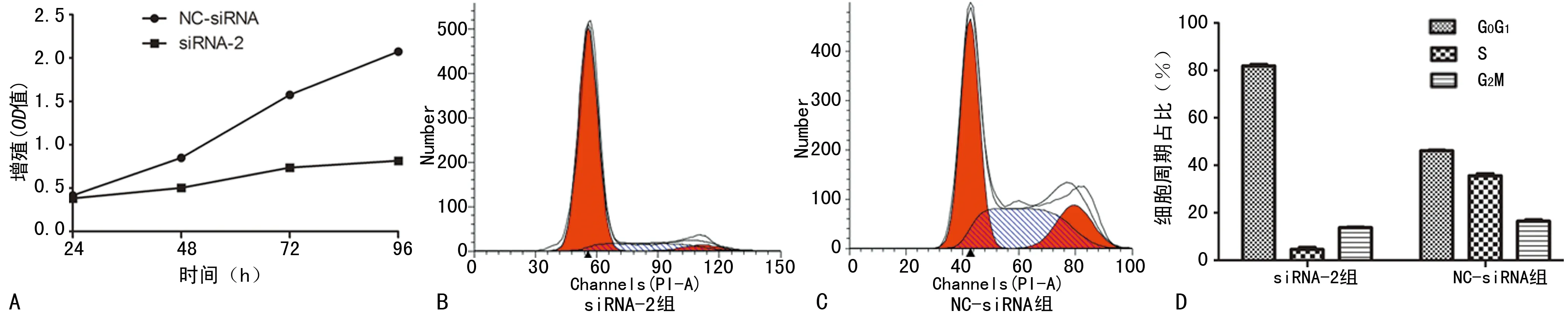
图6 CCEN1 siRNA对细胞增殖和周期的影响
3 讨 论
非小细胞肺癌是最常见的肺癌类型,但早期不易发现,患者确诊时往往已经处于中晚期,失去手术机会,于是化疗和分子靶向治疗为其主要治疗手段。对于常规化疗无效或不能耐受联合化疗的晚期患者,化疗的效果非常有限且疗效较差,故这部分患者的5年生存率非常低[2]。根据分子生物学的信号转导通路发现的靶向药物治疗非小细胞肺癌展现了一定的优越性,如吉非替尼,但是以往报道称吉非替尼只能抑制肿瘤的生长而不会使肿瘤最终得到缓解。这是因为肿瘤的发生和发展是一个非常复杂的过程,吉非替尼仅针对酪氨酸激酶传导通路,所起的治疗作用也就有一定的局限性。很多学者对非小细胞肺癌中的差异表达的miRNAs进行深入研究并探索其发生的机制,以期望能够通过miRNAs 检查筛选早期非小细胞肺癌和进一步指导靶向药物治疗的研发。
笔者通过查阅文献发现miR-107在多种肿瘤中呈低表达,如胃癌、乳腺癌、肺癌等[9-12],在一定程度上说明miR-107的异常表达可能与这些肿瘤的发生和发展有关联。XIA等[11]通过研究证实miR-107在30例非小细胞肺癌临床标本和细胞系中呈低表达,同时发现miR-107能靶向抑制BDNF表达,进一步阻滞PI3K/AKT信号通路,最终抑制非小细胞肺癌细胞的侵袭能力。ZHANG等[12]发现miR-107靶向抑制CDK8后非小细胞肺癌细胞对化疗药物顺铂的敏感性增加。这些研究结果说明miR-107在非小细胞肺癌发生和发展中扮演着抑癌基因的作用。为证实这一结论,笔者在A549细胞中分别过表达和下调miR-107行细胞功能实验。MTT实验结果显示过表达miR-107组细胞较下调miR-107组和阴性对照组明显抑制了细胞的增殖,流式细胞周期结果显示过表达组较下调miR-107组和阴性对照组明显阻滞了更多的细胞停留在G0G1期,细胞功能学实验证实miR-107在非小细胞肺癌中发挥着抑癌基因的作用。
为了探讨过表达miR-107能够抑制细胞增殖和阻滞细胞周期的具体机制,笔者通过targetscan、miRanda和miRBase生物信息学网站对miR-107下游靶基因进行预测,3个数据库结果交集发现CDK8和CCNE1序列上均有miR-107明确的结合位点。因为miRNA通过其序列5′-端的碱基可与多个基因的mRNA的靶点结合,即一个miRNA可与多个靶基因相结合。CDK8是细胞周期的调控因子,可激活Cyclin C,作用于G1S期,调控正常细胞周期,对于CDK8在肺癌组织中表达情况还未有大样本临床资料报道。CCNE1属于细胞周期蛋白家族中的一员,细胞周期蛋白是调控细胞周期和变构激活周期蛋白依赖性激酶所必需的蛋白,是调控细胞从G0G1期到S期转换过程中最基本和最广泛的限速调节因子,CCNE1通过特异性结合和激活CDK2,正性调控使细胞从G0G1期进入到S期。文献报道在肺癌组织中CCNE1呈过表达状态[13],同时在非小细胞肺癌中常常可以观察到细胞组织纺锤体和中心体异常,这是因为细胞中大量表达CCNE1引起的[14]。也就是说CCNE1在肺癌的发生、发展中可能扮演着促癌基因的角色。而且目前还没有文献报道miR-107对CCNE1基因的调控机制。笔者构建含有CCNE1基因3′-UTR片段的psiCHECK-2/CCNE1 3′-UTR质粒,转染293T细胞后行双荧光素酶报告基因实验,实验结果提示miR-107能直接结合质粒的CCNE1的3′-UTR片段。鉴于双荧光素酶实验只能验证外源miRNA和外源CCNE1 3′-UTR的结合位点,笔者检测了miR-107组和NC组CCNE1 mRNA和蛋白表达水平。本实验结果提示miR-107组细胞CCNE1 mRNA和蛋白表达水平较NC组明显下调,说明miR-107能直接结合CCNE1的3′-UTR区域,介导其mRNA的降解,并最终下调蛋白水平。
本文将CCNE1 siRNA转染至A549细胞,通过实时荧光定量PCR选择siRNA-2序列进行后续细胞功能实验。MTT检测结果显示,转染siRNA-2的A549细胞增殖能力明显低于对照组,且其生长抑制随转染时间的延长而增加。流式周期显示siRNA-2组较对照组阻滞更多细胞停留在G0G1期。细胞周期中G1S期转换的交界点是细胞生长调控的关键调控点,而CCNE1在非小细胞肺癌细胞高表达将会导致细胞的无限制增殖。
综上所述,CCEN1是细胞周期中重要的调节因子,miR-107靶向调节CCNE1影响A549细胞的增殖和调控细胞周期,进一步证实miR-107是介导肺癌发生、发展的重要miRNA,并可能起着抑癌基因的作用。但miR-107对CCNE1具体调控机制,以及在CCNE1调控的G1/S交界点是否有特定因子的失调、缺失或过表达,都有待于进一步探索。
[1]TORRE L A,BRAY F,SIEGEL R L,et al.Global cancer statistics,2012[J].CA Cancer J Clin,2015,65(2):87-108.
[2]SIEGEL R L,MILLER K D,JEMAL A.Cancer statistics,2016[J].CA Cancer J Clin,2016,66(1):7-30.
[3]SCHABATH B,NGUYEN A,WILSON P,et al.Temporal trends from 1986 to 2008 in overall survival of small cell lung cancer patients[J].Lung Cancer,2014,86(1):14-21.
[4]BARTEL D P.MicroRNAs:genomics,biogenesis,mechanism,and function[J].Cell,2004,116(2):281-297.
[5]MARCO G,JORGE C B,MARTA C,et al.Exosomal miRNA analysis in non-small cell lung cancer (NSCLC) patients′ plasma through qPCR:A feasible liquid biopsy Tool[J].J Vis Exp,2016(111):e53900.
[6]HU Z,CHEN J,TIAN T,et al.Genetic variants of miRNA sequences and non-small cell lung cancer survival[J].J Clin Invest,2008,118(7):2600-2608.
[7]LIN Y,YANG C.Circulating miRNA signature for early diagnosis of lung cancer[J].EMBO Mol Med,2011,3(8):436-437.
[8]CHEN L,LI Y,XU Y,et al.Upregulation of miR-107 inhibits glioma angiogenesis and VEGF expression[J].Cell Mol Neurobiol,2016,36(1):113-120.
[9]ZHANG L,MA P,SUN M,et al.MiR-107 down-regulates SIAH1 expression in human breast cancer cells and silencing of miR-107 inhibits tumor growth in a nude mouse model of triple-negative breast cancer[J].Mol Carcinog,2016,55(5):768-777.
[10] ZHANG M,WANG X,LI W,et al.miR-107 and miR-25 simultaneously target LATS2 and regulate proliferation and invasion of gastric adenocarcinoma (GAC) cells[J].Biochem Biophys Res Commun,2015,460(3):806-812.
[11] XIA H,LI Y,LV X H.MicroRNA-107 inhibits tumor growth and metastasis by targeting the BDNF-mediated PI3K/AKT pathway in human non-small lung cancer[J].Int J Oncol,2016,49(4):1325-1333.
[12]ZHANG Z,ZHANG L,YIN Y,et al.miR-107 regulates cisplatin chemosensitivity of A549 non small cell lung cancer cell line by targeting cyclin dependent kinase 8[J].Int J Clin Exp Pathol,2014,7(10):7236-7241.
[13]HAN Z Y,ZHANG Y B,YANG Q Y,et al.miR-497 and miR-34a retard lung cancer growth by co-inhibiting cyclin E1 (CCNE1)[J].Oncotarget,2015,6(15):13149-13163.
[14]KOUTSAMI M K,TSANTOULIS P K,KOULOUKOUSSA M,et al.Centrosome abnormalities are frequently observed in non-small-cell lung cancer and are associated with aneuploidy and cyelin Eoverexpression[J].J Pathol,2006,209(4):512-521.
