二代测序技术在Cardio-facio-cutaneous综合征诊断中的应用研究*
2018-03-28张照婧郭谦楠侯巧芳王红丹刘红彦霍晓东廖世秀
肖 海,张照婧,吕 雪,李 涛,郭谦楠,侯巧芳,王红丹,刘红彦,霍晓东,廖世秀△
(1.河南省人民医院医学遗传研究所,郑州 450003;2.郑州大学基础医学院医学遗传与细胞生物学系,郑州 450003;3.河南省人民医院健康管理科,郑州 450003)
Cardio-facio-cutaneous综合征(CFC)与Costello综合征(CS)、Noonan综合征(NS)一起被归类为RAS心肌病群[1-2]。该病群的临床表型有很多相似之处,患者均可表现出不同程度的智力发育异常、心脏发育异常及身材矮小等临床症状。虽然该病群疾病也有各自相对特异性的表征,但是仅仅凭借表型进行诊断还是十分困难。本文利用比较基因组杂交技术(aCGH)结合二代测序技术(NGS)对1例疑似NS患者进行检测,并结合临床表型诊断为CFC,现报道如下。
1 资料与方法
1.1一般资料 患儿,女,1岁11月,汉族,因生长发育迟缓就诊于河南省人民医院医学遗传研究所。患儿系G1P1,孕27周超声提示永久性右脐静脉,羊水过多,羊水最大深度82 cm,羊水指数319 mm。足月顺产。出生后偶有抽搐发作,1月时磁共振(MRI)脑部平扫未见明显异常。患儿运动发育滞后,1岁时头部CT结果提示:(1)考虑复合脑积水征象;(2)左顶部头皮下血肿。1岁11月时心脏超声检查提示:(1)左房稍大;(2)左室壁弥漫性增厚;(3)左室流出道流速稍增快;(4)左室舒张功能减低。患儿眼距稍宽,鼻梁塌平,外侧眼角偏下,头发稀疏,父母非近亲结婚,否认遗传病家族史,见图1。本研究经医院伦理委员会批准,患者及家属知情同意并签署知情同意书。
1.2方法
1.2.1DNA提取 签署知情同意书后,分别抽取患儿及其父母外周血各2 mL,EDTA抗凝。采用DNA提取试剂盒(Dneasy Tissue Kit DNA,德国Qiagen公司)提取外周血DNA,采用Nandrop 2000分光光度计(美国Thermo公司)进行DNA定量检测。
1.2.2aCGH检测分析 应用Human genome CGH Microarray 8X60K芯片(美国Agilent公司)对患儿进行检测,采用Microarray Scanner(美国Agilent公司)及其他配套软件对芯片进行扫描和初步分析,检索UCSC、DECIPHER、ISCA等数据库对检测出的缺失、重复进行比对及致病性鉴定。
1.2.3NGS高通量测序 根据参考文献[3],取3 μg患者的DNA构建测序文库。用Nanodrop 2000分光光度计对文库标本进行定量检测。文库经PCR扩增后,应用心肌病相关基因检测试剂盒(北京迈基诺基因科技公司)进行检测,Illumina HiSeq2000 基因分析系统(美国Illumina公司)上机测序。
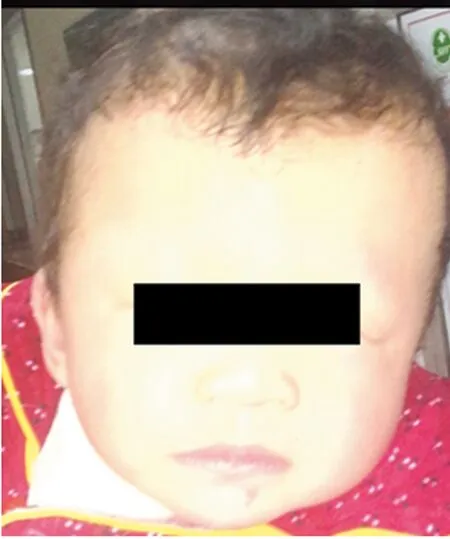
图1 患儿面部图
1.2.4Sanger测序 按照Sanger法检测患儿及其父母的BRAF基因c.1406位点。GenBank上查找BRAF基因序列,用NCBI上的在线软件Primer-BLAST设计引物,引物由上海生工生物工程有限公司合成,上游引物5′-TTG GGA GAT TCC TGA TGG GC-3′,下游引物5′-TTG GAG GAG TCC TGA AAC TAA TCA-3′。PCR体系为25.0 μL,其中DNA模版1.0 μL,上下游引物各0.5 μL,2X Taq DNA mix 12.5 μL,ddH2O 10.5 μL。PCR条件:95 ℃预变性3 min;94 ℃变性30 s,58 ℃退火35 s,72 ℃延伸50 s,循环35次;72 ℃延伸10 min;4 ℃保存。所有标本的PCR产物经纯化后利用ABI3130基因分析仪进行测序。测序结果与NCBI上的标准序列进行BLAST分析。
2 结 果
2.1aCGH检测情况 患儿染色体未发现拷贝数变化,为一正常女性,见图2。
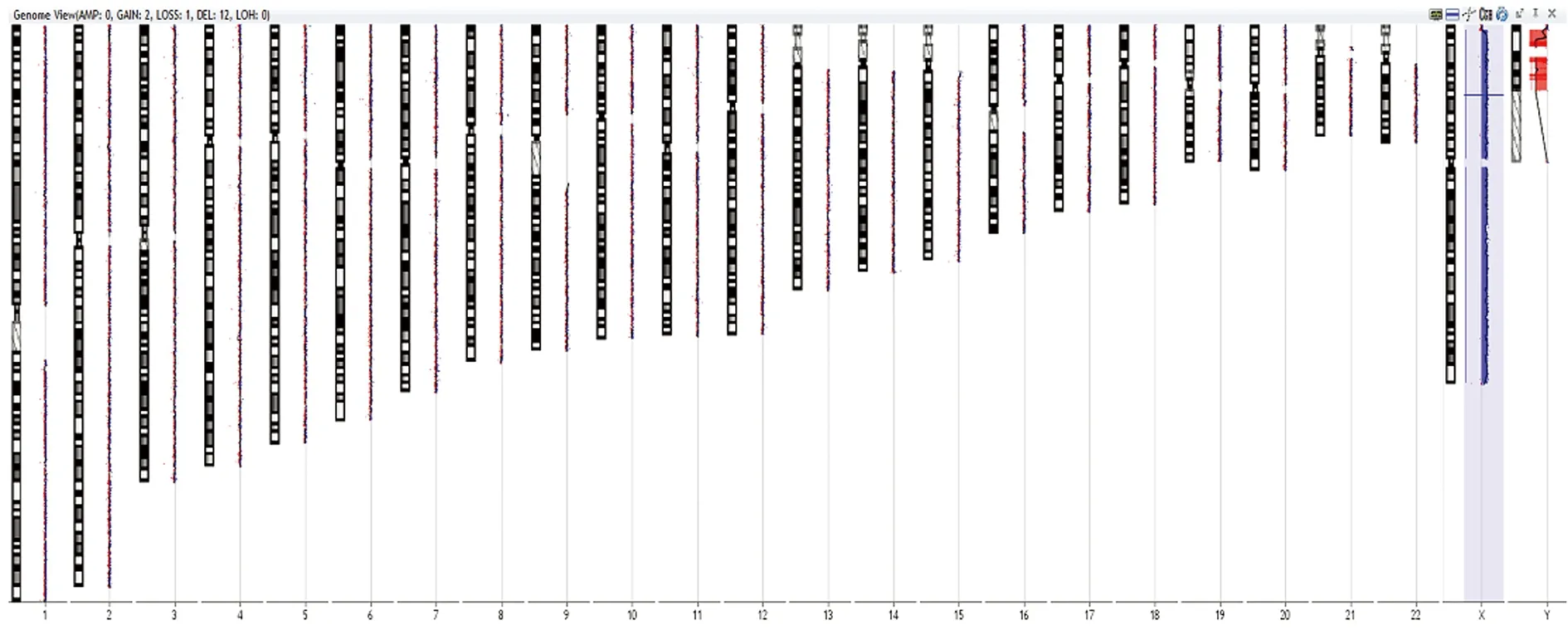
图2 患儿aCGH检测情况
2.2突变位点检测 二代测序结果显示,在chr7-140481402位点即BRAF基因第11外显子c.1406处存在G>A杂合突变(红色区域),见图3。该突变导致基因编码的第469位密码子由甘氨酸变为谷氨酸,即p.G469E。经查阅相关数据库已有该位点相关致病性报道。
2.3Sanger法测序 利用Sanger法对患儿的NGS结果进行验证,发现患儿BRAF基因第11外显子存在c.1406 G>A杂合突变(图4A),Sanger法检测患儿父母的BRAF基因c.1406位点,发现其父母该位点均为G/G野生型(图4B、4C)。
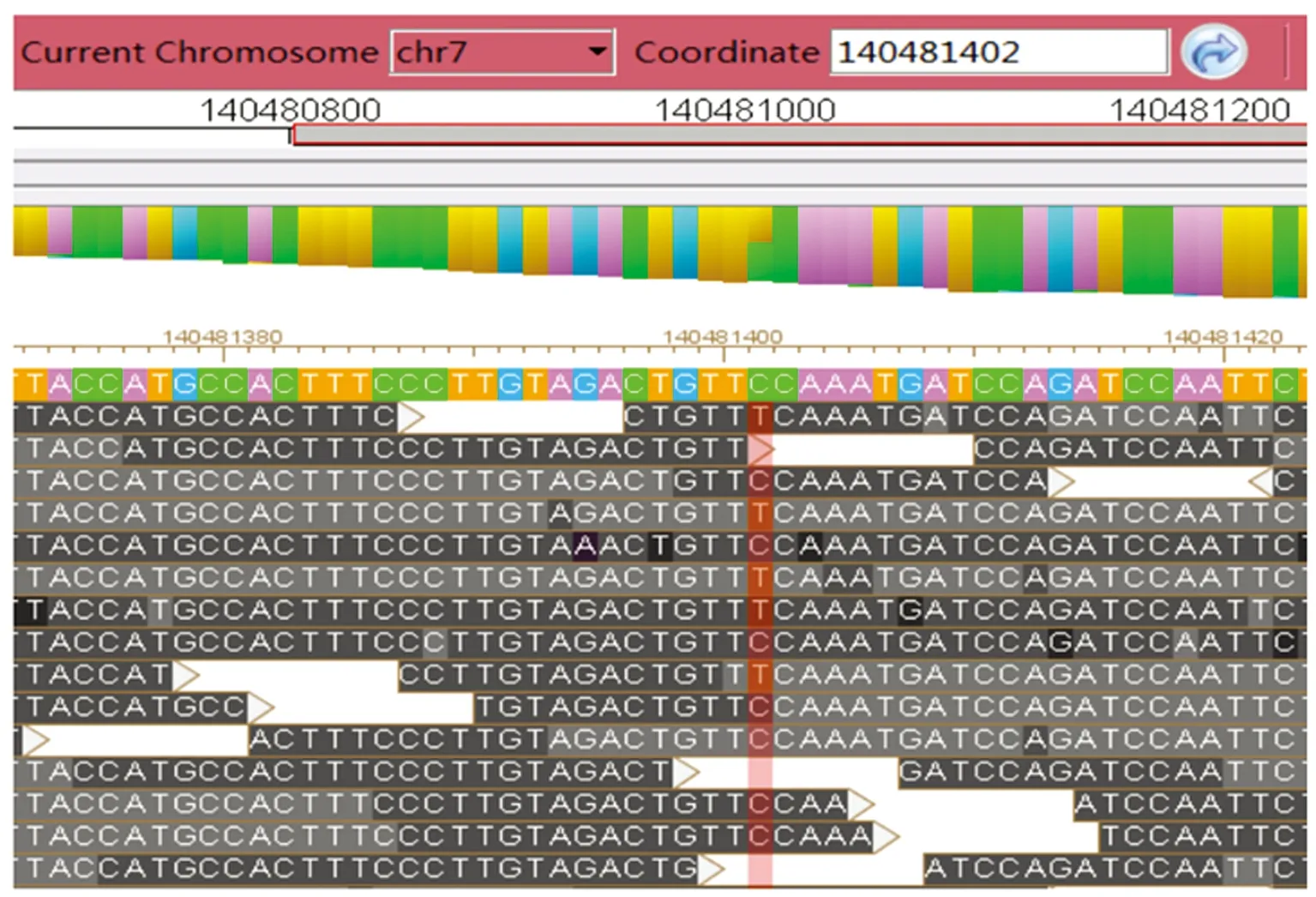
图3 患儿突变位点检测
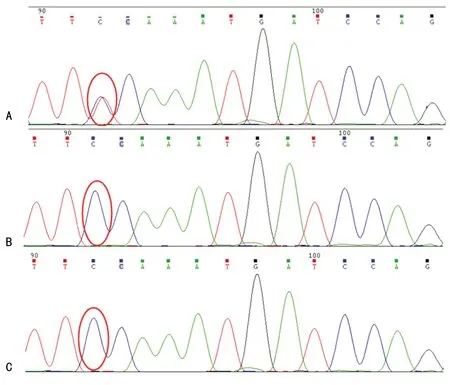
A:患儿BRAF基因c.1406G>A杂合突变(红圈处)B:患儿父亲BRAF基因c.1406位点为G/G野生型(红圈处);C:患儿母亲BRAF基因c.1406为G/G野生型(红圈处)
图4 BRAF基因c.1406位点反向测序情况
3 讨 论
染色体不平衡的拷贝数变异(copy number variants,CNVs)与原因不明的发育迟缓、智力低下、多种体征畸形及自闭症患者关系密切。2010年,国际细胞基因组芯片标准协作组推荐将aCGH作为这类患者的临床首选检测方法[4]。由于临床诊断不明确,并且患儿存在先天性心脏病、生长发育迟缓、智力障碍等症状,为了避免漏检,笔者先用aCGH技术在全基因组水平对患儿进行检测,检测是否存在CNVs。aCGH检测结果显示,患儿染色体未发现拷贝数变化,排除CNVs导致的先天性心脏病、生长发育迟缓、智力障碍。
RAS心肌病群中的3种疾病在临床症状上有太多相似之处,本研究中的患儿具有典型的智力发育迟缓、心脏发育异常等,临床医生根据症状很难做出明确诊断,疑似为NS。虽然3种疾病的表型相似,但是致病的分子机制却不同,并且RAS心肌病群中的疾病具有遗传异质性的特点,比如CFC主要是由4种基因突变导致的,分别为BRAF、MAP2K1、MAP2K2和KRAS[5]。如果利用一代测序技术对3种疾病的致病基因外显子逐一进行检测,需要的工作量十分巨大。与一代测序不同,NGS凭借其通量大、速度快等优点,在分子生物学研究、疾病的诊断等方面发挥了重要作用,已用于复杂性神经系统疾病、恶性肿瘤、免疫检测及微生物学研究等领域[6]。因此本研究选择利用NGS技术同时对3种疾病的致病基因进行检测。
NGS结果显示,患儿BRAF基因第11外显子存在c.1406 G>A杂合突变。该突变为错义突变,导致该基因编码的第469位氨基酸由甘氨酸变为谷氨酸,即p.G469E。2006年,NIIHORI等[7]在4例CFC患者中检查到该突变。利用Sanger法对患儿的NGS结果进行验证,二者结果一致说明二代测序结果准确可信。甘氨酸为极性不带电氨基酸,谷氨酸为极性带负电氨基酸,氨基酸的改变会对基因编码的蛋白空间结构造成影响,进而影响蛋白的正常功能。BRAF是RAS-RAF-MEK-ERK通路的关键调控因子,该通路对细胞的增殖、生长、凋亡十分重要[8]。目前研究显示,CFC患者中近75%为BRAF基因突变导致的,近25%为MAP2K1基因和MAP2K2基因突变导致的,2%~3%为KRAS基因突变导致[9-10]。利用Sanger法对患儿父母的BRAF基因c.1406位点进行检测,发现其父母该位点均为野生型,说明患儿为自发突变导致的CFC。
CFC是一种常染色体显性遗传病,该病于1986年首次报道[11-12]。目前关于CFC的报道特别少,在全世界范围的发病率不详,有文献报道日本CFC的发病率估计为1/810 000[13]。其常见的临床表现为先天性心脏病、生长发育迟缓、智力障碍、皮肤异常等[14]。CFC最早的临床特征为胎儿期超声提示胎儿颈部透亮度增加,有时为囊状水瘤,67%可见羊水过多[15],50%患儿早产。
综上所述,结合基因检测结果与临床资料,本研究患儿排除NS,应为CFC。在对于临床症状相似但致病基因不同的疾病诊断过程中,NGS技术可以起到很好的辅助诊断作用。
[1]MYERS A,BERNSTEIN J A,BRENNAN M,et al.Perinatal features of the RASopathies:noonan syndrome,cardiofaciocutaneous syndrome and costello syndrome[J].Am J Med Genet A,2014,164(11):2814-2821.
[2]UEDA K,YAOITA M,NIIHORI T,et al.Craniosynostosis in patients with RASopathies:accumulating clinical evidence for expanding the phenotype[J].Am J Med Genet A,2017,173(9):1-7.
[3]QIN L,GUO L,WANG H,et al.A novel MIP mutation in familial congenital nuclear cataracts[J].Eur J Med Genet,2016,59(9):488-491.
[4]MILLER D T,ADAM M P,ARADHYA S,et al.Consensus statement:chromosomal microarray is a first-tier clinical diagnostic test for individuals with developmental disabilities or congenital anomalies[J].Am J Hum Genet,2010,86(5):749-764.
[5]PIERPONT M E,MAGOULAS P L,ADI S A,et al.Cardio-facio-cutaneous syndrome:clinical features,diagnosis,and management guidelines[J].Pediatrics,2014,134(4):E1149-1162.
[6]肖海,张卉,李涛,等.第二代测序技术在一中国先天性白内障家系致病基因检测中的应用[J].中华实验眼科杂志,2015,33(8):705-709.
[7]NIIHORI T,Aoki Y,NARUMI Y,et al.Germline KRAS and BRAF mutations in cardio-facio-cutaneous syndrome[J].Nat Genet,2006,38(3):294-296.
[8]CIARA E,PELC M,JURKIEWICZ D,et al.Is diagnosing cardio-facio-cutaneous (CFC) syndrome still a challenge? Delineation of the phenotype in 15 Polish patients with proven mutations,including novel mutations in the BRAF1 gene[J].Eur J Med Genet,2015,58(1):14-20.
[9]RAUEN K A,BANERJEE A,BISHOP W,et al.Costello and Cardio-facio-cutaneous syndromes:moving toward clinical trials in RASopathies[J].Am J Med Genet C,2011,157(2):136-146.
[10]张欢欢,李牛,郁婷婷,等.Cardio-facio-cutaneous综合征2例报告并文献复习[J].临床儿科杂志,2017(4):286-289.
[11]REYNOLDS J F,NERI G,HERRMANN J P,et al.New multiple congenital anomalies/mental retardation syndrome with cardio-facio-cutaneous involvement--the CFC syndrome[J].Am J Med Genet,1986,25(3):413-427.
[12]ELIK N,CINAZ P,BIDECI A,et al.Cardio-Facio-Cutaneous syndrome with precocious puberty,growth hormone deficiency and hyperprolactinemia[J].J Clin Res Pediatr Endocrinol,2014,6(1):55-58.
[13]ABE Y,AOKI Y,KURIYAMA S,et al.Prevalence and clinical features of Costello syndrome and cardio-facio-cutaneous syndrome in Japan:findings from a nationwide epidemiological survey[J].Am J Med Genet A,2012,158(5):1083-1094.
[14]HAZAN F,KARACA E,KOKER S A,et al.A novel missense mutation in BRAF caused Cardio-facio-cutaneous syndrome[J].Iran J Pediatr,2013,23(5):608-609.
[15]TEMPLIN L,BAUMANN C,BUSA T A,et al.Prenatal findings in cardio-facio-cutaneous syndrome[J].Am J Med Genet A,2016,170(2):441-445.
