老年2型糖尿病患者胰岛α细胞及β细胞功能改变的观察
2018-03-24陈国伟钟连江
陈国伟,钟连江
(桐乡市第二人民医院1.检验科;2. 内科,浙江嘉兴314511)
糖尿病已成为世界第三大慢性非传染性疾病。统计数据预测,到 2030 年,全球糖尿病患病人数将达5.3亿[1]。胰岛细胞主要包括α 细胞、β 细胞、δ 细胞和PP 细胞四种细胞,其中α 细胞分泌胰高血糖素,发挥升高血糖的作用;β 细胞分泌的胰岛素是人体内唯一能够降低血糖的激素;胰岛的α细胞和β细胞具有相互拮抗的作用,共同参与血糖水平的调控和稳定[2]。
目前认为,2型糖尿病的主要病理机制是胰岛功能进行性衰退;糖尿病患者以老年居多,目前老年糖尿病患者的病理改变尚不完全清楚。既往少量研究主要集中于对胰岛β细胞病理变化的研究,而对胰岛α细胞功能在糖尿病早期及2型糖尿病发展中的病理变化研究甚少。本研究重点分析2型糖尿病老年患者胰岛α细胞和胰岛β细胞的功能改变,以及胰岛素抵抗特点,为老年2型糖尿病的临床防治工作提供理论依据和新思路。
1 资料和方法
1.1 纳入标准和排除标准 纳入标准:青年受试者(年龄20 ~40岁),老年受试者(年龄>65岁);糖尿病和血糖调节受损符合2013年版《中国糖尿病防治指南》中的诊断标准[3],无长期大量饮酒史、吸烟史、糖尿病急性并发症,不伴有严重器质性病变;新诊断糖尿病患者未接受过任何糖尿病治疗;长病程糖尿病患者(病程> 5年)且近1个月内未使用胰岛素。排除精神异常、沟通障碍、智力低下者,排除肝肾功能障碍、肿瘤患者,排除妊娠和哺乳期女性;新诊断糖尿病组、血糖调节受损组、正常对照组排除近1个月内服用过影响糖、脂代谢药物者。
1.2 研究对象 共纳入2015年1月—2016年12月我院收治的老年患者180例,根据其血糖水平和病程分为长病程糖尿病组、新诊断糖尿病组和血糖调节受损组各60例;以同期在我院体检的健康者60例为正常对照组,根据年龄分为老年糖耐量正常组和青年糖耐量正常组各30例。
1.3 临床资料的收集和整理 收集受试者的年龄、性别、体重指数、腰臀比、糖尿病病史、病程,测定受试者的血压、空腹血糖、空腹胰岛素水平、总胆固醇(total cholesterol, TC)、甘油三酯(triglyceride, TG)、高密度脂蛋白-胆固醇(High-density lipoprotein cholesterol, HDL-C)、低密度脂蛋白-胆固醇(Low-density lipoprotein cholesterol, LDL-C)。
1.4 相应指标测定 ⑴胰岛素和胰高血糖素:采用西门子centaurXP化学发光仪测定胰岛素;采用双抗体夹心酶联免疫吸附法测定胰高血糖素,试剂购自武汉新启迪生物科技有限公司。⑵生化指标:采用日立7600生化分析仪测定血糖、总胆固醇、甘油三脂、高密度脂蛋白-胆固醇、低密度脂蛋白-胆固醇,试剂购自浙江世纪康大医疗科技股份有限公司。
1.5 胰岛功能评估 胰岛素抵抗指数(Homeastatic Model Assessment of Insulin Resistance,HOMA-IR)[4]的估算:HOMA-IR=I0×G0÷22.5(G0代表空腹血糖,I0代表空腹胰岛素)。胰岛β细胞功能(Homeastatic Model Assessment ofβ cell Function,HOMA-β)[5]估算:HOMA-β=20×I0÷G0-3.5 (G0代表空腹血糖,I0代表空腹胰岛素)。α 细胞与β细胞衰竭程度:以青年糖耐量正常组为基线,计算各组HOMA-β/青年糖耐量正常组HOMA-β的比值,判断胰岛β细胞的衰竭或亢进程度;以青年血糖调节正常组为基线,计算各组胰高血糖素/青年血糖调节正常组胰高血糖素的比值,判断胰岛α细胞的衰竭或亢进程度。
1.6 统计分析 采用统计软件SPSS21.0进行数据分析。计量资料多组间比采用ANOVA分析,两组间比较采用q检验;计数资料组间比较采用卡方检验;相关分析采用Pearson分析。P<0.05表示差异具有统计学意义。
2 结果
2.1 一般资料 各组受试组的性别和腰臀比差异无统计学意义(P>0.05);青年糖耐量正常组的年龄小于其它各组,老年血糖调节受损组的体重指数大于其它各组,其差异均具有统计学意义(P<0.05)。
2.2 临床指标 各组受试者的血压、TC和LDL-C差异无统计学(P>0.05)。血糖调节受损组的TG水平明显高于青年糖耐量正常组,长病程糖尿病组、新诊断糖尿病组和血糖调节受损组的HDL-C明显低于正常对照组,差异均具有统计学意义(P<0.05)。表1。

表1 各组受试者临床指标
注:*与青年糖耐量正常组比较,P<0.05;**与老年糖耐量正常组比较,P<0.05;下同。
2.3 空腹血糖和胰岛功能 糖尿病患者中的各组空腹血糖、胰高血糖素水平均明显高于正常对照组,差异均有统计学意义(P<0.05);长病程糖尿病组的空腹胰岛素水平明显高于正常对照组,长病程糖尿病组和新诊断糖尿病组的胰岛素抵抗指数均明显高于正常对照组,差异均具有统计学意义(P<0.05)。糖尿病患者胰岛β细胞功能明显低于老年糖耐量正常组,老年糖耐量正常组明显低于青年糖耐量正常组,差异均有统计学意义(P<0.05)。随着病程进展,胰岛素抵抗水平也逐渐增强,β细胞功能逐渐衰退;胰岛α细胞的功能在病程早期增强,随病程进展逐渐衰退。见表2。

表2 各组受试者空腹血糖、空腹胰岛素、胰岛素抵抗指数和胰岛功能
2.4 各组胰岛α细胞与β细胞衰竭程度 如表3所示,老年糖耐量正常组胰岛α细胞功能较青年糖耐量正常组降低20.9%,β细胞功能降低约31.3%,胰岛β细胞的功能衰竭程度高于α细胞。长病程糖尿病组的胰岛α功能较血糖调节受损组和新诊断组低,但较青年糖耐量正常组强;胰岛β细胞功能随糖尿病病程延长进一步下降。
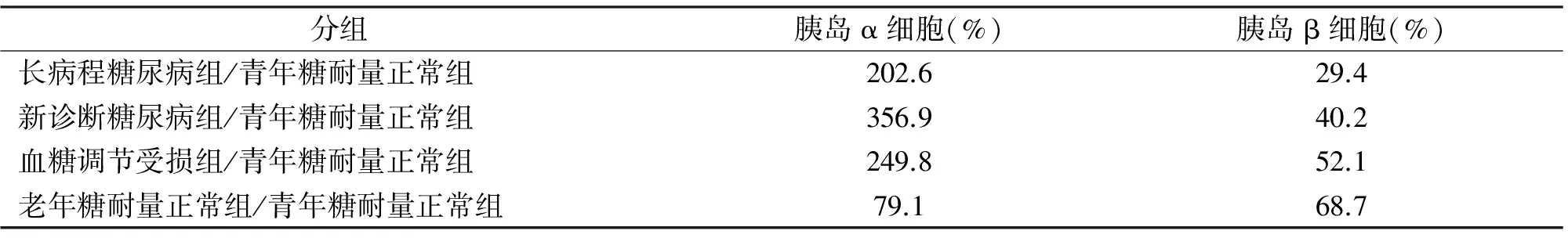
表3 胰岛α细胞与β细胞的功能
2.5 胰岛α细胞和β细胞功能与各临床指标的相关性分析 胰岛α细胞功能(胰高血糖素水平)与各临床指标间无明显相关性(均P>0.05),包括体重指数、TC、TG、空腹血糖、空腹胰岛素、LDL-C、HDL-C、HOMA-IR和HOMA-β;HOMA-β与空腹血糖呈负相关,与空腹胰岛素呈正相关,均具有统计学意义(P<0.05,表4)。

表4 胰岛β细胞功能(HOMA-β)与各临床指标的相关性分析
3 讨论
目前认为,2型糖尿病的主要病理机制是胰岛功能进行性衰退,既往研究显示,2型糖尿病患者中,胰岛α细胞数量明显增多,胰高血糖素分泌增加[6],而胰岛β细胞数量减少,胰岛素分泌减少,导致胰高血糖素/胰岛素比例失调,引起血糖增高[7]。另外,研究显示,糖尿病的患病率与年龄呈正相关性[8]。老年人新陈代谢减慢、基础代谢率低,特别是对葡萄糖的利用和代谢能力下降,促进了胰岛素抵抗发生和发展,β细胞最终因负荷加重而衰竭,导致老年2型糖尿病的发生。研究表明[9]老年患者胰岛素原比例增加, 可在胰岛素受体前水平引起胰岛素抵抗。本研究中,我们也发现,随着病程进展,老年2型糖尿病患者胰岛素抵抗水平也逐渐增强。
本研究中,我们发现随年龄增加,正常人群的胰岛β细胞功能明显降低;进一步分析显示老年2型糖尿病患者胰岛β细胞功能自发病初期就较正常组明显下降,而且,随着病程进展,β细胞功能呈进行性衰竭。这说明老年糖尿病患者胰岛β细胞分泌胰岛素的能力更差。这可能与高血糖使β细胞长期超负荷工作,导致β细胞受损, 胰岛素储备减少有关,也可能与β细胞因长期高血糖刺激引起耐受有关[10]。
Unger等[11]研究发现胰岛α细胞在老年2型糖尿病的发生发展中发挥重要作用。当胰岛α细胞对血糖的应答反应减弱,会增加肝糖原输出,导致高血糖的发生。另外,血糖水平的改变和胰岛素分泌受限[12],以及中枢和自主神经系统紊乱也可能参与胰高血糖素分泌的调控过程。老年人神经反应比较迟钝或存在神经病变,更易导致胰高血糖素分泌增加,导致血糖紊乱。本研究也发现当血糖调节受损时,胰岛α细胞分泌胰高血糖素就出现增高,而且长病程组的胰岛α细胞功能比糖耐量异常组及新诊断糖尿病组的α功能有所下降,说明随病程进展,胰岛α细胞功能开始衰退,但仍明显高于糖耐量正常组。进一步相关性分析显示,胰岛β细胞功能的衰竭与空腹血糖和空腹胰岛素有关,通过检测空腹血糖和空腹胰岛素水平有利于我们监测老年人群与老年糖尿病患者胰岛β细胞功能,对监测病程进展和预后分析具有重要意义。
综上所述,与青年人群相比,老年人群的胰岛 α 细胞和 β 细胞功能出现衰退,老年2型糖尿病患者存在明显的胰岛素抵抗,且进行性加重;随着病程进展,胰岛 β 细胞的功能的衰竭速度加快加重。及早评估和干预老年人 α、β 细胞功能,对缓减糖尿病的发生发展具有重要意义。但本研究尚有一些不足之处,如本研究各组病例数还较少,对受试者未进行长期随访,仅依靠胰高血糖素浓度来评估胰岛α细胞功能存在一定局限性。在今后研究中,我们需进一步开展大规模临床试验,并进一步完善实验设计。
[1] Wild S,Roglic G,Green A,etal.Global prevalence of Diabetes: estimates for the year 2000 and projections for 2030[J].Diabetes Care, 2004, 27(05):1047-1053.
[2] Pfeifer CR, Shomorony A, Aronova MA,etal. Quantitative analysis of mouse pancreatic islet architecture by serial block-face SEM[J]. J StruBiol, 2015, 189 (01):44.
[3] 范国洽, 郝慧斌, 杨昱, 等. 2013版《中国2型糖尿病防治指南》解读[J]. 中国临床医生杂志, 2015, 1 (10):92-94.
[4] Sarbolouki S, JavanbakhtMH, Derakhshanian H,etal. Eicosapentaenoic acid improves insulin sensitivity and blood sugar in overweight type 2 diabetes mellitus patients: a double-blind randomised clinical trial [J]. Singapore Med J, 2013, 54 (07):387-390.
[5] Dimitroulas T, Hodson J, Sandoo A,etal. Symmetric dimethylarginine (SDMA) serum levels in rheumatoid arthritis: correlations with insulin resistance and disease activity scores [J]. Amino Acids, 2015, 47(09):1995-2004.
[6] BaronM, Veres A, Wolock SL,etal. . A Single-cell transcriptomic map of the human and mouse pancreas reveals inter- and intra-cell population structure[J]. Cell Syst, 2016, 3(04):346-360.
[7] Butler AE,JansonJ,Bonner-Weir S,etal.α-Cell deficit and increased α-cell apoptosis in humans with type 2 diabetes[J].Diabetes,2003,52:102-110.
[8] 董静莲, 卢丙艳. DPP-4抑制剂在2型糖尿病治疗中的作用[J]. 天津药学, 2013, 27(06): 65-67.
[9] Sathananthan A, Dalla MC, Zinsmeister AR,etal. A Concerted Decline in Insulin Secretion and Action occurs across the Spectrum of Fasting and Post-Challenge Glucose Concentrations [J]. ClinEndocrinol, 2012, 76(02):212.
[10] 白利青, 宋娟, 高彩云, 等. 甲状腺功能亢进与糖代谢紊乱及胰岛β细胞功能异常、胰岛素抵抗的相关性[J]. 海南医学, 2017, 28(02):249-251.
[11] Escalada FJ. The physiology of glucagon-like peptide-1 and its role in the pathophysiology of type 2 diabetes mellitus][J]. Med Clin, 2014, 143(S1):2-7.
[12] Dunning BE, Foley JE, Ahren B. Alpha cell function in health and disease: influence of glucagon-like Peptide-l[J]. Diabetologia, 2005, 48(09): 1700-1713.
