长链非编码MALAT-1调控miR-205的表达影响非小细胞肺癌细胞的生长和迁移①
2018-03-07王俊钢李聪聪毛广显
王俊钢 李聪聪 毛广显 张 洁 杨 翠
(郑州大学附属医院/南阳市中心医院胸外科,南阳 473000)
肺癌是全世界最主要的癌症相关死亡原因之一,发病率持续上升[1]。非小细胞肺癌是除小细胞肺癌以外的其他上皮来源的肺癌[2]。非小细胞肺癌约占所有肺癌的85%[3]。肺癌的治疗和长期疗效取决于其类型、分期和患者的整体健康状况。常见的治疗手段包括手术、化疗和放疗[4]。与小细胞癌相比,非小细胞肺癌对化疗相对不敏感[5]。虽然许多治疗方法已经得到广泛运用,但肺癌患者的长期生存率却不尽如人意[6]。随着免疫治疗和分子靶向治疗的兴起,需要进一步提高我们对肺癌发生的分子生物过程的理解,寻找潜在的标志物和新的治疗靶点。
肺腺癌转移相关转录本1(MALAT-1)是一个7 kb 长链非编码RNA,属于LncRNA的一种,定位于染色体11q13上,在哺乳动物中高度保守并在细胞核中表达,能发挥重要的生物学功能[7]。 MALAT-1与非小细胞肺癌的转移有着密切的联系,并且是肺腺癌的独立预后标志物[8]。
microRNA是一种短链的非编码调节RNA,它已被证实在肿瘤的发生和发展中起着关键的作用[9]。microRNA有希望成为非小细胞肺癌新的生物标志物[10]。有研究表明miR-205在多种肿瘤中起到抑癌的作用[11]。在非小细胞肺癌中,miR-205参与了肿瘤的侵袭和上皮间质转化[12],在鳞状细胞癌中的表达高于腺癌[13]。但是对于miR-205在非小细胞肺癌中的作用机制却不明确。
本研究中,我们评估了MALAT-1在非小细胞肺癌细胞中的表达状态,并进一步探讨MALAT-1和miR-205的相互作用关系。
1 材料与方法
1.1细胞系和试剂 人非小细胞肺癌株A549、H1299、H460由上海细胞生物研究所提供。RPMI-1640培养液、10%新生小牛血清、含100 U/ml青霉素和100 μg/ml 链霉素的0.25% 胰酶溶液购自Gibco公司,二甲基亚砜(DMSO)购自Sigma公司。细胞在含有10%FBS,100 mg/ml青霉素和100 mg/ml 链霉素的培养基中培养,37℃在5%CO2培养箱中培养,生长至80%左右浓度时进行传代和冻存,用于后续的实验。细胞培养瓶和96孔板购自杭州四季庆生物工程材料有限公司。
1.2方法
1.2.1miRNA提取和qPCR试验 使用TRIzol试剂(Invitrogen,Carlsbad,CA,USA)分离非小细胞肺癌细胞株的总RNA,并使用赛默飞miRNATM分离试剂盒(Ambion,Austin,TX,USA)进一步纯化miRNA部分。通过光谱测定RNA样品的浓度和纯度。使用实时PCR系统进行实时逆转录PCR(qPCR)。U6管家基因作为对照。反应条件:95℃10 min,45个循环;在95℃变性10 s,在60℃下退火和延伸60 s。使用2-ΔΔCt方法计算非小细胞肺癌细胞株的miRNA相对表达量。实验重复3次。
1.2.2细胞培养和转染 通过慢病毒转染获得表达MALAT-1+siRNA和miR-205-inhibitor的非小细胞肺癌细胞A549,将编码MALAT-1+siRNA或空载体的慢病毒感染到非小细胞肺癌细胞A549中。并根据制造商的说明书使用Lipofectamine 2000(Invitrogen,Carlsbad,CA)将其转染入细胞48 h,获得相应稳定表达的细胞株。
1.2.3双荧光素酶试验测定 为了验证MALAT-1和miR-205的相关关系,我们使用双荧光素酶测实验测定。首先我们构建了miR-205携带3′-UTR的荧光素酶报告因子,其中每个基因的结合位点与MALAT-1结合位点相对应。荧光素酶测定显示MALAT-1下游结合位点miR-2053′-UTR符合,而不是其他靶点基因,将要检测的转录因子表达质粒与报告基因质粒共转染293U细胞中荧光素酶基因就会表达,荧光素酶的表达量与转录因子的作用强度成正比。加入特定的荧光素酶底物,荧光素酶与底物反应,产生荧光,通过检测荧光的强度可以测定荧光素酶的活性,从而判断转录因子是否能与此靶启动子片段有作用。根据 siPORTneoFX使用方法操作,在转染后48 h制备裂解物。使用双荧光素酶报告基因测定系统(Promega),转染24 h后测定荧光素酶活性。对于每个转染的萤火虫荧光素酶活性被检测为海肾荧光素酶活性。实验重复3次。MALAT-1的引物序列:5′-CTATGCATGCATGCTAGCATCGAT-3′;3′-ATCGATCGTACGTACGACGTAC-GT-5′;miR-205克隆的引物如下:5′-TAGCTAGCAGTCGCATCGATCGTA-3′;3′-GTAGCTAGCTAGC-TAGCTAGCTAG-5′。
1.2.4划痕实验 将非小细胞肺癌细胞A549(48 h)进行胰蛋白酶消化,并将适量细胞平铺在6孔板上。使用200 μl无菌枪头轻划孔板,每个孔划4~5次,尽量保证所划线处于平行状态,放置37℃恒温细胞培育箱,在24 h后,分别用适量PBS冲洗孔板,显微镜下观察SKVO3卵巢癌细胞迁移的距离。然后对比各组之间的统计差异。
1.2.5Transwell侵袭实验 通过Transwell对非小细胞肺癌细胞A549侵袭能力测定。将非小细胞肺癌细胞A549在含有0.1%FBS的DMEM中培养。 24 h后,在没有FBS或HGF的DMEM中的2×105个饥饿过的细胞用含有基质胶的小室(直径6.5 μm,孔径为8 μm,Corning,NY,USA)接种在上室中,将具有10%FBS和HGF(20 ng/ml)的培养基置于下腔中。在37℃下孵育24 h后,小心地去除上膜表面上的细胞。用95%乙醇固定20 min后,用0.5%结晶紫溶液染色10 min,自来水冲洗干净后,于倒置显微镜下计数。三次独立测定后取其平均值。
1.2.6裸鼠皮下成瘤实验 选择BALB/c小鼠(18~20 g)10只,由动物中心提供。小鼠喂养在25℃和70%相对湿度的环境下,同时给予12 h光照/黑暗循环。所有小鼠的饮水及饲料都经过高温高压处理。取对数期生长的非小细胞肺癌细胞A549,分为对照组和MALAT-1-siRNA组。调整为细胞浓度为2×105ml-1。在无菌条件下,小鼠首先被固定,用酒精消毒右腋窝皮肤。然后用0.2 ml含有A549肿瘤细胞的培养基接种在小鼠右腋窝,建立实体肿瘤模型。注射细胞后,监控小鼠的存活率、体重和生存状态。2周后通过颈椎脱位法处死荷瘤小鼠。测量死亡小鼠的肿瘤的尺寸、重量,并统计之间差异。

2 结果
2.1MALAT-1和miR-205在非小细胞肺癌细胞株中的表达情况 我们首先通过qPCR检测MALAT-1和miR-205在不同非小细胞肺癌细胞株中的表达情况。MALAT-1在A549、H1299、H460细胞株中的表达如图1A所示,在A549中的表达相对最高(1.40±0.12),与H1299(0.91±0.08)、H460(0.75±0.11)相比,差异有统计学意义(P<0.05)。如图1B所示,miR-205在A549细胞中的表达显著低于H1299和H460(P<0.05)。
2.2双荧光素酶试验检测MALAT-1和miR-205的关系 使用siRNA将非小细胞肺癌细胞A549中的MALAT-1进行下调,siRNA的转染效率如图2A所示。在siRNA转染后,MALAT-1-siRNA组中MALAT-1的相对表达量明显降低[(0.32±0.05)vs(1.03±0.25),P<0.05]。

图1 MALAT-1和miR-205在非小细胞肺癌细胞株中的表达Fig.1 Expression of MALAT-1 and miR-205 in different non-small cell lung cancer cell lines
为明确与MALAT-1相关的miRNA在结肠癌细胞中的表达情况,我们使用生物信息学预测工具发现MALAT-1可能与miR-205有直接作用,两者较为相似的结合序列(图2B)。为了验证MALAT-1能否与miR-205 3′UTR相结合,我们将MALAT-1-siRNA与miR-205共转染到293T细胞中。双荧光素酶报告基因结果显示(图2C):MALAT-1-siRNA可以明显抑制miR-205的荧光素酶活性。结果表明,MALAT-1-siRNA能与miR-205的3′UTR特异性结合,并可以调控其表达活性与水平。
2.3MALAT-1对非小细胞肺癌细胞A549侵袭的影响 Transwell实验结果如图3所示,MALAT-1-siRNA组通过Matrigel基质胶的细胞数量为(52.52±3.24),明显少于对照组(77.34±2.79),差异有统计学意义(P<0.05),说明抑制MALAT-1的表达可以减弱非小细胞肺癌细胞A549的侵袭能力。
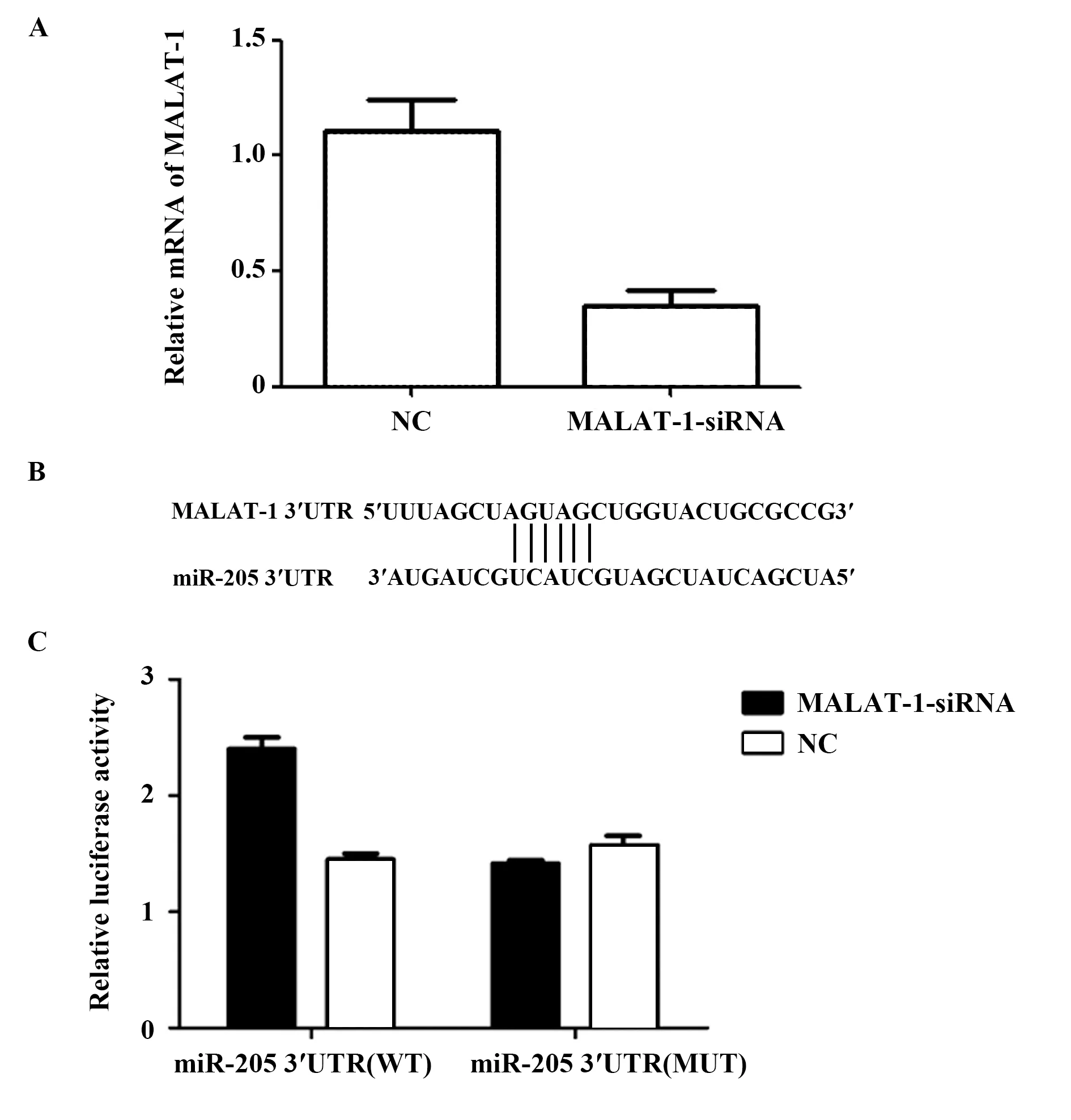
图2 双荧光素酶试验检测MALAT-1和miR-205的关系Fig.2 Dual luciferase assay examines relationship between MALAT1 and miR-205
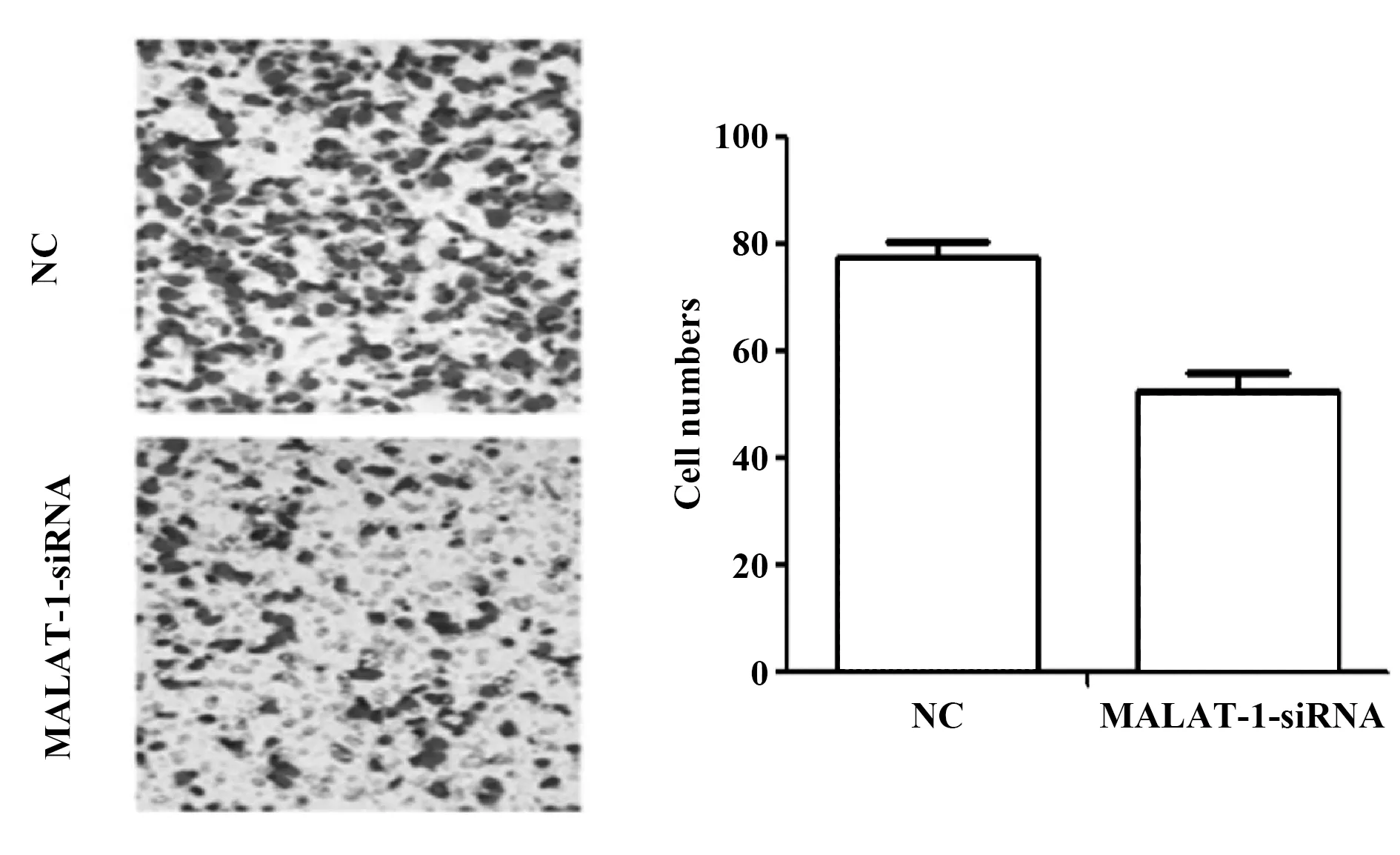
图3 Transwell实验检测MALAT-1对A549细胞侵袭力的影响Fig.3 Transwell assay to detect effect of MALAT-1 on invasiveness of A549 cells
2.4MALAT-1对非小细胞肺癌细胞A549迁移的影响 划痕愈合实验结果如图4所示,MALAT-1-siRNA组细胞的迁移速率明显低于对照组,迁移率下降了约59%(P<0.05),说明抑制MALAT-1的表达可以减弱非小细胞肺癌细胞A549的迁移能力。
2.5miR-205对非小细胞肺癌细胞A549侵袭行为的影响 使用miR-205的抑制剂探讨其对非小细胞肺癌细胞A549的侵袭力。如图5所示,MALAT-1-siRNA+miR-205-inhibitor组通过Matrigel基质胶的细胞数量为(63.17±6.13),明显多于MALAT-1-siRNA组(36.23±7.36),差异有统计学意义(P<0.05),表明非小细胞肺癌细胞A549的侵袭能力随miR-205的降低而增强,miR-205可以抑制A549细胞的侵袭能力,说明抑制miR-205的表达可以促进MALAT-1对非小细胞肺癌细胞A549侵袭能力的增强作用。
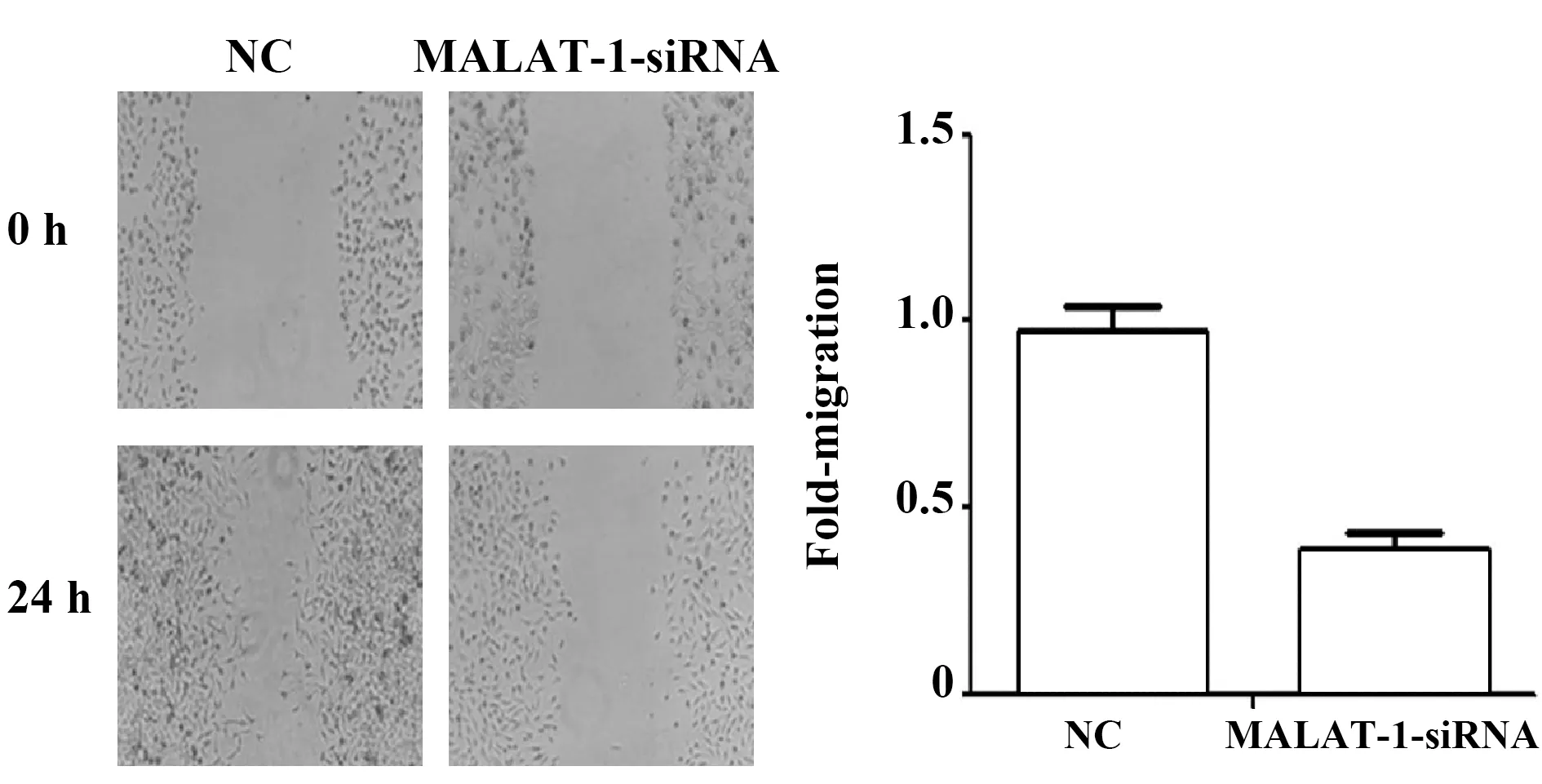
图4 划痕实验检测MALAT-1对A549细胞迁移力的影响Fig.4 Scratch test to detect effect of MALAT-1 on migration of A549 cells
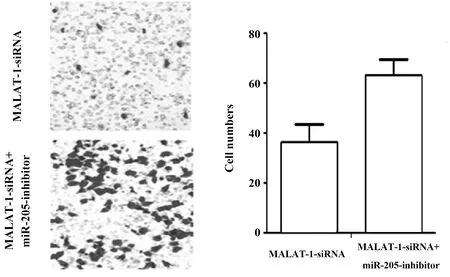
图5 Transwell实验检测miR-205对A549细胞侵袭力的影响Fig.5 Transwell assay to detect reversal effect of miR-205 on invasiveness of A549 cells
2.6miR-205对非小细胞肺癌细胞A549迁移行为的影响 划痕愈合实验结果如图6所示,MALAT-1-siRNA+miR-205-inhibitor组细胞的迁移比率(0.98±0.12)明显高于MALAT1-siRNA组(0.32±0.08),后者迁移率下降了68%,差异具有统计学意义(P<0.05),表明非小细胞肺癌细胞A549的迁移能力随miR-205的降低而增强,miR-205可以抑制A549细胞的迁移能力。结果表明抑制miR-205的表达可以促进MALAT-1对非小细胞肺癌细胞A549迁移能力的增强作用。综上所述,抑制miR-205的表达可以进一步促进MALAT-1对非小细胞肺癌细胞A549迁移和侵袭能力的促进作用,间接说明miR-205和MALAT-1之间有相互调控的关系。
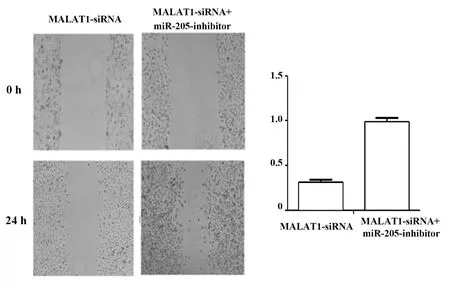
图6 划痕实验检测miR-205对A549细胞迁移力的影响Fig.6 Scratch test to detect reversal effect of miR-205 on A549 cell migration
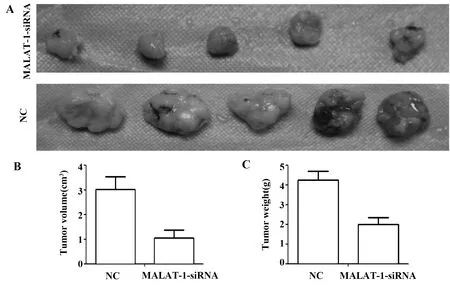
图7 MALAT1 对非小细胞肺癌细胞A549 成瘤能力的影响Fig.7 Effect of MALAT1 on tumorigenicity of non-small cell lung cancer A549 cells
2.7MALAT-1对非小细胞肺癌细胞A549成瘤能力的影响 对小鼠尸体解剖见右腋下肿瘤均有生长,肿瘤质地较硬,呈类圆形。两组小鼠肿瘤生长情况如图7所示:与对照组小鼠肿瘤大小相比,MALAT-1-siRNA组的肿瘤体积明显缩小[(3.02±0.51)cm3vs(1.21±0.32)cm3,P<0.05],重量减轻[(4.23±0.45)g vs(1.98±0.35)g,P<0.05]。体内实验表明抑制MALAT-1的表达后,可以有效抑制非小细胞肺癌细胞A549在小鼠体内的生长。
3 讨论
大多数非小细胞肺癌患者在中晚期才被确诊,总体5年生存率<15%[14,15]。 因此,我们迫切需要发现早期诊断和监测非小细胞肺癌的新策略。有研究指出,约98%的DNA转录为非编码的RNA,包括短链非编码RNA(NcRNA)和长链非编码RNA(LncRNA)[16]。microRNA(miRNA)属于短链非编码RNA(约含有22个核苷酸),存在于绝大多数植物、动物和一些病毒中[17]。它在调控RNA沉默和转录后基因表达中起重要作用[18]。大多数miRNA位于细胞内,一些miRNA通常称为循环miRNA或细胞外miRNA也已在细胞外环境中被发现[19]。
LncRNA被定义为长度超过200个核苷酸单位的内源性细胞RNA,具有许多分子生物学功能,例如调节选择性剪接、染色质重塑和RNA的代谢等[20-22]。尽管LncRNA在功能和结构上较已知的内源性小RNA(如microRNA)有明显不同,但是在这些RNA之间仍存在一些联系[23]。MALAT-1,也被称为NEAT2,在多种类型的生理过程中起到重要的作用,例如基因表达的表观遗传调控等[24]。许多证据表明MALAT-1与多种癌症的病理过程密切相关。它能调控肿瘤转移相关基因的表达,还能通过调节基因的转录改变细胞的运动能力[25,26]。MALAT-1被认为是非小细胞肺癌肿瘤转移和生存预后的一种标志物,特别是对于肺腺癌的早期阶段[27]。在肺鳞状细胞癌中,MALAT-1的高表达也与预后不良相关[28]。MALAT-1可能会影响非小细胞肺癌细胞在体外生长和集落形成[29]。将敲低MALAT-1后的非小细胞肺癌细胞注射入裸鼠后,显著减缓了肿瘤的生长[30]。在本研究中,通过siRNA将非小细胞肺癌细胞A549中的MALAT-1进行下调,肿瘤细胞的侵袭能力和迁移能力有显著的改变。从Transwell实验结果可以看出,侵袭细胞的数量较对照组有显著的下降[(52.52±3.24)vs(77.34±2.79),P<0.05],而划痕实验结果显示,MALAT-1-siRNA组细胞的迁移速率也明显低于对照组。在小鼠体内成瘤实验中,MALAT-1-siRNA组的肿瘤体积和肿瘤明显小于对照组,说明MALAT-1在非小细胞肺癌中起促癌的作用。
miR-205涉及许多正常或异常的病理生理过程,包括细胞再生、增殖和侵袭等。miR-205通过转录后靶向调控相应的基因,进而参与不同肿瘤的发生与发展[31]。在乳腺癌中,肿瘤中miR-205的表达较正常乳腺组织相有所下降,而高表达miR-205的乳腺癌患者往往获得更长的生存期[32]。类似的结果在前列腺癌的患者中也得到了证实,miR-205通过抵抗上皮间质转化和减少细胞迁移和侵袭力,来达到抑制肿瘤的目的[33]。本试验先从生物信息学预测到MALAT-1和miR-205有相似的结合序列位点,二者可能有相互调控的关系,然后通过双荧光素酶试验检测发现MALAT-1的确可以影响miR-205的荧光活性,说明二者确实存在相互调控的关系。敲减MALAT-1的表达后miR-205的表达及活性均上调,表明MALAT-1可以抑制miR-205的表达水平。当我们使用miR-205-inhibitor转染MALAT-1-siRNA的A549细胞时发现,MALAT-1-siRNA+miR-205-inhibitor组细胞的迁移力和侵袭力均得到了显著的提高,说明MALAT-1的确可以靶向抑制miR-205的表达,促进肺癌A549细胞的迁移和侵袭行为,而抑制miR-205的表达后,一定程度上促进了MALAT1对非小细胞肺癌A549细胞迁移和侵袭行为的增强作用。
综上所述,MALAT-1可以调控miR-205的表达影响非小细胞肺癌细胞A549的侵袭和迁移能力,为理解非小细胞肺癌发生的分子机制和探索新的潜在治疗策略提供相应理论帮助,它可能成为治疗非小细胞肺癌新的靶点。
[1] 石远凯,孙 燕,于金明,等.中国晚期原发性肺癌诊治专家共识(2016 年版)[J].中国肺癌杂志,2016,19(1):1-15.
Shi YK,Sun Y,Yu JM.China experts Consensus on the diagnosis and treatment of advanced primary lung cancer(2016 version)[J].Chin J Lung Cancer,2016,19(1):1-15.
[2] Gridelli C,Rossi A,Carbone DP,etal.Non-small-cell lung cancer[J].Nat Rev Dis Primers,2015,1:15009.
[3] Sharma P,Allison JP.Immune checkpoint targeting in cancer therapy:toward combination strategies with curative potential[J].Cell,2015,161(2):205-214.
[4] Soda M,Choi YL,Enomoto M,etal.Identification of the transforming EML4-ALK fusion gene in non-small-cell lung cancer[J].Nature,2007,448(7153):561-566.
[5] Reck M,Rodríguez-Abreu D,Robinson AG,etal.Pembrolizumab versus chemotherapy for PD-L1-positive non-small-cell lung cancer[J].N Engl J Med,2016,2016(375):1823-1833.
[6] Zingone A,Brown D,Bowman ED,etal.Relationship between anti-depressant use and lung cancer survival[J].Cancer Treatment Res Communicat,2017,10:33-39.
[7] Gutschner T,Hämmerle M,Diederichs S.MALAT1—a paradigm for long noncoding RNA function in cancer[J].J Mol Med,2013,91(7):791-801.
[8] Gutschner T,Hämmerle M,Eissmann M,etal.The noncoding RNA MALAT1 is a critical regulator of the metastasis phenotype of lung cancer cells[J].Cancer Res,2013,73(3):1180-1189.
[9] Ha M,Kim VN.Regulation of microRNA biogenesis[J].Nat Rev Mol Cell Biol,2014,15(8):509-524.
[10] Martinez NJ,Gregory RI.MicroRNA gene regulatory pathways in the establishment and maintenance of ESC identity[J].Cell Stem Cell,2010,7(1):31-35.
[11] Zhang P,Wang L,Rodriguez-Aguayo C,etal.miR-205 acts as a tumour radiosensitizer by targeting ZEB1 and Ubc13[J].Nat Communicat,2014,5:5671.
[12] Hirata H,Hinoda Y,Shahryari V,etal.Long noncoding RNA MALAT1 promotes aggressive renal cell carcinoma through Ezh2 and interacts with miR-205[J].Cancer Res,2015,75(7):1322-1331.
[13] Jiang M,Zhang P,Hu G,etal.Relative expressions of miR-205-5p,miR-205-3p,and miR-21 in tissues and serum of non-small cell lung cancer patients[J].Mol Cell Biochem,2013,383(1-2):67-75.
[14] 廉政君,黄建国.晚期非小细胞肺癌预后相关因素分析[J].现代肿瘤医学,2014,22(1):95-97.
Lian J,Huang JG.Prognosis of advanced non-small cell lung cancer-related factors [J].Modern Oncol,2014,22(1):95-97.
[15] Yoshizawa K,Willett WC,Morris SJ,etal.Study of prediagnostic selenium level in toenails and the risk of advanced prostate cancer[J].J Nat Cancer Inst,1998,90(16):1219-1224.
[16] 张 常,王新文,王 亮,等.“垃圾” DNA 的奥秘[J].科学通报,2016(28):3079-3084.
Zhang C,Wang XW,Wang L,etal.The mystery of garbage smelting DNA [J].Chin Sci Bulletin,2016(28):3079-3084.
[17] Agarwal V,Bell GW,Nam JW,etal.Predicting effective microRNA target sites in mammalian mRNAs[J].eLife,2015,4:e05005.
[18] Rozovski U,Hazan-Halevy I,Calin G,etal.Describing a transcription factor dependent regulation of the microRNA transcriptome[J].J Visual Exp,2016(112):e53300-e53300.
[19] Chevillet JR,Kang Q,Ruf IK,etal.Quantitative and stoichiometric analysis of the microRNA content of exosomes[J].Proc Nat Acad Sci,2014,111(41):14888-14893.
[20] Engreitz JM,Haines JE,Perez EM,etal.Local regulation of gene expression by lncRNA promoters,transcription and splicing[J].Nature,2016,539(7629):452-455.
[21] Engreitz JM,Haines JE,Munson G,etal.Neighborhood regulation by lncRNA promoters,transcription,and splicing[J].BioRxiv,2016:050948.
[22] 李琪儿,叶国良,郭俊明.lncRNA:肿瘤分子诊断中的一颗新星[J].中国生物化学与分子生物学报,2014,30(3):233-240.
Li QE,Ye GL,Guo JM.LncRNA:A Novel Star in the Diagnosis of Tumor [J].Chin J Biochem Mol Biol,2014,30(3):233-240.
[23] Ballantyne MD,McDonald RA,Baker AH.lncRNA/MicroRNA interactions in the vasculature[J].Clin Pharmacol Therapeutics,2016,99(5):494-501.
[24] Wu Y,Lu W,Xu J,etal.Prognostic value of long non-coding RNA MALAT1 in cancer patients[J].Tumor Biol,2016,37(1):897-903.
[25] Dong Y,Liang G,Yuan B,etal.MALAT1 promotes the proliferation and metastasis of osteosarcoma cells by activating the PI3K/Akt pathway[J].Tumor Biol,2015,36(3):1477-1486.
[26] Ji Q,Zhang L,Liu X,etal.Long non-coding RNA MALAT1 promotes tumour growth and metastasis in colorectal cancer through binding to SFPQ and releasing oncogene PTBP2 from SFPQ/PTBP2 complex[J].Br J Cancer,2014,111(4):736.
[27] Huang N,Chi Y,Xue J,etal.Long non-coding RNA metastasis associated in lung adenocarcinoma transcript 1(MALAT1)interacts with estrogen receptor and predicted poor survival in breast cancer[J].Oncotarget,2016,7(25):37957.
[28] Schmidt LH,Görlich D,Spieker T,etal.Prognostic impact of Bcl-2 depends on tumor histology and expression of MALAT-1 lncRNA in non-small-cell lung cancer[J].J Thoracic Oncol,2014,9(9):1294-1304.
[29] Guo F,Guo L,Li Y,etal.MALAT1 is an oncogenic long non-coding RNA associated with tumor invasion in non-small cell lung cancer regulated by DNA methylation[J].Int J Clin Exp Pathol,2015,8(12):15903.
[30] He F,Che J,Shi G,etal.Long non-coding RNA MALAT1 promotes the proliferation and metastasis in non-small cell lung cancer through the ERK/MAPK pathway[J].Int J Clin Exp Pathol,2017,10(1):417-424.
[31] Hanif EAM,Kennedy R,Mullan P.Mir205 is a p53/p63-dependent marker lost in poor outcome triple negative breast cancers[J].Eur J Cancer Care,2015,24:29-30.
[32] Anand S,Cheresh DA.MicroRNA-mediated regulation of the angiogenic switch[J].Curr Opin Hematol,2011,18(3):171.
[33] Wang W,Liu J,Wu Q.MiR-205 suppresses autophagy and enhances radiosensitivity of prostate cancer cells by targeting TP53INP1[J].Eur Rev Med Pharmacol Sci,2016,20(1):92-100.