东北地区动物源粪肠球菌耐药性监测与分析
2018-03-06李延山李欣南韩镌竹武凤娇
李延山,李欣南,韩镌竹,高 铎,武凤娇
(1.辽宁省畜产品安全监察所,辽宁 沈阳 110003;2.辽宁省兽药饲料畜产品质量安全检测中心,辽宁 沈阳110016)
粪肠球菌(Enterococcus faecalis)是革兰氏阳性,过氧化氢阴性球菌,是人和动物肠道内主要菌群之一[1],占肠道菌群的82%~87%[2],具有重要的生理功能。其能产生细菌素等抑菌物质,抑制大肠杆菌和沙门氏菌等病原菌的生长,改善肠道微环境[3];还能抑制肠道内产尿素酶细菌和腐败菌的繁殖,减少肠道尿素酶和内毒素的含量,使血液中氨和内毒素的含量下降[4]。农业部在2008年公布的第1126号公告《饲料添加剂品种目录》中将其列为允许在饲料中添加的益生菌种类[5]。但在发挥作用的同时,粪
1.1 菌株来源粪肠球菌质控菌株为ATCC29212,购自中国兽药监察所;猪肛门或鸡泄殖腔棉拭子来源于肉鸡和生猪养殖场(户)。肠球菌也是一种条件致病菌[6]。在动物中,常见粪肠球菌引发狗的外耳炎[7],家禽的败血症和心内膜炎[8-9]及仔猪的关节炎和败血症[10]等。本文借鉴选择分离、生化鉴定、药物敏感性试验等方法[11-12],通过分析东北地区健康动物中粪肠球菌的耐药性变化趋势,为临床粪肠球菌的应用提供参考。
1 材料与方法
1.2 仪器生物安全柜CLASSⅡ(美国NUAIRE公司)、全自动高压灭菌器(日本三洋电器集团)、恒温培养箱(德国BINDER公司)、ABT Expression鉴定仪(BIOMERIEUX公司)。
1.3 培养基与材料运送培养基、肠球菌肉汤培养基、哥伦比亚血琼脂购自北京陆桥技术有限责任公司;粪肠球菌琼脂培养基购自青岛高科园海博生物技术有限公司;API NaCl 0.85%培养基、rapid ID 32 STREP鉴定条均购自BIOMERIEUX公司;肠球菌药敏检测板购自天津市金章科技发展有限公司。
1.4 方法
1.4.1 采样用灭菌棉签采集动物肛门和泄殖腔样品,置入运送培养基中0~4℃保存。
1.4.2 分离纯化将拭子样品直接接入肠球菌肉汤中,36±1℃培养48 h。挑取预增菌培养物划线接种于粪肠球菌琼脂培养基36±1℃培养48 h。将疑似菌株接种于哥伦比亚血琼脂上36±1℃培养24 h,备用。
1.4.3 生化鉴定将上述获得的疑似单菌落,在哥伦比亚血琼脂平板上划线纯化培养不超过24 h。将待检细菌单个菌落,悬浮于3 mL悬浮培养基,制备4.0麦氏浓度的菌悬液,使用自动加样器将菌悬液滴入试纸条反应杯中,每个反应杯中滴入55 μL,菌液和试剂滴加完毕后,37℃培养4小时,用细菌鉴定仪判读。
1.4.4 药物敏感性试验用接种环挑取营养琼脂平板上培养1~18小时的3~5个单菌落,用无菌生理盐水稀释至0.5麦氏单位。取M-H肉汤稀释至5×105CFU/mL浓度的菌液0.1 mL分别加入含系列抗菌药物溶液的板中,混匀,试管中最终抗菌药物的浓度为原稀释浓度的一半。将加有菌液和抗菌药物的板,置37℃培养箱中培养20~24 h。取出培养后的板,观察结果,以无菌生长的最低抗菌药物溶液的浓度为最低抑菌浓度(MIC)。在质控菌株的最低抑菌浓度符合规定范围的前提下,按判断标准判断被检菌株的敏感性—敏感(S),中度敏感(I)或耐药(R),判定标准参照美国临床实验室标准化委员会(CLSI)标准。
2.1 分离纯化结果采集了东北地区26个养殖场的猪肛门或鸡泄殖腔棉拭子共780份样品,分离鉴
2 结果与分析
定得到289株粪肠球菌,分离率为37.05%。在肠球菌肉汤中,培养后混浊变黑为疑似菌株,仍保持澄清透明、棕褐色为阴性,具体结果见图1。

图1 肠球菌肉汤中的生长情况Fig.1 The growth condition of Enterococcus broth
粪肠球菌琼脂培养基上带棕色环的棕黑色菌落,边缘光滑没有白色润圈的为疑似单菌落,白色菌落为其他菌株,结果见图2。最终在哥伦比亚血琼脂上菌落圆形、纯白色,表面凸起湿润,有光泽,边缘整齐的菌落确定为阳性粪肠球菌,结果见图3。
图2 阳性粪肠球菌在粪肠球菌琼脂培养基上的生长形态Fig.2 The growth pattern of positive Enterococcus faecalis in the agar medium of Enterococcus faecalis
图3 粪肠球菌在哥伦比亚血琼脂上的生长状态Fig.3 The growth state of Enterococcus faecalis on Columbia blood agar
2.2 鉴定结果经细菌鉴定仪判读后得到的粪肠球菌生化鉴定,与中国微生物菌种目录给出的粪肠球菌一致。
2.3 药物敏感性试验结果
2.3.1 粪肠球菌的耐药率和MIC分布根据药敏试验结果,将最小抑菌浓度minimum inhibitory concentration,MIC)分布列于表1。
总体来说,粪肠球菌对13类测试抗生素普遍耐药,猪源粪肠球菌和鸡源粪肠球菌的耐药状况没有明显区别,均对截短侧耳素类、头孢菌素类、大环内酯类和林可胺类高度耐药,对万古霉素高度敏感。
猪源粪肠球菌对青霉素类、头孢菌素类、磺胺异噁唑、截短侧耳素类、大环内酯类和林可胺类药物耐药率均大于90.0%;对氨基糖苷类、四环素类、喹诺酮类和氯霉素类耐药率介于30.0%~80.0%之间,MIC也主要分布在耐药的区域;对β-内酰胺类复合物、唑烷酮类和万古霉素相对敏感,耐药率小于10.0%,多数菌株MIC仍然分布在敏感区域。
鸡源粪肠球菌对头孢菌素类、氨基糖苷类、磺胺异噁唑、截短侧耳素类、大环内酯类和林可胺类药物耐药率均大于88.0%;对四环素类、喹诺酮类、氯霉素类、复方新诺明耐药率介于30.0%~70.0%之间,MIC也主要分布在耐药的区域;对β-内酰胺类和万古霉素相对敏感,耐药率小于10.0%,多数菌株MIC仍然分布在敏感区域。
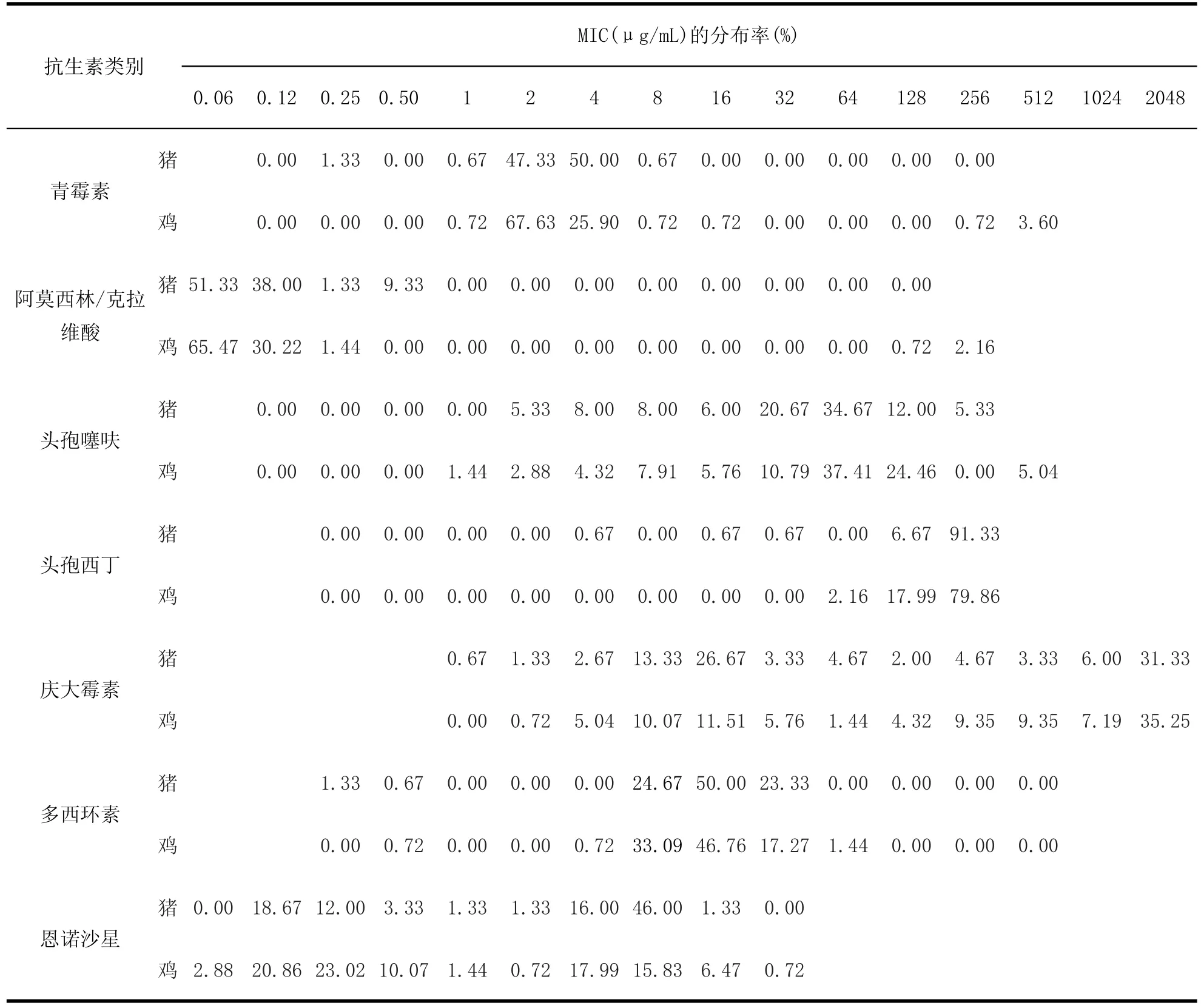
表1 东北地区猪、鸡源粪肠球菌耐药率及MIC分布情况Table 1 The resistance rate of Enterococcus faecalis and MIC distribution of Pig and chicken source in Northeast China

表1 东北地区猪、鸡源粪肠球菌耐药率及MIC分布情况(续)
2.3.2 粪肠球菌的EUCAST分布 将得到的MIC分布结果与欧盟药敏试验标准(European Committee Antimicrobial Susceptibility Testing, EUCAST)进行比较,结果如图4所示。由图4可以看出,代表药物MIC分布整体相对集中,变化不大,相对于EUCAST的MIC整体水平右移,MIC在增大,导致耐药率增高。
2.3.3 多重耐药性状况 本文中的多重耐药均是以药物类别来进行统计分析。总体来看,不同动物来源的菌株多重耐药率没有明显差异,4类及4类以上粪肠球菌耐药菌株占98.61%;10类粪肠球菌耐药株占1.73%,未见全部耐药菌株(见图5)。
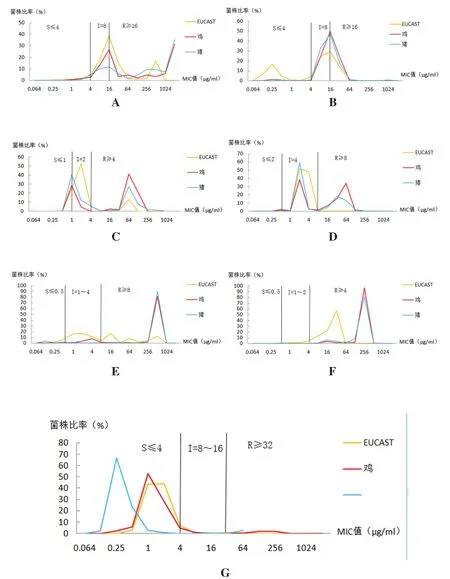
图4 东北地区猪、鸡源肠球菌代表药物的MIC分布图Fig.4 The MIC distribution of Enterococcus drug representatives of Pig and chicken in Northeast China
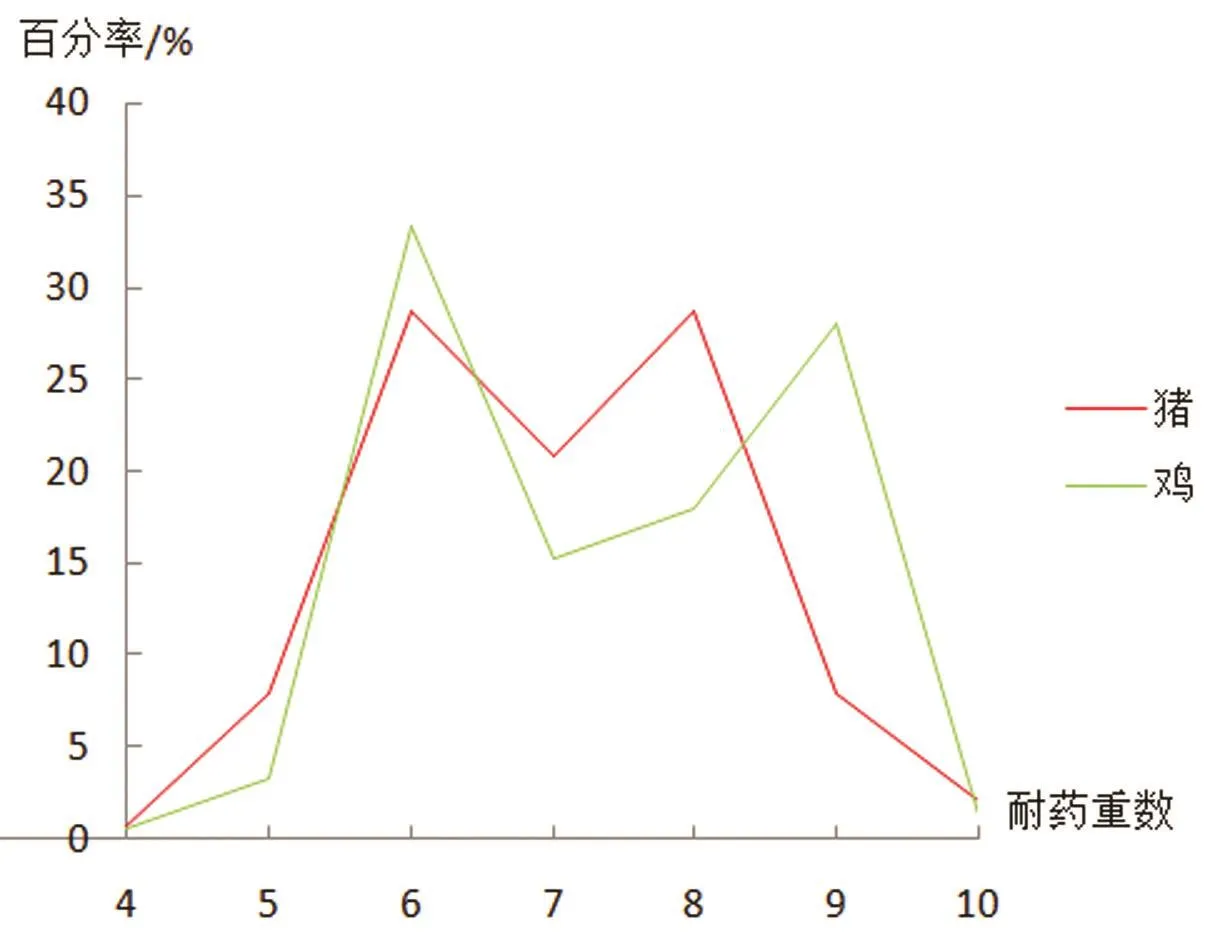
图5 东北地区猪、鸡源肠球菌多重耐药折线图Fig.5 Multiple resistance line diagram of Enterococcus source of Pig and chicken in Northeast China
3 讨论
本文对东北地区的动物源粪肠球菌进行了耐药性监测,药敏试验表明分离获得的粪肠球菌对临床常用的多种抗菌药物有较高的耐药率,耐药率较高的几种常见抗生素依次为头孢菌素类、磺胺异噁唑、截短侧耳素类、大环内酯类和林可胺类药。这几类抗菌药物中,一些耐药性是天然耐药,例如头孢菌素类;一些是获得性耐药,例如磺胺类,说明该类抗菌素用药压力严重,若继续使用不但增加治疗预防成本,也会诱发耐药性的进一步迁移,因此,临床用药应参考耐药性监测结果进行合理调整,降低耐药性的产生。
在我国,耐万古霉素肠球菌感染的发生率呈逐年上升趋势,耐万古霉素肠球菌是临床重要病原菌之一,通过监测发现,在东北地区尚未发现耐万古霉素的粪肠球菌,应持续监测及时预警。
[1]Malik RK,Montecalvo MA,Reale MR,et a1.Epidemiology and contral of vancomycin-resistant enterococci in a regional neonatal intensive care unit.Pediatr Infect Dis J,1999,18(4):352.
[2]王建业,王永坤.益生菌必备条件及其功效评价[J].中国家禽,2002,24(2):4-9.
[3]Dimov S G,Peykov S,Raykova D.A newly discovered bacteriocin produced byEnterococcus faecalis3915[J].Benef Microbes,2010,1(1):43-51.
[4]杨珍妮,刘丹,刘冰熔.肠道菌群与结直肠癌发病关系的研究进展[J].世界华人消化杂志,2014,6:2547-2552.
[5]《农业知识:科学养殖》记者.农业部公布《饲料添加剂品种目录(2008)》[J].农业知识,2009(3):5.
[6]王亚宾,陈丽颖,张红英,等.仔猪感染粪肠球菌的病原鉴定及病原特性初报[J].中国农学通报,2008,24(5):39-43.
[7]刘晓强,李引乾,张小莺.氟喹诺酮类药物对陕西境内犬粪肠球菌的敏感性和防突变浓度[J].中国抗生素杂志,2014,39(2):151-154.
[8]傅爱玲,索翠萍.从腹腔引流物中检出一株母鸡肠球菌[J].医学检验与临床,2007,18(6):101.
[9]狄婷婷,高原,聂鑫,等.致鹅败血症粪肠球菌的分离鉴定[J].中国预防兽医学报,2012,34(3):192-196.
[10]王亚宾,胡清林,陈丽颖,等.一株致仔猪关节炎粪肠球菌的鉴定[J].动物医学进展,2010,31(s1):157-161.
[11]苏葳艺,李欣南,韩镌竹.某养殖场鸡源粪肠球菌分离鉴定及耐药性研究[J].现代畜牧兽医,2014,4:48-50.
[12]韩镌竹,李欣南,苏葳艺,等.两种粪肠球菌的分离方法比较[J].现代畜牧兽医,2015(1):5-9.
