H1N1亚型三个谱系猪流感病毒RT-PCR鉴别诊断方法的建立
2018-03-06兰德松
兰德松
(辽宁省动物疫病预防控制中心,辽宁 沈阳 110164)
猪流感(Swine influenza,SI)是由正黏病毒科A型流感病毒属的猪流感病毒(Swine influenza virus,SIV)感染猪引起的一种高度接触性呼吸道传染病,发病率高、传播迅速、但死亡率较低[1]。SI作为猪其他疾病的一种重要的诱因之一,在规模化养猪场中普遍存在,难以根除。除SIV单独感染造成的直接损失外,由于SIV感染导致呼吸道上皮细胞损伤,感染猪易继发感染或混合感染其他细菌或病毒病,使疫情变得更为复杂,死亡率升高[2-3]。目前,SI已在世界大部分国家广泛存在并造成严重经济损失,是目前危害养猪业的重大疾病之一。更重要的是,由于猪呼吸道上皮细胞中有SA-α-2、6-Gal和SA-α-2,3-Gal两种受体,导致猪对SIV、禽流感病毒和人流感病毒均易感,多种类型的流感毒株可在猪体内发生基因重配产生新的毒株,因此猪被认为是流感病毒重组的“混合器”及产生新亚型毒株的活载体[4-6],鉴于SI在禽流感和人流感的流行、传播和流感病毒分子变异中的特殊作用,因而其公共卫生学意义重大。目前,在世界范围内引起SI的主要有H1N1、H1N2和H3N2三种亚型SIV[7-8]。其中,H1N1亚型SIV为猪群中SIV感染的优势亚型毒株,H1N1亚型SIV又分为古典型、类人型、类禽型和2009年在人群中大流行的甲型H1N1 4个谱系[8-9],其中,又以古典型、类禽型和甲型H1N1三个谱系感染较为普遍,危害较大。目前SI在我国养猪业中已经广泛存在,SI的诊断与防制已成为我国养猪业面临的重大问题,SI的有效防控对控制猪群感染其他细菌或病毒同样具有重要意义、同时能促进人流感和禽流感的有效防控。本研究建立H1N1亚型古典型、类禽型和甲型三个谱系的SIV的鉴别诊断方法,实现对H1N1亚型SIV不同谱系的快速、准确的鉴别诊断,进而为政府部门和养殖场户有针对性地采取综合防控措施提供有力技术支撑。
1 材料与方法
1.1 毒株、血清及核酸古典型、类禽型和甲型H1N1三个谱系H1N1亚型SIV由本实验室分离并保存,不同亚型SIV标准抗原和血清由哈尔滨兽医研究所动物流感参考实验室提供;H5、H7和H9亚型流感病毒核酸为匹基生物试剂盒中提供的标准阳性对照。
1.2 主要试剂及仪器核酸提取试剂(适用于提取病毒DNA/RNA)为天隆科技有限公司产品;TAE电泳缓冲液、溴化乙锭、DL 2000 DNA Marker、RNA酶抑制剂(RNase Inhibitor)(40 U/μL、dNTP(2.5 mmol/L)、M-MLV反转录酶(5 U/μL)、DTT(0.1 mmol/L)、Premix EX Taq等为宝生物(大连)有限公司(TaKaRa)产品;低温高速离心机为美国Thermo公司产品;C1000 PCR扩增仪、BIORAD-3000电泳仪和Gel Doc XR+凝胶成像系统为美国BIO-RAD公司产品。
1.3 临床样品的采集与前处理猪鼻咽拭子和肺脏等临床样品,采自辽宁省不同地区猪场和猪屠宰场(采集鼻咽拭子样本)。
猪鼻咽拭子的采集与前处理:用病毒采集管采取临床疑似猪流感活体猪的鼻腔和咽喉拭子,编号备用,待检;猪肺脏样本的采集与前处理:采取病死猪的肺脏,称取1 g肺脏组织进行研磨,然后加入1 mL灭菌PBS,混匀,3 000 r/min离心10 min,取上清液转入1.5 mL离心管中编号备用,待检。
1.4 引物设计及合成根据甲型、古典型及类禽型H1N1亚型不同谱系SIV的血凝素(Haemagglutinin,HA)基因保守区序列设计3套引物(表1),参考序列GenBank收录号分别为:GQ259909、FJ789832和JQ319648,引物由上海生工生物工程股份有限公司合成。
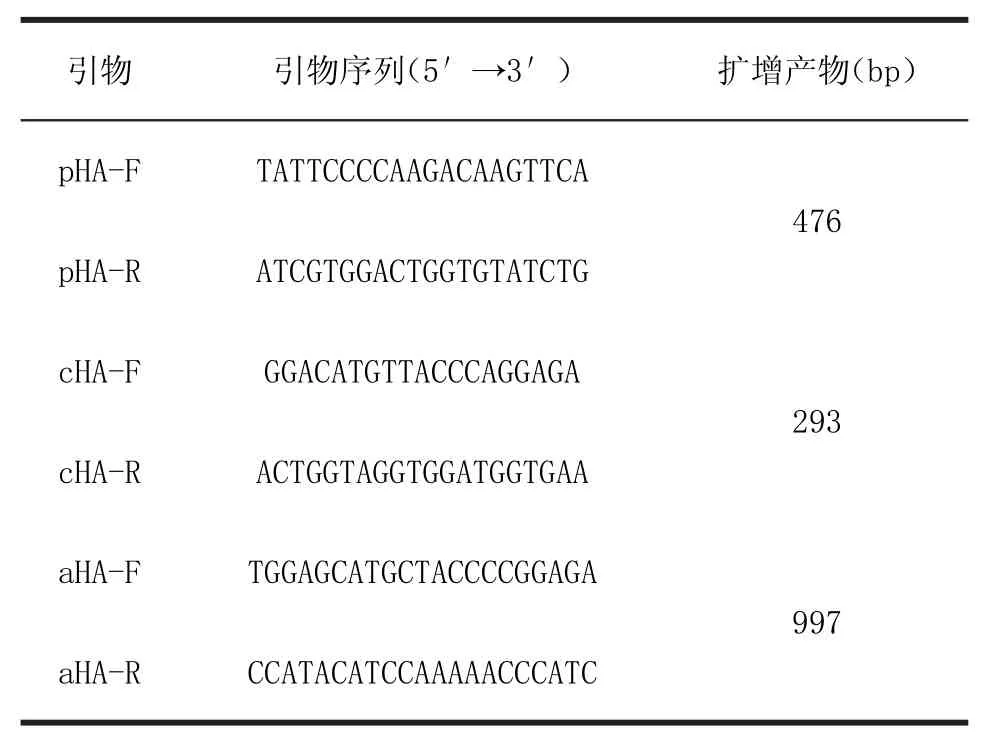
表1 引物序列Table 1 Sequences of primers
1.5 病毒RNA提取及RT-PCR方法的建立按照核酸提取试剂说明书进行病毒RNA的提取,并用Uni12:5′-AGCAAAAGCAGG-3′引物进行反转录,体系(25 μL)如下:DEPC处理的水 11.5 μL,dNTP(2.5 mmol/L)2 μL,Uni1(220 μmol/L)1 μL,DTT(0.1 mmol/L)2.5 μL,5×Reverse Transcriptase XL Buffer 5 μL,M-MLV反转录酶0.5 μL,RNA酶抑制剂0.5 μL,总RNA 2 μL。反转录条件:反应体系混匀后,37℃,水浴1 h;70℃,水浴15 min;反转录获得的cDNA直接用于PCR或-20℃保存备用。通过正交试验对PCR的引物终浓度、模板浓度等反应要素条件进行优化,通过梯度试验对引物退火温度进行优化。
1.6 RT-PCR方法的特异性试验应用本试验建立的RT-PCR方法分别对甲型、古典型及类禽型H1N1亚型不同谱系SIV核酸及H5、H7和H9亚型流感病毒、CSFV及PRRSV核酸进行RT-PCR检测,验证方法的可靠性及其特异性。
1.7 RT-PCR方法的敏感性试验分别对甲型、古典型及类禽型H1N1亚型三种谱系SIV的核酸进行10倍倍比稀释,再进行RT-PCR反应,各取5 μL PCR产物于1%琼脂糖凝胶孔中进行电泳鉴定。
1.8 RT-PCR方法的重复性试验实验室不同人员平行提取甲型、古典型及类禽型H1N1亚型SIV的总RNA,重复进行3次RT-PCR反应,验证方法的重复性。
1.9 RT-PCR方法对临床样品的检测将采集的460份猪鼻咽拭子样品接种鸡胚,收取尿囊液,进行血凝和血凝抑制试验(HA-HI),鉴定亚型;应用本试验建立的RT-PCR方法进行检测,比较方法之间的符合率。
2 结果
2.1 PCR条件优化的结果确定PCR反应体系(25 μL)为:Premix EX Taq,12.5 μL;灭菌蒸馏水10.5 μL;上、下游特异性PCR引物(10 μmol/L),各0.5 μL;反转录产物cDNA,1 μL。最终确定扩增反应条件为:94℃,3 min;94℃,30 s,54℃,30 s,72℃,1 min,35个循环;72℃7 min。

图1 H1N1三个谱系SIV RT-PCR特异性试验结果Fig.1 The specificity test results of RT-PCR of three sublineage of H1N1 Subtype SIV
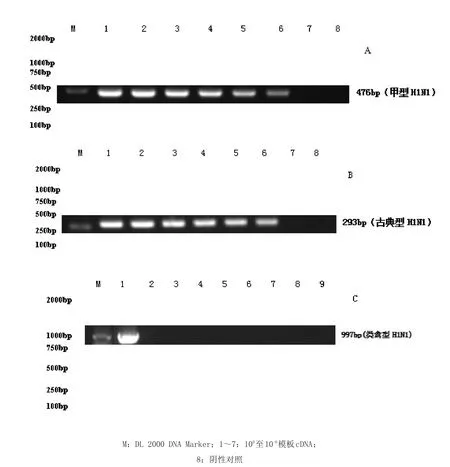
图2 H1N1三个谱系RT-PCR灵敏度试验结果Fig.2 The sensitivity test results of RT-PCR of three sublineages of H1N1 Subtype SIV
2.2 特异性试验试验表明,甲型H1N1、古典型H1N1和类禽型H1N1 RT-PCR方法均能特异性地检测出相应的SIV核酸,分别在476、293和997 bp位置出现特异性条带,而与其他病毒均无交叉反应(见图1);用本试验建立的RT-PCR方法对鸡胚分离的阳性样品的检测结果与尿囊液的病毒亚型鉴定结果一致;同时分别回收纯化3个不同谱系的目的片段,送上海生工生物公司进行序列测定,然后应用DNA-star软件分析其同源性,结果测定序列与参考序列同源性达99%以上,表明该方法具有良好的特异性。
2.3 RT-PCR方法的敏感性试验结果试验结果表明,甲型和古典型H1N1亚型SIV RT-PCR可检测出稀释至10-5的模板cDNA(见图2A、B),类禽型H1N1 RT-PCR方法可检测出稀释至10-6的模板cDNA(见图2C);利用分光光度计测定核酸浓度,按照《分子克隆实验指南》(第三版)中的方法换算成拷贝数,结果:甲型H1N1、古典型H1N1和类禽型H1N1 RT-PCR方法可检测的极限拷贝量分别为1 896、1 655和1 459拷贝/μL SIV核酸。
2.4 RT-PCR方法的重复性试验结果3次平行提取甲型、古典型及类禽型H1N1亚型SIV阳性样品的总RNA进行了RT-PCR重复性检测,试验结果表明该方法具有良好的重复性(见图3)。
2.5 RT-PCR方法对临床样品的检测460份鼻咽拭子经鸡胚接种后用HA-HI方法鉴定,结果:甲型H1N1 SIV阳性3份、类禽型H1N1 SIV阳性6份、古典型H1N1 SIV未检测到,阳性率分别为0.65%、1.30%、0%;本试验建立的H1N1亚型3谱系RT-PCR方法对尿囊液进行检测,结果与HA-HI检测结果一致,符合率为100%。
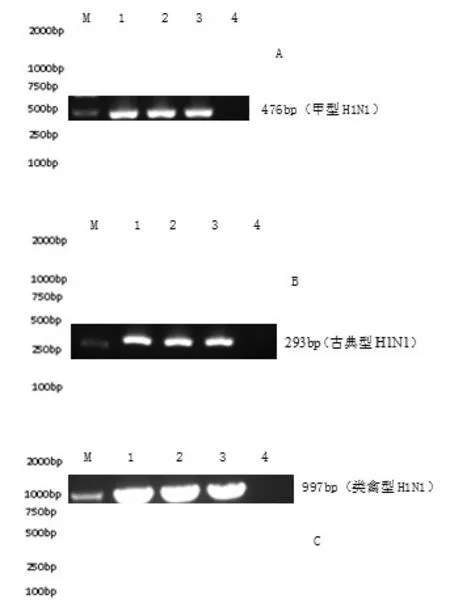
图3 H1N1三个谱系SIV RT-PCR重复性试验结果Fig.3 The sensitivity test results of RT-PCR of three sublineages of H1N1 Subtype SIV
3 讨论
在1918年人流感暴发期间,北美猪群中首例SI被报道,Shope等人于1930年首次分离并鉴定了SIV,命名为“古典型H1N1”(Classical Swine H1N1,CS H1N1)SIV,该型SIV在北美和亚洲国家一直流行,直到1976年通过从美国引种而传到意大利,随后传遍整个欧洲,直到1979年,欧洲猪群仅发现单一感染CS H1N1 SIV。随后,在1979年,相继在欧洲的比利时和德国分离到抗原性与遗传性与CS H1N1有显著差异的SIV,被命名为“欧亚类禽型猪 H1N1”(Eurasianavian-likeswineH1N1,EA H1N1),该型SIV迅速传遍整个欧洲,并取代CS H1N1 SIV成为猪群中的优势毒株[4,10-11]。管毅等[12]于1996年首次报道在我国的南方部分省份猪群中分离到类禽型H1N1亚型SIV,经遗传进化分析表明,分离株位于EA H1N1大分支内,但形成一个独立的亚洲分支谱系。近年来的监测表明,类禽型H1N1 SIV已成为我国猪群中的优势毒株。另外,据Qi等[13]、Wang等[14]报道,相继于2011年在中国江苏、2012年在中国河北各一名患严重肺炎死亡的3岁男童体内分离到H1N1亚型流感病毒株,通过遗传分析表明,分离株与中国猪群中流行的类禽型H1N1亚型和欧洲流行的EA H1N1亚型SIV在抗原性和遗传性方面密切相关,可能为SIV直接感染人而在人体内适应的结果,表明了类禽型H1N1亚型流感病毒具备跨种间传播的能力[15]。2009年爆发的甲型H1N1流感疫情,起初被报道为“SI”疫情,经过遗传分析表明,该型病毒为三源重配病毒,该病毒的前体已在猪群中流行长达17年之久[16]。
RT-PCR方法是当前鉴定病毒的可靠方法,在病毒亚型鉴定、测序分析等方面具有重要作用,很多实验室建立的快速诊断方法能区分不同亚型的SIV,如齐海涛等[17]建立的SIV分型RT-PCR方法,能对H1、H3、N1、N2亚型进行鉴别诊断;王博等[18]建立的SIV双重荧光定量RT-PCR方法,能对H1、H3亚型进行鉴别诊断,但均不能特异性的实现对H1N1亚型古典型H1N1、类禽型H1N1和甲型H1N1等3个谱系的快速鉴别检测,而近年来的监测结果表明,类禽型H1N1和甲型H1N1为当前我国猪群中流行的优势毒株,古典型H1N1也偶尔能监测到[19],因此,本试验建立的鉴别诊断方法对这3个谱系的鉴别诊断具有重要意义。但由于普通RT-PCR方法自身在灵敏度上的缺陷,该方法较荧光RT-PCR方法灵敏度低几十倍,在低病毒载量样本的检测中可能出现假阴性结果,但该方法特异性和重复性良好,结合鸡胚接种分离病毒的方法将在H1N1亚型SIV的检测及3个谱系鉴别诊断中发挥重要作用。
4 结论
本试验建立H1N1亚型古典型H1N1、类禽型H1N1和甲型H1N1 3个主要谱系SIV的鉴别诊断RT-PCR方法,该方法敏感性高、特异性强、重复性好,可作为对H1N1亚型3个主要谱系SIV快速鉴别诊断的有效检测手段,应用前景良好。
[1]阮宝阳,宫晓倩,刘晓敏,等.重组欧洲禽源H1N1亚型猪流感病毒疫苗株的构建及免疫保护效力[J].中国兽医学报,2016,36(12):2106-2112,2118.
[2]Ma W, Kahn R E, Richt J A. The pigs as a mixingvessel for influenza viruses:Human andveterinary implications[J]. Journal of MolecularGenetic Medicine, 2008, 3(1): 158-166.
[3]杨帅,朱闻斐,舒跃龙,等.猪流感病毒概述[J].病毒学报,2013,29(3):330-336.
[4]Brown I H.The epidemiology and evolution of influenza viruses in pigs[J].Veterinary Microbiology,2000,74(1/2):29-46.
[5]Elisa C,Tufaria M,Lorenzo F,et al.Review:Influenza virus in pigs[J].Molecular Immunology,2013,55:200-211.
[6]徐汇洋,许榜丰,陈艳,等.一株H1N1猪流感病毒的进化分析与分子特征[J].中国农业科学,2015,48(15):3071-3078.
[7]祁贤,陆承平.猪流感病毒进化方式及其流行特点[J].微生物学报,2009,49(9):1138-1145.
[8]孟沙沙,乔传玲,陈艳,等.一株类禽型H1N1亚型猪流感病毒的反向遗传系统的建立[J].中国预防兽医学报,2013,35(2):91-94.
[9]Sikkema R S,Frelel G S,de Bruin E,et al.Weighing serological evidence of human exposure to animal influenza viruses-a literature review[J].Eurosurveillance,2016,21(44):30388.
[10]Liu J H,Bi Y H,Qin K,et al.Emergence of European avian influenzavirus-LikeH1N1 swine influenza A viruses in China[J].Journal of Clinical Microbiology,2009,47(8):2643-2646.
[11]Simon J W,Pinky L,Scott M R,et al.Molecular Epidemiology and Evolution of Influenza Viruses Circulating within European Swine between 2009 and 2013[J].Journal of Virology,2015,89(19):9920-9931.
[12]Guan Y,Shortridge K F,Kruss S.Emergence of avian H1N1 influenza viruses in pigs in China[J].Journal of Virology,1996,70(11):p8041-8046.
[13]Qi X, Cui L B, Jiao Y J, et al. Antigenicand genetic characterization of a Europeanavian-like H1N1 swine influenza virus from aboy in China in 2011[J]. Archives of Virology,2013, 158: 39-53.
[14]Wang D Y, Qi S X, Li X Y, et al. Human Infectionwith Eurasian Avian-like Influenza A(H1N1) Virus, China[J]. Emerging InfectiousDisease, 2013, 19(10): 1709-1711.
[15]兰德松,赵凤菊,魏澍,等.辽宁省H1N1亚型猪流感病毒的分离鉴定与遗传演化分析[J].现代畜牧兽医,2013,12:24-28.
[16]Webster R G and Govorkova E A.Continuing challenges in influenza[J].Annals of the New York Academy of Sciences,2014,1323(1):115-139.
[17]齐海涛,孔维立,张桂红,等.猪流感病毒H1、H3、N1、N2亚型分型RT-PCR方法的建立[J].中国畜牧兽医,2012,39(3):187-191.
[18]王博,王慧煜,赵宝华,等.H1、H3亚型猪流感病毒双重实时荧光定量RT-PCR检测方法的建立及应用[J].中国畜牧兽医,2012,39(3):187-191.
[19]隋金钰,杨大为,杨焕良,等.我国部分省份猪群中流感病毒血清学抗体的调查[J].中国预防兽医学报,2016,38(1):11-14.
