雌激素受体α、β在雌性山羊颈动脉体的分布
2018-03-06杜宜楠赵建帅金秀芳徐永平赵泓淙陈彦至姜艺媛
杜宜楠,赵建帅,金秀芳,徐永平,赵泓淙,陈彦至,姜艺媛
(西北农林科技大学动物医学院,陕西杨凌 712100)
雌激素(ertrogen)是一类主要由卵巢和胎盘产生并分泌的类固醇激素,以雌二醇,雌三醇以及雌酮为主,主要参与雌性动物生殖器官发育的调控以及第二性征的维持。研究表明,雌激素除了参与对生殖系统的调控作用外,也参与非生殖器官功能的调节,如对消化系统[1]、神经系统[2]以及心血管系统[3]的调节作用。雌激素的生物学效应由特异性的雌激素受体(estrogen receptor,ER)所介导,经典的ER主要包括α和β两种亚型,雌激素与ER结合可引发基因组效应或非基因组效应从而影响细胞的功能。研究表明,在牛主动脉的内皮细胞[4]、大鼠心脏的心肌细胞和成纤维细胞[5]以及人冠状动脉内皮细胞[6]内均有ER的表达。Simeriy等[7]在小鼠下丘脑的腹外侧核、腹内侧核、室旁核以及弓状核等与心血管活动调节有关的中枢核团内也检测到ER的mRNA的分布。王志豪等[8]则采用免疫组织化学SP法证明ER在雌性山羊星状神经节神经元中广泛分布。以上资料表明,雌激素可以通过直接作用于心血管系统的ER或通过中枢或外周神经系统内的ER间接作用于心血管系统,参与对心血管系统功能活动的调节。
颈动脉体(carotid body,CB)是位于颈总动脉分叉后缘的外周化学性呼吸感受器,可通过感受血液中氧分压、CO2分压以及pH的化学变化并将这些信息传递至中枢延髓内,进而调节心血管的活动[9-11]。那么CB是否具有接受雌激素作用的条件呢?雌激素是否可以通过影响CB的反射活动,进而对心血管活动产生影响?本试验采用免疫组织化学SP法检测了雌性山羊CB中ERα与ERβ的分布特点,为探索雌激素能否通过影响外周化学感受器CB对心血管活动进行调节提供依据。
1 材料与方法
1.1 试验动物健康的成年非妊娠雌性奶山羊5只。
1.2 试验材料内源性生物素阻断试剂盒(福州迈新生物技术开发有限公司);即用型免疫组化SP超敏试剂盒(兔)(福州迈新生物技术开发有限公司);兔抗鼠ERα多克隆抗体(武汉博士德生物技术有限公司);兔抗鼠ERβ多克隆抗体(武汉博士德生物技术有限公司);DAB显色试剂盒(福州迈新生物技术开发有限公司);德国Leica石蜡切片机;Montic生物显微镜。
1.3 石蜡切片制备及SP免疫组化染色过程将山羊保定,陆眠宁麻醉,颈总动脉放血处死,从寰枕关节处取下羊头,立即沿两侧颈动脉断端分离至分叉处并迅速取下后缘的CB,投入4%多聚甲醛磷酸盐缓冲液中固定24 h。固定好的组织经修块,流水冲洗12 h后,采用梯度酒精脱水,二甲苯透明,石蜡包埋制成包埋块。包埋块经修整后石蜡切片机切片,片厚5 μm,40℃恒温水浴锅展片,载玻片贴片,37℃烘箱烘干。切片分为3套,第一套用于ERα与ERβ免疫组织化学SP法染色:切片烘干后经二甲苯和梯度酒精脱蜡复水,置于0.1 mol/L枸橼酸盐缓冲溶液中进行热抗原修复,沸水浴20 min后在自然条件下静置降至室温,滴加内源性生物素阻断剂A、B液各孵育15 min,之后按照免疫组织化学SP法试剂盒说明书,先后滴加试剂盒中的A液和B液,室温各孵育20 min,而后滴加兔抗羊ERα与兔抗羊ERβ多克隆抗体(工作浓度均为1:300),4℃冰箱孵育过夜,次日取出复温,先后滴加试剂盒中的C液与D液,室温各孵育20 min。以上各步骤之间均用PBS磷酸盐缓冲液充分洗涤3次,每次5 min。避光条件下滴加新配置的DAB显色液显色5 min左右,待呈色反应完全后用蒸馏水终止显色反应,后经梯度酒精脱水、二甲苯透明,使用中性树胶封固。第二套切片做免疫组织化学SP法染色后用苏木素复染进行细胞核定位;切片终止DAB显色后用苏木素复染1 min,1%盐酸乙醇分化后流水冲洗5 min,再进行常规脱水透明,封片。第三套作为免疫组织化学SP法染色的阴性对照组;使用PBS磷酸盐缓冲液代替兔抗羊ER多克隆抗体,其余步骤相同。
1.4 图像分析切片晾干后使用Motic数码显微镜观察拍照,每只山羊分别选取连续的5张切片,每张切片随机选取5个视野,在相同条件下观察拍照。用江苏捷达高清晰图像分析系统进行分析,分别计算出CB中ERα与ERβ免疫阳性物质的相对表达量(相对表达量=光镜倍数×阳性面积×平均光密度/像素)。用SPSS 18.0软件进行数据分析,数据用“平均数±方差”表示。
2 结果
2.1 颈动脉体免疫组织化学SP法染色结果见图1和图2。
试验组苏木精复染后可见细胞核呈蓝色,实质细胞与部分间质呈不同程度的阳性着色。空白对照组经苏木精复染后可见蓝色细胞核,无阳性着色,表明ER的SP免疫组化染色无非特异性着色。根据染色程度的不同,参照黄双等[12]的方法,将染色结果分为四个等级:强阳性,染色呈棕黄色或棕褐色;中等阳性,染色呈黄色;弱阳性,染色呈淡黄色;阴性,无着色。

图1 雌性山羊颈动脉体ERα免疫组织化学SP法染色Fig.1 Immunohistochemical SP staining of ERα of the CB of female goat
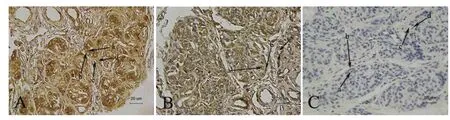
图2 雌性山羊颈动脉体ERβ免疫组织化学SP法染色Fig.2 Immunohistochemical SP staining of ERβ of the CB of female goat
免疫组织化学结果显示,在CB中ERα与ERβ的免疫阳性产物广泛分布,在球细胞、支持细胞、血管内皮细胞、神经纤维及结缔组织均有不同程度的阳性或弱阳性产物分布。其中ERα免疫阳性产物在球细胞的细胞核内染色最强,为棕黄色,呈强阳性;部分球细胞的细胞质着色呈黄色,为中等阳性;在间质组织中无着色或有淡黄色颗粒,呈阴性或弱阳性表达。而ERβ免疫阳性产物在球细胞的细胞膜染色最强,呈棕褐色,为强阳性;大部分球细胞细胞质中着色呈黄色,为中等阳性;而球细胞细胞核内阳性反应产物呈淡黄色或无着色,为弱阳性或阴性。在间质组织中无着色或有淡黄色颗粒,呈阴性或弱阳性表达。此外在穿插于实质细胞群和间质组织之间的微血管上的血管内皮细胞中也有ERβ免疫阳性产物分布,呈黄色,为中等阳性表达。
2.2 颈动脉体ERα和ERβ的相对表达量结果见表1和表2。

表1 雌性山羊颈动脉体颈动脉体细胞中ERα和ERβ的相对表达量Table 1 Relitive expression of ERα and ERβ of the CB of female goat
图像分析显示在雌性山羊CB中ERα免疫阳性产物在球细胞的相对表达量为13.072±7.779,与非球细胞结构的相对表达量(3.454±1.788)相比,差异显著(P<0.05)。ERβ免疫阳性产物在球细胞的相对表达量为20.756±3.160,与非球细胞结构的相对表达量(3.473±1.009)相比,差异极显著(P<0.01)。
3 讨论
雌激素是一类具有广泛生物学效应的类固醇激素,主要由卵巢和胎盘分泌产生,除了对生殖系统发挥调节作用之外,也参与如对消化道损伤的保护作用[1],对神经系统的发育及保护作用[2],对心血管系统活动的调节作用[3]等非生殖系统的功能活动。雌激素生物学效应的产生依赖于ER的介导,经典的ER包括ERα与ERβ两种亚型,二者均是细胞内配基激活的转录因子,通过引发雌激素的经典调节途径发挥基因调节作用,即雌激素首先与ER结合并二聚化形成二聚体,再与位于靶基因启动子上的雌激素作用元件相互识别并结合,从而启动该靶基因的转录,发挥调节作用[13-15]。Kim等[4]的研究发现ERα在牛主动脉的内皮细胞内广泛分布。Grohé C等[5]则在离体培养的大鼠心脏的心肌细胞和成纤维细胞内检测到ER的mRNA的表达。杜志军等[16]发现生理浓度的雌激素持续刺激人脐动脉环内皮细胞可产生显著的舒张作用。Tanabe等[17]的研究表明17-β-雌二醇可显著抑制离体豚鼠心室肌细胞外向K+电流从而延长其动作电位时程(ADP)。Karas RH等[18]发现雌激素可通过促进血管内皮细胞释放NO减少血管细胞粘附分子(VCAM)的形成,抑制血管内皮细胞的粘附作用,从而抑制动脉粥样硬化的形成,并且这种作用是完全由分布于心血管系统的ER所介导的。以上研究结果表明雌激素可以通过分布在心血管系统中的ER对心血管功能的活动产生直接的调控作用。而在中枢神经系统,研究发现ER在下丘脑的腹外侧核、腹内侧核、室旁核以及弓状核等与心血管活动调节有关的中枢核团均有表达[7]。Saleh MC等[19]的研究表明在孤束核和延髓头端腹外侧区注射小剂量的17-β-雌二醇可明显降低动脉血压,在疑核注射小剂量的17-β-雌二醇则可显著降低心率。Beyer等[20]的研究表明雌激素可以直接作用于中枢神经系统神经元上的ER,通过改变细胞膜以及细胞内的信号转导途径影响神经递质的传递,进而改变神经元的功能。提示雌激素可以通过调节控制心血管系统的中枢活动间接调节心血管的活动。在外周神经系统,王志豪等[8]采用免疫组织化学SP法证明ERα与ERβ在雌性山羊星状神经节神经元中广泛分布,星状神经节是支配心脏以及头颈和前肢血管的主要交感神经节后神经元胞体聚集区,ERα与ERβ在星状神经节神经元的广泛分布提示雌激素可通过对自主神经的调节作用间接影响心血管活动的功能。以上资料表明雌激素可以通过对心血管系统的直接作用,或者通过对中枢神经系统以及自主神经的间接作用等多条途径完成对心血管功能活动的调节。
CB是位于颈总动脉后缘的一种重要的外周化学性感受器,可以感受动脉血液化学信息的改变,并将这些信息传递到心血管中枢以使机体对心血管系统的活动做出适应性调整。CB的感受器细胞主要为拥有丰富突触联系并具备神经内分泌功能的球细胞,可以合成并分泌多种神经递质和肽能神经调质,调节颈动脉体的化学感受功能。研究表明球细胞与窦神经的传入神经纤维末梢直接构成突触联系,在血液氧分压或CO2分压等改变的刺激下即可释放兴奋性神经递质并作用于附近的传入神经纤维末梢,引起窦神经兴奋,并将神经冲动经孤束核换元后传递至迷走神经背核以及下丘脑等处,引起呼吸和心脏的活动变化[9-11]。本试验的研究结果显示,ERα与ERβ的免疫阳性产物均广泛分布于CB的球细胞。其中,ERα在球细胞的相对表达量显著高于非球细胞结构(P<0.05),而ERβ在球细胞的相对表达量极显著高于非球细胞结构(P<0.01)。以上结果说明,CB的球细胞是雌激素作用的主要靶点,CB对雌激素作用具备基本反应条件,提示雌激素可能通过作用于分布在CB球细胞上的ER影响其神经递质的合成和释放,进而影响实质细胞群与心血管中枢之间的信息传递,从而对心血管系统的功能活动产生间接的调节作用。此外本试验的研究结果表明ERβ的免疫阳性产物在穿插于实质细胞群和间质组织之间的微血管内皮细胞有中等程度的分布,提示雌激素也可以通过影响CB的微循环进而调节CB的功能活动。
4 结论
ERα与ERβ的免疫阳性产物在雌性山羊CB中广泛分布且强阳性产物主要集中在球细胞。表明CB中的球细胞是雌激素作用的主要靶点,提示雌激素可能通过作用于分布在CB球细胞上的ER,对心血管系统的功能活动产生神经途径的调节作用,为阐明雌激素的非生殖调控作用提供了依据。
[1]MOHIBBI H, QASIMI MI, NAGAOKA K, et al. Steroidogenicenzyme expression in estrogen productionin the goat gastrointestinal(GI)tract and the effect of castration[J]. J VetMed Sci, 2017, 79(7): 1253-1260..
[2]SARA M,ELIZABETH M.The Expanding Complexity of Estrogen Receptor Signaling in the Cardiovascular System[J].CircRes,2016,118(6):994-1007.
[3]JIE C,YONG S,RENA L.Estrogen synthesis and signaling pathways during ageing:from periphery to brain[J].Trends Mol Med,2013,19(3):197-209.
[4]KIM HP,LEE JY,JEONG JK,et al.Nongenomic stimulation of nitric oxide release by estrogen is mediated by estrogen receptor alpha localized incaveolae[J].Biochem Biophys Res Commun,1999,263(1):257-262.
[5]GROHE C, KAHLERT S, LOBBERT K, et al. Cardiacmyocytes and fibroblasts contain functionalestrogen receptors[J]. FEBS Lett, 1997, 416(1): 107-112.
[6]KIM-SCHULZE S,MCGOWAN KA,HUBCHAK SC,et al.Expression of an estrogen receptor by human coronary artery and umbilical vein endothelial cells[J].Circulation,1996,94(6):1402-1407.
[7]SIMERLY S, CHANG C, MURAMATSU M, et al. Distributionof androgen and estrogen receptormRNA-containing cells in the rat brain: an insitu hybridization study[J]. J Comp Neurol,1990, 294(1): 76-95.
[8]王志豪,李强,徐永平,等.雌激素α、β受体在雌性山羊星状神经节的分布[J].西北农林科技大学学报(自然科学版),2014,42(12):13-17+28.
[9]DE CARO R,MACCHI V,SFRISO MM,et al.Structural and neurochemical changes in the maturation of the carotid body[J].RespirPhysiolNeurobiol,2013,185(1):9-19.
[10]IZAL-AZCARATE A,BELZYNEGUI S,SAN SEBASTIAN W,et al.Immunohistochemical characterization of the rat carotid body[J].RespirPhysiolNeurobiol,2008,161(1):95-99.
[11]NAJAFI G,SOLTANALINEJAD F,HASANZADEH H,et al.A preliminary anatomical study on carotid body of Makouei sheep[J].Vet Res Forum,2013,4(2):129-131.
[12]黄双,孙曼,金秀芳,等.催产素受体在雌性山羊颈动脉体的分布[J].畜牧兽医学报,2016,47(6):1260-1265.
[13]KLINGE CM. Estrogen receptor interactionwith estrogenresponse elements[J]. NucleicAcids Res, 2001, 29: 2905-2919.
[14]WOOD JR,LIKHITE VS,LOVEN MA,et al.Allosteric modulation estrogen receptor conformation by different estrogen response elements[J].MolEndocrinol,2001,15:1114-1126
[15]PEARCE ST,JORDAN VC,et al.The biological role of estrogen receptors α and β in cancer[J].Crit Rev OncolHematol,2004,50:3-22.
[16]杜志军,孙梅励,王柏生,等.性激素对血管作用的研究[J].中国医学科学院学报,1999,(4):281-286.
[17]TANABE S,HATA T,HIRAOKA M.Effects of estrogen on action potential and membrane currents in guinea pig ventricular myocytes[J].Am J Physiol,1999,277(2):H826-833.
[18]KARAS RH,SCHULTEN H,PARE G,et al.Effects of estrogen on the vascular injury response inestrogen receptoralpha,beta(double)knockout mice[J].Circ Res.2001,89(6):534-539.
[19]SALEHMC,CONNELLBJ,SALEHTM.Autonomic and cardiovascular reflex responses to central estrogen injection in ovariectomized female rats[J].Brain Res,2000,879(1-2):105-114.
[20]BEYER C, IVANOVA T, KAROLCZAK M, et al. Celltype-specificity of nonclassical estrogensignaling in the developing midbrain[J]. J
