融合表达抗菌肽和IL基因的重组酵母制剂对仔猪生长和免疫的调节效应
2018-03-06胡立博吴雪颖马常俊万小平肖永乐李江淩吕学斌王泽洲
黎 凌,胡立博,吴雪颖,马常俊,万小平,肖永乐,梁 歌,曾 凯,李江淩,吕学斌,王泽洲,高 荣⋆
(1.生物资源与生态环境教育部重点试验室动物疫病防控与食品安全四川省重点试验室四川大学生命科学学院,四川 成都 610064;2.四川省畜牧科学研究院,四川 成都 610066;3.四川省动物疫病预防控制中心,四川 成都 610035)
随着养猪产业的集约化发展,疾病已成为困扰养猪业的最大问题。目前,疫苗是预防和控制猪类传染病发病率与传播的主要手段。近年来疫苗防治收到了一定的效果[1],但由于多方面的原因,免疫失效现象也时常发生,给养猪业带来了巨大的经济损失和严重的健康卫生问题[2-3]。因此,预防和控制猪类传染病,不能仅仅依靠常规的免疫接种,研制一种能有效提高仔猪综合免疫力的新型免疫制剂是可行的措施[4]。
白细胞介素(IL)是由白细胞或免疫细胞产生,并在细胞间相互作用的淋巴因子,它与血细胞生长因子均属于细胞因子[5]。两种因子相互影响,共同发挥造血和免疫调节作用[6-8]。白细胞介素在传递信息,激活与调节免疫细胞,介导T、B细胞活化、增殖与分化及在炎症反应中起重要作用。IL-2的生物学功能相当广泛,它对多种细胞如T细胞、B细胞、NK细胞、巨噬细胞以及少突神经胶质细胞均能产生一定作用,包括刺激活性B细胞和T细胞的增殖,刺激B细胞分化为浆细胞等,尤其是对于T细胞生长的影响极为显著[9-10]。它是体液免疫和适应性免疫的关键调节因子。IL-4对于B细胞、T细胞、肥大细胞、巨噬细胞和造血细胞都有免疫调节作用[11],能够诱导B细胞抗体类别转换向IgE,促进MHC II类表达[12]。它对体液免疫和适应性免疫也具有调节作用。IL-6兼有促炎和抗炎的特性,是介导人体发热和急性期反应的重要媒介之一[13]。它能够跨越血脑屏障,在下丘脑引发合成PGE2,从而改变温度设定值[14]。在肌肉和脂肪组织中,IL-6能够刺激能量调动,从而升高体温。
抗菌肽是一种具有生物活性的小分子多肽,也是先天性免疫防御系统的重要组成部分[15]。它不但具有广谱抗菌作用,对于真菌、病毒、寄生虫等也具有一定的杀伤能力[16-17]。同时抗菌肽具有抑制肿瘤细胞、中和内毒素、提高免疫力、加速伤口愈合等诸多生物学功能。它们还可以通过趋化树突状细胞、单核细胞和记忆T细胞,在先天性免疫和获得性免疫反应之间起桥梁作用[18-19]。其抗菌活性高,抗菌谱广,种类多,可供选择的范围广,靶菌株不易产生抗性突变等优势使得抗菌肽在医药领域具有广阔的应用前景[20-21]。
酵母菌品种多、分布广、生长快、代谢旺盛,又具有耐温、耐酸性、耐高渗透压、耐高浓度有机底物及分解有毒物质等特性[22],同时酵母菌菌体蛋白质含量高,营养成分与活性物质种类丰富[23-24],并且酵母细胞还具有高等细胞高等真核表达系统的许多特点。重组酵母可用于表达细胞因子基因,通过口服接种的方式有效提高动物免疫力[25]。
我们以往的研究表明,融合表达猪IL-2和IL-4/6基因可有效提高对病原菌感染的抗性,通过口服可引起局部和全身的免疫反应[26-28]。本实验室在以往的试验的基础上,成功构建了融合表达猪IL-2基因与IL-4/6基因、融合表达猪IL-4/6基因和牛源抗菌肽的两种重组毕赤酵母,以研究其对仔猪生长和免疫功能的影响。
1 材料与方法
1.1 重组毕赤酵母的构建重组猪IL-2、4/6(SG246)和猪IL4/6与牛源抗菌肽重组毕赤酵母SMD1168酵母菌(SG46B),本实验室构建保存。
1.2 重组毕赤酵母的发酵本试验所用发酵制剂均是在100 L发酵罐中进行发酵所得。
1.2.1 种子的活化与制备 解冻保存的两种重组毕赤酵母和空白对照毕赤酵母,取90 μL加入3 mL酵母浸出粉胨葡萄糖(YPD)种子培养基,30℃,200 r/min,于摇床上培养14 h左右以便活化菌种。待菌液在600 nm波长处的吸光值(OD600)约为6,取30 μL重组酵母细胞培养液接种到3 mL YPD一级种子培养基,并加入300 μg博来霉素,30℃,200 r/min,于摇床上培养10 h左右制备一级种子。将一级种子接入30 mL YPD二级种子培养基中,30℃,200 r/min,于摇床上培养10 h左右制备二级种子。将二级种子分3份,分别接入3个1 L YPD三级种子培养基中,30℃,200 r/min,于摇床上培养10 h左右制备三级种子。分别制备3种毕赤酵母的三级种子。
1.2.2 毕赤酵母的高密度发酵 将1 L摇好的种子加入含有35 L优化BSM发酵培养基(具体成分如表1和表2所示)的100 L发酵罐中。按照下列条件进行高密度发酵:30℃,搅拌转速设定为150 r/min,调整搅拌和通气速率以控制溶解氧(DO)维持在20%~30%水平,添加氨水(28%)维持pH在6.0左右、添加GPE型聚醚类消泡剂控制气泡产生。在不同发酵时间点测量OD600的值,从而控制酵母生长。发酵结束后,添加壳聚糖浓度为0.3 mg/mL絮凝剂至发酵液中絮凝酵母。

表1 优化的BSM培养基组成成分Table 1 Compositions of modified BSM medium

表2 PTM1(微量元素)组成成分Table 2 Compositions of PMT1 trace salts
3种毕赤酵母各发酵1次,每次发酵35 L,试验中的所有发酵条件均于上述条件一致。
1.3 仔猪分组及饲喂此次试验选用28头体重约为7 kg的45日龄健康杜大长杂交仔猪,随机分为3组,两个试验组:A1组10头,A2组10头,以及一个对照组:C组8头。整个试验期间,所有仔猪所饲喂的饲料以及所接受的常规免疫疫苗均相同,21日龄时分别肌肉注射猪瘟弱毒疫苗和蓝耳病灭活苗(成都药械厂生产)常规免疫;饲喂环境皆一致;试验组分别饲喂对应的A1、A2两种重组毕赤酵母发酵液,连续饲喂4周;对照组C组饲喂重组毕赤酵母发酵液,连续饲喂4周。重组毕赤酵母发酵液饲喂前需先摇匀,具体用量及安排列于表3。
1.4 试验仔猪体重变化试验的第0、14、28和42天,在相同的称量条件下,测定各组仔猪的总体重,并记录试验期间每组的饲料消耗量。计算3组仔猪的平均增重、净增重与各组的料重比,以评价2种不同的重组毕赤酵母制剂对仔猪生长方面的影响。
1.5 试验仔猪外周血血样采集试验的第0、7、14、28和42天,采取仔猪3~4 mL前腔静脉血,用含有EDTA-K2的真空采血管收集血样。用以评估两种重组毕赤酵母制剂对仔猪免疫功能的调节作用。

表3 动物试验分组及饲养方案Table 3 Animal experiment grouping and feeding scheme
1.6 试验仔猪外周血免疫细胞数量的测定试验的第0、7、14、28和42天,每个组别取100µL所采集的仔猪血液样品,用MIND-RAYBC-3000血细胞分析仪测定血样中红细胞、白细胞、血红蛋白的数量。
1.7 试验仔猪外周血Th和Tc细胞数量的变化的测定小鼠抗猪CD3、CD4和CD8单克隆抗体分别由Southern Biotech的异硫氰酸荧光素(FITC)、R-藻红蛋白(R-PE)和光谱红(SPRD)(购自Southern Biotech公司)标记。
试验的第0、7、14、28和42天,每个组别取50 μL所采集的仔猪混合血液样品,加入等体积的生理盐水,然后每个样品添加1 μL FITC标记的抗CD3,2 μL PE标记的抗CD4和2 μL SPRD标记的抗CD8,在黑暗中孵育20 min。完成孵化后,加入2 mL(10%V/V)红细胞裂解液(购自Becton Dickinson公司)的混合物,充分混匀,裂解5 min以确保所有红细胞完全裂解,1 500 r/min离心5 min,弃上清。最后,加入2 mL冷PBS重悬细胞,洗涤沉淀,1 500 r/mIN离心5 min,弃上清,共洗2次。完成洗涤后,加入150 μL PBS重悬细胞,并移入流式细胞仪试管中,待上机分析。
1.8 试验仔猪外周血中特异性抗体的检测——ELI-SA选用猪瘟(CSF)抗体和猪繁殖与呼吸综合征(PRRS)抗体ELISA试剂盒(上海艾丽莎生物科技有限公司提供),用于检测血样上清液中CSF抗体和PRRS抗体。每组每头仔猪取2 mL采集好的全血血样,离心20 min左右(2 000~3 000 r/min),仔细收集上清,-80℃保存,以测定CSF和PRRS抗体。按照试剂盒上的步骤进行检测分析。
1.9 荧光定量检测免疫应答相关基因的表达水平试验的第0、7、14、28和42天,每组每头仔猪取100 μL采集好的全血血样,加入900 μL RNAios plus,混合均匀,参照Takara RNAios plus说明书提取细胞总 RNA。取 3 μL RNA(RNA量在 50 ng~5μg之间)溶液,按照全式金One-Step gDNA Removal and cDNA Synthesis SuperMix反转录试剂盒的使用步骤,反转合成cDNA。
选基因PPIA作为内参基因(PPIA的Ct值为25左右);选用表4所设计的引物作为免疫应答相关基因的荧光定量检测引物。
具体定量PCR扩增反应体系如下:cDNA 1 μL、上下游引物0.5 μL、2X SsoFast EvaGreen SuperMix 7.5 μL、ddH2O 6μL,合计:15 μL 体系。所有成分均在低温下添加,充分混匀并瞬离。
定量PCR扩增反应条件如下:95℃3 min;95℃6 s、退火温度9 s、72℃10 s,40个循环;72℃10 min;溶解曲线参数为:65~95℃,每10 s上升0.5℃。
以PPIA作为内参基因,以对照组第一次样品cDNA为校准样品,采用2-ΔΔCT[29]法分析定量后PCR数据,比较同一目的基因的表达水平在试验组和对照组之间的差异。1.10统计数据分析使用GraphPad Prism 6 Demo软件分析试验数据,以P<0.05为显著性差异的标准。
2 结果与分析
2.1 对猪生长性能的影响2种重组酵母制剂对仔猪体重变化的影响图1和图2所示,两种重组酵母制剂对料重比的影响如图3所示。由图1可以看出,A1和A2组每头仔猪的平均体重均明显升高(P<0.05)且高于C组;由图2可以看出,A1和A2组每头仔猪的净增重也高于对照组C(P<0.05),尤其是在第42天,A1和A2组每头仔猪的净增重比对照组C的高出1.66 kg和3.47 kg;由图3可以看出,A1料重比持续高于C组(P<0.05),A2的料重比持续低于C组(P<0.05)。结果表明,A1、A2两种重组酵母制剂均可明显促进仔猪的生长,且A1制剂促进仔猪生长效果优于A2制剂。但A2制剂在降低料重比方面优于A1制剂。

表4 定量引物的序列Table 4 Sequences of QPCR primers
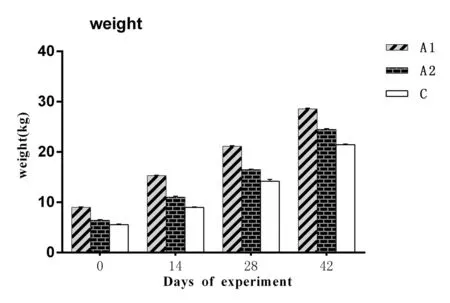
图1 试验仔猪的平均体重变化Fig.1 The average weight change of piglets
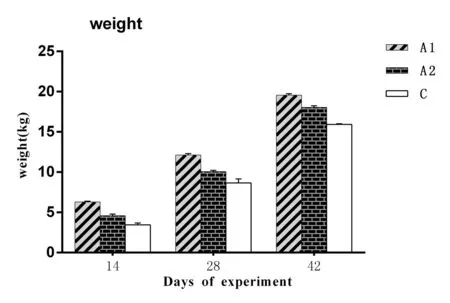
图2 试验仔猪的平均净增重量变化Fig.2 The average net weight change of piglets
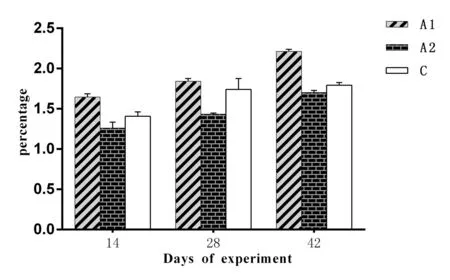
图3 试验仔猪的平均料重比变化Fig.3 The feed-gain ratio of piglets
2.2 外周血免疫细胞的变化从图4可以看出,在A图与C图中,A1和A2组的红细胞和血红蛋白数量与C组无明显差异(P>0.05)。B图中第14天到第28天,A1组的白细胞数量显著增高(P<0.05),且高于其他各组。

图4 试验仔猪血液中免疫细胞数量的变化Fig.4 The quantity change of immune cells in the blood of experimental piglets
2.3 外周血 T细胞的变化从图5可以看出,在整个试验期间,A1、A2和C组的血样中CD4+T细胞的数量无明显差异;但从第14天到第28天,在A1组的血样中CD8+T细胞的比例比其他组高(P<0.05)。
2.4 特异性抗体的变化从图6可以看出,试验的第0天到第28天,A1和A2组血清中的CSF特异性抗体和PRRS特异性抗体对照组C明显增加(P<0.05)。在整个试验期间,C组血清中的CSF特异性抗体和PRRS特异性抗体没有明显改变(P>0.05)。
2.5 免疫相关基因的变化
2.5.1 Toll样受体(TLR)基因的变化图7表明,从试验的第14天到第28天,A1组的TLR-2、TLR-4和TLR-7基因的表达水平均明显高于C组(P<0.05);另外在接种后的第42天,A2组的4种TLR基因(TLR2,TLR4,TLR7,TLR9)的表达水平显著高于A1组与C组(P<0.05)。
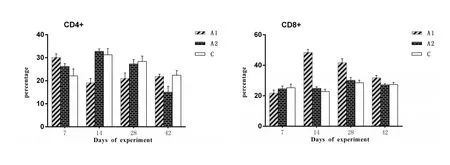
图5 试验仔猪血液中T细胞数量的变化Fig.5 The change of T cells quantity in the peripheral blood of pigs.
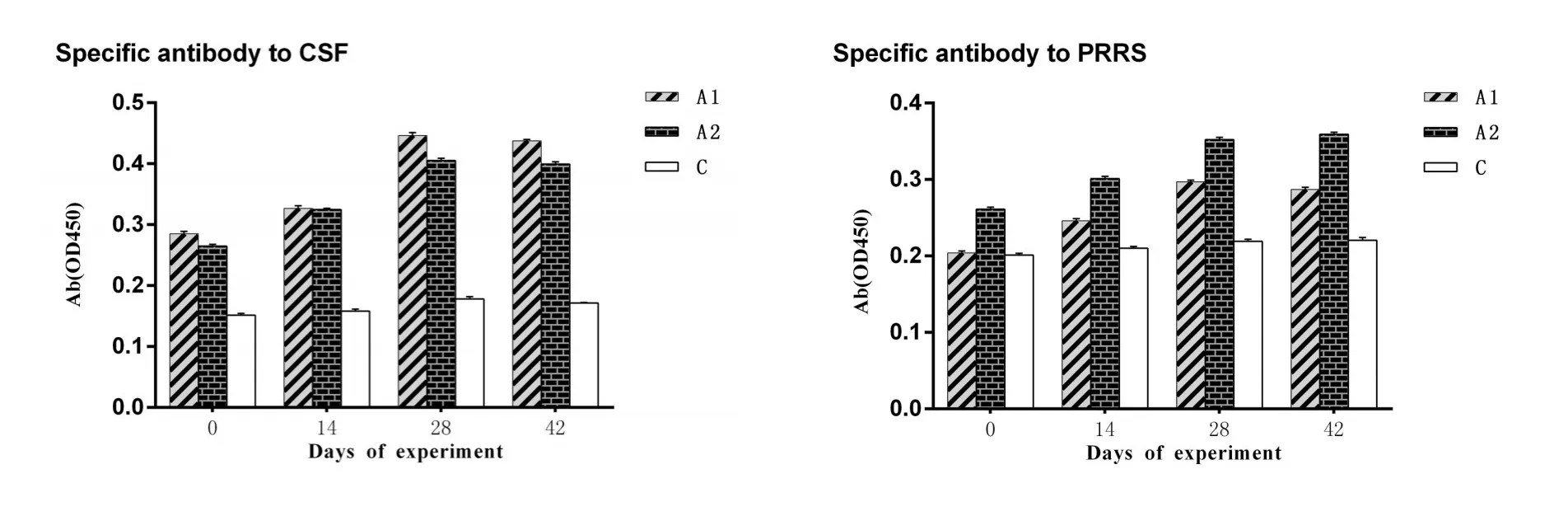
图6 试验仔猪血液中CSF特异性抗体和PRRS特异性抗体数量的变化Fig.6 the change of specific antibody to CSF and specific antibody to PRRS in serum
2.5.2 免疫信号转导分子相关基因的变化 在试验期间,每组仔猪的血液样本中4种免疫信号转导分子相关基因的表达水平虽然有一些波动,但没有明显差异(P>0.05)。不过从图8的B、C和D图中也可以看出,在试验的第42天,与A1组与C组相比,A2组STAT1、STAT3和NF-κB基因的表达水平更显著(P<0.05)。
2.5.3 免疫记忆相关基因的表达变化 如图9所示,3组之间早期基因的表达水平没有明显的规律(P>0.05)。在试验的第42天,A1和A2组的CD45和CD62L基因的表达水平相比于C组更显著(P<0.05)。
3 讨论
以往的研究表明,通过口服接种融合表达猪IL-2和IL-4/6基因的重组毕赤酵母,可以促进仔猪生长并显著的提高仔猪免疫力。同时,前期研究也表明,口服接种融合表达牛源抗菌肽和猪IL-4/6的重组毕赤酵母也可以显著增强小鼠免疫应答水平。本研究主要集中在评估融合表达牛源抗菌肽和猪IL-4/6的重组毕赤酵母是否可以通过口服接种来促进仔猪生长和提高免疫应答水平。
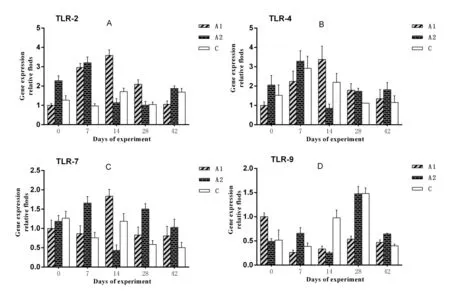
图7 试验仔猪血液中TLR样基因的表达水平变化Fig.7 The change of TLR genes in blood samples of experiment piglets
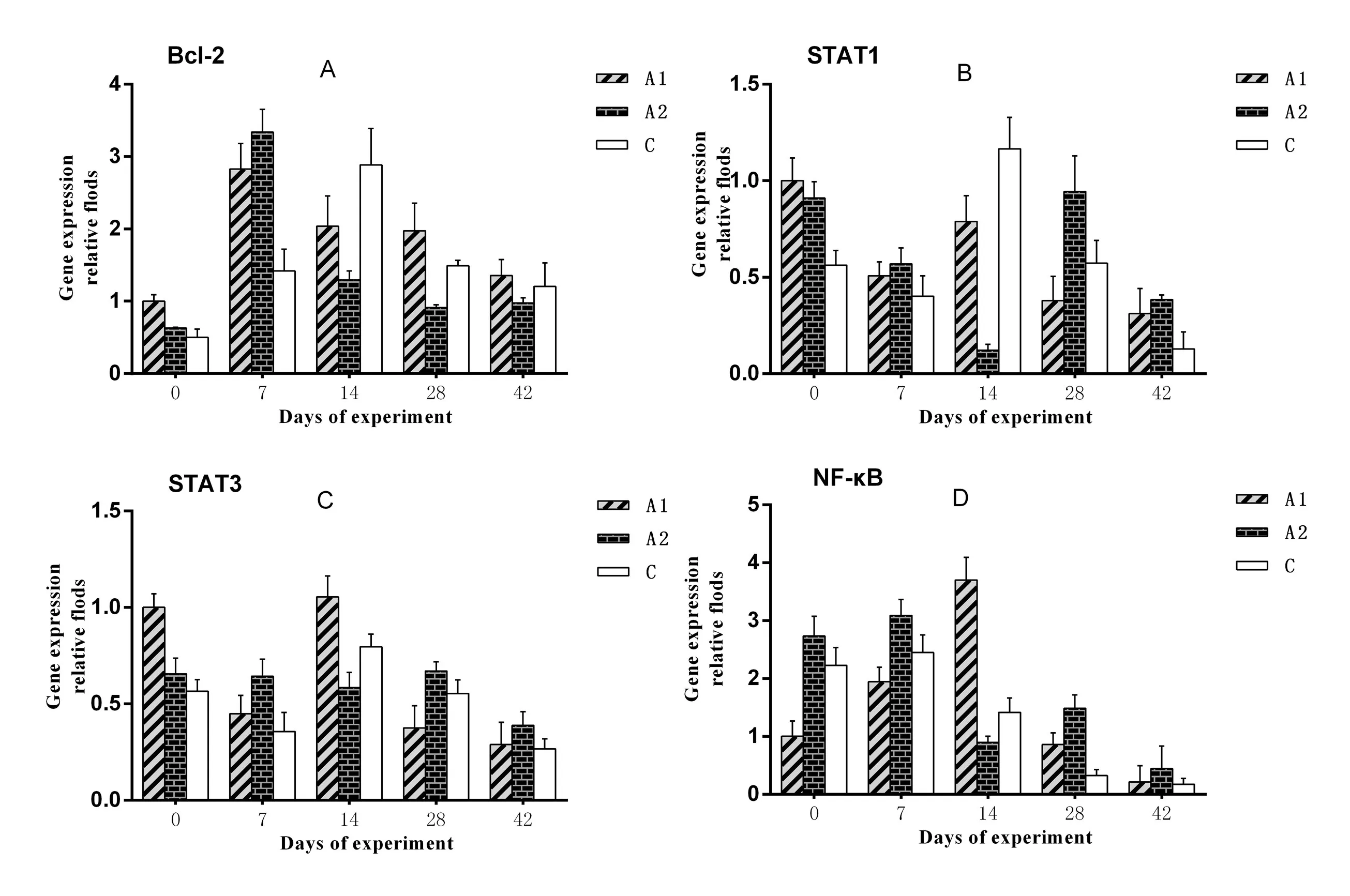
图8 试验仔猪血液中免疫信号转导分子相关基因的表达水平变化Fig.8 The change of the immune signal transduction molecules relative genes in blood samples of experiment piglets
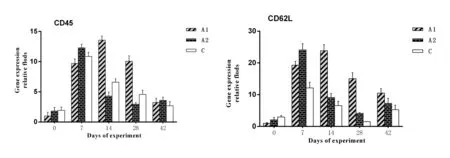
图9 试验仔猪血液中免疫记忆相关基因的表达水平变化Fig.9 The change of the immune memory relative genes expression in blood samples of experiment piglets
本次试验可以观察到,融合表达猪IL-2和IL-4/6基因的重组毕赤酵母与融合表达牛源抗菌肽和猪IL-4/6的重组毕赤酵母相比于对照组均能有效促进仔猪生长和提高免疫应答水平
A1、A2组每头仔猪平均体重较C组相比均明显升高(P<0.05),在试验的第42天,A1、A2组每头仔猪的净增重分别高出对照组C 3.47 kg和1.66 kg(P<0.05)。有趣的是,A1的料重比均高于C组(P<0.05),而A2的料重比均低于C组(P<0.05)。血液中的A1和A2的CD8+T细胞的比例均高于C组(P<0.05)。从试验的第0天到第28天,在A1和A2组的血清中CSF特异性抗体和PRRS特异性抗体的增加比对照C组更明显(P<0.05)。早期一些报道已表明,细胞因子不仅在细胞之间传达信息,同时也调节细胞的生理过程,提高机体的免疫力,而且影响生长和增重效率[30-31]。抗菌肽具有广谱抗菌活性,是生物先天性免疫的重要组成部分,同时,抗菌肽的适宜量能促进生长[32]。因此,这些结果可能与融合基因的介导调控的有关。
在这个试验中,可以看到,在试验的第42天,A1组的大部分选定基因的表达水平与C组比较显著升高,A2组的4种Toll样受体(TLR2、TLR4、TLR7、TLR9)基因和部分重要的免疫相关基因如STAT1、STAT3、NF-κB、CD45和CD62L的表达水平与C组比较显著升高。
TLR是先天免疫系统的组成部分,也是特异性免疫和非特异性免疫之间的桥梁[33]。STAT1基因编码的蛋白质参与诱导细胞凋亡和抑制Bcl-2的表达。STAT3在调控细胞增殖,细胞凋亡和细胞迁移方面有重要作用[34]。Bcl-2是抑制细胞凋亡的重要基因,它和促凋亡因子Bax一起调节细胞凋亡[35]。NF-κB能促进基因转录和蛋白表达,它与炎症反应,免疫反应,细胞增殖、转化和凋亡的病理生理过程密切相关[36]。CD45在免疫细胞的选择和转化中扮演着一个非常重要的角色[37]。CD62L属于表面凝集素的一种,中性粒细胞的“滚动”以及炎症过程中的初始与之密切相关[38]。这些均与免疫调节剂能增强仔猪免疫应答水平相关。
简而言之,本研究结果证试,融合表达牛源抗菌肽和猪IL-4/6的重组酵母能够有效促进仔猪的生长发育,并增强仔猪的免疫应答水平,是一种经济试用安全的免疫生物调节剂。
[1]Kekarainen T, McCullough K, Fort M, et al. Immuneresponses and vaccine-induced immunityagainst Porcine circovirus type 2[J]. VeterinaryImmunology and Immunopathology, 2010,136(3-4): 185-193.
[2]司红彬,李海洲,王世坤.导致免疫失败的因素分析及相应对策[J].现代畜牧兽医,2005,(10):15-17.
[3]雷莉辉.动物免疫失败的影响因素及对策[J].动物医学进展,2011,32(1):106-109.
[4]Shams H. Recent developments in veterinaryvaccinology[J]. Veterinary Journal, 2005, 170(3): 289-299.
[5]Sims JE,Nicklin MJ,Bazan JF,et al.A new nomenclature for IL-1-family genes[J].Trends Immunol,2001,22(10):536-537.
[6]Johnson RW, Arkins S, Dantzer R, et al. Hormones,lymphohemopoietic cytokines and theneuroimmune axis[J]. Comp Biochem Physiol APhysiol, 1997, 116(3): 183-201.
[7]Haddad JJ, Saadé NE, Safieh-Garabedian B. Cytokinesand neuro-immune-endocrine interactions:a role for the hypothalamic-pituitaryadrenalrevolving axis[J]. Journal of Neuroimmunology,2002, 133 (1-2): 1-19.
[8]Kolls JK, McCray PB Jr, Chan YR. Cytokine-mediated of antimicrobial proteins[J].Nature Reviews Immunology,2008,8(11):829-835.
[9]翟志敏.IL-2对免疫激活和免疫耐受的双向调节作用[J].中国药理学通报,2013,29(3):319-322.
[10]Gaffen SL,Liu KD.Overview of interleukin-2 function,production and clinical applications[J].Cytokine,2004,28(3):109-123.
[11]张展,杨焕民.冷应激仔猪血浆中抗炎性细胞因子IL-4、IL-10水平变化的研究[J].现代畜牧兽医,2007,(6):9-12.
[12]Nelms K,Keegan AD,Zamorano J,et al.The IL-4 receptor:signaling mechanisms and biologic functions[J].Annual Review of Immunology,1999,17(17):701-738.
[13]李昕,刘佳佳.IL-6对中性粒细胞在炎症中作用的影响[J].国际免疫学志,2005,28(5):277-280.
[14]Banks WA,Kastin AJ,Gutierrez EG.Penetration of interleukin-6across the murine blood-brain barrier[J].Neuroscience Letters,1994,179(1-2):53–56.
[15]Zanetti M. Cathelicidins, multifunctionalpeptides of the innate immunity[J]. Journalof Leukocyte Biology, 2004, 75(1): 39-48.
[16]Shai Y.Mode of action of membrane active antimicrobial peptides[J].Peptide Science,2002,66(4):236-248.
[17]Veldhuizen EJ,Rijnders M,Claassen EA,et al.Porcine β-defensin 2 displays broad antimicrobial activity against pathogenic in-testinalbacteria[J].Molecular Immunology,2008,45(2):386-394.
[18]OppenheimJJ,BiragynA,KwakLW,etal.Roles of antimicrobial peptides such as defensins in innate and adaptive immunity[J].Annals of the Rheumatic Diseases,2003,62(Suppl 2):ii17-ii21.
[19]黎观红,洪智敏,贾永杰,等.抗菌肽的抗菌作用及其机制[J].动物营养学报,2011,23(4):546-555.
[20]Hancock RE,Sahl HG.Antimicrobial and hostdefense peptides as new anti-infective the rapeuticstrategies[J].Nature Biotechnology,2006,24(12):1551-1557.
[21]汲全柱,任静柏.抗菌肽的研究进展[J].现代畜牧兽医,2010,(4):64-66.
[22]刘静,刘聚祥.酵母菌的营养特性及在畜牧业中的应用[J].动物医学进展,2007,28(5):98-100.
[23]Bontempo V, Giancamillo A Di, Savoini G, etal. Live yeast dietary supplementation actsupon intestinal morpho-functional aspectsand growth in weanling piglets[J]. AnimalFeed Science Technology, 2006, 129(4): 224-236.
[24]陈如水,付瑞珍,黄元林.发酵蛋白饲料对生长育肥猪生产性能和猪肉品质的影响[J].现代畜牧兽医,2014,(3):25-28.
[25]潘永荣,张俊峰,蒋运友.微生态制剂在养猪生产中的应用[J].现代畜牧兽医,2010,(8):34-35.
[26]Yang X, Sun WK, Chen WL, et al. Promotion ofthe immunity of piglets to Hog cholera vaccineinduced by shuffled pig interleukin-2gene and CpG immunostimulatory sequences encapsulatedin chitosan nanoparticles[J]. Procediain Vaccinology, 2010, 2(1): 51-59.
[27]Yang X,Xiao YL,Chen JL,et al.Potentiation of Immunity of Piglets to Mycoplasma Hyopneumoniae Vaccine with Fused Gene for Pig IL-4 and IL-6 Embodied in Chitosan Nanoparticles[J].Procedia in Vaccinology,2013,7(8):15-22.
[28]Huang J,Chen JL,Wang Y,et al.Enhancement of the Immunity of Piglets to Pseudorabies Vaccine with Plasmids Containing Interleukin-6 Gene and CpG Motifs Encapsulated in Chitosan Nanoparticles[J].Procedia in Vaccinology,2013,7(8):8-14.
[29]Livak KJ, Schmittgen TD. Analysis of relativegene expression data using real-timequantitative PCR and the 2(-Delta Delta C(T)) Method[J]. Methods, 2001, 25(4): 402-408.
[30]Fossum C. Cytokines as markers for infectionsand their effect on growth performanceand well-being in the pig[J]. Domestic AnimalEngocrinology, 1998, 15(5): 439-444.
[31]Spurlock ME.Regulation of metabolism and growth during immune challenge:an overview of cytokine function[J].Journalo fanimal science,1997,75(7):1773-1783.
[32]侯改凤,李瑞,韦良开,等.抗菌肽对育肥猪生长性能及血液生理生化指标的影响[J].中国饲料,2017,(12):24-26.
[33]Oda K,Kitano H.A.Comprehensive map of the toll-like receptor signaling network[J].Molecular Systems Biology,2006,2(1):2006.0015.
[34]Wen LH,Craig J,Dyce PW,et al.Cloning of porcine signal transducer and activator of transcription 3 cDNA and its expression in reproductive tissues[J].Reproduction,2006,132(3):511-518.
[35]车晓芳,罗颖,刘云鹏.Bcl-2和Bax调节细胞凋亡的研究[J].国际输血及血液学杂志,2001,24(2):103-105.
[36]Beg AA,Baltimore D.An essential role for NF-kappa B in preventing TNF-alpha-induced cell death[J].Science,1996,274(5288):782-784.
[37]张伟,邓友金,漆安慎. CD45在T细胞激活过程中的作用[J].北京师范大学学报(自然科学版),2001,37(2):166-169.
[38]张新丹,宫芳,姜冬梅,等.L-选择素的结构及其在炎症反应中的作用研究[J].黑龙江畜牧兽医,2007(5):52-53.
