抗真菌药单用及联合体外抗皮炎外瓶霉生物膜效应
2018-03-06郑文倩孙毅高露娟邬清芝李明曾同祥
郑文倩 孙毅 高露娟 邬清芝 李明 曾同祥
434100湖北荆州,长江大学(郑文倩);长江大学第二临床医学院 荆州市中心医院皮肤科(孙毅、邬清芝、曾同祥);复旦大学附属中山医院皮肤科(高露娟、李明)
皮炎外瓶霉是暗色丝孢霉病的常见致病菌之一[1],可引起皮肤、皮下组织感染,偶可致系统性播散性感染,在亚洲人群以中枢神经系统感染多见,死亡率高达90%[2-3]。生物膜形成不仅是侵袭性感染发展的先决条件,同时也与80%的非急性感染相关[4]。与游离态真菌相比,生物膜对多数抗真菌药物耐药,是临床疗效欠佳的潜在原因[4]。为了评估皮炎外瓶霉生物膜的抗真菌药物敏感性,开发可能的药物联合方案,我们用96孔板构建皮炎外瓶霉生物膜,以棋盘式微量液基稀释法评估抗真菌药物单用及联合抗皮炎外瓶霉生物膜的效果。
一、材料和方法
1.实验菌株:皮炎外瓶霉菌株5株,质控菌株为近平滑念珠菌(ATCC22019),所有菌株均于实验前用沙氏培养基活化1周,以保证受试真菌的活力与纯度。所有皮炎外瓶霉菌株均分离自临床患者,并经形态学和分子生物学方法鉴定。
2.抗真菌药:伊曲康唑(批号84625-61-6,纯度>99%)、伏立康唑(批号137234-62-9,纯度>99%)、两性霉素B(批号1397-89-3,纯度 >80%)和卡泊芬净(批号179463-17-3,纯度>97%)均由美国Sigma公司生产。使用分析纯二甲基亚砜将药物溶解成储存液,浓度均为1 600mg/L。
3.构建皮炎外瓶霉生物膜:通过改良的96孔板法构建皮炎外瓶霉生物膜[5-6]。从沙氏培养基上收集孢子,用20ml RPMI1640培养基重悬,并调至1×107/m l菌悬液;在96孔板加入200μl上述孢子悬浮液,于37℃培养72 h;去上层培养基,避免破坏底部生物膜。磷酸盐缓冲液清洗3次。
4.体外单药药物敏感性测试:参考美国临床实验室标准化研究所(Clinical Laboratory Standard Institute,CLSI)颁布的M38-A2方案[7],制备抗真菌药物溶液,伊曲康唑、伏立康唑和卡泊芬净终浓度为0.25~32mg/L,两性霉素B终浓度为0.125~8mg/L。倍比稀释后,将受试药物加入96孔板,每孔加入100μl,同时设立阳性对照(无药孔区)和阴性对照(无菌孔区),37℃孵育72 h。每孔加入100μl3,3′-[1-(苯氨酰基)-3,4-四氮唑]-二(4-甲氧基-6-硝基)苯磺酸钠(XTT)/甲萘醌混合溶液,孵育4 h后,于每孔中取80μl上清液,转移到新的96孔板,并在490 nm处读取吸光度(A值)[8]。所有实验均重复3次。生物膜最低抑菌浓度(SMIC)50和SMIC80定义为:与对照组相比,其A值减少50%或80%的抗真菌药物浓度[7]。
5.体外联合药物敏感性测试:采用棋盘法[8]。在含有生物膜的96孔板中分别加入不同的两种药物,自左向右1~8列为联合区,每孔加入2倍终浓度药物倍比稀释液各50μl;第9、10列为单独用药区,药物终浓度梯度同联合区,同时设立阳性对照(无药孔区)和阴性对照(无菌孔区),35℃孵育72 h。每孔加入100μl XTT/甲萘醌混合溶液,孵育4 h,每孔取80μl上清液,转移到另1个96孔板,并在490 nm处读取A值[9]。所有实验均重复3次。药物联合效应根据分数抑菌浓度指数(fractional inhibitory concentration index,FICI)评判,FICI=SMICA联合/SMICA单独+SMICB联合/SMIC B单独[9]。FICl< 0.5为协同作用,0.5<FICI≤4为无关,FICI>4为拮抗作用[10]。
二、结果
1.抗真菌药单用抗皮炎外瓶霉生物膜效应:伊曲康唑、伏立康唑和卡泊芬净对皮炎外瓶霉生物膜的SMIC50和SMIC80范围均>32mg/L;两性霉素B的SMIC50为1~2mg/L,SMIC80为4~8mg/L。见表1。
2.抗真菌药联合抗皮炎外瓶霉生物膜效应:伏立康唑与两性霉素B联合时,两者SMIC80范围分别降低至0.5~1mg/L和0.25~0.5mg/L,表现为协同效应。两性霉素B与伊曲康唑、两性霉素B与卡泊芬净、伏立康唑与卡泊芬净联合时均未观察到协同效应。所有联合用药组均未观察到拮抗作用。见表1。
三、讨论
我们用改良的96孔板法构建皮炎外瓶霉生物膜体外模型,进行抗真菌药物敏感性测试。由于皮炎外瓶霉生长缓慢,在制备过程中,我们将菌悬液调至1×107/ml,孵育时间延长到72 h;生物膜药物敏感性测试的孵育时间与参考方案相比也延长至48 h[5-6,8]。研究显示,抗真菌药物单药作用于皮炎外瓶霉生物膜时,两性霉素B的SMIC50浓度范围为1~2mg/L,相对其他药物具有较好的抗皮炎外瓶霉生物膜活性。既往研究显示,伏立康唑、伊曲康唑和两性霉素B对皮炎外瓶霉游离态均有较好的抗真菌效应[4],但本研究发现,伏立康唑、伊曲康唑和卡泊芬净对皮炎外瓶霉生物膜的SMIC50及SMIC80范围均较高,证实抗真菌药物对生物膜态的活性明显低于对游离态的活性[11]。体外联合药物敏感试验显示,两性霉素B与伏立康唑联合对皮炎外瓶霉生物膜具有协同效应,既往有此联合方案成功治愈系统性皮炎外瓶霉感染的报道[12]。此外,既往研究显示,卡泊芬净与两性霉素B或伏立康唑联合分别对62.5%和93.8%的游离态皮炎外瓶霉具有协同效应[7],但本研究发现,这两个组合方案以及两性霉素B与伊曲康唑组合对皮炎外瓶霉生物膜均无协同作用,体现了生物膜态和游离态对联合药物敏感性的差异,提示我们应积极探索针对生物膜的新型治疗方案。
综上所述,与伏立康唑、伊曲康唑和卡泊芬净相比,两性霉素B具有更强的抗皮炎外瓶霉生物膜作用,两性霉素B和伏立康唑联合能够增强抗皮炎外瓶霉生物膜的作用,为难治性皮炎外瓶霉相关感染的治疗方案提供理论基础。本研究为体外实验,将来还需要更多研究来证实该联合方案的体内效应。
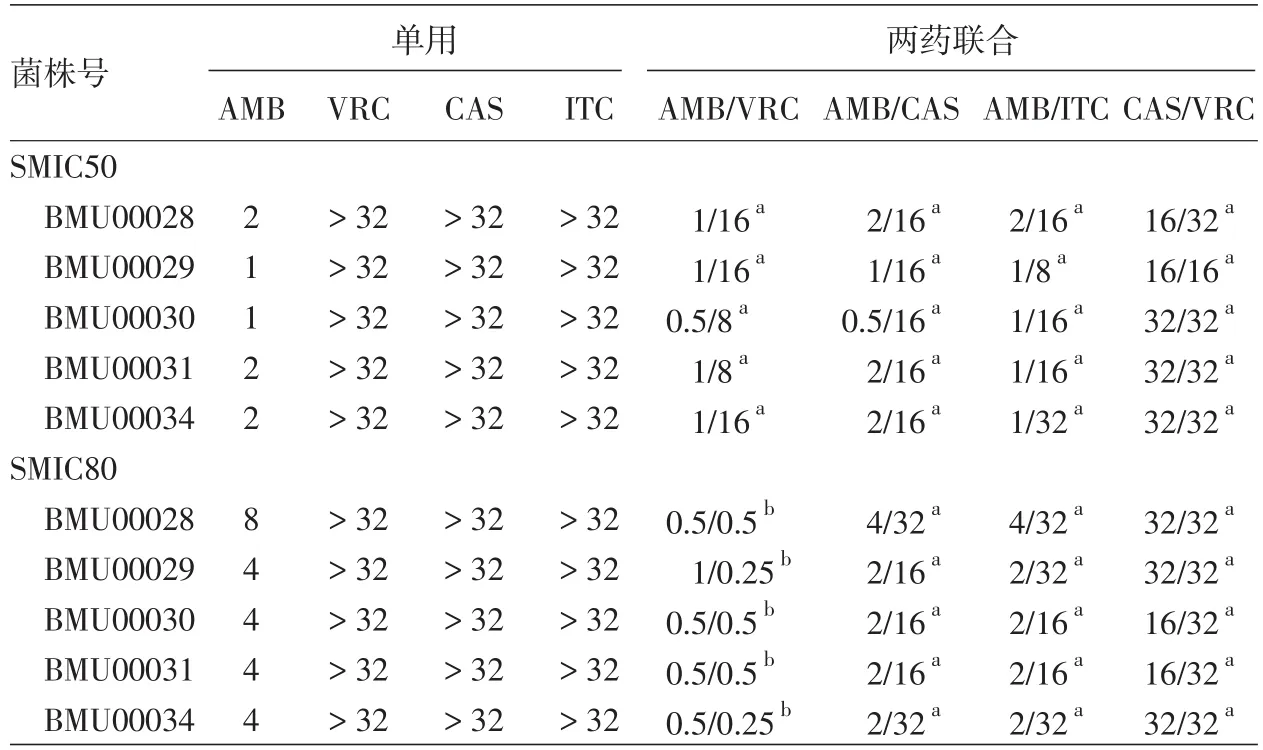
表1 4种抗真菌药单用及联合体外抗皮炎外瓶霉生物膜50%与80%最低抑菌浓度(SMIC50、SMIC80) mg/L
志谢北京大学第一医院李若瑜教授和刘伟教授提供皮炎外瓶霉临床菌株
[1]Li DM,Li RY,de Hoog GS,et al.FatalExophialainfections in China,with a report of seven cases[J].Mycoses,2011,54(4):e136-142.DOI:10.1111/j.1439-0507.2010.01859.x.
[2] Chakrabarti A.Epidemiology of central nervous system mycoses[J].Neurol India,2007,55(3):191-197.
[3]Patel AK,Patel KK,Darji P,et al.Exophialadermatitidis endocarditis on native aortic valve in a postrenal transplant patient and review of literature onE.Dermatitidisinfections[J].Mycoses,2013,56(3):365-372.DOI:10.1111/myc.12009.
[4]Davies D.Understanding biofilm resistance to antibacterial agents[J].Nat Rev Drug Discov,2003,2(2):114-122.DOI:10.1038/nrd1008.
[5]Pierce CG,Uppuluri P,Tristan AR,et al.A simple and reproducible 96-well plate-based method for the formation of fungal biofilms and its application to antifungal susceptibility testing[J].Nat Protoc,2008,3(9):1494-1500.DOI:10.1038/nport.2008.141.
[6]Gao L,Jiang S,Sun Y,et al.Evaluation of the effects of photodynamic therapy alone and combined with standard antifungal therapy on planktonic cells and biofilms ofFusarium spp.andExophiala spp[J].Front Microbiol,2016,7:617.DOI:10.3389/fmicb.2016.00617.
[7] Clinical and Laboratory Standards Institute.Referencemethod for broth dilution antifungal susceptibility testing of filamentous fungi;approved standard—2nd ed.CLSI document M38-A2.Clinical and Laboratory Standards Institute,Wayne,PA,USA.2008.
[8]Ramage G,VandeWK,Wickes BL,etal.Standardizedmethod forin vitroantifungal susceptibility testing ofCandida albicansbiofilms[J].Antimicrob Agents Chemother,2001,45(9):2475-2479.
[9]Tobudic S,Kratzer C,Lassnigg A,et al.In vitroactivity of antifungal combinations againstCandida albicansbiofilms[J].J Antimicrob Chemother,2010,65(2):271-274.DOI:10.1093/jac/dkp429.
[10]Odds FC.Synergy,antagonism,and what the chequerboard puts between them[J].JAntimicrob Chemother,2003,52(1):1.DOI:10.1093/jac/dkg301.
[11] Singhal D,Baker L,Wormald PJ,et al.Aspergillus fumigatusbiofilm on primary human sinonasal epithelial culture[J].Am J Rhinol Allergy,2011,25(4):219-225.DOI:10.2500/ajra.2011.25.3622.
[12]Diemert D,Kunimoto D,Sand C,et al.Sputum isolation ofWangiella dermatitidisin patientswith cystic fibrosis[J].Scand J InfectDis,2001,33(10):777-779.
