肥大细胞在金黄色葡萄球菌肠毒素B诱导小鼠特应性皮炎样炎症反应中的作用
2018-03-06王珊赵作涛王誉涵涂平刘玲玲
王珊 赵作涛 王誉涵 涂平 刘玲玲
100034北京大学第一医院皮肤科 皮肤病分子诊断北京市重点实验室(第一作者现在国家儿童医学中心 首都医科大学附属北京儿童医院皮肤科,100045北京)
感染与免疫的相互作用是特应性皮炎(atopic dermatitis,AD)的发病机制研究中的热点之一,而金黄色葡萄球菌(金葡菌)的感染或定植在AD中的作用已得到公认[1]。与诱发加重AD炎症相关的金葡菌产物目前认为主是与金葡菌超抗原(staphylococcal superantigen,SsAg)的作用有关。已有研究显示,SsAg诱发加重AD的机制主要与T细胞[2]、B细胞[3]、树突细胞、角质形成细胞[4]、嗜酸性粒细胞[5]等作用有关。然而,SsAg对另一在AD中起重要作用的肥大细胞尚未见报道。我们研究[6]发现,金葡菌肠毒素B(Staphylococcus aureusenterotoxins B,SEB)可直接活化肥大细胞,使其释放类胰蛋白酶及组胺,但在体内微生物如金葡菌感染或定植是否作用于肥大细胞并参与AD尚不清楚。因此,本研究用SEB来构建小鼠AD模型,初步探讨肥大细胞在SEB诱导的AD样炎症反应中的作用。
资料与方法
一、实验材料
1.实验动物:SPF级纯系BALB/c小鼠24只,6~8周龄,体重20 g左右,雌性,购自斯贝福(北京)试验动物科技有限公司,合格证号SCKK(京)2011-0004,许可证号SYXK(军)2012-0014。
2.主要实验试剂:卵清蛋白(OVA,北京华越洋生物科技有限公司),SEB(美国AnaSpec公司),抗肥大细胞类胰蛋白酶抗体(ab2378)(英国Abcam公司),PV-二步法免疫组化检测试剂盒PV-9002、浓缩DAB试剂盒(北京中杉金桥生物技术有限公司)。
二、方法
1.小鼠AD模型造模:24只BALB/c小鼠分为4组,每组6只。分为OVA组:1 g/LOVA;SEB组:0.1 g/L SEB;OVA+SEB组:含1 g/LOVA及0.1 g/L SEB的混悬液;对照组:生理氯化钠溶液。将小鼠戊巴比妥钠麻醉后电剃刀剔除背部颈部毛发,3M胶带在除毛部位反复粘贴6次,以上背部中央1 cm2皮肤作为靶部位。依据分组将各组需配制的100μl致敏物质加入斑试器中的滤纸片,将斑贴器用绷带固定于背部,每2~3天更换,1周后取下,间隔2周再循环封闭斑贴1周,共循环封闭斑贴3轮。7周造模结束后去除斑试器,观察靶部位的临床表现并参照EASI评分法[7]评估小鼠背部皮损炎症的严重程度,即分别对皮损的红斑、浸润(水肿)或丘疹、鳞屑和苔藓样变4项进行评分。每项严重程度以0~3分计分:0计无,1计轻度,2计中度,3计重度,4项评分之和为皮损严重程度评分。
2.皮损标本收集及处理:第7周第3轮封闭斑贴诱导结束后收集组织标本,使用5mm环钻取各组小鼠接触斑试器部位皮肤,以4%甲醛固定,常规石蜡包埋、连续切取4μm石蜡切片(免疫组化切片使用专用阳离子防脱片),行HE染色、甲苯胺蓝染色及免疫组化类胰蛋白酶染色。免疫组化采用常规二步法,常规脱蜡、抗原修复、3%H2O2孵育15min,分别加入稀释的类胰蛋白酶一抗,4℃孵育过夜,滴加通用二抗IgG抗体-HRP多聚体,室温孵育20min,DAB显色2~5min,常规复染、风化、透明化及封片,光镜下观察染色情况。
3.肥大细胞计数:肥大细胞使用甲苯胺蓝染色的切片计数。每张切片取独立10个高倍视野(HPF,×400),每个视野分别计数甲苯胺蓝(+)细胞数,累加为肥大细胞总数目,除以10取均值为该切片高倍视野肥大细胞均数(肥大细胞数/HPF);同时计数该视野中处于脱颗粒形态的肥大细胞数,即脱颗粒肥大细胞均数(脱颗粒肥大细胞数/HPF),并计算脱颗粒肥大细胞百分比。脱颗粒百分比=脱颗粒肥大细胞均数/肥大细胞均数×100%。为减少人为计数误差,采用两位实验者同时计数的方法,将每人计数的结果相加取均值。
4.统计学方法:数据的统计和分析采用SPSS14.0统计分析软件。数据结果经正态性检验,若为正态分布,采用±s描述,若不符合正态分布,采用中位数(四分位数间距)描述。分析不同处理的组间差别,若数据符合正态分布且方差齐,采用单因素方差分析(ANOVA),两两比较采用Tukey-kramer法。若数据不符合正态分布,则采用多重比较Wilcoxon方法。相关分析采用二元变量相关分析Pearson法。P<0.05为差异有统计学意义。

图1 经皮刺激BALB/c小鼠背部7周后皮损表现 卵清蛋白(OVA)组、金黄色葡萄球菌肠毒素B(SEB)组及OVA+SEB组均见不同程度的红斑、鳞屑及结痂,OVA+SEB组最严重
结 果
一、模型小鼠AD样皮损炎症反应和评分
分别使用OVA、SEB及OVA+SEB联合组经皮诱导BALB/c小鼠后背7周后,3个组背部接触斑试物部位皮肤均出现不同程度炎症反应:表现为红斑、鳞屑以及少许结痂。其中,OVA+SEB组的红斑和鳞屑表现较OVA组及SEB组明显严重,OVA组较SEB组红斑和鳞屑略严重,对照组未见明显的红斑、鳞屑、结痂表现。见图1。
皮损严重程度评分OVA组为6.0(0.75),SEB组为6.00(1.50),OVA+SEB组为7.50(1.75),对照组为1.00(0.75)。其中OVA+SEB组皮损严重程度评分最高,采用多重比较Wilcoxon法与OVA组、SEB组及对照组比较,差异均有统计学意义(Z值分别为2.124、2.084和 2.381,P值分别为 0.034、0.037和0.017);OVA组和SEB组皮损严重程度平均评分均高于对照组,分别与对照组比较,组间差异有统计学意义(Z值分别为2.428和2.381,P值分别为0.015和0.017),OVA组和SEB组间比较,差异无统计学意义(Z=0.500,P=0.617)。见图2。

图2 不同组别皮损严重程度评分均值比较 a:与对照组比较,P<0.05;b:与OVA+SEB组比较,P<0.05。OVA:卵清蛋白;SEB:金黄色葡萄球菌肠毒素B
二、模型小鼠AD样皮损的组织病理表现
光镜下观察皮损HE染色组织,OVA组、SEB组和OVA+SEB联合组与对照组相比,均表现出不同程度的表皮角化过度和角化不全,部分区域表皮增厚,海绵水肿,真皮全层、皮下脂肪、肌肉间隙以淋巴细胞为主的单个核细胞浸润,小血管扩张充血。各组单个核细胞细胞浸润程度由重到轻依次为OVA+SEB组、OVA组、SEB组和对照组。见图3。
三、模型小鼠AD样皮损组织的甲苯胺蓝染色与类胰蛋白酶免疫组化染色对比
观察甲苯胺蓝染色(+)及类胰蛋白酶免疫组化染色(+)的细胞的分布、数目、形态基本一致(图4)。但类胰蛋白酶染色有部分假阳性,而甲苯胺蓝非特异性染色较少,更为清晰,故肥大细胞计数依据甲苯胺蓝染色结果。
四、模型小鼠AD样皮损组织的肥大细胞数目、脱颗粒肥大细胞数目及脱颗粒肥大细胞百分比
1.甲苯胺蓝染色(+)肥大细胞数目:在光镜下OVA组、SEB组和OVA+SEB组的平均甲苯胺蓝染色(+)肥大细胞数目均较对照组显著增多,差异均有统计学意义(多重比较Wilcoxon法,Z值分别为2.647、2.807和 2.807,P值分别为 0.008、0.005和0.005),其中OVA+SEB组肥大细胞数目最多,高于OVA组及SEB组,但组间差异均无统计学意义(Z值分别为1.201和1.201,P值分别为0.230和0.230)。OVA组和SEB组平均肥大细胞数目接近,组间差异无统计学意义(Z=0,P=1)。见表1。

图3 卵清蛋白(OVA)组、金黄色葡萄球菌肠毒素B(SEB)组和OVA+SEB联合组和对照组皮损HE染色及甲苯胺蓝染色结果 各组单个核细胞细胞浸润程度由重到轻依次为OVA+SEB组、OVA组、SEB组和对照组
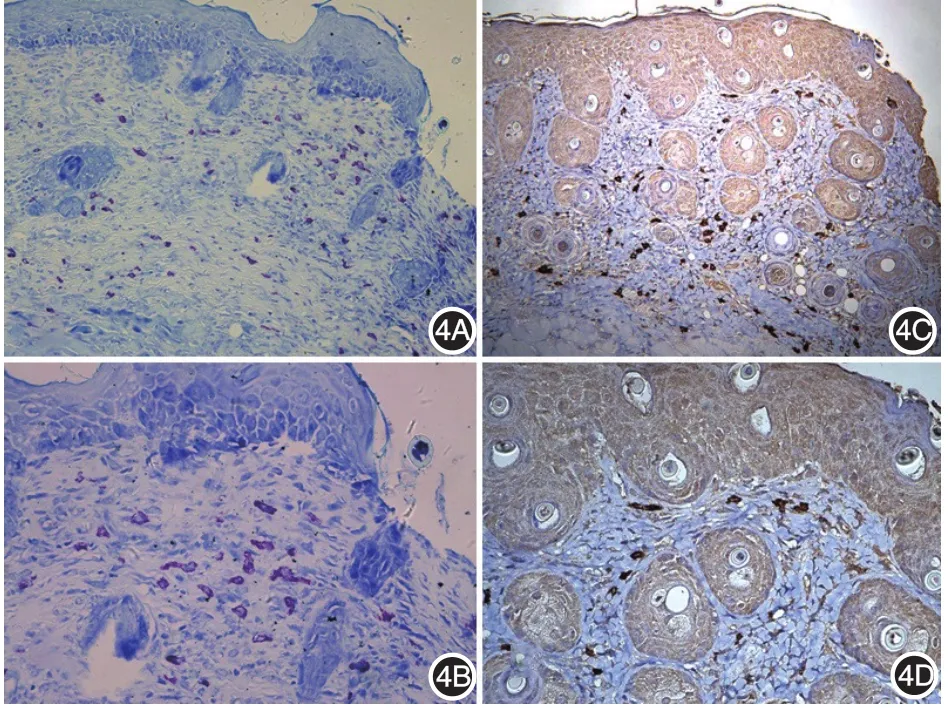
图4 甲苯胺蓝染色与类胰蛋白酶免疫组化染色 4A:甲苯胺蓝染色×100;4B:甲苯胺蓝染色×400;4C:类胰蛋白酶免疫组化染色×100;4D:类胰蛋白酶免疫组化染色×400。甲苯胺蓝染色(+)及类胰蛋白酶免疫组化染色(+)的细胞分布、数目、形态基本一致
2.甲苯胺蓝染色(+)脱颗粒肥大细胞数目及百分比:在光镜下计数各组脱颗粒肥大细胞数目及计算百分比见表1。采用单因素方差分析计算各组肥大细胞脱颗粒比例差异,F=20.465,P<0.001,各组间差异有统计学意义。进一步应用Tukey-kramer法进行组间比较显示,SEB组及OVA+SEB组的脱颗粒肥大细胞比例较高,均明显高于对照组,组间差异有统计学意义(t值分别为6.261和4.636,均P<0.001),而SEB组与SEB+OVA组比较,组间差异无统计学意义(t=1.625,P=0.388)。OVA组脱颗粒肥大细胞比例较低,与对照组比较差异无统计学意义(t=0.057,P=0.999)。见表1。
五、模型小鼠AD样皮损组织中甲苯胺蓝染色(+)肥大细胞数目与临床皮损严重程度的相关性
将OVA组、SEB组、OVA+SEB组和对照组甲苯胺蓝染色(+)肥大细胞数目与临床皮损严重程度评分做二元变量相关分析,Pearson相关系数为0.940,P=0.040,差异有统计学意义。故认为肥大细胞数目与皮损严重程度评分呈线性正相关。即肥大细胞数目越多,临床皮损炎症程度越重。
讨 论

表1 甲苯胺蓝染色(+)肥大细胞数目、脱颗粒肥大细胞数目及脱颗粒肥大细胞百分比
OVA诱导BALB/c小鼠AD模型是由1998年Spergel等首先建立[8-9],SEB作为超抗原刺激小鼠皮肤建立的AD模型是由Laouini等[10]建立。Skov等[11]发现在人身上以SEB封闭斑贴实验也可产生红斑、炎症等皮肤表现,SEB可通过超抗原的方式激活皮肤T细胞并产生炎症反应。本研究使用OVA诱导模拟AD皮损,而使用OVA+SEB联合诱导模拟了在AD皮损基础上合并金葡菌感染的模型。
OVA+SEB联合刺激时,其诱导产生的皮损临床表现如红斑鳞屑等局部皮炎反应程度、皮损严重程度评分及病理上单个核细胞的浸润程度明显重于单用OVA刺激的皮损,表明联合刺激时的皮损炎症更重。甲苯胺蓝染色显示,OVA+SEB联合组皮损的肥大细胞平均数也明显地高于单独使用OVA诱导的皮损,虽然差异无统计学意义(可能与OVA+SEB组的组内标准差较大及实验鼠样本量较少有关),但肥大细胞明显增多的趋势仍可表明:SEB的作用可以加重OVA诱导的AD样皮肤炎症反应;且肥大细胞的数目越多,AD样皮损越严重。相关性分析也表明,肥大细胞的数目与AD样皮损的严重程度是平行的。
OVA与SEB建立的AD小鼠模型在肉眼观察皮损外观、皮损处病理模式及肥大细胞数目方面均有相似,表明SEB与OVA同样能经皮诱导AD样的皮炎并导致皮损局部肥大细胞增多,共同参与AD皮损发生过程中的机制。但不同的是,使用SEB以及OVA+SEB联合刺激产生的模型小鼠AD样皮损中脱颗粒肥大细胞的百分比明显高于单用OVA组,表明与OVA相比,SEB更能刺激活化肥大细胞,使其脱颗粒。原因可能为OVA是蛋白抗原,其对肥大细胞的活化需要经过APC的提呈,依次活化T细胞和B细胞,产生IgE活化肥大细胞;而SEB是超抗原,既可通过该IgE依赖途径也可通过非IgE依赖途径直接活化肥大细胞,故更加增强了活化肥大细胞作用,在皮损中表现为更多的肥大细胞处于脱颗粒状态。
肥大细胞经典的甲苯胺蓝染色与类胰蛋白酶免疫组化染色的对比显示二者有比较好的一致性,表明肥大细胞活化后所释放的介质主要成分之一即是类胰蛋白酶。本研究证实,肥大细胞在SEB诱导的模型小鼠AD样皮损中发挥作用,而类胰蛋白酶是介导该作用的炎症介质之一。AD患者的皮损部位伴发的严重瘙痒症状困扰着大多数AD患者,临床上第一、二代抗组胺药物治疗AD瘙痒的效果均不甚理想,此与类胰蛋白酶可能是比组胺更加重要的介导AD瘙痒介质[12]有关。近年来有研究证实,类胰蛋白酶抑制剂具有稳定肥大细胞膜的作用,如双苯甲眯、分泌性白细胞蛋白酶抑制剂、乳铁蛋白等[13]。本研究结果提示,临床可研发抑制肥大细胞活性药物或可尝试使用类胰蛋白酶抑制剂来控制及缓解AD的瘙痒症状和皮肤炎症反应。
本实验不足之处在于获得模型标本后检测内容有限,尚不能全面描述肥大细胞在SEB诱导的AD样皮损中的作用,且样本量有限。未来研究将进一步检测更多炎症介质在其中的表达,并探索该过程与IgE的关系,同时着眼结合肥大细胞基因敲除小鼠模型进行体内试验,以求更加完善地阐明肥大细胞在AD中的作用。
综上所述,本研究进一步验证了SEB经皮刺激可诱导BALB/c小鼠产生AD样皮损,并可加重OVA诱导小鼠AD样皮损严重程度;证实了肥大细胞增殖、活化脱颗粒释放类胰蛋白酶等参与此炎症过程。
[1]Ong PY,Leung DY.The infectious aspects of atopic dermatitis[J].Immunol Allergy Clin North Am,2010,30(3):309-321.DOI:10.1016/j.iac.2010.05.001.
[2]Cardona ID,Cho SH,Leung DY.Role of bacterial superantigens in atopic dermatitis:implications for future therapeutic strategies[J].Am JClin Dermatol,2006,7(5):273-279.
[3]Leung DY,Harbeck R,Bina P,etal.Presenceof IgE antibodies to staphylococcal exotoxins on the skin of patients with atopic dermatitis.Evidence fora new group ofallergens[J].JClin Invest,1993,92(3):1374-1380.DOI:10.1172/JCI116711.
[4]Kim KH,Han JH,Chung JH,et al.Role of staphylococcal superantigen in atopic dermatitis:influence on keratinocytes[J].JKorean Med Sci,2006,21(2):315-323.DOI:10.3346/jkms.2006.21.2.315.
[5] Wedi B,Wieczorek D,Stünkel T,et al.Staphylococcal exotoxins exert proinflammatory effects through inhibition of eosinophil apoptosis,increased surface antigen expression(CD11b,CD45,CD54,and CD69),and enhanced cytokine-activated oxidative burst,thereby triggering allergic inflammatory reactions[J].J Allergy Clin Immunol,2002,109(3):477-484.
[6]王珊,赵作涛,王誉涵,等.金黄色葡萄球菌肠毒素B对LAD2肥大细胞系活化作用的研究[J].中华皮肤科杂志,2017,50(10):626-630.
[7]赵辨.湿疹面积及严重度指数评分法[J].中华皮肤科杂志,2004,37(1):3-4.DOI:10.3760/j.issn:0412-4030.2004.01.002.
[8]Spergel JM,Mizoguchi E,Brewer JP,et al.Epicutaneous sensitization with protein antigen induces localized allergic dermatitis and hyperresponsiveness tomethacholine after single exposure to aerosolized antigen inmice[J].JClin Invest,1998,101(8):1614-1622.DOI:10.1172/JCI1647.
[9]Jin H,He R,OyoshiM,et al.Animalmodels of atopic dermatitis[J].J Invest Dermatol,2009,129(1):31-40.DOI:10.1038/jid.2008.106.
[10]LaouiniD,Kawamoto S,Yalcindag A,et al.Epicutaneous sensitization with superantigen induces allergic skin inflammation[J].J Allergy Clin Immunol,2003,112(5):981-987.DOI:10.1016/j.jaci.2003.07.007.
[11]Skov L,Olsen JV,Giorno R,et al.Application ofStaphylococcalenterotoxin B on normal and atopic skin induces up-regulation of T cells by a superantigen-mediatedmechanism[J].JAllergy Clin Immunol,2000,105(4):820-826.DOI:10.1067/mai.2000.105524.
[12]Kawakami T,Ando T,Kimura M,et al.Mast cells in atopic dermatitis[J].Curr Opin Immunol,2009,21(6):666-678.DOI:10.1016/j.coi.2009.09.006.
[13] Caughey GH.Mast cell proteases as pharmacological targets[J].Eur JPharmacol,2016,778:44-55.DOI:10.1016/j.ejphar.2015.04.045.
