纤毛虫群落结构对尕海湿地退化的响应
2018-03-04刘汉成蒲小剑刘晶杜文华甘肃农业大学草业学院甘肃兰州730070甘肃民族师范学院化学与生命科学系甘肃合作747000
刘汉成,蒲小剑,刘晶,杜文华*(.甘肃农业大学草业学院,甘肃 兰州 730070;2.甘肃民族师范学院化学与生命科学系,甘肃 合作 747000)
湿地是地球上兼具水陆特征的特殊生态系统,不仅是人类赖以生存的重要环境,也是自然界最富生物多样性的生态景观之一,具有多种生态功能和社会经济价值,在抵御洪水、调节径流、改善气候、控制污染、美化环境和维护区域生态平衡等方面有其他系统所不能替代的作用[1]。但是,随着人口增长和人类工业化程度的不断提高,湿地资源逐渐成为人类开发利用的对象,使湿地资源受到严重破坏,湿地类型和面积不断减少,生物多样性逐步丧失,湿地功能日趋下降[2]。因此,湿地日益受到世界各国众多学科学者与政府管理部门的极大关注,是当前国际众多学科学者共同关注的前沿热门研究领域,湿地保护与利用的概念,也已经从“湿地作为水禽及其栖息地”上升到新的高度——“保护湿地,更是为了保护其所具有的巨大生态、社会与经济功能,特别是在提供淡水资源、蓄洪防旱减灾、控制环境污染等方面的功能和效益”[3]。
尕海高寒湿地位于青藏高原东北缘,平均海拔在3400 m左右,属典型高寒湿冷气候,冬季漫长,春秋短暂,无明显夏季。尕海湿地地处黄河上游,是重要的水源涵养和补给区,其生态功能的稳定与否,直接影响着黄河中下游地区的工农业生产和社会发展。近年来,受全球性“厄尔尼诺”现象和超载放牧影响,高原湿地草场沙化现象日趋严重,湿地面积急剧减少,不少河流常年干涸或变成了季节河,生物多样性受到严重威胁[4]。保护湿地是保障国家生态安全的需要。湿地生态系统功能独特,兼具有水体和陆地两大生态类型特性,且具有明显的生态过渡性,结构复杂,生态脆弱,但却支撑着独具特色的生物多样性[5]。青藏高原尕海高寒湿地是黄河上游重要的湿地系统,一旦破坏,湿地功能丧失,将导致整个流域生物多样性下降,下游河流湖泊会迅速萎缩、干涸乃至流域的盐碱化等,进一步加剧区域生态环境的恶化,严重威胁人类生存[6]。为此,重点保护好高原沼泽湿地资源,是维护国家和区域生态安全的重要保障。
研究湿地生物群落结构有利于了解湿地生态系统的稳定性。近年来,关于高原沼泽湿地的研究领域逐渐扩大,从植物类群及区系的研究发展到对大型动物群落的调查研究。目前,许多学者开始聚焦微型生物在湿地生态系统中的功能研究,包括对环境的生物量累计效应和对环境污染的指示作用等。原生动物因其个体微小、繁殖速率高,对环境变化敏感,越来越受到湿地生物工作者的青睐。分析湿地原生动物群落结构和其生态功能对评价湿地环境状况具有重要作用[7]。但尚未有青藏高原尕海高寒湿地原生动物的系统性研究报道,尕海湿地原生动物群落结构及其生态功能更鲜有报道。因此,本研究拟对青藏高原尕海高寒湿地纤毛虫群落结构进行分析研究,将为湿地微型生物研究工作提供参考资料,同时也为丰富高原沼泽湿地生物多样性提供基础数据。
1 材料与方法
1.1 样区概况及样点设置
青藏高原尕海湿地隶属于尕海-则岔国家级自然保护区,位于甘肃省甘南藏族自治州碌曲县西南的尕海乡境内(图1A),E 102°09′-102°46′,N 33°58′-34°32′。该湿地为青藏高原东北缘的高寒湿地,横跨长江、黄河两大水系,境内水资源丰富,水草茂盛,是许多珍稀鸟类南迁北返的落脚点和繁殖基地。本研究采样区海拔3473.8~3493.7 m,采样时样区内水体和土壤温度均在冬季,低温-0.8~0 ℃,高温18~30 ℃。各样点的(土壤)含水量随季节不同差异较大(表1)。本研究的6个采样点分布见图1B。其中,1 号为尕海湿地水样;2号为湖缘典型沼泽样点;3号为尕海东北角退化沼泽样点;4号为尕海西北角退化沼泽样点;5号为尕海东南角样点,该样点由于长期用于牲畜的饮水通道,植被严重退化;6号为尕海东南角退化后经围栏保护的沼泽样点。

图1 尕海湿地的位置(A)和采样点位置(B)Fig.1 Geographic position of the Gahai wetland (A) and sampling sites in Gahai wetland (B)
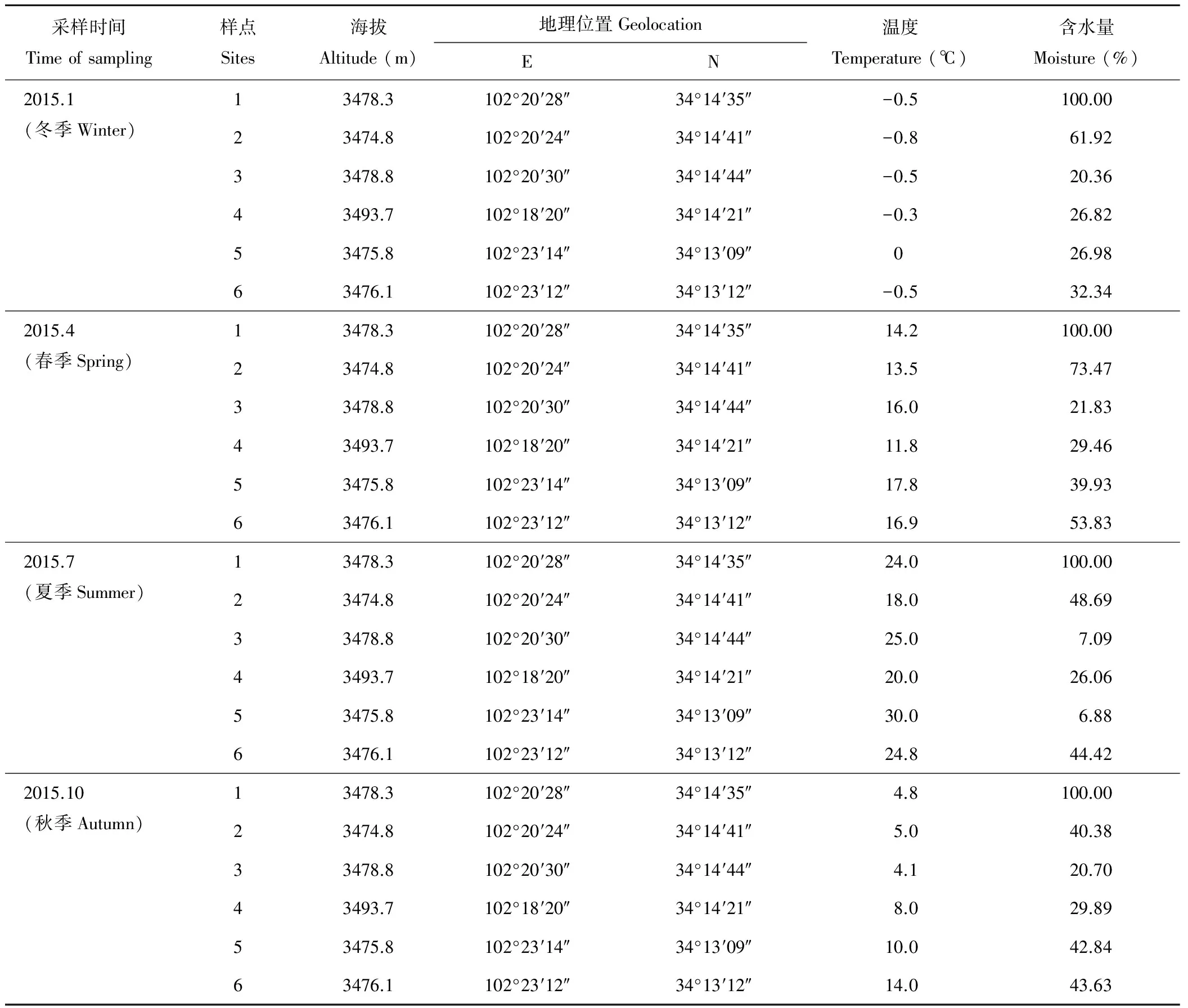
表1 采样点环境因子特征Table 1 Characteristics of the environmental factor of sampling sites
1.2 采样
1.2.1水样采集 用广口瓶在选定水域内分表层、中层和深层分别随机采5个水样,然后将采到的15 个水样混合,摇匀后取样镜检。
1.2.2土样采集 用15 mL圆筒形采样器在每个样点面积约400 m2的范围内用梅花5点取样法取样,采样时使用曲管地温计测量土壤温度,用GPS测定样点海拔和经纬度,植被类型参考文献[8]。
1.3 土样预处理
将采集的土壤样品带回实验室后,用烘干法测定土壤含水量[9],剩余土样在实验室自然风干后装纸袋保存,在风干过程中要防止环境原生动物的交叉污染。
1.4 培养
水体样品直接镜检即可。风干土样使用“非淹没培养皿法”[10]培养后开始镜检。
1.5 镜检
取含虫体水样或培养的土壤悬液1滴,分别在低倍物镜(4×~10×)、中倍物镜(40×)和高倍物镜(100×)下观察虫体的相关特征(如虫体的体形、运动方式、伸缩泡位置等),并拍照或绘图记录[11]。对于部分在活体下不易观察到的特征,可使用蛋白银染色法和碳酸银染色法对虫体染色后确定。综合虫体各类特征后,参考相关文献[12-30]予以鉴定分类。
1.6 物种相似性计算
利用Jaccard 相似性系数[31]计算公式:
J=c/(a+b-c)
式中:J为相似性系数;a为a样点全部种类数;b为b样点全部种类数;c为a、b两样点共同种类数。
1.7 纤毛虫食性分析
根据沈韫芬等[19]的分类标准,对纤毛虫不同类群摄取食物的种类角度,划分了4个营养功能类群,即食藻者(A组)、食菌-碎屑者(B组)、食肉者(R组)和无选择性杂食者(N组)。
1.8 数据处理
用Excel 2010和SPSS 19.0进行数据分析处理。
2 结果与分析
2.1 纤毛虫群落结构
经活体观察和银染法,对尕海湿地4个季节6个样点的土样或水样进行详细观察记录,共鉴定到纤毛虫162种,隶属于3纲13目46科66属,其中包括30个未定名种。
从纤毛虫的群落结构多样性(表2)来看,162种纤毛虫中,有6目22科29属78种属于动基片纲(Kinetofragminophorea),占所有纤毛虫物种总数的48.15%;多膜纲(Polyhymenophorea)次之,计4目14科24属51种,占31.48%;寡膜纲(Oligohymenophorea)最少,共有3目10科13属33种,占20.37%。
从目级分析,纤毛门下毛目的物种比重最大,有7科17属34种,占纤毛虫物种总数的20.99%;前口目次之,计有31种,占19.14%;肾形目(Colpodida)、异毛目(Heterotrichida)、盾纤目(Scuticociliatida)、侧口目(Leurostomatida)、篮口目(Nassulida)、管口目(Cyrtophorida)、吸管目(Suctorida)、膜口目(Hymenostomatida)、缘毛目(Peritrichida)、砂壳目(Tintinnida)和寡毛目(Oligotrichida)各有25、13、13、5、9、6、2、12、8、1和3种,分别占15.43%、8.02%、8.02%、3.09%、5.56%、3.70%、1.23%、7.41%、4.94%、0.62%和1.85%。
在尕海湿地纤毛虫群落中,计有30个未定名种,占纤毛虫物种总数的18.52%。
2.2 纤毛虫分布特征
2.2.1各样点分布状况 各样点162种纤毛虫的分布见表3和图2。从图中可以看出,6个样点中,1号和2号样点各个季节纤毛虫物种数均多于其他样点,5号样点的纤毛虫物种数明显少于其他样点,其余3个样点中,3号样点的物种数少于4号和6号,4号样点和6号样点的物种数目无明显差异。
从季节分布来看,各样点在秋季时可观察到的纤毛虫数最多,但2号样点夏季出现的纤毛虫数多于秋季,主要是因为该样点为湖边沼泽区域,常被湖水淹没,生境特征对土壤类群和水生类群的适合生存,故其种群结构更加复杂。利用环境因素分析各季节纤毛虫物种数的变化情况可知,温度影响纤毛虫分布。由于夏季和秋季水体和土壤温度高于春、冬季节,故在夏季和秋季可观察到更多的纤毛虫物种。
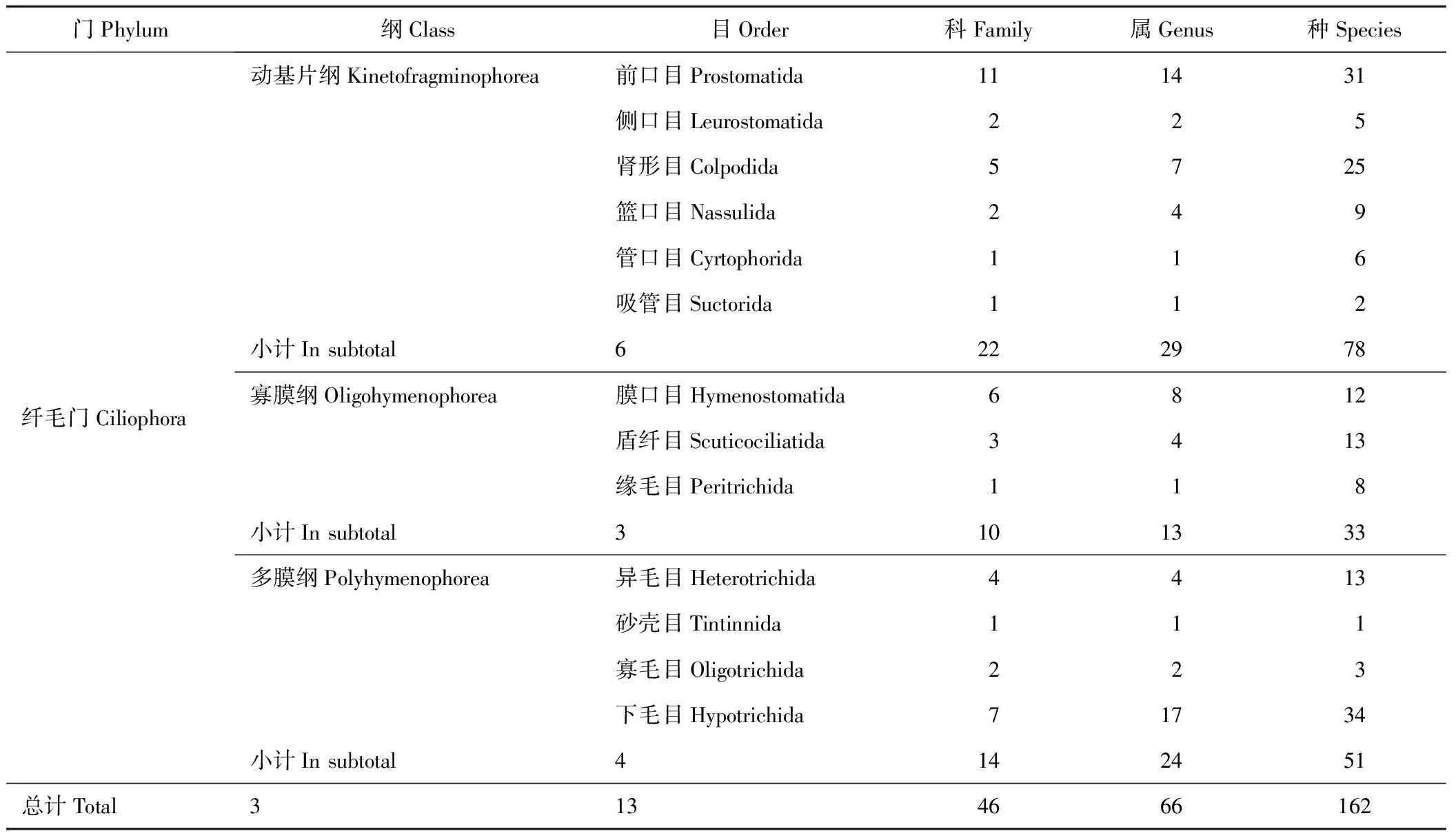
表2 尕海湿地纤毛门原生动物群落组成Table 2 Community composition of Ciliophora (Protozoa) in Gahai wetland
纤毛虫在各个样点出现的频度是反映物种空间分布特征的重要指标,也能体现纤毛虫对环境的适应性和选择性。4个季节162种纤毛虫在6个样点的分布频度表明,大口薄咽虫(Leptopharynxeurostoma)、膨胀肾形虫(Colpodainflata)、大弹跳虫(Halteriagrandinella)和近缘殖口虫(Gonostomumaffine)是该区域的广布种,分布频度达0.71以上;常见种有瓜形膜袋虫(Cyclidiumcitrullus)、善变膜袋虫(Cyclidiumversatile)、齿脊肾形虫(Colpodasteinii)等,出现频度在0.25~0.68之间,共有50种,占所有纤毛虫总数的30.9%;而辐射射纤虫(Actinobolinaradians)、明显长颈虫(Dileptusconspicuous)、鹅长颈虫(Dileptusanser)等33种纤毛虫为该地区的稀有物种,仅在其中1个样点的某个季节出现(表3),可见这些种类对季节有较强的选择性。
仅从各种在各样点的出现频度分析,在6个样点中出现14个种,是各样点的广布种;在4~5个样点中出现的纤毛虫共有45种,这些种是该样点的常见种;仅在1个样点中出现的种有39个,占所有种的24%,为该样点的特有物种或罕见种。
2.2.2尕海湿地纤毛虫种数与环境因子相关性分析 将尕海湿地纤毛虫种数与环境因子用SPSS 19.0进行二元变量的Pearson相关性分析(表4)。结果表明,纤毛虫种数与样点温度和含水量均呈显著正相关(P<0.05),这与图3所示的种在各样点的季节性分布相一致。尕海湿地纤毛虫种数的边际均值(图3)表明,在适宜温度和充沛降水量条件下,纤毛虫群落结构将趋于复杂而稳定。

表3 纤毛虫在尕海湿地各样点的季节分布和营养功能类群Table 3 Seasonal distribution and functional-trophic group of ciliate species in 6 sampling sites of Gahai wetland

续表3 Continued Table 3

续表3 Continued Table 3

续表3 Continued Table 3
A:食藻者Algivore;B:食菌和碎屑者Baactivores-detricores;R:捕食者Predators of raptors;N:无选择的杂食者Nonselective omnivores. ★ 未定名种Unnamed species;* 示该物种在该样点出现Indicating appearance of species in this site. 营养功能类群 Functional trophic group.
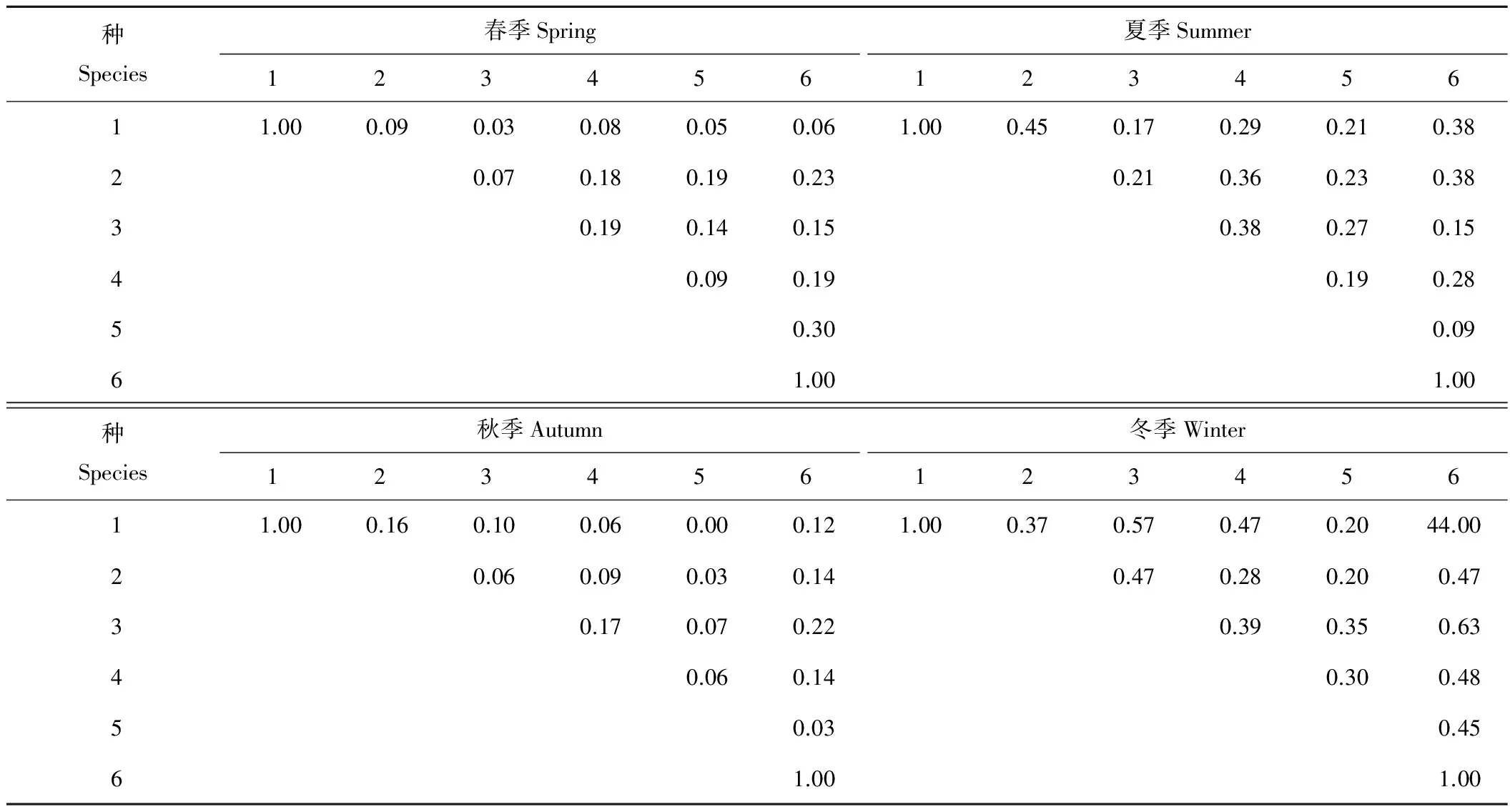
表4 不同季节各样点纤毛虫物种相似性Table 4 Similarity of species of ciliate in different season in each site
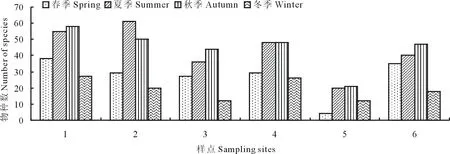
图2 不同季节各样点中纤毛虫分布Fig.2 Seasonal distributions of ciliates in sampling sites
2.3 纤毛虫物种相似性比较
2.3.1不同季节各样点内物种相似性比较 不同样点内的物种相似性系数在一定程度上可以反映各个样点空间异质性程度,具有较大相似值的样点之间,可能具有相似的生态因子或纤毛虫所需的营养物质等。各季节不同样点内纤毛虫物种相似性(表4和表5)表明,在春、秋季节,各个样点间纤毛虫物种极不相似,这可能是由于该区域是当地牧民的冬季草场,牲畜过度践踏和草原超载放牧,在一定程度上影响了地表植被覆盖度,致使纤毛虫生境改变而影响其分布;当地水体和土壤温度在秋季达到最高水平,此时,各样点的纤毛虫数量较少,故出现物种的极不相似;在夏季,1号样点和3号、5号样点,2号样点和3号、5号样点,3号和6号样点、4号和5号样点,5号和6号样点均极不相似,而其他样点之间表现为中等不相似,此时,正值草场休牧,气温回升,样区降水量增加,生态环境逐步改善,适合纤毛虫的解包囊生活、繁殖乃至迁徙;到了冬季,样点间纤毛虫物种更趋于相似,1号和3号样点,3号和6号样点之间都表现出中度相似,极不相似的样点只有5号和1号、2号样点之间,而其他样点的相似性系数均表现为中等不相似。
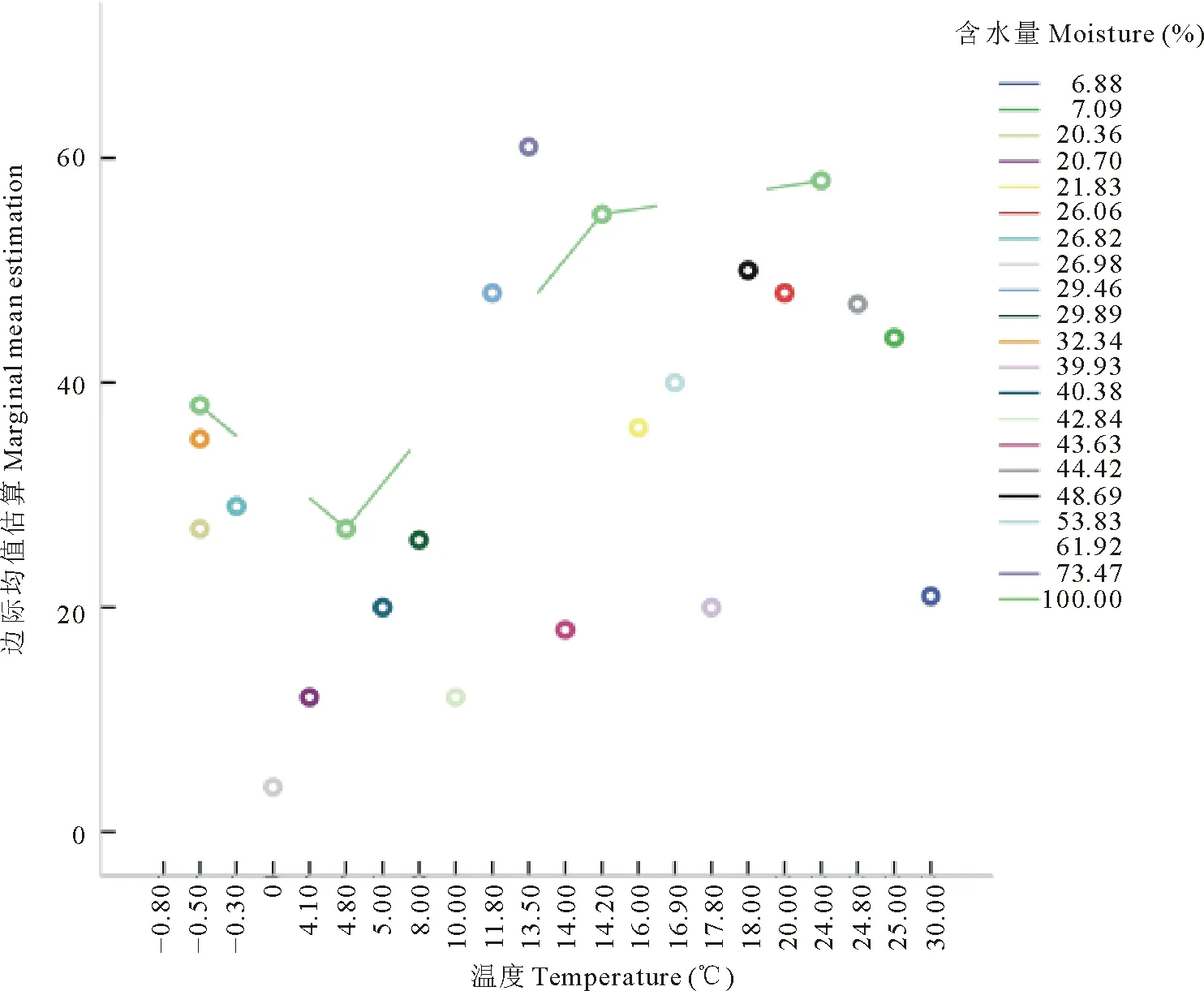
图3 尕海湿地纤毛虫种数的边际均值估算Fig.3 Marginal estimation of the number of ciliate species in Gahai wetland
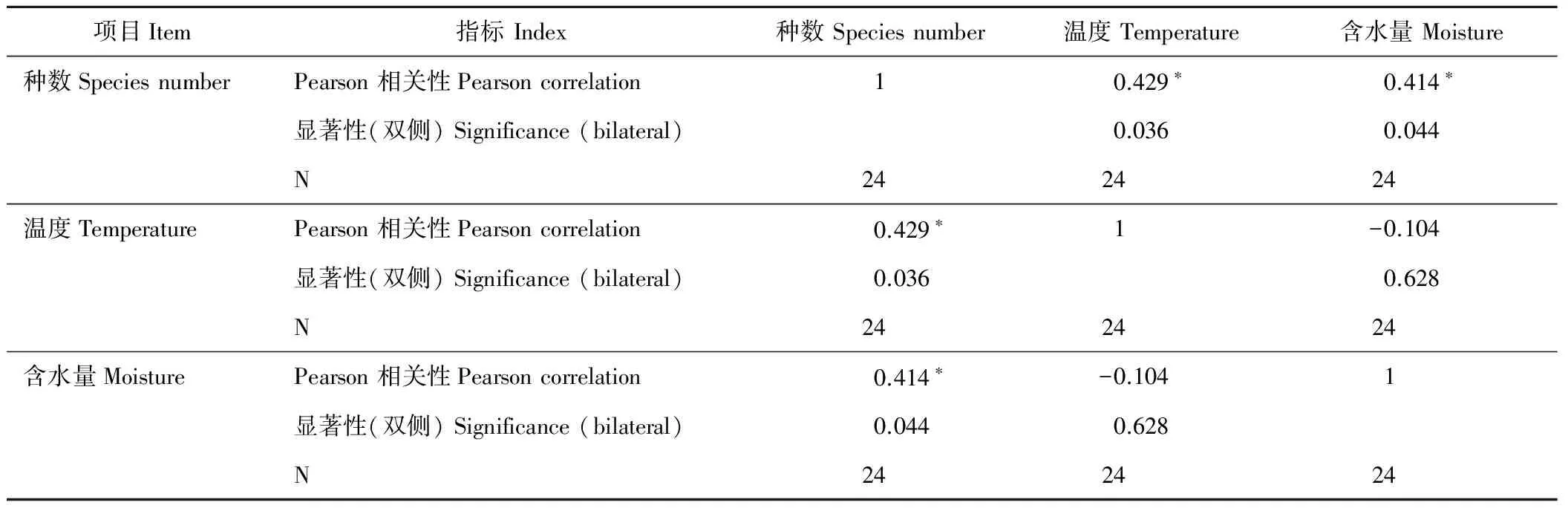
表5 纤毛虫种数与环境因子的相关性Table 5 Correlation analysis between the number ciliate of species and environment factors
* 在 0.05 水平(双侧)上显著相关。
* Correlation is significant at 0.05 level.
2.3.2青藏高原尕海湿地与中国典型地带纤毛虫物种的相似性比较 通过比较宁应之等[32]研究的中国典型地带(中热带-海南尖峰岭,北热带-云南西双版纳,亚热带-湖北神农架、珞珈山,暖温带-北京小龙门和高寒带-青海海北)各样点间纤毛虫物种的相似性得出,尕海湿地纤毛虫组成与我国典型地带各样点间相似性系数为0~0.18,极不相似(表6)。这说明不同地带之间,纤毛虫群落组成均有很大差异,即使是在同一地带的不同样点间,由于小生境不同,纤毛虫区系组成也有很大差异。
2.4 青藏高原尕海湿地纤毛虫营养功能类群分析
从表3中可以看出,尕海湿地162种纤毛虫中,B组物种占优势,共计有118种,占所有物种的72.84%,其中部分种类既是食藻者,又是摄食菌类和碎屑者;A组物种次之,有51种,占物种总数的31.48%;R组和N组物种分别有18和4种。不同生境内不同食性的原生动物所占的比例不同,可反映生境的有机污染状况。早期研究主要是通过分析水体内原生动物的营养功能类群,进而对水体污染状况进行评价。笔者认为,无论是水体内原生动物还是土壤内原生动物,均有其生存的水环境,不过是广义和狭义的区分而已。因此,在土壤环境中的原生动物,其营养功能类群的划分,同样可以反映生境状况。因此,从本研究的结果来看,162种纤毛虫,其中A组和B组物种所占比例很大,这也说明了尕海湿地环境尚未受到污染。

表6 尕海湿地与中国不同地带各样点间纤毛虫种的相似性系数Table 6 Similarity index of ciliate species between Gahai wetland and other sampling sites in different zones of China
3 讨论与结论
在青藏高原尕海高寒湿地,虽然植被结构单一,高等动物群落结构简单,但其特殊的水陆生态系统,对于较原始而低等的原生动物而言,小生境条件尚未限制原生动物分布。尕海湿地共鉴定到162种,隶属于3纲13目46科66属,其中包括30个未定名种。这与宁应之等[33-36]和巴桑[37]分别对甘肃玛曲高原沼泽湿地和西藏拉鲁湿地纤毛虫物种多样性的研究结果相比较,具有明显的物种优势和复杂的群落结构。采样点环境因子中水分和温度均影响纤毛虫分布状况,而样点含水量是影响纤毛虫物种分布的主要因素,在6个样点中, 1号样点和2号样点因其含水量较高,纤毛虫物种总数多于其他各个样点;5号样点因长期受牲畜践踏,土质紧密,无植被覆盖,持水能力降低,纤毛虫物种数最低,这也较好地反映了水分的重要作用;3号样点物种数又较4号和6号样点少,主要是由于该样点沼泽退化比较严重,且位于阳坡,植被覆盖度低,土壤含水量下降所致。这与田佳玉[38]和廖崇惠等[39]的研究结果一致,即水分是影响原生动物生存与分布的重要因素。
青藏高原尕海湿地纤毛虫群落组成具有高度的空间异质性。纤毛虫物种组成不但与国内典型地带样点的表现极不相似,而且由于尕海湿地各样点间小生境的差异,不同季节纤毛虫物种分布的相似性系数均小于0.5。由此可见,尕海高寒湿地环境条件具有一定的独特性,这与该地区高原沼泽湿地特殊的生境类型密切相关。
纤毛虫是生态系统的重要组成部分,影响着自然界中物质循环和能量流动,同时也能够对所生活的微环境表现出灵敏反应。本研究表明,尕海湿地纤毛虫中食菌碎屑者类群占优势,与宁应之等[40]和叶欣等[26]研究结果相一致,说明菌类是土壤中现存生物量最大生物类群,自然可以为原生动物提供源源不断的营养物质,而自然潮湿环境中有机物碎屑也是原生动物易于摄取的食物。
References:
[1] Guo H. Discussion on the technology and development of artificial wetland wastewater treatment. Products and Quality, 2016, (32): 108-109.
郭昊. 浅谈人工湿地污水处理技术及其发展. 商品与质量, 2016, (32): 108-109.
[2] Qu M, Hu Y H. The utilization status and sustainable development strategy of wetland resources in Guangdong. Central South Forest Inventory and Planning, 2015, 34(4): 18-21.
屈明, 胡喻华. 广东省湿地资源利用现状与可持续发展对策探讨. 中南林业调查规划, 2015, 34(4): 18-21.
[3] Yang Y X. Main characteristics, progress and prospect of international wetland science research. Progress in Geography, 2002, 21(2): 111-120.
杨永兴. 国际湿地科学研究的主要特点、进展与展望. 地理科学进展, 2002, 21(2): 111-120.
[4] Cheng X, Liu H C, Du H F,etal. Species diversity of sarcodinids and flagellates in the provincial nature reserve of wetland of first meander of Yellow River. Journal of Northwest Normal University (Natural Science), 2009, 45(6): 92-97.
程晓, 刘汉成, 杜海峰, 等. 甘肃黄河首曲湿地省级自然保护区肉鞭虫物种多样性研究. 西北师范大学学报(自然科学版), 2009, 45(6): 92-97.
[5] Zhou Y F. An analysis of the causes of wetland ecological function degradation and its restoration and protection——a case study of Lianhua Lake Wetland in Tieling. Science and Technology Achievements, 2012, (3): 54-55.
周雅芳. 浅析城市湿地生态功能退化的原因及其恢复与保护——以铁岭市莲花湖湿地为例. 科技成果纵横, 2012, (3): 54-55.
[6] Shang H Y, Yin Z D. An analysis on the Tarim River Basin ecological water conveyance. Water Conservancy Science and Technology and Economy, 2014, (2): 17-20.
尚河英, 尹忠东. 塔里木河流域生态输水效益分析. 水利科技与经济, 2014, (2): 17-20.
[7] Sun Z Q, Shi X L, Xu L L,etal. The protozoan community structure and its response to the change of water quality in a typical wetland landscape in summer. Acta Hydrobiologica Sinica, 2013, 37(2): 290-299.
孙志强, 施心路, 徐琳琳, 等. 景观湿地夏季原生动物群落结构与水质关系. 水生生物学报, 2013, 37(2): 290-299.
[8] Compilation Group of “Soil Animal Research Methods Manual”. Soil Animal Research Methods Manual. Beijing: China Forestry Publishing House, 1998: 63-67.
土壤动物研究方法手册编写组. 土壤动物研究方法手册. 北京: 中国林业出版社, 1998: 63-67.
[9] Li G W, Wang Y J, Luo J M,etal. Research on the soil moisture content of Zhalong wetland during thawing period. Journal of Science of Teachers’ College and University, 2009, 29(6): 71-74.
李广文, 王永洁, 罗金明, 等. 融冻时期扎龙湿地土壤含水量变化研究. 高师理科学刊, 2009, 29(6): 71-74.
[10] Foissner W. Estimating the species richness of soil protozoa using the “non-flooded Petri dish method”//Lee J J, Soldo A T. Protocols in Protozoology. Lawrence: Allen Press, 1992.
[11] Song W B. Progress Protozoology. Qingdao: Qingdao Ocean University Press, 1999.
宋微波. 原生动物学专论. 青岛: 青岛海洋大学出版社, 1999.
[12] Lee J J, Leedale G F, Bradbury P. An Illustrated Guide to the Protozoa. 2nd edition. Volume I, Volume II. Lawrence: Allen Press Inc, 2000.
[13] Page F C. An Illustrated Key to Freshwater and Soil Amoebae with Notes on Cultivation and Ecology. Ambleside: Freshwater Biological Association, 1976.
[14] Patterson D J, Hedley S. Free-living Freshwater Protozoa, A Color Guide. London: Wolfe Publishing, 1992.
[15] Patterson D J, Larsen J. The Biology of Free-living Heterotrophic Flagellates. Oxford: Oxford University Press, 1991.
[16] Feng W S, Yang J, Ye Z H,etal. Soil protozoa in wetland treatment system of Pb-Zn mine in Fankou. Chinese Journal of Zoology, 2004, 39(1): 2-11.
冯伟松, 杨军, 叶志鸿, 等. 凡口铅锌矿湿地处理系统的土壤原生动物. 动物学杂志, 2004, 39(1): 2-11.
[17] Hu H J, Li Y Y, Wei Y X,etal. The Algae China. Shanghai: Shanghai Science Technology Press, 1980.
胡鸿钧, 李尧英, 魏印心, 等. 中国淡水藻类. 上海: 上海科学技术出版社, 1980.
[18] Ning Y Z, Shen Y F. New records of protozoa (Sarcomastigophora) in China. Chinese Journal of Zoology, 1999, 34(4): 2-5.
宁应之, 沈韫芬. 中国土壤原生动物新记录种(肉鞭虫门). 动物学杂志, 1999, 34(4): 2-5.
[19] Shen Y F, Zhang Z S, Gong X J,etal. Modern Biomonitoring Techniques Using Freshwater Microbiota. Beijing: Chinese Architecture and Building Press, 1990: 231-524.
沈韫芬, 章宗涉, 龚循矩, 等. 微型生物监测新技术. 北京: 中国建筑工业出版社, 1990: 231-524.
[20] Jiang X Z, Shen Y F, Gong X J. Aquatic Invertebrates of the Tibetan Plateau. Beijing: Science Press, 1983.
蒋燮治, 沈韫芬, 龚循矩. 西藏水生无脊椎动物. 北京: 科学出版社, 1983.
[21] Angeler D G, Alvarez-Cobelas M, Rojo C,etal. The significance of water inputs to plankton biomass and trophic relationships in a semi-arid freshwater wetland (central Spain). Journal of Plankton Research, 2000, 22(11): 2075-2093.
[22] Berger H, Foissner W. Morphology and biomentry of some soil hypotrichs (Protozoa: Ciliophora). Zoologische Jahrbücher Systematik, 1987, 114: 193-239.
[23] Berger H. Monograph of the Oxytrichidae (Ciliophora, Hypotrichia). London: Kluwer Academic Publishers, 1999.
[24] Berger H, Foissner W. Morphology and biometry of some soil hypotrichs (Protozoa, Ciliophora) from Europe and Japan. Bulletin of the British Museum of Natural History, 1989, 55(1): 19-46.
[25] Wickham S, Nagel S, Hillebrand H. Control of epibenthic ciliate communities by grazers and nutrients. Aquatic Microbial Ecology, 2004, 35: 153-162.
[26] Ye X, Liao Q Y, Xu R L. Ecological research of protozoan communities on five different habitats of arbor barks in Sun Yat-sen University Campus. Acta Scientiarum Naturalium Universitatis Sunyatseni, 2008, 47(S1): 77-84.
叶欣, 廖庆玉, 徐润林. 中山大学校园5种乔木树皮上原生动物群落的生态学研究. 中山大学学报(自然科学版), 2008, 47(S1): 77-84.
[27] Foissner W. Tropical protozoan diversity: 80 ciliate species (Protozoa, Ciliophora) in a soil sample from a tropical dry forest of Costa Rica, with descriptions of four new genera and seven new species. Archiv für Protistenkunde, 1995, 145: 37-79.
[28] Hardoim E L, Heckman C W. The seasonal succession of biotic communities in wetlands of the tropical wet-and-dry climatic zone: IV. The free-living sarcodines and ciliates of the Pantanal of Mato Grosso, Brazil. Internationale Revue der Gesamten Hydrobiologie und Hydrographie, 2007, 81(3): 367-384.
[29] John M D, Ward A K. Influence of phagotrophic protistan bacterivory in determining the fate of dissolved organic matter (DOM) in a wetland microbial food web. Microbial Ecology, 1997, 33(2): 149-162.
[30] Wickham S, Gieseke A, BerNinger U G. Benthic ciliate identification and enumeration: an improved methodology and its application. Aquatic Microbial Ecology, 2000, 22: 79-91.
[31] Jaccard P. Nouvelles recherches sur la distribution florale. Bulletin de la Société vaudoise des Sciences Naturelles, 1908, 44: 223-270.
[32] Ning Y Z, Shen Y F. Soil protozoa in typical zones of China: I. Faunal characteristics and distribution of species. Acta Zoologica Sinica, 1998, 44(1): 5-9.
宁应之, 沈韫芬. 中国典型地带土壤原生动物: Ⅰ. 区系特征和物种分布. 动物学报, 1998, 44(1): 5-9.
[33] Ning Y Z, Su C, Wang H J,etal. Community characteristics of ciliates in Plateau Swamp wetland of Gannan, Gansu province in summer. Journal of Northwest Normal University (Natural Science), 2013, 49(3): 81-86.
宁应之, 苏苌, 王红军, 等. 甘肃甘南高原沼泽湿地夏季纤毛虫群落特征. 西北师范大学学报(自然科学版), 2013, 49(3): 81-86.
[34] Ning Y Z, Wang F G, Du H F,etal. Ciliate species diversity and its relationships with environmental factors in Plateau Swamp wetlands of southern Gansu Province, Northwest China in autumn. Chinese Journal of Ecology, 2013, 32(3): 634-640.
宁应之, 王芳国, 杜海峰, 等. 甘南高原沼泽湿地秋季纤毛虫物种多样性及其与环境因子的关系. 生态学杂志, 2013, 32(3): 634-640.
[35] Ning Y Z, Liu G L, Dang H,etal. Community characteristics of Ciliates in Plateau Swamp Wetland of Gannan, Gansu in winter. Journal of Anhui Agriculture Science, 2014, 42(4): 1059-1062.
宁应之, 刘光龙, 党怀, 等. 甘肃省甘南高原沼泽湿地冬季纤毛虫群落特征. 安徽农业科学, 2014, 42(4): 1059-1062.
[36] Ning Y Z, Wu W N, Liu H C,etal. Community characteristics of ciliates in Plateau Swamp wetland of Gannan in spring. Journal of Northwest Normal University (Natural Science), 2014, 50(2): 87-92.
宁应之, 武维宁, 刘汉成, 等. 甘南高原沼泽湿地春季纤毛虫群落结构特征. 西北师范大学学报(自然科学版), 2014, 50(2): 87-92.
[37] Ba S. Study on the Characteristics of Community Structure of Protozoa, Lhasa Lhalu Wetland National Nature Reserve, Tibet. Lanzhou: Northwest Normal University, 2013.
巴桑. 西藏拉鲁湿地国家级自然保护区原生动物群落结构特征. 兰州: 西北师范大学, 2013.
[38] Tian J Y. Impact factor of growth and distribution of Protozoa. Natural Science Journal of Harbin Normal University, 2012, 28(4): 61-63.
田佳玉. 原生动物生长和分布的影响因子. 哈尔滨师范大学自然科学学报, 2012, 28(4): 61-63.
[39] Liao C H, Li J X, Yang Y P,etal. The community of soil animal in tropical rain forest in Jianfeng Mountain, Hainan Island, China: Relationship between seasonal change of community structure and climatic factors. Acta Ecologica Sinica, 2003, 23(1): 139-147.
廖崇惠, 李健雄, 杨悦屏, 等. 海南尖峰岭热带林土壤动物群落—群落结构的季节变化及其气候因素. 生态学报, 2003, 23(1): 139-147.
[40] Ning Y Z, Shen Y F. Observation of feeding habits of soil protozoa in Chinese six typical zones. Zoological Research, 1998, 19(5): 397-400.
宁应之, 沈韫芬. 中国典型地带土壤原生动物食性的观察. 动物学研究, 1998, 19(5): 397-400.
