细叶百合LpAGD14基因的克隆与表达分析
2018-03-04汪王田忠平苏小霞杨柳慧周蕴薇东北林业大学园林学院黑龙江哈尔滨150000
汪王,田忠平,苏小霞,杨柳慧,周蕴薇(东北林业大学园林学院,黑龙江 哈尔滨150000)
GTP酶激活蛋白(GAPs)是一类调节蛋白质,是ADP核糖基化因子(ADP-ribosylation factor,Arf)基因功能的关键调节剂,能够与小G蛋白α亚基结合,激活GTP酶活性,促使GTP水解成GDP,转变为非活化状态[1-2]。失活状态的Arf会结合到高尔基体上转变成活化态的ArfGTP,与ArfGAP结合作用于KDEL-跨膜受体,同时ArfGAP可以促使ArfGTP水解失活[3-4]。与ArlGTP(类ArfGTPase)不同,ArfGAPs不但能激活霍乱毒素还可以回复Arf。有研究表明ArfGAP基因主要定位在高尔基体上,参与蛋白质在高尔基体和内质网间的转运,对蛋白的分类筛选起到促进作用,失活状态的ARF1的内源GTP酶会抑制高尔基体产生α-淀粉酶和液泡蛋白的共表达[5]。ArfGAPs作为一种外壳蛋白参与囊泡的形成,是囊泡转运途径的重要组成部分[6]。酵母细胞中GCS1和GLO3(ArfGAP)缺失突变体破坏内质网和高尔基体间的囊泡运输,导致膜结构积累,进一步证实 ArfGAP在囊泡运输中的重要作用[7]。同时研究发现, 在动物细胞中,ArfGAPs 参与物质跨膜运输过程[8];此外,ArfGAPs在激素信号转导、细胞分裂以及器官分裂等生物过程同样发挥重要作用[9-10]。
关于Arf参与植物休眠解除进程仅在马铃薯(Solanumtuberosum)中有过报道[11]。ArfGAP同属于Arf家族成员,且是高尔基体囊泡的重要组成部分,通过介导物质转运ArfGAP是否也能参与植物休眠调控研究尚属空白。细叶百合(Liliumpumilum)地下鳞茎具有休眠特性,未解除休眠的鳞茎开花质量差甚至出现盲花现象。本研究从细叶百合鳞茎cDNA文库中克隆得到LpAGD14基因,分子生物手段和组织形态观察相结合,对阐明LpAGD14功能和作用机制具有重要意义,同时对采用基因工程解除植物休眠提供理论指导。
1 材料与方法
1.1 试验材料
1.1.1植物材料 细叶百合鳞茎取自东北林业大学园林学院苗圃。试验于2014年10月中旬选出完好无损伤的周径在4~6 cm的鳞茎,用水清洗干净,再用50%多菌灵可湿性粉剂1000倍液浸泡30 min后,清水漂洗干净,晾干。最后用消毒的蛭石(湿度以手握成团、放手散开为度)混合拌匀,装入塑料盆中,用保鲜膜封上(膜上打小孔以透气),置于4 ℃ 冰箱中冷藏处理。低温处理阶段,以处理第0、30、60、90天样品分别标记为S1、S2、S3、S4时期,提取RNA,并合成cDNA文库。
1.1.2主要试剂和药品 胶回收试剂盒和质粒提取试剂盒购自于天根生化科技(北京)有限公司;荧光定量反转录试剂盒和高保真酶KOD-Plus-Neo购自TOYOBO,克隆基因反转录试剂盒购自Takara,T载体PMD18-T购自全式金公司,内切酶KpnⅠ和SpeⅠ购自NEB。
1.2 试验方法
1.2.1细叶百合总RNA的提取和cDNA第一链的合成 采用改良的CTAB法提取细叶百合鳞茎总RNA[12],采用PrimeScripTM Ⅱ 1st Strand cDNA Synthesis Kit(Takara)反转录cDNA,具体做法是Oligo dT Primer (1 μL)+dNTP (1 μL)+RNA (1 μL),补水至10 μL,65 ℃保温5 min,迅速冷却,上述体系加5×PrimeScrip Ⅱ Buffer (4 μL)+RNase Inhibitor (0.5 μL)+PrimeScrip Ⅱ Rtase (1 μL),补水至20 μL,经42 ℃ 45 min;95 ℃ 5 min后迅速冷却,即得到cDNA模板。
1.2.2LpAGD14基因的克隆和序列分析 根据已获得的该基因最大开放阅读框(ORF)序列设计特异性上下游引物LpAGD14-F: ATGGCGAATCGGATGAAGGA和LpAGD14-R:AGCAAACCCC TTTGGGAAGA。进行PCR扩增,转化大肠杆菌,随机挑取阳性克隆,以M13R为测序引物进行测序。将获得的序列采用Clustalx 1.83 软件与已知的ORF序列进行比对,NCBI在线软件BlastX进行同源比对。利用MEGA 5.0构建系统进化树;在线分析工具SMART (http://smart.emblheidelberg.de/)和Pfam (Protein family: http://pfam.Sanger.ac.uk/)用于蛋白质保守结构域的分析;用Expasy (www.EXPASY.org)预测氨基酸相关理化性质。利用TMHMM (http://www.cbs.dtu.dk/ services/TMHMM/)对蛋白质的跨膜结构域进行预测,利用SOPMA对蛋白质二级结构进行预测。
1.2.3实时荧光定量PCR分析基因表达模式 以lilyActin[13](GenBank 登录号:JX826390)基因作为内参基因,ReverTra Ace®qPCR RT Master Mix (TOYOBO,Japan)反转录低温贮藏4个时期总RNA (500 ng),所得cDNA稀释5倍作为荧光定量模板。荧光染料采用SYBR Green (TOYOBO,Japan),在Roche LightCycler96上进行如下反应:预变性(95 ℃ for 30 s);3步法(95 ℃ for 5 s;60 ℃ for 15 s;72 ℃ for 30 s;45 cycles);溶解(95 ℃ for 10 s;65 ℃ for 60 s;97 ℃ for 1 s);冷却(37 ℃ for 30 s),每组3个重复,以S1时期表达量为对照,LpAGD14的相对表达量计算参考2-ΔΔCt[14]。
1.2.4亚细胞定位分析基因表达位点 对测序正确的LpAGD14质粒稀释100倍作为模板,设计添加酶切位点KpnⅠ (NEB)和SpeⅠ (NEB)的特异性引物:LpAGD14-F:5′-GGTAC∨CATGGCGAATCGGATGAAG-3′和LpAGD14-R:5′-A∨CTAGTCCCAAAAGGGTTTCCTCC-3′进行PCR扩增反应,对加上酶切位点的质粒与带有GFP绿色荧光蛋白报告基因的pBI121-MCS-GFP载体分别经KpnⅠ+SpeⅠ双酶切,酶切体系为:PMD18-T-LpAGD14 /pBI121-MCS-GFP (8 μL)+KpnⅠ(1 μL)+SpeⅠ(1 μL)+CutSmart Buffer (2 μL)+ddH2O (8 μL),37 ℃酶切20 min,1%琼脂糖凝胶电泳回收后T4连接过夜,构建pBI121-LpAGD14-GFP植物表达载体,经鉴定后,以pBI121-MCS-GFP为对照,参考刘锴栋等[15]的基因枪法转化洋葱(Aliumcepa)表皮细胞,经过24 h的暗培养,共聚焦显微镜观察基因瞬时表达。
1.2.5透射电子显微镜观察高尔基体超微结构 取冷藏处理4个时期的细叶百合鳞茎,通过固定、冲洗、脱水、渗透、包埋、切片、染色等步骤,电镜样品的制备具体参考刘芳等[16]的方法,H-7650透射电子显微镜下观察不同时期高尔基体形态变化。
2 结果与分析
2.1 细叶百合基因LpAGD14的克隆及序列特征分析
采用改良CTAB法提取RNA, 所得RNA 28S条带亮度大约为18S两倍,D260/D280介于1.8~2.0间,RNA效果较好,可用于后续实验。以提取总RNA反转录合成的第一链cDNA为模板,获得目的基因扩增片段,获得的拼接结果与已知ORF序列比对,完全吻合。生物信息学分析表明,该编码区大小为1923 bp,预测编码一个含有640个氨基酸的蛋白。具有ArfGAP保守结构域(图1),该结构域位于氨基酸序列的第12~130位,由119个氨基酸组成,属于Arf基因家族,是一种GTPase。
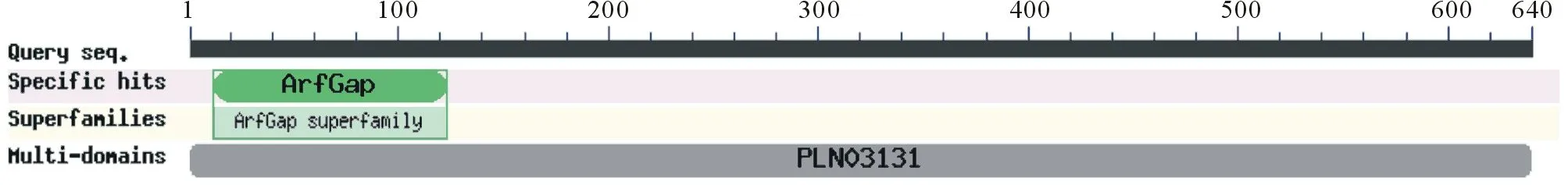
图1 LpAGD14的保守结构域预测Fig.1 The conserved domain prediction of LpAGD14
2.2 LpAGD14基因氨基酸理化性质与结构预测分析
对基因编码的氨基酸序列的组成成分和理化性质分析结果表明,该蛋白的分子量约为69.43 kDa,理论等电点为8.95,氨基酸的亲水指数为-0.733(正值:疏水;负值:亲水),说明该蛋白为亲水性蛋白。跨膜结构域进行预测显示该蛋白的氨基酸肽链位于膜外,推测其可能不存在跨膜结构域,属于非跨膜类蛋白。LpAGD14基因编码的蛋白质二级结构含有丰富的无规则卷曲和α-螺旋,其次为延伸链和β-卷角。
2.3 LpAGD14基因氨基酸同源性分析
氨基酸同源性比对结果显示该氨基酸序列与油棕(Elaeisguineensis)、芭蕉(MusaacuminatesubspMalaccensis)、海枣(Phoenixdactylifera)、凤梨(Ananascomosus)等多种植物的GTP激活蛋白AGD14具有较高的同源性,都含典型的C4型锌指结构,有4个固定的半胱氨酸(cysteine),即CX2CX16CX2C结构域,分析其与不同物种的GTP激活蛋白AGD14进化关系(图2),其中与油棕(XP_010934816)GTP激活蛋白AGD14同源性达到59%,与其他植物的同源性均在40%以上,因此,将该细叶百合GTP酶激活蛋白命名为LpAGD14(登录号:KY434115)。
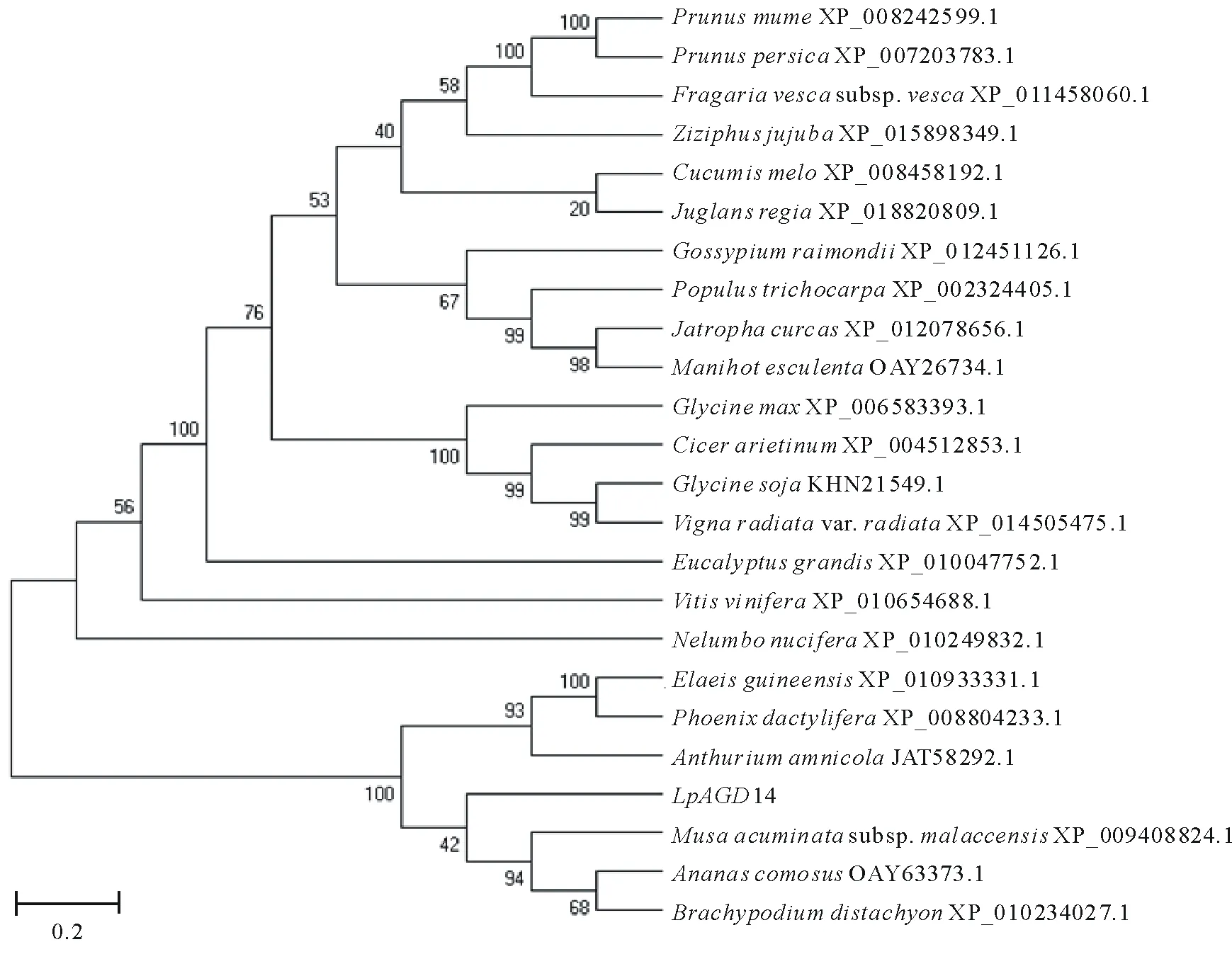
图2 细叶百合及其他植物AGD14基因的氨基酸序列系统进化树Fig.2 Phylogenetic tree based on the amino acid sequences of AGD14 of lily and other plants
2.4 LpAGD14基因表达模式分析
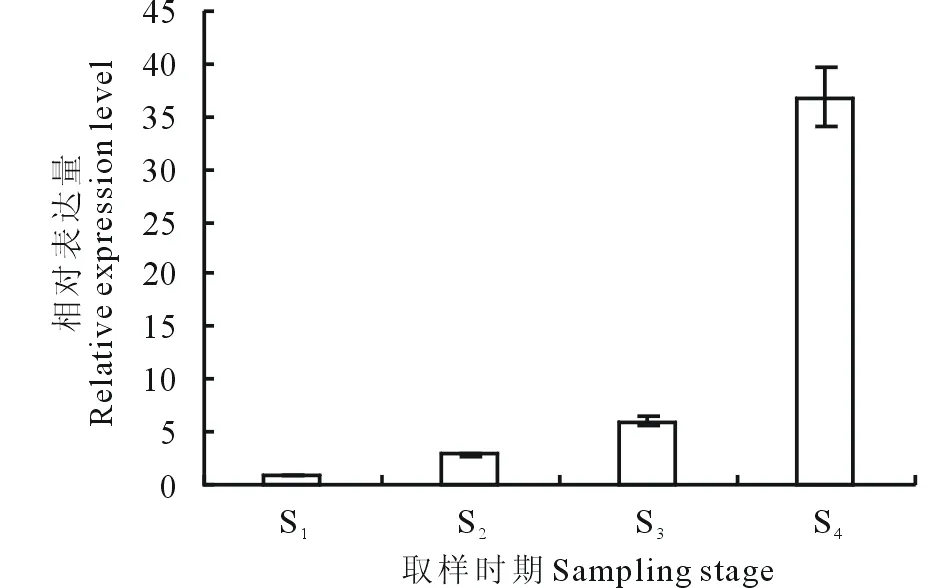
图3 LpAGD14基因在细叶百合鳞茎不同休眠时期的相对表达Fig.3 The relative expression of LpAGD14 gene in different dormancy stages of Lilium pumilum
以百合肌动蛋白基因lilyActin[13]为内参基因,采用qRT-PCR法对细叶百合鳞茎低温储藏0 d(S1)、30 d(S2)、60 d(S3)、90 d(S4)鳞茎的LpAGD14基因相对表达量进行分析(图3),结果表明,LpAGD14基因相对表达量在S2时期较前一时期增长3倍,在S3时期较前一时期增长2倍,在S4时期较前一时期增长6倍,差异表达显著。
2.5 LpAGD14基因亚细胞定位分析
共聚集显微镜观察发现,空载体质粒打入洋葱表皮后,绿色荧光分布于整个细胞中(图4A),而重组融合载体pBI121-LpAGD14-GFP质粒打入洋葱表皮后,在细胞核和细胞膜中均有较为明显的绿色荧光,并且能同时检测到多个洋葱表皮细胞中出现绿色荧光(图4B),说明pBI121-LpAGD14-GFP融合亚细胞表达载体定位在细胞膜上。
2.6 透射电子显微镜观察高尔基体超微结构
高尔基体结构在低温贮藏不同时期具有较为明显的变化(图5)。在S1时期,高尔基体数量较少,分泌囊泡数量不多,基本分布为1~3层,到S2时期,可见高尔基体上分布3~5层扁平囊泡,随低温贮藏时间的延长,在S3时期高尔基体结构更为复杂,囊泡层数继续增多,可以观察到6~7层囊泡,并在S4时期进一步增长到8~10层,此时期正与鳞茎休眠解除相对应。

图4 LpAGD14基因在洋葱表皮细胞中的瞬时表达Fig.4 Transient expression of LpAGD14 gene in onionA1, A2, A3: 瞬时表达pBI121-MCS-GPF的洋葱表皮细胞作为对照,分别为荧光、白光和重叠视野。B1, B2, B3: 瞬时表达pBI121-LpAGD14-GFP的洋葱表皮细胞,分别为荧光、白光和重叠视野。A1, A2, A3:Transiently expressed pBI121-MCS-GPF in onion epidermal cells, fluorescent, bright and vision.B1, B2, B3:Transiently expressed pBI121-LpAGD14-GFP in onion epidermal cells, fluorescent, bright and vision.
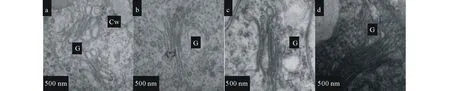
图5 低温贮藏时期细叶百合鳞茎高尔基体超微结构的观察Fig.5 Golgi bodies ultrastructure observation of Lilium pmnilmn during cold storagea, b, c 和 d分别代表低温贮藏0、30、60、90 d高尔基体超微结构。Cw: 细胞壁;G:高尔基体。a, b, c and d represent Golgi bodies ultrastructure during cold storage of 0, 30, 60 and 90 days, respectively. Cw: Cell wall; G: Golgi body.
3 讨论
有研究表明,抑制马铃薯(Solanumtuberosum)Arf基因的表达会导致植物表型及碳水化合物含量发生变化[17],而淀粉及可溶性糖和相关酶活性的变化,能够进一步影响百合鳞茎所处的休眠状态[18-19],推测Arf基因可能间接参与休眠进程的调控。Liu等[11]从马铃薯中克隆得到Arf基因,荧光定量分析发现,Arf基因表达量在马铃薯块茎休眠解除后期显著增长,Arf基因积极参与马铃薯块茎休眠解除进程。LpAGD14属于Arf家族下的ArfGAP亚家族成员,在低温解除细叶百合鳞茎休眠期间,其表达量显著增长,LpAGD14基因的上调表达与鳞茎的休眠解除进程相对应。前人发现,ArfGAPs参与构成细胞内吞系统[20],作为一种主要定位在高尔基体上的外壳蛋白,参与囊泡的形成,是囊泡转运途径的重要组成部分[5-6]。小G蛋白中Arf GAP1,Arf GAP2和Arf GAP3对囊泡的形成具有重要作用[21-24],通过膜包裹、形成囊泡、与膜融合或断裂的囊泡转运过程,ArfGAPs能影响细胞间的物质交流,以此调控植物生物进程[25]。此外,高尔基体囊泡被认为与内质网物理相连[26],两者构成细胞重要的内膜系统,参与物质转运。通过超微结构观察,在低温贮藏初期,高尔基体囊泡层数较少,仅可看到1~3层,而在低温贮藏后期,高尔基体囊泡层数显著增多,结构更为复杂,可看到8~10层囊泡层数,此时鳞茎已解除休眠状态,且LpAGD14基因的相对表达量增长到最大值。分子生物分析结合组织形态观察可以发现,低温贮藏期间,功能基因差异表达与囊泡层数变化存在内在联系,推测克隆得到的LpAGD14基因可能通过影响囊泡形成,从而影响物质转运过程,对百合鳞茎休眠与解除产生影响。
4 结论
在模式植物拟南芥(Arabidopsisthaliana)和水稻(Oryzasativa)中,已确认几种具有ArfGAP活性的蛋白质,但大部分ArfGAP 基因在植物中的具体功能研究报道较少,尤其是对植物休眠的研究上仅在马铃薯中有过报道[11]。高尔基体小囊泡是物质转运的重要载体,对细叶百合LpAGD14基因的克隆与分析,及进一步研究其对细胞体内物质运输作用机制和对休眠的调控作用奠定了基础。
References:
[1] Gillingham A K, Munro S. The small G proteins of the Arf family and their regulators. Annual Review of Cell and Developmental Biology, 2007, 23(23): 579-611.
[2] Tanabe K, Torii T, Natsume W,etal. A novel GTPase-activating protein for ARF6 directly interacts with clathrin and regulates clathrin-dependent endocytosis. Molecular Biology of the Cell, 2005, 16(4): 1617-1628.
[3] Lanoix J, Ouwendijk J, Lin C,etal. GTP hydrolysis by arf-1 mediates sorting and concentration of Golgi resident enzymes into functional COP I vesicles. EMBO Journal, 1999, 18(18): 4935-4948.
[4] Moss J, Vaughan M. Molecules in the ARF orbit. Journal of Biological Chemistry, 1998, 273(34): 21431-20434.
[5] Pimpl P, Hanton S L, Taylor J P,etal. The GTPase ARF1p controls the sequence-specific vacuolar sorting route to the lyticvacuole.Plant Cell, 2003, 15: 1242-1256.
[6] Moss J, Vaughan M. Structure and function of ARF proteins: activators of cholera toxin and critical components of intracellular vesicular transport processes. Journal of Biological Chemistry, 1995, 270(21): 12327-12330.
[7] Poon P P, Cassel D, Huber I,etal. Expression, analysis, and properties of yeast ADP-ribosylation factor (ARF) GTPase activating proteins (GAPs) Gcs1 and Glo3. Methods Enzymol, 2001, 329: 317-324.
[8] Yahara N, Sato K, Nakano A. The Arf1p GTPase-activating protein Glo3p executes its regulatory function through a conserved repeat motif at its C-terminus. Journal of Cell Science, 2006, 119(12): 2604-2612.
[9] Zhuang X L, Jiang J F, Li J H,etal. Over-expression ofOsAGAP, an ARF-GAP, interferes with auxin influx, vesicle trafficking and root development. Plant Journal, 2006, 48(4): 581-591.
[10] Liljegren S J, Leslie M E, Darnielle L,etal. Regulation of membrane trafficking and organ separation by the nevershed ARF-GAP protein. Development, 2009, 136(11): 1909-1918.
[11] Liu B L, Zhang N, Wen Y K,etal. Identification of differentially expressed genes in potato associated with tuber dormancy release. Molecular Biology Reports, 2012, 39(12): 11277-11287.
[12] Du Y P, Li S, He H B,etal. Comparative of methods for RNA extraction from Lily bulb scales. Molecular Plant Breeding, 2010, 8(4): 832-836.
杜运鹏, 李双, 何恒斌, 等. 百合鳞片总RNA提取方法的比较. 分子植物育种, 2010, 8(4): 832-836.
[13] Feng D L, Lai Y, He S L. Cloning, characterization and expression of anArfGAPgene from pepper (CapsicumannuumL.). Chinese Agricultural Science Bulletin, 2012, 28(34): 184-189.
冯冬林, 赖燕, 何水林. 辣椒ArfGAP基因的克隆与表达分析. 中国农学通报, 2012, 28(34): 184-189.
[14] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod. Methods, 2001, 25(4): 402-408.
[15] Liu K D, Li H L, Zhong S T,etal. Cloning, subcellular localization and expression analysis ofAsAGfrom sugar apple (AnnonaspuamosaL.). Scientia Agricultura Sinica, 2016, 49(1): 142-154.
刘锴栋, 黎海利, 钟舒婷, 等. 番荔枝花器官发育基因AsAG的克隆, 亚细胞定位及表达分析. 中国农业科学, 2016, 49(1): 142-154.
[16] Liu F, Wang J Y, Wang X L,etal. The apical bud cell ultra-structure changes ofLiliumpumilumbulbs during breaking dormancy under refrigerated condition. Acta Horticulturae Sinica, 2013, 40(6): 1110-1118.
刘芳, 王家艳, 王晓丽, 等. 细叶百合鳞茎在低温解除休眠过程中茎尖细胞超微结构的变化. 园艺学报, 2013, 40(6): 1110-1118.
[17] Zuk M, Prescha A, Keüpczynaski J,etal. ADP ribosylation factor regulates metabolism and antioxidant capacity of transgenic potato tuber. Journal of Agricultural and Food Chemistry, 2003, 51: 288-294.
[18] Sun H M, Li T L, Li Y F. Starch metabolism and sprouting of bulb inLiliumdavidiivar.unicolorstored at different cold temperatures. Acta Horticulturae Sinica, 2004, 31(3): 337-342.
孙红梅, 李天来, 李云飞. 不同贮藏温度下兰州百合种球淀粉代谢与萌发关系初探. 园艺学报, 2004, 31(3): 337-342.
[19] Liu F, Li D D, Lian H,etal. Relationship between dormancy breaking and protective enzymes in refrigeratedLiliumpumilumbulbs. Acta Prataculturae Sinica, 2015, 24(12): 180-187.
刘芳, 李丹丹, 廉华, 等. 细叶百合冷藏过程中鳞茎保护酶活性与休眠解除的关系. 草业学报, 2015, 24(12): 180-187.
[20] Chen P W, Jian X, Luo R,etal. Simpleinvitroassay of Arf GAPs and preparation of Arf proteins as substrates. Methods in Cell Biology, 2015, 30: 69-80.
[21] Kartberg F, Asp L, Dejgaard S Y,etal. ARFGAP2 and ARFGAP3 are essential for COPI coat assembly on the Golgi membrane of living cells. Journal of Biological Chemistry, 2010, 285(47): 36709-36720.
[22] Oix J, Ouwendijk J, Stark A,etal. Sorting of Golgi resident proteins into different subpopulations of COPI vesicles: a role for ArfGAP1. Journal of Cell Biology, 2001, 155(7): 1199-1212.
[23] Ismail S A, Vetter I R, Sot B,etal. The structure of an Arf-ArfGAP complex reveals a Ca2+regulatory mechanism. Cell, 2010, 141(5): 812-821.
[24] Spang A, Shiba Y, Randazzo P A. ArfGAPs: gatekeepers of vesicle generation. FEBS Letters, 2010, 584(12): 2646-2651.
[25] Dodonova S O, Diestelkoetter-Bachert P, von Appen A,etal. A structure of the COPI coat and the role of coat proteins in membrane vesicle assembly. Science, 2015, 349(6244): 195-198.
[26] Sparkes I A, Ketelaar T, De Ruijter N C A,etal. Grab a Golgi: laser trapping of Golgi bodies revealsinvivointeractions with the endoplasmic reticulum. Traffic, 2009, 10(5): 567-571.
