海洋浮游纤毛虫摄食研究综述*
2016-01-15张武昌李海波王超锋
张武昌 陈 雪, 李海波, 王超锋, 梁 晨,张 珊 肖 天
(1. 中国科学院海洋研究所海洋生态与环境科学重点实验室 青岛 266071; 2. 青岛海洋科学与技术国家实验室海洋生态与环境科学功能实验室 青岛 266071; 3. 中国科学院大学 北京 100049)
海洋浮游纤毛虫(以下简称纤毛虫)根据肉体外是否具有壳体可分为砂壳纤毛虫和无壳纤毛虫两大类, 主要隶属于旋毛纲(Sprirotrichea)下的环毛亚纲(Choreotrichia)和寡毛亚纲(Oligotrichia), 另外也包括叶口纲(Litostomatea)下的中缢虫和一些寡膜纲(Oligohymenophora)下浮游生活的尾丝虫。纤毛虫是海洋微食物环的重要组成部分, 是连接微食物环与经典食物链的重要环节(Azam et al, 1983; Pierce et al,1992)。因此研究海洋浮游纤毛虫的摄食情况对了解海洋浮游纤毛虫在海洋浮游生态系统物质循环和能量流动中的作用有重要意义。
纤毛虫摄食的研究内容包括纤毛虫的食性、纤毛虫对不同饵料的摄食强度(摄食率、清滤率)和选择性、影响摄食的因素及摄食后的同化和排遗。对纤毛虫摄食的研究开始于Daday (1887)的研究, 他发现个体小的砂壳纤毛虫会被个体较大的砂壳纤毛虫摄食。随后,体内饵料颗粒法(Gold, 1968)、维持生长法(Gold, 1969;Johansen, 1976; Capriulo et al, 1980; Stoecker et al,1981; Stoecker et al, 1985; Verity et al, 1986)等方法被用来研究纤毛虫的食性。Spittler(1973)首次在实验室内用不同粒径的活性炭颗粒代替饵料的方法研究纤毛虫的摄食强度, 随后荧光标记饵料(Sherr et al,1987)等方法被应用到纤毛虫摄食研究中来。本文综述海洋浮游纤毛虫摄食研究的历史和现状, 以期为国内的相关研究提供借鉴。
1 纤毛虫的食性
研究纤毛虫的摄食首先要确定其食性, 即饵料组成。研究纤毛虫食性的方法主要有两种: 第一种是体内饵料颗粒法, 即检查纤毛虫体内因摄食而形成的食物泡, 鉴定饵料的种类; 第二种是维持生长法,即在实验室内用不同的饵料来喂养纤毛虫, 依据纤毛虫的生长状况来判断纤毛虫对饵料的摄食情况。
1.1 体内饵料颗粒法
体内饵料颗粒法最先应用于纤毛虫食性研究。浮游纤毛虫研究的早期, 在海上采集的砂壳纤毛虫体内的食物泡中发现有小的砂壳纤毛虫(Daday, 1887;Blackbourn, 1974), 颗石藻和无壳纤毛虫(Entz, 1909),细菌、硅藻、放射虫和金胞藻类(Campbell, 1926, 1927)以及甲藻(Beers et al, 1967)。在砂壳纤毛虫的食物泡中很少看到硅藻, Blackbourn(1974)认为硅藻太大, 不能被砂壳纤毛虫摄食。
体内饵料颗粒法在实验室内也得到应用。Gold(1968)首次尝试实验室内培养砂壳纤毛虫 Tintinnopsis sp.,混合饵料中包括藻类 Rhodomonas lens, Isochrysis galbana, Platymonas tetrathele, Saccharomyces cerevisiae以及培养基中原有的藻类 Diaphanoeca grandis和细菌, 随后在活体纤毛虫的食物泡中观察到上面的成分, 说明Tintinnopsis sp.可以摄食这些藻类和细菌。在室内实验中, Stoecker(1984)发现砂壳纤毛虫Favella sp.在饵料缺乏时会摄食自己的粪粒。
1.2 维持生长法
体内饵料颗粒法可以得到纤毛虫的饵料组成,但是此方法存在局限性, 不能说明被摄食饵料对纤毛虫的营养价值。维持生长法可以在实验室内检验饵料对于纤毛虫的营养价值。早期的研究者在实验室内使用维持生长法寻找合适的饵料培养纤毛虫以进行各种实验。Gold(1968, 1969, 1973)最先在实验室内成功培养砂壳纤毛虫, 所用的饵料为自养鞭毛虫(phytoflagellates), 虽然他没有进行纤毛虫摄食的观察, 但是这个培养实验已经可以说明砂壳纤毛虫摄食自养鞭毛虫并维持生长。用不同饵料培养纤毛虫时,纤毛虫的生长情况可以作为饵料对纤毛虫是否具有营养价值的指标(Gold, 1969; Johansen, 1976; Capriulo et al, 1980; Stoecker et al, 1981; Stoecker et al, 1985;Verity et al, 1986)。
1.2.1 硅藻对于纤毛虫的营养价值 多数研究表明硅藻作为饵料几乎不能维持纤毛虫的生长。Blackbourn(1974)发现砂壳纤毛虫 Favella serrata 对硅藻不摄食或很少摄食。Johansen (1976)报导砂壳纤毛虫在只有硅藻作为饵料的情况下不能培养成功。Jonsson(1986)在实验室中观察到无壳纤毛虫Strombidium可以摄食硅藻, 但是并不生长。Capriulo等(1980)在自然海区进行培养实验说明微型浮游动物(包括浮游纤毛虫)可以摄食较小的硅藻, 但是有长须的硅藻(Thalassiosira或 Chaetoceros)不易被摄食。Gifford(1981)认为硅藻 Thalassiosira weissflogii的长须(β-chitin threads)使得硅藻不易被纤毛虫摄食。Verity等(1986)也得到了类似的实验结果, 他们使用带长须的硅藻和不带长须的硅藻分别喂养砂壳纤毛虫Tintinnopsis acuminata和T. vasculum, 两种砂壳纤毛虫在没有长须的硅藻做为饵料时生长很快, 在有长须的硅藻作为饵料时几乎不生长, 较小的 T.vasculum还出现个体的死亡。
1.2.2 甲藻对于纤毛虫的营养价值 不同种类的甲藻对于纤毛虫的营养价值不同。Gold(1969)和Stoecker等(1981)对比各种饵料对纤毛虫生长的影响,得出砂壳纤毛虫Favella campanula和F. ehrenbergii必须要有甲藻作为饵料才能存活。Stoecker等(1981)研究表明并不是所有的甲藻都是F. ehrenbergii适合的饵料, 甲藻 Gonyaulax tamarensis、G. polyedra、Heterocapsa sp.能很好地支持F. ehrenbergii的生长;甲藻 Prorocentrum mariaelebouriae虽然被摄食, F.ehrenbergii的生长率却较低, 所以不是很好的饵料;甲藻 Amphidinium carterae会产生类似胆碱的物质,不被F. ehrenbergii摄食。
根据培养的经验, 有些用来培养纤毛虫的经验饵料。例如甲藻Heterocapsa triquetra用来培养砂壳纤毛虫Favella taraikaensis (Kamiyama et al, 2005)。
1.2.3 鞭毛虫对于纤毛虫的营养价值 纤毛虫摄食鞭毛虫的相关研究目前较少, 已有的研究表明鞭毛虫并不是适合纤毛虫的饵料。Jonsson(1986)发现无壳纤毛虫 Strombidium vestitum、S. reticulatum和Lohmanniella spiralis虽然摄食一些自养和异养的鞭毛虫, 但是却不生长。
而在自然海区, 砂壳纤毛虫偏好摄食鞭毛虫。Modigh等(2003)检查自然海区采集的砂壳纤毛虫体内的食物泡, 根据荧光特点, 发现体内有聚球藻等,但是主要的饵料是 nano级鞭毛虫, Modigh等(2003)认为 nano级鞭毛虫的丰度较低, 而砂壳纤毛虫如果偏好以 nano级鞭毛虫为食, 必然饵料受限, 导致丰度不会太高。这可能是自然海区砂壳纤毛虫丰度不高的原因之一。
1.2.4 聚球藻对于纤毛虫的营养价值 一些淡水的聚球藻Coccoid cyanobacteria对纤毛虫没有营养价值(Klaveness, 1984; Skogstad et al, 1987)。Verity 等(1986)在实验室内用海洋聚球藻培养两种海洋浮游砂壳纤毛虫(Tintinnopsis acuminate, T. vasculum)都没有成功, 可能是这两种砂壳纤毛虫不摄食聚球藻, 也可能由于聚球藻营养不够, 不能维持砂壳纤毛虫生长。
另外一些研究表明, 在自然海区中聚球藻是纤毛虫的重要饵料之一。Sherr等(1986)用荧光显微镜在自然海区纤毛虫的体内的食物泡中发现了聚球藻。Perez等(1996)发现在自然海水中添加聚球藻, 纤毛虫的生长得到促进, 而在自然海水中添加纤毛虫, 聚球藻的生长得到明显抑制。Bernard等(1993)在法国的维勒弗朗什湾(Bay of Villefranche)检查砂壳纤毛虫体内的食物泡, 发现聚球藻是砂壳纤毛虫 Rhabdonella spiralis主要饵料, 是砂壳纤毛虫 Salpingella acuminata的唯一饵料。Pitta等(2001)用荧光显微镜计数地中海纤毛虫体内的聚球藻, 发现纤毛虫体内的聚球藻最多可达14个, 平均为0.94个; 无壳纤毛虫体内的聚球藻平均为0.28个。
1.3 其它方法
除了上述方法之外, 一些研究者还用其它的方法来确认纤毛虫的饵料组成, 例如通过监测饵料的减少来证明纤毛虫对饵料的摄食。Gold(1969)将砂壳纤毛虫 Favella campanula和甲藻 Glenodinium foliaceum或Peridinium trochoideum混合(个体数比例1︰14), 经过一晚的摄食后, 加入14C标记的NaHCO3,光合作用1 h, 测定甲藻固定的14C, 实验组甲藻的光合作用比对照组平均低了 38%, 因此可以证明纤毛虫摄食了甲藻。
另外还有些研究根据纤毛虫和饵料生物在自然环境中出现的先后次序推论这些饵料生物与纤毛虫的被摄食关系(Verity et al, 1986)。
Gold(1969)还用实验证明砂壳纤毛虫 Tintinnopsis tubulosa能吸收氨基酸。把14C标记的氨基酸放入砂壳纤毛虫的培养液中, 培养一段时间后砂壳纤毛虫的壳上就会有放射性标记, 而且培养240 min后比培养10 min后活体砂壳纤毛虫的壳上有更多的放射性。
2 纤毛虫摄食强度的研究方法
衡量纤毛虫的摄食强度的参数包括摄食率[I,ingestion rate, cells/(grazer h)]、清滤率(F, clearance rate, μL/(grazer h)]等。摄食率即摄食者在单位时间内摄入体内的饵料个数(或质量, 通常以碳 C表示), 摄食率除以培养期间饵料的平均丰度即为清滤率。
研究浮游纤毛虫摄食率和清滤率常用的方法有两种。第一种是饵料浓度差减法, 即将浮游纤毛虫和饵料混合培养, 根据培养前和培养后饵料浓度的降低, 利用Frost(1972)在研究桡足类摄食时使用的公式进行估计。第二种是体内饵料颗粒增多法, 饵料被摄入纤毛虫体内不会立即被消化, 所以摄食实验开始后随着时间增加, 纤毛虫体内的颗粒增加, 一段时间后(最开始被摄食的颗粒被消化掉之后), 纤毛虫体内的颗粒数目保持稳定。体内饵料颗粒增加法主要研究的是无壳纤毛虫和透明壳砂壳纤毛虫, 黏着壳纤毛虫的壳有粘着颗粒, 不易观察肉体内的饵料颗粒, 所以黏着壳纤毛虫摄食的研究较少。
饵料进入纤毛虫体内后不易被辨认, 所以开始有人使用替代饵料的颗粒来研究摄食, 这些替代颗粒包括活性炭(Spittler, 1973)、淀粉(Spittler, 1973;Kivi et al, 1995)、刚果红染色的酵母菌(Spittler, 1973)等。后来使用荧光标记的颗粒(Jonsson, 1986), 用荧光显微镜观察纤毛虫体内颗粒发出的荧光。这些荧光标记颗粒可以是荧光塑料微球, 也可以是荧光标记藻类(FLA)、荧光标记细菌(FLB) (表1)。
Spittler(1973)用活性炭作为替代饵料的颗粒, 结果表明砂壳纤毛虫会摄食大于 2 μm 的活性炭颗粒,但是摄食量很少, 对小于2 μm的活性炭颗粒则不摄食。另有研究结果表明, 砂壳纤毛虫可以摄食淀粉颗粒(直径 3—60 μm)和刚果红染色的酵母菌(直径 2—8 μm)。由于纤毛虫摄食过程可能存在机械感应或化学感应, 这些替代饵料进行的实验结果可能不能反映真实的摄食情况。另外, 由于这些饵料不能运动,可能导致被捕获的几率降低(Bernard et al, 1990)。
除这两种方法外, Fenchel等(1988)根据具沟急游虫游泳速度为600 μm/s, 用于摄食的胞口小膜的面积为 1200 μm2, 估计具沟急游虫的清滤率为 2.59 μL/(ciliate h)。
3 纤毛虫对不同饵料的摄食
迄今为止, 除没有纤毛虫对硅藻摄食率和清滤率的研究数据以外, 纤毛虫对纤毛虫(表 2)、甲藻(表3)、鞭毛虫(表4)、聚球藻和原绿球藻(表5)以及细菌(表6)的摄食研究均有展开。
3.1 纤毛虫对不同饵料的摄食强度
有研究表明个体较大的纤毛虫可以摄食较小的纤毛虫, 纤毛虫对纤毛虫的摄食率范围是0.15—4.50 cells/(ciliate h), 清滤率的范围是12.20—129.86 μL/(ciliate h)。纤毛虫对甲藻摄食的研究比较广泛, 摄食率范围是 0.10—500 cells/(ciliate h), 清滤率的范围是0.3—110 μL/(ciliate h)。纤毛虫对鞭毛虫的摄食报道也较多, 摄食率范围是0.095—51 cells/(ciliate h), 清滤率的范围是0.02—17.4 μL/(ciliate h)。纤毛虫对聚球藻和原绿球藻的摄食率, 实验室内的结果与自然海区的结果差异较大。自然海区的摄食率范围是0.13—0.41 cells/(ciliate h); 实验室内得出的摄食率范围是18—920 cells/(ciliate h)。纤毛虫对聚球藻和原绿球藻的清滤率较小, 范围是44—515 nL/(ciliate h)。

表1 纤毛虫对不同饵料颗粒的摄食(检查体内饵料颗粒法)Tab.1 Ciliates grazing on different food particles (by observing the food particles in ciliate food vacuoles)

表2 纤毛虫摄食纤毛虫的清滤率[F, μL/(ciliate h)]和摄食率[I, cells/(ciliate h)]Tab.2 Clearance rates [F, μL/(ciliate h)] and ingestion rates [I, cells/(ciliate h)] of ciliates grazing on ciliates
纤毛虫对细菌摄食的研究方法有两种, 一种是用自然细菌(包括同位素标记的细菌)喂养纤毛虫, 另一种是用单分散性荧光标记细菌喂养纤毛虫。Sherr等(1987)发明了单分散性荧光标记细菌(monodispersed,fluorescently labeled bacteria, 简称 FLB), 用来研究纤毛虫等原生动物对细菌的摄食, 标记的荧光染料为 5-(4,6-dichlorotriazin-2-yl) aminofluorescein, 简称DTAF。实验证明FLB对原生动物没有毒性, 原生动物能消化 FLB并生长, 生长状况和没有染色的同种活菌株没有差异, 即原生动物对 FLB和没有被标记的细菌没有选择性摄食。纤毛虫对细菌的摄食率为3.2—630 cells/(ciliate h), 清滤率为< 1—213000 nL/(ciliate h)。其中Lessard等(1985)在自然海区得到的一种纤毛虫对细菌的清滤率[213000 nL/(ciliate h)]的值远高于其它种类纤毛虫对细菌的清滤率。另外,还有研究利用细菌的生长率和毛生长率的数据推算纤毛虫对细菌的摄食率, Rivier等(1985)用细菌喂养Strombidium sulcatum, 推算出的清滤率为 602—73100 nL/(ciliate h), 摄食率为(4.3—237.6)×103cells/(ciliate h), 这个结果大大高于其它实验结果, 因此其准确性还有待验证。



表5 纤毛虫摄食聚球藻和原绿球藻的清滤率[F, nL/(ciliate h)]和摄食率[I, cells/(ciliate h)]Tab.5 Clearance rates [F, nL/(ciliate h)], ingestion rate [I, cells/(ciliate h)] of ciliate grazing on Synechococcus and Prochlorococcus

表6 纤毛虫摄食细菌的清滤率[F, nL/(ciliate h)]和摄食率[I, cells/(ciliate h)]Tab.6 Clearance rates [F, nL/(ciliate h)] and ingestion rates [I, cells/(ciliate h)] of ciliate grazing on bacteria
3.2 纤毛虫对饵料的选择性
纤毛虫摄食时, 对不同的饵料会有选择性。纤毛虫对饵料选择性可能源自其对饵料物理性质(大小、形状、质地)或化学性质(如化学成分)的辨别和喜好。
3.2.1 饵料的粒级 对于纤毛虫而言, 较小的种类摄食粒径小的饵料, 较大的种类摄食的饵料粒级较广。随着纤毛虫本身粒级的增大, 对于粒径较小的饵料的摄食比例减小。Rassoulzadegan等(1988)用观察自然界中纤毛虫体内颗粒的方法得出粒级小于30 μm 的纤毛虫的饵料颗粒中有 72%是 pico级(0.2—2 μm), 28%是 nano 级(2—20 μm); 30—50 μm 的纤毛虫的饵料颗粒中30%是pico级, 70%是nano级;大于50 μm的纤毛虫的饵料颗粒中5%是pico级, 95%是nano级。Pitta等(2001)发现砂壳纤毛虫对nano级浮游生物的摄食比对pico级浮游生物的摄食更有效。Jonsson (1986)使用不同粒级的乳胶微球(fluorescent latex beads), 检查纤毛虫对粒级的选择性。用不同粒级(直径为 1.11、2.11、2.87、4.9、5.7、6.4、7.9、9.7、14.4、19.1 μm)的乳胶微球来做实验, 无壳纤毛虫Lohmanniella spiralis、Strombidium reticulatum和S.vestitum有摄食的粒级分别为 2.11—14.4、1.11—6.4和 1.11—6.4 μm。Lohmanniella spiralis的围口小膜间的空隙在小膜基部为2 μm, 而在远端为4 μm; 而对于Strombidium reticulatum, 这两个数值分别为1.2 μm 和 4.4 μm。S. reticulatum和S. vestitum能摄食1.1 μm的乳胶微球, 可能是因为在小膜基部, 小膜间隙会变小(Jonsson, 1986)。浮游纤毛虫中环毛类的小膜间距大于 2 μm (Fenchel, 1980a; 1980b; Jonsson,1986), 一些研究结果表明纤毛虫对小于2 μm的颗粒的清滤效果要比大于2 μm的颗粒差很多。
实验室内的实验结果多表明纤毛虫饵料的粒径级小于纤毛虫口区直径或壳开口直径。Jonsson (1986)用直径为1.01—19.2 μm的乳胶微球或纯培养的微藻在 12°C的恒温下喂养三种无壳纤毛虫, 用复式显微镜观察纤毛虫能摄食的最大颗粒的直径与口区直径的比例为40%。Spittler(1973)用直径为3—60 μm、浓度为80 mg/L的淀粉颗粒喂养砂壳纤毛虫, 用显微镜测定砂壳纤毛虫摄入体内的淀粉颗粒的直径, 发现砂壳纤毛虫摄食的最大淀粉颗粒的直径是壳开口的41.2%—45%。Heinbokel(1978b)发现砂壳纤毛虫能够摄食的颗粒直径可以到达其口区直径的43%。砂壳纤毛虫Stenosemella ventricosa口径大约为30 μm, 可摄食粒径为1.3—33 μm的颗粒, 但主要还是3—12 μm的颗粒(Rassoulzadeganet al, 1981)。Gifford(1985)发现无壳纤毛虫Strombidiumspp.能摄食与自己一样大的颗粒, 在饵料缺乏时, 甚至自相残杀。Kamiyama等(2001)在室内实验得出Favella ehrenbergii和F.taraikaensis摄食的饵料的最大粒径为壳开口直径的59%和78%。
Verity等(1986)报道砂壳纤毛虫摄食硅藻的直径大于砂壳纤毛虫壳的开口直径的50%, Capriulo(1982)也发现野外砂壳纤毛虫自然饵料的粒径大于砂壳纤毛虫的开口直径。Kamiyama等(2001)认为自然饵料和人工饵料的实验结果不同说明了纤毛虫的化感作用在选择饵料时是很重要的, 当饵料合口时, 饵料的粒径大于纤毛虫口径时也可以被摄食。
有很多研究总结了不同种类纤毛虫的饵料粒径范围及最适饵料粒径(表 7)。Kivi等(1995)用直径为1.4—40 μm的小麦淀粉集中研究纤毛虫的摄食粒级,得出不同种类纤毛虫的饵料粒径范围及最适饵料粒径。Rychert(2008)使用小麦淀粉(1.25—10 μm)研究发现无壳纤毛虫Balanion comatum和Strombidiumsp.分别摄食1.25—7.5 μm和1.25—5 μm的颗粒。Bernard等(1990)用不同粒径的颗粒(0.6—11.9 μm), 包括一种FLB、两种聚球藻和 9种微藻作为无壳纤毛虫Strombidium sulcatum的饵料, 得出S.sulcatum摄食的粒径范围为0.6—6.6 μm, 最适粒径为2.5 μm。因为这个研究中不同粒径的饵料是不同的藻类, 所以这个结果仅作为参考。Rassoulzadegan(1978)用自然海水喂养砂壳纤毛虫Favella ehrenbergii, 用颗粒计数器监测水中颗粒的减少, 发现F. ehrenbergii摄食的粒级范围为 4—30 μm。
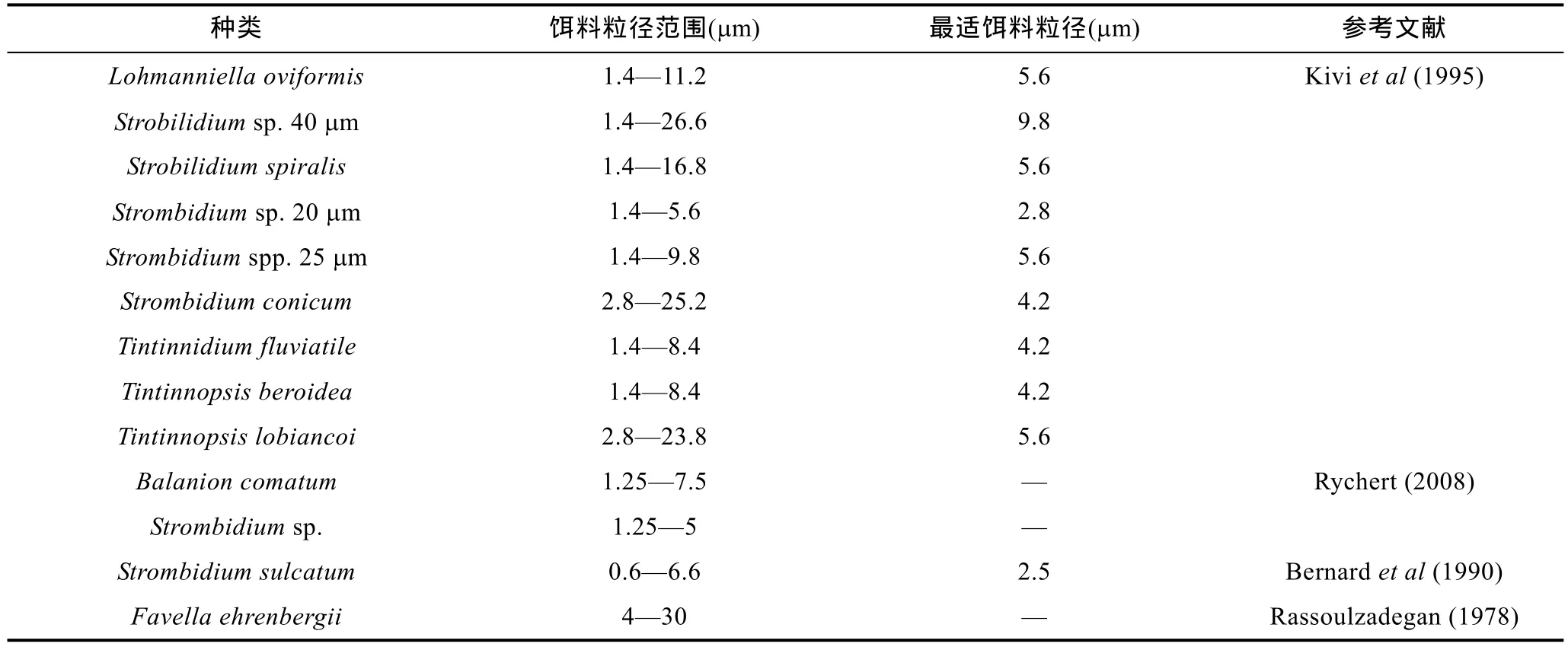
表7 不同种类纤毛虫可摄食饵料的粒径范围及最适饵料粒径Tab.7 Size ranges of ingested particles for different ciliate species and the most suitable particle sizes
Capriulo(1982)认为砂壳纤毛虫的摄食率和清滤率与食物颗粒大小呈正相关。Fenchel等(1988)用检查纤毛虫体内颗粒增加的方法研究具沟急游虫对不同粒径颗粒(0.21 μm的荧光微球, 0.51 μm的荧光微球,0.8 μm 的绿色微球, 1.1 μm 的荧光微球, 2.83 μm 的微球)的选择性, 发现纤毛虫对这些颗粒的最大清滤率随粒径的减小而减少, 对 0.51 μm 颗粒的清滤率是2.83 μm 颗粒的 5%, 对 0.21 μm 颗粒没有摄食。Bernard等(1990)的研究表明, 当饵料浓度都是0.49×10–6(体积比)时, 一个粒级为 30 μm 的纤毛虫对聚球藻的清滤率为174.3 μm3/h, 对微球藻Nannochloris的清滤率为3125.3 μm3/h, 相差1个数量级。
3.2.2 饵料化学性质 饵料化学性质(quality)对纤毛虫摄食的影响研究较少, 也比较难。要寻找形状和运动性相同(相似)的颗粒作为对比是比较困难的。Christaki等(1998)和 Dolan等(2003)利用普通的塑料荧光微球(plain fluorescent microsphere, pMS)和表面涂有羧酸酯的微球(carboxylate microsphere, cMS)作为对比, 发现无壳纤毛虫Strombidium sulcatum对这两种微球的清滤率不同, 从而确定纤毛虫在摄食时对饵料的化学性质是有区分的。
Chen等(2010)用两种单胞藻Nannochloropsis sp.和 Isochrysis galbana作为饵料来研究一种寡毛类纤毛虫(未定种)的摄食, 这两种饵料的相应球型直径(equivalent spherical diameter, ESD)和C、N含量相近,纤毛虫对这两种饵料摄食率存在差异, Chen等(2010)认为存在差异与它们的化学性质有关。但是Nannochloropsis sp.运动能力很差, 而I. galbana有很强的运动能力, 不同的运动能力也有可能会对摄食率造成影响。
3.3 不同种类纤毛虫摄食的比较
为了比较不同种类纤毛虫的摄食率和清滤率, 一般使用特定生物量摄食率(specific ingestion rate)即单位时间内摄食的生物量是自身生物量的倍数(Rose et al, 2013)和特定体积清滤率(volume-specific clearance rate)即单位时间内清滤的体积是纤毛虫体积的倍数(Christaki et al, 1998)。
不同种类纤毛虫在摄食不同饵料时特定体积清滤率不同[(0.06—52)×104h–1]。Strombidium sulcatum对几种颗粒的特定体积清滤率为(0.06—1.2)×104h–1(Christaki et al, 1998)。Chrisataki 等(1999)认为Strombidium sulcatum摄食Prochlrococcus的特定体积清滤率为(0.29—0.34)×104h–1, 而摄食 Synechococcus的特定体积清滤率为(3.29—3.64)×104h–1。Chen 等(2010)指出Strobilidium sp.摄食I. Galbana的最大特定体积清滤率为52×104h–1, 摄食Nannochloropsis sp.时的最大特定体积清滤率为18×104h–1。
不同种类纤毛虫特定生物量摄食率相似。Verity(1991)发现无壳纤毛虫Strombidium的特定碳生物量摄食率为 0.13—0.15 h–l。Rose 等(2013)认为无壳纤毛虫 Strombidium sp.的特定摄食率为 0.0510—0.187 h–1。Kamiyama等(2005)给出砂壳纤毛虫 Favella taraikaensis特定碳生物量摄食率为3.5 d–1。
4 影响纤毛虫摄食的因素
4.1 饵料浓度
饵料浓度对纤毛虫摄食的影响研究较多。有研究表明, 随着饵料浓度的增加, 纤毛虫的清滤率和摄食率先是增加, 而当饵料浓度达到一定值时, 清滤率或者摄食率达到最高值, 之后随饵料浓度的继续增加而迅速降低。
砂壳纤毛虫 Favella azorica摄食甲藻Heterocapsa triquetra时, 当饵料浓度为 300—400 cells/mL时, 清滤率达到最大18.2 μL/(ciliate h), 高于这个浓度, 清滤率迅速降低, 当饵料浓度达到6000—7000 cells/mL时, 清滤率只有0.9 μL/(ciliate h);砂壳纤毛虫F. azorica摄食甲藻H. circularisquama时,当饵料浓度为 300—400 cells/mL时, 清滤率达到最大27.5 μL/(ciliate h), 高于这个浓度, 清滤率迅速降低, 当饵料浓度达到 6000—7000 cells/mL时, 只有4.1 μL/(ciliate h), 当饵料浓度高于 104cells/mL时,无法测得清滤率(Kamiyama, 1997)。Verity(1985)发现拟铃虫属(Tintinnopsis)砂壳纤毛虫摄食率随着饵料浓度的增加而增加, 到80 μgC/L时达到最大, 饵料浓度再升高时, 摄食率保持不变, 饵料浓度超过400—500 μgC/L时摄食率下降。砂壳纤毛虫 Amphorides quadrilineata的摄食率在饵料藻(Isochrysis galbana)浓度为100 μgC/L时达到最大, 然后保持恒定直到饵料浓度增加到 600 μgC/L (Jakobsen et al, 2001)。Kamiyama等(2005)发现砂壳纤毛虫 Favella taraikaensis的摄食率随饵料甲藻 Alexandrium tamarense浓度的升高先升高, 当A. tamarense的浓度超过100 cells/mL时, F. taraikaensis的摄食率维持不变。在日本的濑户内海的Western Hiroshima Bay, 当发生有害藻华(甲藻Heterocapsa circularisquama)时(最大丰度为3950 cells/mL), 可以检测到的主要砂壳纤毛虫有 Favella、Tontonia、Eutintinnus、Tintinnopsis和Amphorellopsis, 当甲藻 Heterocapsa circularisquama的浓度由 260 cells/mL增至 1170 cells/mL时,Favella、Tontonia的丰度上升, Tintinnopsis和Amphorellopsis在整个藻华期间丰度稳定。当Heterocapsa circularisquama的丰度为100 cells/mL时,纤毛虫能摄食其现存量的 5%—75%, 而当其丰度为2000 cells/mL时, 纤毛虫只能摄食其现存量的1%—3% (Kamiyama et al, 2005)。Rassoulzadegan等(1981)将砂壳纤毛虫Stenosemella ventricosa在自然海水中适应培养 24 h后, 用自然海水培养来观察其摄食率, S. ventricosa的丰度为2.3 cells/mL, 根据饵料浓度的变化, 发现在开始的几个小时内 S. ventricosa有很高的摄食率, 达到 4×105μm3(wet vol food)/(ciliate d)。在20小时后摄食率下降并在30小时后最终稳定在 4.6×104μm3(wet vol food)/(ciliate d), 大约相当于砂壳纤毛虫湿重的66%或体内有机碳的43%。
无壳纤毛虫 Strobilidium sp.摄食单胞藻 Isochrysis galbana和 Nannochloropsis sp.时, 饵料浓度达到 1000 μgC/L时, 摄食率才达到最大。当以Nannochloropsis sp.为饵料时, 清滤率随着饵料浓度的增加会稍微升高, 到饵料浓度为500 μgC/L时达到最大, 然后保持在一定的水平, 饵料浓度为 2000 μgC/L时降低(Chen et al,2010)。Banse(1982)总结了大部分已知的数据, 认为在大洋中纤毛虫的适口饵料浓度很低, 这造成了纤毛虫的低摄食率, 进而导致了纤毛虫生长率较低。
也有一些不同的结果, Verity(1985)发现拟铃虫属(Tintinnopsis)砂壳纤毛虫的清滤率随饵料浓度(10—700 μgC/L)的升高而降低。
4.2 温度
多数研究表明温度升高会使得纤毛虫摄食率增加。Rassoulzadegan(1982)发现 15—26 °C 范围内, 纤毛虫摄食率随温度的升高而升高。Verity(1985)发现拟铃虫属(Tintinnopsis)砂壳纤毛虫在饵料浓度相同的情况下, 清滤率和摄食率随温度的升高而升高, 15°C时的清滤率和摄食率分别是 5°C时的 1.5—1.7倍和5—2.9倍。Aelion等(1985)估计砂壳纤毛虫Favella sp.的摄食率在 8—12°C时较低, 12—16°C时迅速升高,16—19°C 基本不变, 21°C 降低。
也有研究表明温度对砂壳纤毛虫摄食率影响不大。Stoecker等(1982)发现Favella sp.以甲藻为食,饵料浓度为 80—800 cells/mL 的情况下, 在8—20°C的范围内, 清滤率不受温度的影响。Capriulo(1982)研究了 7种从野外收集的砂壳纤毛虫对自然悬浮颗粒的摄食率和清滤率, 认为纤毛虫的摄食与温度无关。
4.3 纤毛虫的状态
纤毛虫所处的状态有四种, 饥饿期、指数生长期(饵料不受限制)、静止期(饵料受限)、分裂滞后期(摄食很多饵料, 但是还没有分裂)。不同时期的纤毛虫摄食强度有差异, Christaki 等(1998)研究了无壳纤毛虫Strombidium sulcatum在指数生长期和静止期的摄食率, 对于同一种饵料, 指数生长期个体的清滤率大于静止期个体。
饥饿期的纤毛虫其摄食强度一般较高。Taniguchi等(1985)发现经过少于45 min的饥饿处理后, 砂壳纤毛虫的摄食率升高。Rassoulzadegan等(1981)也发现经过一天的饥饿处理后, 砂壳纤毛虫 Favella ehrenbergii的摄食率升高。
4.4 光线
有的研究结果表明光照可以使纤毛虫的摄食强度增加。Rassoulzadegan(1978)认为光照能影响砂壳纤毛虫Favella ehrenbergii摄食活动, 在有光线的条件下摄食率较高。Stoecker等(1982)发现砂壳纤毛虫Favella sp.会聚集在饵料浓度高的地方, 导致在有光的条件下清滤率增加。Strom(2001)发现两种纤毛虫在中等光照下的摄食率是黑暗时的2—7倍。
也有的研究表明光照降低纤毛虫的摄食强度。Chen等(1999)使用FLA喂养Lohmanniella sp., 在黑暗状态下, 摄食率为 0.4 FLA/(ciliate min), 在 115 μE/(m2s)的光照下, 降为0.07 FLA/(ciliate min), 当光线突然关闭或打开时, 摄食率立即发生变化。
另外有一些研究认为光线对纤毛虫摄食没有影响。Heinbokel(1978a)用砂壳纤毛虫的研究没有发现摄食行为有明显的昼夜节律。Blackbourn(1974)在实验室内用砂壳纤毛虫 Tintinnopsis parvala和 T.cylindrica摄食微藻Pavlova lutheri, 也没有发现摄食行为有明显的昼夜节律。
4.5 扰动
纤毛虫的清滤率受扰动的影响因种而异。砂壳纤毛虫Helicostomella sp.在剪切率为10 s–1时的清滤率为静止水体的0.42倍, 而Favella sp.受扰动的影响较小(Shimeta et al, 1995)。同样的, 无壳纤毛虫Strombidium sulcatum在扰动时清滤率会降低。
5 同化和排遗
同化(assimilation)即纤毛虫对所摄食饵料的消化吸收, 纤毛虫消化吸收的饵料与所摄食饵料的比值即为同化率。排遗(egestion)是指纤毛虫排出未被消化的食物颗粒。
5.1 饵料摄食量
Rassoulzadegan(1978)估计砂壳纤毛虫 Favella ehrenbergii每天摄食量相当于自身含碳量的 70%。Heinbokel(1978a)报道植食性砂壳纤毛虫每天能摄食微型甲藻的量达自身体重的240%, Rassoulzadegan等(1981)得出Stennosomella ventricosa每天的摄食量为自身体重的43%。
5.2 同化率
Stoecker(1984)用甲藻Heterocapsa triquetra喂养砂壳纤毛虫 Favella sp., 观察砂壳纤毛虫的粪粒, 发现里面最多可以有 4个饵料藻的残余, 粒级最大为19×32 μm。粪便中的 C、N含量是饵料藻的 21%和8%, C:N是26, 大于饵料藻(C:N=9.1)。粪粒的体积是其摄食饵料体积的 21%—22%, 因为砂壳纤毛虫Favella摄食甲藻时将细胞整个吞下, 所以估计纤毛虫的同化率为78%—79%。Rassoulzadegan(1978)估计砂壳纤毛虫Favella ehrenbergii的同化率为67%。
5.3 饵料在纤毛虫体内通过的时间
Bernard等(1990)用不同饵料饲养无壳纤毛虫Strombidium sulcatum。发现通过S. sulcatum体内时间最短的是粒级为 2.5 μm 的甲藻 Nannochloris sp.[(13.7±2.2) min]。FLB, 聚球藻 Synechococcus sp., 微藻Emiliania huxleyi和Isochrysis galbana的通过时间分 别 是 (20.1±3.1), (23.1±6.0), (21.4±2.6)和 (20.1±3.7) min。Dolan等(1997)测得一系列食物[荧光微球,聚球藻以及单胞藻(Isochrysis galbana)]通过无壳纤毛虫Strombidium sulcatum的食物泡的时间的一半约为75min。
Rassoulzadegan等(1988)将喂食 2 h的砂壳纤毛虫 Favella用孔径 50 μm 的筛绢过滤出来, 放入0.22 μm 过滤的海水中, 用颗粒计数器计数海水中排遗颗粒的增加, 发现排遗过程主要发生在12 h以后,并在24 h内完成。Kopylov等(1987)测得两种砂壳纤毛虫摄食藻类的半消化时间约为1 h (60±10 min)。
6 小结
目前国外在实验室内和自然海区对纤毛虫的摄食已经进行了相当广泛的研究。资料表明纤毛虫的食性很广, 海水中自由生活的纤毛虫、硅藻、甲藻、鞭毛虫、细菌等都可以成为纤毛虫的饵料。不同纤毛虫对不同饵料的摄食率[0.1—920 cells/(ciliate h)]和清滤率[0—110 μL/(ciliate h)]均有不同, 纤毛虫的摄食会受到饵料浓度、温度、光线、扰动及纤毛虫所处的生长阶段等的影响。纤毛虫对饵料的粒径有一定的选择性, 一般摄食比本身粒径小的颗粒, 但也有研究表明砂壳纤毛虫可以摄食大于其口径的颗粒。纤毛虫对饵料的化学性质也有选择性。饵料颗粒通过纤毛虫体内的时间变化范围较大(13.7 min—24 h)。我国对纤毛虫摄食的研究较少, 本综述总结纤毛虫摄食研究的现状及研究结果, 以期为我国的相关研究提供参考。
Aelion C M, Chisholm S W, 1985. Effect of temperature on growth and ingestion rates of Favella sp. Journal of Plankton Research, 7(6): 821—830
Apple J K, Strom S L, Palenik B et al, 2011. Variability in protist grazing and growth on different marine Synechococcus isolates. Applied and Environmental Microbiology, 77(9):3074—3084
Azam F, Fenchel T, Field J G et al, 1983. The ecological role of water-column microbes in the Sea. Marine Ecology Progress Series, 10: 257—263
Banse K, 1982. Cell volumes, maximal growth rates of unicellular algae and ciliates, and the role of ciliates in the marine pelagial. Limnology and Oceanography, 27(6):1059—1071
Beers J R, Stewart G L, 1967. Micro-zooplankton in the euphotic zone at five locations across the California current. Journal of the Fisheries Research Board of Canada, 24(10):2053—2068
Bernard C, Rassoulzadegan F, 1990. Bacteria or microflagellates as a major food source for marine ciliates: possible implications for the microzooplankton. Marine Ecology Progress Series, 64: 147—155
Bernard C, Rassoulzadegan F, 1993. The role of picoplankton(cyanobacteria and plastidic picoflagellates) in the diet of tintinnids. Journal of Plankton Research, 15(4): 361—373
Blackbourn D J, 1974. The feeding biology of tintinnid Protozoa and some other inshore microzooplankton. Canada: PhD Thesis, University of British Columbia
Campbell A S, 1926. The Cytology of Tintinnopsis nucula (FOL)Laackmann with an Account of Its Neuromotor Apparatus,Division, and a New Intranuclear Parasite. Berkeley, Calif:University of California Press, 179—236
Campbell A S, 1927. Studies on the Marine Ciliate Favella(Jörgensen), with Special Regard to the Neuromotor Apparatus and its Role in the Formation of the Lorica.Campbell: The Marine Ciliate Favella, 429—452
Capriulo G M, 1982. Feeding of field collected tintinnid microzooplankton on natural food. Marine Biology, 71(1): 73—86
Capriulo G M, Carpenter E J, 1980. Grazing by 35 to 202 μm micro-zooplankton in Long Island Sound. Marine Biology,56(4): 319—326
Chen B Z, Liu H B, Lau M T S, 2010. Grazing and growth responses of a marine oligotrichous ciliate fed with two nanoplankton: does food quality matter for micrograzers?Aquatic Ecology, 44(1): 113—119
Chen K M, Chang J, 1999. Short communication: influence of light intensity on the ingestion rate of a marine ciliate Lohmanniella sp. Journal of Plankton Research, 21(9):1791—1798
Christaki U, Dolan J R, Pelegri S et al, 1998. Consumption of picoplankton-size particles by marine ciliates: effects of physiological state of the ciliate and particle quality.Limnology and Oceanography, 43(3): 458—464
Christaki U, Jacquet S, Dolan J R et al, 1999. Growth and grazing on Prochlorococcus and Synechococcus by two marine ciliates. Limnology and Oceanography, 44(1):52—61
Christoffersen K, González J M, 2003. An approach to measure ciliate grazing on living heterotrophic nanoflagellates.Hydrobiologia, 491(1—3): 159—166
Daday E, 1887. Monographie der familie der tintinnodeen.Mittheilungen aus der Zoologischen Station zu Neapel,473—591
Dolan J R, Coats D W, 1991. A study of feeding in predacious ciliates using prey ciliates labeled with fluorescent microspheres. Journal of Plankton Research, 13(3): 609—627 Dolan J R, Sall N, Metcalfe A et al, 2003. Effects of turbulence on the feeding and growth of a marine oligotrich ciliate.Aquatic Microbial Ecology, 31(3): 183—192
Dolan J R, Šimek K, 1997. Processing of ingested matter in Strombidium sulcatum, a marine ciliate (Oligotrichida).Limnology and Oceanography, 42(2): 393—397
Entz G Jr, 1909. Studien über organisation und biologie der Tintinniden. Arch Protistenkd, 15: 93—226
Epstein S S, Shiaris M P, 1992. Size-selective grazing of coastal bacterioplankton by natural assemblages of pigmented flagellates, colorless flagellates, and ciliates. Microbial Ecology, 23(3): 211—225
Fenchel T, 1980a. Suspension feeding in ciliated protozoa:functional response and particle size selection. Microbial Ecology, 6(1): 1—11
Fenchel T, 1980b. Suspension feeding in ciliated protozoa:feeding rates and their ecological significance. Microbial Ecology, 6(1): 13—25
Fenchel T, Jonsson P R, 1988. The functional biology of Strombidium sulcatum, a marine oligotrich ciliate(Ciliophora, Oligotrichina). Marine Ecology Progress Series,48: 1—15
Frost B W, 1972. Effects of size and concentration of food particles on the feeding behavior of the marine planktonic copepod Calanus pacificus. Limnology and Oceanography,17(6): 805—815
Gifford D J, 1985. Laboratory culture of marine planktonic oligotrichs (Ciliphora, Oligotrichida). Marine Ecology Progress Series, 23: 257—267
Gifford D P, 1981. Taphonomy and paleoecology: a critical review of archaeology's sister disciplines. Advances in Archaeological Method and Theory, 4: 365—438
Gold K, 1968. Some observations on the biology of Tintinnopsis sp. The Journal of Protozoology, 15(1): 193—194
Gold K, 1969. Tintinnida: feeding experiments and lorica development. The Journal of Protozoology, 16(3): 507—509 Gold K, 1973. Methods for growing Tintinnida in continuous culture. American Zoologist, 13(1): 203—208
Gonzalez J M, Sherr E B, Sherr B F, 1990. Size-selective grazing on bacteria by natural assemblages of estuarine flagellates and ciliates. Applied and Environmental Microbiology,56(3): 583—589
Hall J A, Barrett D P, James M R, 1993. The importance of phytoflagellate, heterotrophic flagellate and ciliate grazing on bacteria and picophytoplankton sized prey in a coastal marine environment. Journal of Plankton Research, 15(9):1075—1086
Heinbokel J F, 1978a. Studies on the functional role of tintinnids in the southern California Bight. I. Grazing and growth rates in laboratory cultures. Marine Biology, 47(2): 177—189
Heinbokel J F, 1978b. Studies on the functional role of tintinnids in the southern California Bight. II. Grazing rates of field populations. Marine Biology, 47(2): 191—197
Hollibaugh J T, Fuhrman J A, Azam F, 1980. Radioactively labeling of natural assemblages of bacterioplankton for use in trophic studies. Limnology and Oceanography, 25(1):172—181
Ichinotsuka D, Ueno H, Nakano S I, 2006. Relative importance of nanoflagellates and ciliates as consumers of bacteria in a coastal sea area dominated by oligotrichous Strombidium and Strobilidium. Aquatic Microbial Ecology, 42(2):139—147
Jakobsen H H, Hyatt C, Buskey E J, 2001. Growth and grazing on the 'Texas brown tide' alga Aureoumbra lagunensis by the tintinnid Amphorides quadrilineata. Aquatic Microbial Ecology, 23(3): 245—252
James M R, Hall J A, Barrett D P, 1996. Grazing by protozoa in marine coastal and oceanic ecosystems off New Zealand.New Zealand Journal of Marine and Freshwater Research,30(3): 313—324
Jeong H J, Kim J S, Yoo Y D et al, 2008. Control of the harmful alga Cochlodinium polykrikoides by the naked ciliate Strombidinopsis jeokjo in mesocosm enclosures. Harmful Algae, 7(3): 368—377
Jeong H J, Shim J H, Lee C W et al, 1999. Growth and grazing rates of the marine planktonic ciliate Strombidinopsis sp. on red-tide and toxic dinoflagellates. Journal of Eukaryotic Microbiology, 46(1): 69—76
Johansen P L, 1976. A study of tintinnids and other protozoa in eastern Canadian waters with special reference to tintinnid feeding, nitrogen excretion and reproduction rates. Canada:Ph.D Thesis, University of Dalhousie
Jonsson P R, 1986. Particle size selection, feeding rates and growth dynamics of marine planktonic oligotrichous ciliates(Ciliophora: Oligotrichina). Marine Ecology Progress Series,33: 265—277
Kamiyama T, 1997. Growth and grazing responses of tintinnid ciliates feeding on the toxic dinoflagellate Heterocapsacircularisquama. Marine Biology, 128(3):509—515
Kamiyama T, 2000. Application of a vital staining method to measure feeding rates of field ciliate assemblages on a harmful alga. Marine Ecology Progress Series, 197:299—303
Kamiyama T, Arima S, 2001. Feeding characteristics of two tintinnid ciliate species on phytoplankton including harmful species: effects of prey size on ingestion rates and selectivity.Journal of Experimental Marine Biology and Ecology,257(2): 281—296
Kamiyama T, Suzuki T, 2006. Lack of accumulation of paralytic shellfish poisoning (PSP) toxins in the tintinnid ciliate Favella taraikaensis feeding on the toxic dinoflagellate Alexandrium tamarense. Marine Ecology Progress Series,317: 57—65
Kamiyama T, Tsujino M, Matsuyama Y et al, 2005. Growth and grazing rates of the tintinnid ciliate Favella taraikaensis on the toxic dinoflagellate Alexandrium tamarense. Marine Biology, 147(4): 989—997
Kivi K, Setälä O, 1995. Simultaneous measurement of food particle selection and clearance rates of planktonic oligotrich ciliates (Ciliophora: Oligotrichina). Marine Ecology Progress Series, 119: 125—137
Klaveness D, 1984. Studies on the morphology, food selection and growth of two planktonic freshwater strains of Coleps sp.Protistologica, 20: 335—349
Kopylov A I, Tumantseva N I, 1987. Analysis of the contents of tintinnid food vacuoles and evaluation of their contribution to the consumption of phytoplankton production off the Peru coast. Oceanology, 27: 343—347
Lessard E J, Swift E, 1985. Species-specific grazing rates of heterotrophic dinoflagellates in oceanic waters, measured with a dual-label radioisotope technique. Marine Biology,87(3): 289—296
Modigh M, Castaldo S, Saggiomo M et al, 2003. Distribution of tintinnid species from 42° N to 43° S through the Indian Ocean. Hydrobiologia, 503(1—3): 251—262
Perez M T, Dolan J R, Rassoulzadegan F et al, 1996. Predation on marine picoplankton populations examined with an‘add-in’ approach. Journal of Plankton Research, 18(4):635—641
Pierce R W, Turner J T, 1992. Ecology of planktonic ciliates in marine food webs. Reviews in Aquatic Sciences, 6:139—181
Pitta P, Giannakourou A, Christaki U, 2001. Planktonic ciliates in the oligotrophic Mediterranean Sea: longitudinal trends of standing stocks, distributions and analysis of food vacuole contents. Aquatic Microbial Ecology, 24(3): 297—311
Rassoulzadegan F, 1978. Dimensions et taux d'ingestion des particules consommées par un Tintinnide: Favella Ehrenbergii (Clap. et Lachm.) Jörg., cilié pélagique marin.Annales de l’Institut Oceanographique, 54(1): 17—23
Rassoulzadegan F, 1982. Dependence of grazing rate, gross growth efficiency and food size range on temperature in a pelagic oligotrichous ciliate Lohmanniella spiralis Leeg.,fed on naturally occurring particulate matter. Annales de l'Institut oceanographique, Paris, 58: 177—184
Rassoulzadegan F, Etienne M, 1981. Grazing rate of the tintinnid Stenosemella ventricosa (Clap. & Lachm.) jörg. on the spectrum of the naturally occurring particulate matter from a Mediterranean neritic area. Limnology and Oceanography,26(2): 258—270
Rassoulzadegan F, Laval-Peuto M, Sheldon R W, 1988.Partitioning of the food ration of marine ciliates between pico-and nanoplankton. Hydrobiologia, 159(1): 75—88
Rivier A, Brownlee D C, Sheldon R W et al, 1985. Growth of microzooplankton: a comparative study of bactivorous zooflagellates and ciliates. Marine Microbial Food Webs,1(1): 51—60
Robertson J R, 1983. Predation by estuarine zooplankton on tintinnid ciliates. Estuarine, Coastal and Shelf Science, 16(1):27—36
Rose J M, Fitzpatrick E, Wang A et al, 2013. Low temperature constrains growth rates but not short-term ingestion rates of Antarctic ciliates. Polar Biology, 36(5): 645—659
Rychert K, 2008. Particle size selectivity of two marine ciliates-Balanion comatum Wulff and Strombidium sp.Polish Journal of Ecology, 56(2): 251—257
Seong K A, Jeong H J, Kim S et al, 2006. Bacterivory by co-occurring red-tide algae, heterotrophic nanoflagellates,and ciliates. Marine Ecology Progress Series, 322: 85—97
Sherr B F, Sherr E B, Fallon R D, 1987. Use of monodispersed,fluorescently labeled bacteria to estimate in situ protozoan bacterivory. Applied and Environmental Microbiology, 53(5):958—965
Sherr B F, Sherr E B, McDaniel J, 1991. Clearance rates of < 6 μm fluorescently labeled algae (FLA) by estuarine protozoa:potential grazing impact of flagellates and ciliates. Marine Ecology Progress Series, 69: 81—92
Sherr B F, Sherr E B, Pedrós-Alió C, 1989a. Simultaneous measurement of bacterioplankton production and protozoan bacterivory in estuarine water. Marine Ecology Progress Series, 54: 209—219
Sherr E B, Sherr B F, Fallon R D et al, 1986. Small, aloricate ciliates as a major component of the marine heterotrophic nanoplankton. Limnology and Oceanography, 31(1):177—183
Sherr E, Rassoulzadegan F, Sherr B F, 1989b. Bacterivory by pelagic choreotrichous ciliates in coastal waters of the NW Mediterranean Sea. Marine Ecology Progress Series, 55:235—240
Shimeta J, Jumars P A, Lessard E J, 1995. Influences of turbulence on suspension feeding by planktonic protozoa,experiments in laminar shear fields. Limnology and Oceanography, 40(5): 845—859
Skogstad A L, Granskog L, Klaveness D, 1987. Growth of freshwater ciliates offered planktonic algae as food. Journal of Plankton Research, 9(3): 503—512
Spittler P, 1973. Feeding experiments with tintinnids. Oikos, 15:128—132
Stoecker D K, 1984. Particle production by planktonic ciliates.Limnology and Oceanography, 29(5): 930—940
Stoecker D K, 1988. Are marine planktonic ciliates suspensionfeeders? The Journal of Protozoology, 35(2): 252—255
Stoecker D K, Evans G T, 1985. Effects of protozoan herbivory and carnivory in a microplankton food web. Marine Ecology Progress Series, 25: 159—167
Stoecker D K, Guillard R R L, 1982. Effects of temperature and light on the feeding rate of Favella sp. (ciliated protozoa,suborder Tintinnina). Annales de l'institut Oceanographique,Paris, 58: 309—318
Stoecker D K, Guillard R R L, Kavee R M, 1981. Selective predation by Favella ehrenbergii (Tintinnia) on and among dinoflagellates. Biological Bulletin, 160(1): 136—145
Strom S L, 2001. Light-aided digestion, grazing and growth in herbivorous protists. Aquatic Microbial Ecology, 23(3):253—261
Taniguchi A, Kawakami R, 1985. Feeding activity of a tintinnid ciliate Favella taraikaensis and its variability observed in laboratory cultures. Marine Microbial Food Webs, 1(1):17—34
Verity P G, 1985. Grazing, respiration, excretion, and growth rates of tintinnids. Limnology and Oceanography, 30(6):1268—1282
Verity P G, 1991. Measurement and simulation of prey uptake by marine planktonic ciliates fed plastidic and aplastidic nanoplankton. Limnology and Oceanography, 36(4): 729—750 Verity P G, Villareal T A, 1986. The relative food value of diatoms, dinoflagellates, flagellates, and cyanobacteria for tintinnid ciliates. Archiv für Protistenkunde, 131(1—2):71—84
