抗Iss抗血清抑制鸡大肠杆菌血清抗性的分析
2018-03-01曾庆华刘桂芹孙小凡郑焕芹
樊 琛,曾庆华,王 会,李 燕,刘桂芹,孙小凡,郑焕芹
(聊城大学农学院,聊城 252059)
抗Iss抗血清抑制鸡大肠杆菌血清抗性的分析
樊 琛,曾庆华,王 会,李 燕,刘桂芹,孙小凡,郑焕芹
(聊城大学农学院,聊城 252059)
iss基因是鸡大肠杆菌的毒力基因,与菌株的血清抗性有关。本研究采用GST-Iss融合蛋白免疫4~6周龄小鼠,间接ELISA检测抗血清效价,并检测鸡致病性大肠杆菌O2(O2血清型)、CVCC1553(O78血清型)菌株Iss蛋白的表达。通过体外血清抗性抑制试验及iss、ybtA、chuA基因实时荧光定量PCR,检测2株菌株的血清抗性变化及mRNA转录水平的改变。结果表明,鼠源抗Iss抗血清能够在体外试验中抑制O2、CVCC1553菌株的血清抗性,并降低iss、ybtA及chuA基因的转录,并且对不同血清型菌株均有效。由此推测,抗Iss抗血清可能通过降低血清抗性相关基因的转录,使致病性菌株的血清抗性下降。Iss蛋白可能具有制备亚单位疫苗的潜力。
抗Iss抗血清;血清抗性;转录
大肠杆菌病是由某些埃希氏大肠杆菌(Escherichia coli)的致病菌株引起的人畜共患的细菌性传染病,病型复杂,危害最大的是急性败血型。大肠杆菌的毒力是由多种毒力因子共同作用的,包括:黏附素、1型菌毛、毒素、外膜蛋白、ColV质粒、补体抗性、铁转运系统、宿主细胞表面改变因子等[1-4]。进入血流是细菌发挥其致病作用的关键一步,一旦病原菌进入血液循环,它将面对血清的抑菌和杀菌作用。血清抗性可能受荚膜抗原、脂多糖和特定外膜蛋白调节。iss基因编码的外膜蛋白(Iss)可以调节细胞表面上对补体复合体敏感的位点,导致表面排斥,使菌体具有抗血清补体溶菌能力[5-7]。但细菌仅具有抵抗血清补体杀菌作用的能力,不足以支持其在血液中的大量增殖,菌体还必须能够调整其新陈代谢以适应血液的营养环境。动物机体的血液中,游离铁的浓度是极低的,因此菌体需要具备获得铁的能力。ybtA基因和chuA基因被认为与鸡致病性大肠杆菌(Avian pathogenicEscherichia coli,APEC)的铁摄取系统有关[8-12]。
抑制病原菌的血清抗性(补体抗性),降低其在血液中的存活和增殖,可减缓大肠杆菌病的进程,尤其是减少败血症的发生。试验制备鼠源抗Iss抗血清,并探讨抗Iss抗血清对大肠埃希菌血清抗性及在血清中增殖的抑制作用及机理,可为大肠杆菌病的亚单位疫苗的研制和应用提供体外试验依据,有利于食品安全的防控。
1 材料与方法
1.1 菌株来源 大肠杆菌O2为东北农业大学预防兽医教研室赠送,经中国兽医药品监察所鉴定的强毒株,血清型为O2,170 mL/L甘油于-70℃冻存保存;大肠杆菌CVCC1553购自中国兽医药品监察所,血清型O78,与O2菌株iss基因序列一致。经实验室早前雏鸡致死试验和鸡胚致死试验检测,2株菌株的致死率表现一致,雏鸡致死率为100%,鸡胚致死率为70%,均为强致病性菌株。经血清抗性试验检测,2株菌株均为血清抗性菌株。
1.2 试剂 LB肉汤、麦康凯琼脂购自青岛高科技园海博生物技术有限公司;SDS-PAGE蛋白电泳试剂盒购自中科瑞泰(北京)生物科技有限公司;羊抗鼠IgG H&L (HRP) 购自Abcam;RNA酶抑制剂及dNTP Mixture均购自TaKaRa公司;胶回收试剂盒购自中科瑞泰(北京)生物工程有限公司;细胞细菌总RNA提取试剂盒购自天根生化科技(北京)有限公司;SYBR®Green Realtime PCR Master Mix、反转录酶购自东洋纺(上海)生物科技有限公司。
1.3 鼠抗血清的制备 将0.1 mg纯化的Iss融合蛋白与等量氢氧化铝佐剂乳化后,选取4~6周龄小鼠进行腹腔、颈后皮下以及腹股沟皮下注射,实验室常规免疫。四免7 d后加强免疫,3 d后取血。于-20℃保存备用,临用前56℃ 30 min灭活补体[1,2,8]。
1.4 间接ELISA测抗血清效价 纯化的融合蛋白用包被液稀释至10 μg/mL,每孔100 μL。一抗进行倍比稀释;二抗1:3000稀释。采用常规间接ELISA方法进行,OPD显色[1,5]。
1.5 间接ELISA检测菌体Iss蛋白的表达 新鲜培养的菌体分别以全菌体的方式或超声裂解的方式,用包被液稀释至108个/mL,每孔100 μL。一抗1:3000稀释;二抗1:3000稀释。采用常规间接ELISA方法进行,OPD显色[1,5]。
1.6 凝集试验 抗Iss抗血清用生理盐水倍比稀释为1:10、1:20、1:40、1:80、1:160、1:320,等量加入9.97×109个/mL的菌液,观察凝集现象。
1.7 抗Iss抗血清对菌株血清抗性抑制作用的检测 按照1:100接菌于LB中,按1:1000加入56℃ 30 min灭活抗血清及对照组阴性血清,37℃培养至对数期。取1 mL菌液10 000×g离心,用0.6 mol/L NaCl溶液洗2次。0.9%生理盐水重悬混匀,进行倍比稀释。在0.1 mL菌液中加入0.5 mL生理盐水后,与0.4 mL新鲜血清混合,混合物于37℃温育。分别于0、2 h取样,涂板计数,37℃培养18 h,计活菌数[1,3]。按下式计算:
试验组血清抗性: Δlg=lg(2 h)-lg(0 h)
对照组血清抗性: Δlg=lg(2 h)-lg(0 h)
抑制作用:ΔΔlg=Δlg(试验组)-Δlg(对照组)
同时于0、2 h取样,进行实时荧光定量PCR检测。
1.8 实时荧光定量PCR RNA提取及反转录按试剂盒说明书和实验室常规方法进行;q P C R中,iss基因上游引物5'-GCCGCTCTGGCAA TGCTTATTACA-3',下游引物5'-TCCTTTGGTG TTACTGCTGTCGGT-3';ybtA基因上游引物5'-CCGATTCGAGAGCATTACCC-3',下游引物5'-CAACAGCAGTGGGAGTCGAT-3';chuA基因上游引物5'-CAGATAACAAAAGGAGCAAGGC-3',下游引物5'-CTGACGATAATACTCACCGCC-3';GAPDH基因上游引物5'-CATCGTTTCCAACG CTTCCT-3',下游引物5'-ACCTTCGATGATGC CGAAGTT-3'。反应条件:95℃预变性3 min;95℃变性10 s,56℃退火30 s,39个循环。结果用Ct表示[13]。
2 结果
2.1 间接ELISA及凝集试验 经间接ELISA检测,抗血清的效价为1:60 000。当采用全菌体包被进行ELISA检测时,抗血清及阴性血清的待测样孔ΔOD492<0.050、P/N<2.1,皆为阴性。在凝集试验中,各稀释浓度均未出现凝集现象。但在超声裂解菌体后包被ELISA板的试验中,2株菌株均为Iss蛋白表达阳性,见表1。
结果显示,融合蛋白免疫小鼠产生了相应的抗体,但全菌体包被的间接ELISA及凝集试验皆为阴性,超声裂解菌体后包被的间接ELISA呈强阳性反应,表明抗血清与全菌体直接结合的作用较弱。间接ELISA检测菌株Iss时,应预先采用超声等手段裂解细胞。

表1 间接ELISA、血清抗性抑制试验结果Table 1 Indirect ELISA and inhibition results
2.2 抗Iss抗血清对菌株血清抗性抑制作用 抗血清组及对照阴性血清组培养至对数期的菌体,与新鲜血清混合后,于0、2 h取样计数。抗血清组及阴性血清组菌体与新鲜血清混合0 h的活菌数相近,而2 h后活菌数差异明显,2株菌株的抗血清组活菌数明显小于阴性血清组,结果用△△lg表示,见表1。本研究中平板计数的误差通常≤0.200。采用95%置信区间分析,上限为0.176,下限为-0.158。2株菌株的△△lg均小于下限(-0.158),可认为抗血清组及阴性血清组菌体在新鲜血清培养2 h后的活菌数有明显差异,即抗血清组菌体的血清抗性受到抑制。
2.3 实时荧光定量PCR结果 抗血清组及对照阴性血清组培养至对数期的菌体,与新鲜血清混合后0、2 h分别取样,采用实时荧光定量PCR检测iss、ybtA及chuA基因的mRNA转录水平,看家基因为GAPDH,结果用△Ct表示,见表2。
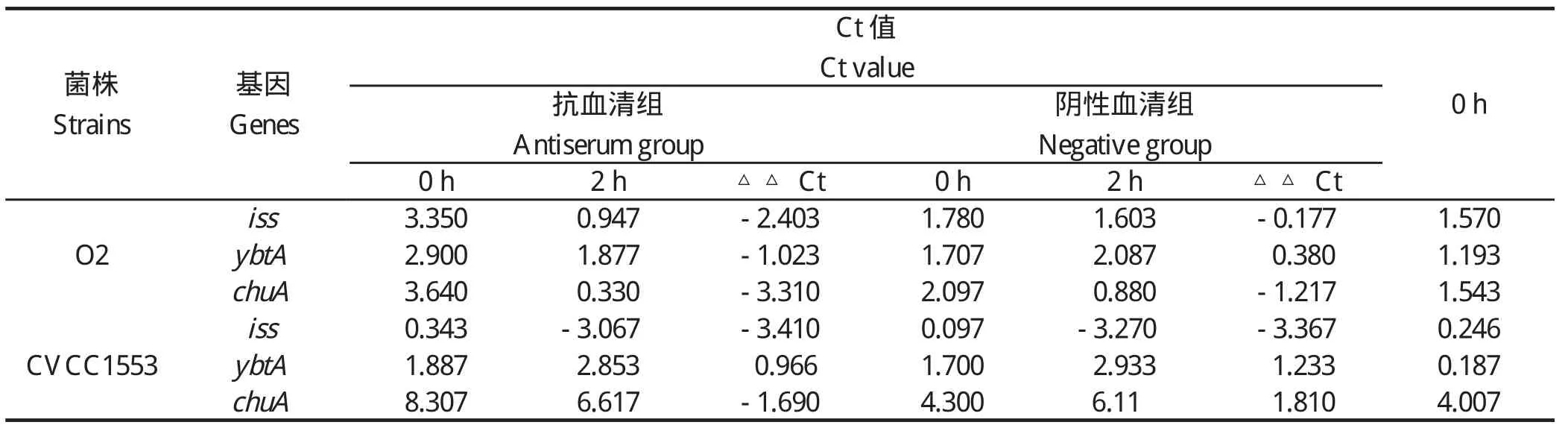
表2 实时荧光定量PCR结果Table 2 Quantitative real-time PCR result
由表2所示,混合后0 h时抗血清组的△Ct均大于阴性血清组(△△Ct>0),表明细菌与抗血清培养后,抗血清对iss、ybtA及chuA基因的mRNA转录水平均产生抑制。洗去抗血清并与含补体的新鲜血清温育2 h后,抗血清组和阴性血清组的菌体iss及chuA基因的△Ct值均比0 h时下降,即mRNA转录水平在新鲜血清刺激下升高。抗血清组iss及chuA基因的△△Ct均小于阴性血清组,结果显示,在去除相应抗血清后,试验组iss、ybtA及chuA基因呈现补偿性转录调节。
3 讨论
血清对大肠杆菌具有抑菌作用和杀菌作用,可能受荚膜抗原、脂多糖和特定外膜蛋白等因素调节。抑制菌株的血清抗性或/和降低菌株在血液中的增殖,可减缓大肠杆菌病的进程,尤其是减少败血症的发生。iss基因编码的外膜蛋白被认为是通过调节细胞表面上对补体膜攻击复合体敏感位点,导致表面排斥,使菌体具有抗血清补体溶菌能力[5-7]。本试验中,在添加补体之前,抗血清和阴性血清组的活菌数无显著差异,但添加补体后,2组菌株的活菌数出现明显差异。结果显示,抗血清并没有直接杀死细菌,也不抑制其增殖。Iss蛋白是细菌外膜蛋白,推测抗血清是通过减少Iss蛋白在菌体表面的表达导致菌体血清抗性下降,进而有利于补体发挥杀菌作用,因此在加入含补体的新鲜血清后,抗血清组的活菌数明显下降。采用间接ELISA及凝集试验分析菌株Iss蛋白表达水平,超声裂解菌体后的间接ELISA结果表明,O2、CVCC1553菌株均为Iss蛋白表达阳性,但全菌体包被的间接ELISA和凝集反应为阴性,表明抗血清与全菌体直接结合的反应较弱。Iss是外膜蛋白,出现阴性结果可能是由于Iss暴露在菌体表面的结合位点较少,或与融合蛋白免疫产生的抗血清结合较弱,从另一方面也说明,抗血清直接与Iss蛋白结合并导致菌体死亡或增殖抑制的可能性较低。由于Iss蛋白锚定在细胞膜上,而不是游离在细胞质中,即使采用超声裂解等手段,也不能确定所有Iss蛋白均完全暴露,因此不利于间接ELISA的定量分析,仅适于定性分析。
ybtA基因及chuA基因被认为与鸡致病性大肠杆菌的铁采集系统有关,可调节菌体在血清中的铁获得能力,有利于菌体在血清中的增殖[8-12]。在实时荧光定量PCR中,抗血清对iss、ybtA及chuA基因的mRNA转录水平均产生抑制。提示抗Iss抗血清可以通过抑制相关毒力基因的转录,进而发挥其免疫保护作用。结合ELISA、凝集试验及血清抗性试验结果,推测菌体在增殖分裂过程中受到抗血清的影响,抑制了基因的转录,使菌体对血清环境敏感性提高。在洗去抗血清后,抗血清组的iss及chuA基因的mRNA转录水平在新鲜血清刺激下升高,而ybtA基因转录水平下降。iss、ybtA及chuA都是与细菌在血清中存活增殖有关的基因,在多项研究中表现出受血清刺激转录升高的现象[7-12]。但也有研究显示1株O1血清型菌株在血清刺激下,相关基因的转录未升高的现象[13],这可能与试验条件及菌株差异有关。本试验中抗血清组iss、ybtA及chuA基因mRNA转录水平的上调幅度大于对照组,呈现补偿性转录调节,提示机体在整个感染期都需要抗血清持续的干预,若抗体水平不足可能导致免疫保护作用下降,这可能会限制Iss蛋白作为亚单位疫苗在免疫防制中的应用。大肠杆菌病主要引起雏鸡的大量死亡,对30日龄以上的鸡致死率低。如试验中的菌株O2、CVCC1553雏鸡致死率为100%,对30日龄以上的鸡攻毒时在观察期间仅产生明显腹泻,致死率仅为20%和0%(相关数据未发表)。因此,在鸡的幼龄期提高免疫时效或阶段性免疫可能是解决此问题的途径。另外,虽然本试验中Iss融合蛋白免疫产生的抗血清对血清型不同的2株菌(血清型分别为O2、O78)都产生了血清抗性抑制,体现出亚单位疫苗的优势,但大肠杆菌病受多毒力因子控制,Iss蛋白作为亚单位疫苗的潜力还需要更多试验证明。
抗Iss抗血清不能直接起到杀菌作用,但可在细菌增殖分裂期间通过抑制iss、ybtA及chuA等基因的转录,降低菌株的血清抗性和菌体在血清中的增殖能力,起到免疫保护作用。
[1]樊琛, 刘桂芹, 王亚君, 等. Iss蛋白在鸡源大肠杆菌不同毒力菌株中的检测[J]. 畜牧与兽医, 2010, 42(2): 71-73.
[2]樊琛, 王亚君, 李一经.iss基因与鸡大肠杆菌毒力相关性的分析[J]. 畜牧兽医学报, 2005, 36(1): 58-61.
[3]Johnson T J, Giddings C W, Horne S M,et al. Location of in-creased serum survivalgene and selected virulence traits on a conju-gative R plasmid in an avianEscherichia coliisolate[J]. Avian Dis, 2002, 46(2): 342-352.
[4]Nolan L K, Giddings C W, Home S M,et al. Complement resistance, as determined by viable count abd cytan entic methods and its association with the presence of iss and the virulence of avianEscherichia coli[J]. Avian Dis,2002,46(2): 386-392.
[5]樊琛, 刘桂芹, 王宇, 等. 鸡源致病性大肠杆菌iss基因原核表达产物的免疫保护作用[J]. 畜牧与兽医, 2010,42(11): 84-86.
[6]Mohamed M A, Shehata M A, Rafeek E. Virulence Genes Content and Antimicrobial Resistance inEscherichia colifrom Broiler Chickens[J]. Vet Med Int, 2014, 195189.
[7]Mellata M, Dho-Moulin M, Dozois C M,et al. Role of virulence factors in resistance of avian pathogenicEscherichia colito serum and in pathogenicity[J]. Infect Immun, 2003, 71(1): 536-540.
[8]Salehi T Z, Derakhshandeh A, Tadjbakhsh H,et al.Comparison and phylogenetic analysis of theissgene in two predominant avian pathogenicE. coliserogroups isolated from avian colibacillosis in Iran[J]. Res Vet Sci,2013, 94(1): 5-8.
[9]Skyberg J A, Johnson T J, Nolan L K. Mutational and transcriptional analyses of an avian pathogenicEscherichia coliColV plasmid[J]. BMC Microbiol, 2008,8(1): 24.
[10]Oh J Y, Kang M S, Yoon H,et al. The embryo lethality ofEscherichia coliisolates and its relationship to the presence of virulence-associated genes[J]. Poult Sci,2012, 91(2): 370-375.
[11]Radwan I A, Salam H S H, Abd-Alwanis S A A,et al.Frequency of some virulence associated genes among multidrug-resistantEscherichia coliisolated from septicemic broiler chicken[J]. Int J Adv Res, 2014, 2(12):867-874.
[12]Salari S, Salehi T Z, Fasaei B N,et al. Construction of an iss deleted mutant strain from a native avian pathogenicEscherichia coliO78: K80 andin vitroserum resistance evaluation of mutant[J]. Iranian J Vet Med, 2014, 8: 1-8.
[13]Li G, Tivendale K A, Liu P,et al. Transcriptome Analysis of Avian PathogenicEscherichia coliO1 in Chicken Serum Reveals Adaptive Responses to Systemic Infection[J]. Infect Immun, 2011, 79(5): 1951-1960.
MECHANISM OF ANTI-ISS SERUM AGAINST AVIAN PATHOGENIC ESCHERICHIA COLI
FAN Chen, ZENG Qing-hua, WANG Hui, LI Yan, LIU Gui-qin, SUN Xiao-fan, ZHENG Huan-qin
(Agricultural College of Liaocheng University, Liaocheng 252059, China)
The iss gene is the virulence gene of avian E. coli, which is related to its serum resistance. However, there are few reports regarding immune protection of the Iss protein. In the present study, the GST-Iss fusion protein was used to immunize 4-6 week-old mice.The indirect ELISA was used to detect the titer of the antiserum and the expression of Iss protein in pathogenic E. coli strains CVCC1553 and O2. The changes of serum resistance and mRNA transcription level were detected in these two strains as detected using in vitro serum resistance inhibition and real-time fl uorescence quantitative PCR assay for iss, ybtA, chuA genes. The results concluded that the anti-Iss serum inhibited the serum resistance of O2 and CVCC1553 strains in vitro and reduced the transcription of iss, ybtA and chuA genes in different serotype strains. The mechanism for the anti-Iss serum may be due to its role in decreasing the serum resistance of pathogenic bacteria by reducing the transcription of the serum resistance related genes. In addition, Iss protein may have the potential for development of the subunit vaccine.
Anti-Iss serum; serum resistance; transcription
S852.612
A
1674-6422(2018)01-0043-05
2017-02-28
国家自然科学基金青年项目(31302128);聊城大学博士科研启动基金(31805)
樊琛,女,博士,主要从事食品营养、食品安全方向的研究
樊琛,E-mail:fanchen7810@126.com
