检测创伤弧菌两种毒力基因的环介导等温扩增检测方法的建立
2018-03-01别闯南白雪瑞李恭贺
别闯南,王 权,白雪瑞,凌 娇,李恭贺,蒋 蔚
(1. 广西大学,南宁530005;2. 中国农业科学院上海兽医研究所,上海 200241)
检测创伤弧菌两种毒力基因的环介导等温扩增检测方法的建立
别闯南1,王 权2,白雪瑞2,凌 娇2,李恭贺1,蒋 蔚2
(1. 广西大学,南宁530005;2. 中国农业科学院上海兽医研究所,上海 200241)
为建立快速检测致病性创伤弧菌两种毒素的环介导等温扩增(loop-mediated isothermal ampli fi cation,LAMP)方法,分别以创伤弧菌溶血素A基因(hemolysin gene A,HA)和多重毒素(repeats in toxin,RTX)毒力基因的保守序列作为靶序列设计内、外引物。通过肉眼观察白色沉淀初步判断检测结果,通过琼脂糖电泳最终确定检测结果。LAMP检测创伤弧菌的两种基因的灵敏度都达到10 CFU/mL。特异性结果表明致病性创伤弧菌的结果为阳性,而其他几种常见弧菌和食源菌检测结果为阴性。在人工模拟样品检测中,LAMP结果显示,采用水煮法提取DNA,从样品处理到报告结果耗时1.5 h,鱼肉中创伤弧菌的检出限为1×102CFU/g(RTX)和1×104CFU/ g(HA);采用同样方法提取 DNA进行普通PCR,其检出限为1×103CFU/g(RTX)和1×104CFU/ g(HA),耗时4 h。结果表明,本研究建立的LAMP方法检测创伤弧菌两种毒力基因时具有灵敏度高、特异性强、方法简便等优点,适用于食品和养殖业中的现场快速检测。
环介导等温扩增;溶血素A基因;多重毒素;创伤弧菌
创伤弧菌(Vibrio vulnificus)是19世纪70年代发现并分离鉴定的一种嗜盐性革兰性阴性菌,菌体短小,呈稍弯曲的逗点状,是弧菌中的一种低度嗜盐菌,并且具有很高的致病性,多存在于近海、河口和水生生物中[1]。创伤弧菌可从牡蛎等海产品中分离得到,通过食入生的海产品,或通过人体表面伤口或者是游泳者吞咽海水,创伤弧菌可进入人体内繁殖,并且在极短的时间内出现败血症和蜂窝组织炎、出血性大疮,一旦出现败血症,具有很高的致死率,在海产品食源性疾病中,占据较高的比重[2]。美国佛罗里达海滨爆发“吃人肉细菌”,致死率超过30%,引起人们的极大关注,而所谓的“吃人肉细菌”就是创伤弧菌[3,4]。感染创伤弧菌后,会引发呕吐、发烧、腹泻、低血压、肿胀和疼痛等症状,尤其容易创口感染,一旦感染创伤弧菌,患者体表伤口附近的肌肉组织将被细菌“杀死和吃掉”,免疫系统功能低下的人(如肝肾功能不全者)最容易感染这种致命的细菌,创伤弧菌严重影响人们的身体健康[5]。目前,对创伤弧菌的检测方法主要有直接病原分离培养、ELISA、PCR 法、荧光定量 PCR法等[6]。
环介导恒温扩增技术(loop-mediated isothermal amplification,LAMP)是日本学者Notomi建立的一种适用于基层诊断的恒温核酸扩增技术[7,8]。因其具有操作简单,对仪器设备要求低,高特异性、高灵敏度的优势[9,10],短短十年多,LAMP就在国内外各种细菌、病毒、寄生虫等病原体检测、食品的安全检查及进出口快速诊断中取得广泛引用,并得到各界的广泛认可[11]。近几年,LAMP也逐渐被应用到水产品弧菌的检测中,主要是对副溶血弧菌、霍乱弧菌的检测,而对创伤弧菌的应用报道较少。
本研究利用创伤弧菌(ATCC27562)溶血素A基因(hemolysin gene A,HA)和多重毒素(repeats in toxin,RTX)毒力基因的保守序列作为靶序列,分别设计内、外引物,建立了LAMP检测方法。利用一台水浴锅或恒温箱就能实现对创伤弧菌的检测,结果只需通过肉眼观察是否形成白色浑浊即可快速判断。
1 材料与方法
1.1 材料
1.1.1 主要仪器和试剂 DK-8D型电热恒温水槽(购自上海精宏实验室设备公司;PCR仪(Eppendorf AG22331)购自德国Eppendorf公司;核酸电泳仪(DYY-6D型)购自北京六一仪器厂;凝胶成像系统(Gel DocTM EZ Imager)购自美国Bio-Rad公司;离心机(H1650-W型)购自长沙湘仪离心机仪器公司;蛋白胨、酵母提取物购自xoid公司;细菌DNA提取试剂盒购自上海天根公司;DNA Marker购自大连宝生物公司;2×PCR Taq Mix购自广东东盛生物科技有限公司;其余试剂均为国产分析纯。
1.1.2 菌株 创伤弧菌ATCC27562和副溶血弧菌ATCC17802购自美国菌种保藏中心(American type culture collection,ATCC);副溶血弧菌、溶藻弧菌、拟态弧菌、沙门氏菌、大肠杆菌、金黄色葡萄球菌、肠球菌和猪链球菌购自中国医学微生物菌种保藏管理中心;霍乱弧菌1304由疾控中心惠赠。
1.1.3 样品 经国标法检测为创伤弧菌阴性的对虾和贝类购自当地农贸市场。
1.2 方法
1.2.1 引物设计 在GenBank上获得创伤弧菌ATCC27562的HA基因和RTX毒力基因序列,分别利用DNAstar软件分析其保守区域,再根据引物设计原则,用Primer Explorer V4(http://primerexplorer.jp/elamp4.0.0/index.html)软件分析并设计4条引物,分别是外引物F3、B3,内引物FIP(F1+F2)、BIP(B1+B2)。HA的扩增位置为93~311区域,共218 bp目的基因片断;RTX的扩增位置为216~430区域,共214 bp目的基因片断。引物的名称和具体序列见表1和表2。每条引物在基因组中具体的位置如图1所示。引物均由上海英潍捷基贸易有限公司合成。
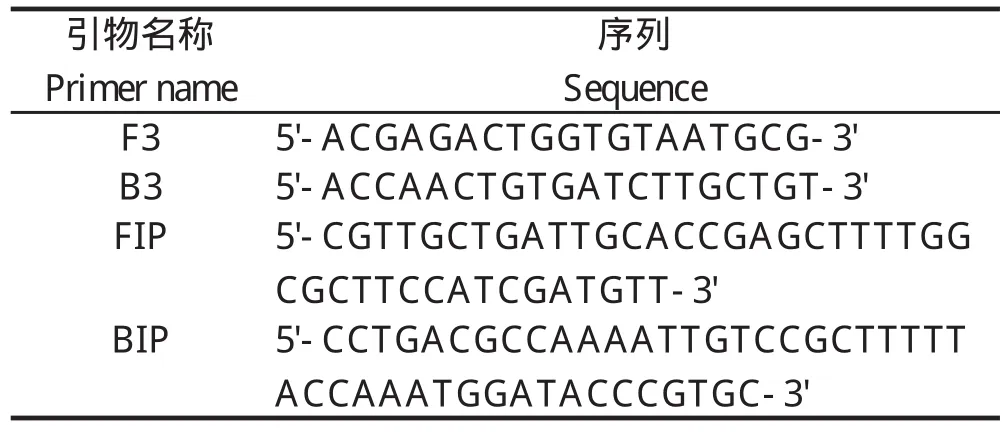
表1 HA基因的LAMP 引物Table 1 LAMP primers of HA gene

表2 RTX基因的LAMP 引物Table 2 LAMP primers of RTX gene

图1 用于检测HA和RTX的LAMP引物设计Fig.1 Design of the LAMP primers for HA and RTX detection
1.2.2 细菌的培养及DNA的提取 创伤弧菌接种于新鲜3%NaCl的LB培养基中,37℃、200 r/min培养12 h,调节菌液浓度并测OD600值。当OD600为0.2时,用无菌生理盐水进行10倍梯度稀释至10-9,然后分别快速涂3%NaCl的LB固体平板, 测定其活菌数平均为1.0×108CFU/mL;同时从每个稀释度的菌液中取1 mL用水煮法提基因组DNA,作为LAMP和PCR灵敏度检测的模板。水煮法提DNA步骤:取1 mL菌液于EP管中,10 800×g离心2 min,弃上清;加100 μL灭菌水,充分混匀;-20℃冰浴45 min,沸水浴10 min,再冰浴10 min;最后8000×g离心4 min,收集上清,保存于-20℃备用;试剂盒法(用于人工布菌试验):按照试剂盒使用说明书提取,保存于-20℃备用。
1.2.3 LAMP反应体系 根据韩先干等[11]研究LAMP的基础上进行优化,总体系25 μL:dNTP(2.5 mmol/L;Tiangen)4 μL、10× ThermoPol buffer 2.5 μL、内引物(FIP和BIP,10 mmol/L)各4 μL、外引物(F3和B3,10 mmol/L)各1 μL、betaine(5 mmol/L;Sigma,St. Louis,MO)5.5 μL、2 μLDNA模板,经94℃,5 min,再冰激20 s后加入1 μL(8 U)的BstDNA聚合酶(M0275;New England Biolabs,Boston,MA),最后将反应管置于63℃水浴锅内,作用60 min,同时以无菌水为模板作为阴性对照。取出反应管,10 000×g离心2 min,目测反应管中液体浑浊度变化,判断是否发生反应,同时取5 μL进行1%琼脂糖凝胶进行电泳验证。
1.2.4 LAMP特异性和灵敏度试验 将实验室保存的创伤弧菌和9种非创伤弧菌(沙门氏菌、大肠杆菌、金黄色葡萄球菌、肠球菌、猪链球菌、霍乱弧菌、溶藻弧菌、拟态弧菌、副溶血弧菌)复苏后,调节菌液OD600值达0.2时,水煮法分别提其DNA,进行HA和RTX的LAMP特异性检测。按照1.2.2方法中的水煮法提取DNA并进行HA和RTX的LAMP灵敏度检测。
1.2.5 PCR法检测 用表1和表2中的外引物(F3和B3)进行普通PCR,并与LAMP检测结果进行比较。PCR总体系25 μL:2×PCR反应缓冲液12.5 μL、外引物(F3/ B3,10 mmol/L)各1μL、ddH2O 9.5 μL、模板DNA 1 μL。反应条件:94℃预变性3 min;94℃变性45 s,55℃退火55 s,72℃延伸90 s,进行30个循环;72℃延伸10 min。
1.2.6 人工布菌试验 在当地农贸市场采集对虾和贝类,无菌剪碎并混合,取2 g肉糜加3%NaCl溶液至2 mL并研磨至匀浆,用试剂盒提取其基因组,按1.2.4中HA和RTX的两条外引物(F3和B3)进行常规PCR。检测结果显示没有目的片段,即该对虾和贝类体内无创伤弧菌。将对虾和贝类无菌条件下制备成1 mL含1 g肉糜的匀浆液8份,加入已倍比稀释的创伤弧菌, 混匀并用3%NaCl溶液进行10倍系列稀释至10-8,终浓度为每克肉糜中108~101CFU,分别用试剂盒提取其基因组。作为模拟样品进行LAMP和PCR灵敏度检测,分析其最低检测限。
2 结果
2.1 LAMP 反应的肉眼可视结果 检测HA的反应结果如图1A中所示,管1未发生LAMP反应,无白色沉淀产生;管2发生LAMP反应,产生明显的白色沉淀。检测RTX的反应结果如图1B中所示,管1未发生LAMP反应,无白色沉淀;管2发生LAMP反应,并产生明显的白色沉淀。

图1 创伤弧菌LAMP方法结果观察Fig.1 Visual observation of ampli fi cation products for Vibrio vulnif i cus by LAMP method
2.2 LAMP和 PCR检测创伤弧菌灵敏度的比较 LAMP检测RTX基因时,菌液稀释至10-6(101CFU/mL)时出现明显条带,而稀释至10-7(100CFU/mL)时未出现明显条带,即检测创伤弧菌RTX基因的灵敏度达10 CFU/mL ;LAMP检测HA基因时,菌液稀释至10-6(101CFU/mL)时出现明显条带,而稀释至10-7(100CFU/mL)时未出现明显条带,即检测创伤弧菌HA基因的灵敏度达10 CFU/mL,相应的沉淀如图2中A、B所示。常规PCR检测RTX基因时,菌液稀释至10-6(10 CFU/mL)时未出现明显条带,即检测创伤弧菌RTX基因的灵敏度达102CFU/mL;检测HA基因时,菌液稀释至10-6(10 CFU/mL)时未出现明显条带,即检测创伤弧菌HA基因的灵敏度达102CFU/mL(图3中A、B、C、D)。

图2 LAMP检测基因组的浑浊度观察Fig.2 Turbidity observation of LAMP method for genomic DNA
2.3 LAMP检测创伤弧菌特异性试验 按照1.2.2中的水煮法提取DNA,进行RTX和HA的LAMP特异性检测,结果分别如图4中A、B所示,除了创伤弧菌,9种其他细菌如沙门氏菌、大肠杆菌、金黄色葡萄球菌、肠球菌、猪链球菌、霍乱弧菌、溶藻弧菌、拟态弧菌、副溶血弧菌均未检测到条带,说明建立的LAMP检测方法具有很好的特异性。
2.4 LAMP和PCR检测人工污染食品样品中创伤弧菌的检出限比较 人工污染对虾和贝类的创伤弧菌的浓度为108~101CFU/g,按1.2.5方法处理样品提取DNA,分别进行LAMP和常规PCR检测RTX的检出限试验。对虾贝类匀浆液加入创伤弧菌后进行10倍系列稀释,LAMP方法在其稀释至10-6倍(102CFU/g)时能出现条带,而稀释到10-7倍 (101CFU/g )时不能检测到创伤弧菌,不出现条带,所以LAMP检测RTX基因的最低检测限为102CFU/g;PCR方法在匀浆液稀释到10-5倍(103CFU/g)时能出现条带,而稀释到10-6倍(102CFU/g)时不能检测到创伤弧菌,不出现沉淀, 所以PCR检测RTX基因的检测限为103CFU/g。

图3 LAMP灵敏度检测结果Fig.3 The results of sensitivity test of LAMP

图4 LAMP特异性试验结果Fig.4 The results of speci fi city test of LAMP
A:LAMP对基因组RTX特异性检测结果; B:LAMP对HA特异性检测结果; 1:DNA分子量标准(DL15 000); 2:创伤弧菌; 3:沙门氏菌; 4:大肠杆菌; 5:金黄色葡萄球菌; 6:肠球菌; 7:猪链球菌; 8:霍乱弧菌; 9:溶藻弧菌; 10:拟态弧菌; 11:副溶血弧菌
A:The results of LAMP speci fi city test for genomic RTX; B:The results of LAMP speci fi city test for genomic HA; 1:DNA Marker(DL15 000); 2:Vibrio vulnif i cus; 3:Salmonella; 4:Escherichia coli; 5:Staphylococcus aureus; 6:Enterococcus; 7:Streptococcus suis; 8:Vibrio cholera; 9:Vibrio alginolyticus; 10:Vibrio mimicus; 11:Vibrio parahemolyticus
以同样的方法分别检测LAMP和常规PCR对HA的检出限。LAMP方法在对虾贝类匀浆液稀释到10-4倍(104CFU/g)时能出现条带,而稀释到10-5倍(103CFU/g)时不能检测到创伤弧菌,不出现条带,所以LAMP检测HA基因的检测限为104CFU/g;PCR方法在对虾贝类匀浆液稀释到10-4倍(1.0×104CFU/g)时能出现条带,而稀释到10-5倍(103CFU/g)时不能检测到创伤弧菌, 不出现沉淀,所以PCR检测HA基因的检测限为104CFU/g 。
3 讨论
创伤弧菌广泛分布于海洋及海产品中,患病者一般误食或经伤口感染,临床病症主要表现为胃肠炎及伤口化脓坏死性病变,易引发败血症[13-15],故成为全球重要的海洋致病细菌,与副溶血弧菌、霍乱弧菌并列为造成人类致病的三大弧菌。随着人们对海产品需求的提高及海上运动的追求,接触并感染创伤弧菌的病例越来越多。1996~2010年,美国累计报道1600余例,病死率达30%[16]。2003~2010年台湾地区报道近100例,病死率高达60%[17]。
目前用于检测创伤弧菌的方法有鉴定培养基、形态学等方法。这些传统方法虽然不需要昂贵的仪器,但是耗时长、特异性和灵敏性太差[17]。荧光定量PCR检测、常规PCR检测和ELISA检测虽然特异性和敏感性强,但是需要专业人员操作,需要的设备仪器比较昂贵,因此不利于在基层检测进行推广。为了人们食用海产品的安全性,需要建立一种快捷、简便、实用性强的方法来满足检测需求。

图5 LAMP和PCR方法对人工污染食品中创伤孤菌的灵敏度检测结果Fig.5 The sensitivity of LAMP and PCR methods for the detection of isolated bacteria in arti fi cially contaminated food
LAMP是一种恒温的核酸扩增技术,不但具有较好的特异性和灵敏度[18],而且不需要十分昂贵的设备仪器,也不需要专业的技术人员进行操作,通过眼睛即可直接观察结果。LAMP最大的优点在于检测时间短,能够大大地降低检测时间和成本[19]。本研究以创伤弧菌(ATCC27562)HA基因和RTX毒力基因的保守序列作为靶序列,分别设计内、外引物,建立快速检测创伤弧菌的方法,并将两段基因的检测结果与普通PCR检测结果进行比较,结果显示其灵敏度不低于普通PCR检测,同时比PCR耗时短。特异性检测结果显示建立的LAMP具有很高的特异性,并且可以直观地通过眼睛观察沉淀达到检测的结果。目的菌DNA通过水煮法即可获得,避免了购买DNA提取试剂盒,进一步降低了检测成本。
本研究建立的LAMP检测具有简便、省时、特异性高、灵敏度好、判断结果简便、成本低等优点,有利于在基层进行推广应用。通过进一步的研究摸索,LAMP可成为检测海产品安全的一种常规方法。
[1]Han F F,Wang F,Ge B. Detecting potentially virulentVibrio vulnificusstrains in raw oysters by quantitative loop-mediated isothermal amplification[J]. Appl Environ Microbiol, 2011, 77(8): 2589-2595.
[2]Surasilp T, Longyant S, Rukpratanporn S,et al. Rapid and sensitive detection ofVibrio vulnificusby loop-mediated isothermal amplification combined with lateral flow dipstick targeted torpoSgene[J]. Mol Cell Probes, 2011,25(4): 158-163.
[3]Han F F,Ge B. Quantitative detection ofVibrio vulnificusin raw oysters by real-time loop-mediated isothermal amplification[J]. Int J Food Microbiol, 2010, 142(1-2):60-66.
[4]Ren C H,Hu C Q,Luo P,et al. Sensitive and rapid identification ofVibrio vulnificusby loop-mediated isothermal amplification[J]. Microbiol Res, 2008, 164(5):514-521.
[5]Han F F,Ge B. Evaluation of a loop-mediated isothermal amplification assay for detectingVibrio vulnificusin raw oysters[J]. Foodborne Pathog Dis, 2008, 5(3): 311-320.
[6]Nemoto J,Kojima T, Kusaba K,et al. Rapid detection ofVibrio vulnificususing a loop-mediated isothermal amplification method[J]. Kansenshogaku Zasshi, 2008,82(5): 407-413.
[7]Fall J, Chakraborty G, Kono T,et al. Establishment of loop-mediated isothermal amplification method (LAMP)for the detection ofVibrionigripulchritudoin shrimp[J].FEMS Microbiol Lett, 2008, 288(2): 171-177.
[8]孙敏. 创伤弧菌LAMP检测方法的建立6[A]//中国畜牧兽医学会. 动物检疫学分会2010年学术年会论文集[C]. 中国畜牧兽医学会, 2010, 5: 12-17.
[9]徐义刚, 李苏龙, 杨君宏, 等. 水产品中创伤弧菌DNA环介导恒温扩增快速检测方法的建立及初步应用[J]. 中国生物工程杂志, 2010(6): 96-102.
[10]张静, 施慧, 谢建军, 等. 利用LAMP法快速检测致病性哈维氏弧菌[J]. 上海海洋大学学报, 2010, 19(5): 601-607.
[11]王耀焕, 王瑞娜, 周前进, 等. 环介导等温扩增联合横向流动试纸条快速检测创伤弧菌检测方法的建立[J]. 生物技术通报, 2014(6): 81-87.
[12]薛超波, 许镇坚, 黄朱梁, 等. 环介导等温扩增技术检测创伤弧菌方法的建立与应用[J]. 食品科学, 2012, 33(20):262-264.
[13]李桂满, 侯敏, 颜军, 等. 环介导等温扩增技术检测副溶血性弧菌的优势[J]. 职业与健康, 2013, 29(5): 573-574+579.
[14]薛超波, 黄朱梁, 孙瑛, 等. 海产品中创伤弧菌实时浊度LAMP检测方法的建立[J]. 中国预防兽医学报, 2013,35(11): 912-915.
[15]张丽娜, 王明义, 杨小蕾, 等. 海洋创伤弧菌LAMP快速诊断方法的建立与评价[J]. 国际检验医学杂志, 2016,37(5): 577-579+582.
[16]周顺, 高志鑫, 张敏. 创伤弧菌和副溶血弧菌双重LAMP检测方法的建立及初步应用[J]. 中国兽医学报, 2016,36(11): 1875-1881.
[17]S Zhou,Z X Gao, M Zhang,et al. Development of a quadruplex loop-mediated isothermal amplification assay for field detection of four Vibrio species associated with fish disease[J]. Springer Plus, 2016, 5(1): 1104.
[18]Zhou Q J,Wang L, Chen J,et al. Development and evaluation of a real-time fluorogenic loop-mediated isothermal amplification assay integrated on a microfluidic disc chip (on-chip LAMP) for rapid and simultaneous detection of ten pathogenic bacteria in aquatic animals[J]. J Microbiol Methods, 2014, 104: 26-35.
[19]Jones J L,Hara-Kudo Y, Krantz J A,et al. Comparison of molecular detection methods forVibrio parahaemolyticusandVibrio vulnificus[J]. Food Microbiol, 2012, 30(1):105-111.
ESTABLISHMENT OF LOOP MEDIATED ISOTHERMAL AMPLIFICATION FOR DETECTION OF TWO VIRULENT GENES OF VIBRIO VULNIFICUS
BIE Chuang-nan1, WANG Quan2, BAI Xue-rui2, LING Jiao2, LI Gong-he1, JIANG Wei2
(1.Guangxi University,Nanning530005, China; 2.Shanghai Veterinary Research Institute, CAAS, Shanghai 200241,China)
In the present study, we developed and validated a loop-mediated isothermal ampli fi cation (LAMP) assay for detection of two toxins genes of Vibrio vulnif i cus. The inner and outer primers of LAMP were designed based on the conserved sequences of V. vulnif i cus hemolysin gene A (HA) and repeats-in-toxin (RTX) virulent gene. The detection method was preliminary evaluated by formation of the white deposition and con fi rmed through agarose gel electrophoresis. The sensitivity of this detection method was 10 CFU/mL for two LAMP genes of V. vulnif i cus. This method showed good speci fi city to V. vulnif i cus as it did not react with any other bacterial species. The bacterial DNA was extracted by water-boiling method and it took 1.5 h from sample processing to obtaining results. The detection limits were 102CFU/g for RTX and 104CFU/g for HA. On the contrast, the detection limit of common PCR method was 103CFU/g for RTX and 104CFU/g for HA and it took 4 h to complete test. This LAMP method may be used for on-site diagnostics of V. vulnif i cus in the food and agricultural industries.
Loop-mediated isothermal ampli fi cation; hemolysin gene A; repeats-in-toxin; Vibrio vulnif i cus
S852.613
A
1674-6422(2017)06-0048-07
2017-04-11
上海市科学技术委员会科研计划项目(17140900400)
别闯男,男,硕士,主要从事病原微生物的防控技术研究
蒋蔚,E-mail:jiangwei@shvri.ac.cn;李恭贺,E-mail:ligonghe@163.com
