环形泰勒虫TRAP-A蛋白酵母双杂交诱饵质粒的构建与鉴定
2018-03-01田占成独军政高闪电杜晓悦于瑞明刘光远罗建勋
田占成,独军政,高闪电,杜晓悦,于瑞明,刘光远,罗建勋,殷 宏
(中国农业科学院兰州兽医研究所 家畜疫病病原生物学国家重点实验室,兰州730046)
环形泰勒虫TRAP-A蛋白酵母双杂交诱饵质粒的构建与鉴定
田占成,独军政,高闪电,杜晓悦,于瑞明,刘光远,罗建勋,殷 宏
(中国农业科学院兰州兽医研究所 家畜疫病病原生物学国家重点实验室,兰州730046)
为了筛选出环形泰勒虫TRAP蛋白在虫体入侵媒介蜱唾液腺过程中相互作用蜱源蛋白, 构建了能够用于酵母双杂交筛选系统的重组诱饵质粒pGBKT7-TRAP-A。本研究以环形泰勒虫裂殖体为材料,根据环形泰勒虫TRAP-A结构域的基因序列设计引物,经过PCR扩增获得576 bp的基因片段,将其连接到线性化载体 pGBKT7上。经双酶切鉴定和序列分析以及重组诱饵质粒在酵母双杂交系统中的自激活、细胞毒性及其表达情况检测,结果显示,本研究成功构建了酵母双杂交重组诱饵质粒pGBKT7-TRAP-A,构建的诱饵质粒对Y2HGold酵母菌无自激活活性和细胞毒性,且构建的诱饵质粒pGBKT7-TRAP-A可以在Y2HGold酵母菌内正确表达。表明所构建的诱饵质粒pGBKT7-TRAP-A可以用于筛选小亚璃眼蜱唾液腺酵母双杂交cDNA文库,获得可能与环形泰勒虫TRAP-A蛋白相互作用的蜱源蛋白。
酵母双杂交系统;环形泰勒虫;TRAP-A蛋白;自激活;细胞毒性
血小板反应相关粘附蛋白(thrombospondin—related adhesive protein,TRAP)是一种Ⅰ型跨膜蛋白,由胞外的血小板结合蛋白样结构域(thrombospodin-like domain,TSR)和或整合素A样结构域(integrin A-like domain)、跨膜区和胞质尾部结构域(cytoplasmic tail domain,CTD)组成[1,2],是由多基因编码的大家族,属于微线体蛋白。结构上与弓形虫MIC2[3]和球虫Etp100[4]相似,TRAP家族成员的胞质部分通过醛缩酶连接肌动马达复合物,辅助虫体滑行运动入侵宿主细胞。TRAP家族蛋白具有种属和发育阶段的特异性,与顶复门原虫入侵宿主细胞的特异性密切相关[5]。TRAP胞外结构的多样性使其可以入侵不同的组织和细胞[6]。
不同寄生虫入侵的宿主不同,可能与细胞表面受体有关,也可能与不同寄生虫表达的TRAP家族蛋白成员的差异有关。疟原虫在媒介体内发育成熟过程中,疟原虫动合子CTRP(TRAP家族成员之一)与层粘连蛋白结合,有助于疟原虫动合子入侵蚊子中肠上皮细胞;子孢子表面的TRAP蛋白介导疟原虫入侵肝细胞的同时,与蚊子唾液腺的saglin结合有助于入侵蚊子唾液腺。疟原虫裂殖子阶段MTRAP蛋白是滑行运动马达复合体的组成成员之一,帮助虫体滑行运动入侵红细胞[7]。与疟原虫在媒介体内的生活史类似,环形泰勒虫在媒介蜱的中肠和唾液腺的上皮细胞要完成配子生殖和孢子生殖两个阶段,在这一过程中,涉及到了环形泰勒虫子孢子和动合子两个发育阶段识别媒介蜱唾液腺和中肠表面分子的关键环节。因此,研究环形泰勒虫子孢子和动合子入侵相关蛋白与蜱源互作蛋白的相互作用分子机制,对于了解环形泰勒虫在媒介蜱体内发育成熟分子机制至关重要。
在已注释的环形泰勒虫裂殖子基因组和裂殖体蛋白组中,可以找出与疟原虫子孢子入侵粘附素TRAP的同源基因。因此,环形泰勒虫入侵粘附素TRAP蛋白可能在入侵媒介蜱唾液腺过程中发挥重要作用。为了弄清楚环形泰勒虫TRAP蛋白在入侵媒介蜱唾液腺过程中的作用机制,本文构建了环形泰勒虫TRAP基因整合素结构域(TRAP-A)的酵母双杂交系统诱饵质粒,旨在为今后从小亚璃眼蜱唾液腺酵母双杂交文库中筛选出环形泰勒虫TRAP-A互作的蜱源蛋白提供物质基础。
1 材料和方法
1.1 实验材料 真核表达载体pGBKT7、酵母菌株Y2HGold、pGEM-T Easy载体均由中国农业科学院兰州兽医研究所家畜疫病病原生物学国家重点实验室保存;X-α-Gal及各种酵母培养基和转化所需试剂均购自Clontech公司;Agarose Gel DNA Purification Kit、X-Gal、限制性内切酶、DL2000 DNA Marker、Taq DNA聚合酶、酵母蛋白抽提液、Agarose Gel DNA回收试剂盒均购自宝生物工程(大连)有限公司;碱性磷酸酶标记的山羊抗兔IgG、ECL显色液购自Sigma公司;其他试剂均为分析纯。
1.2 引物的设计与合成 参照GenBank中已发表的TRAP基因(XP_952976)序列,利用Premier Primer 5.0软件设计用于扩增TRAP基因整合素结构域(TRAP-A)的表达引物,分别在上下游引物引入EcoR I和BamH I酶切位点,委托南京金斯瑞生物工程有限公司进行合成。上游引物TRAP-A-F:5'-GCGAATTCATGGACTTTGTAGTAATGCTCG-3'(EcoR I酶切位点);下游引物TRAP-A-R:5'-TCGGATCCTTAGTCGACCAACTCTTGCAG -3'(BamH I酶切位点)
1.3 TRAP-A基因的克隆和序列分析 离心收集环形泰勒虫裂殖体感染的淋巴细胞,利用TRIzol试剂提取环形泰勒虫裂殖体的总RNA。经1%凝胶电泳鉴定合格后用M-MLV Reverse Transcriptase Kit将其反转录为cDNA,利用合成的特异性引物和裂殖体cDNA模板进行PCR扩增。PCR扩增产物用1%琼脂糖凝胶电泳进行分析后,将目的片段经Agarose Gel DNA Purification Kit回收纯化后克隆到pGEM-T Easy载体,再转化为大肠杆菌JM109感受态细胞。采用常规方法提取质粒,PCR鉴定后,挑取3~5个阳性克隆送至南京金斯瑞生物工程有限公司进行测序,测序片段经对比分析后进行拼接,鉴定正确的阳性克隆命名为pGEM-T-TRAP-A。应用DNAStar软件将TRAP-A基因及其推导的氨基酸序列与GenBank中的序列进行比对分析。
1.4 pGBKT7-TRAP-A诱饵质粒的构建与鉴定 将上述鉴定的阳性质粒pGEM-T-TRAP-A用限制性内切酶EcoR I和BamH I双酶切后,定向插入经同样双酶切的线性化载体pGBKT7中,转化为大肠杆菌JM109感受态细胞。重组诱饵质粒经PCR和双酶切鉴定正确后,送至南京金斯瑞生物工程有限公司进行测序,将含有正确插入TRAP-A基因的诱饵质粒命名为pGBKT7-TRAP-A。
1.5 诱饵质粒pGBKT7-TRAP-A转化酵母Y2HGold参照Yeast maker yeast transformation system protocol制备酵母Y2HGold菌株感受态细胞,取制备好的酵母感受态细胞50μL加入5μL处理过的Yeast maker carrier DNA和100 ng的高质量重组质粒,再加入500 μL PEG/LiAc轻轻混匀,于30℃水浴孵育30 min,再加入20 μL二甲基亚砜(DMSO),轻轻混匀后置于42℃水浴孵育15 min后,室温1000×g离心15 s,弃去上清,沉淀用1 mL的YPD Plus重悬,然后室温1000×g离心15 s,弃去上清,用1 mL的0.9%NaCl溶液重悬,铺于营养缺陷型培养基SD/-Trp,30℃温箱倒置培养3~5 d;待白色克隆长出,挑取直径在2~3 mm的单菌落进行PCR扩增,以验证诱饵质粒是否转化成功。
1.6 pGBKT7-TRAP-A对报告基因自激活的检测 将转化有诱饵质粒pGBKT7-TRAP-A和空载体pGBKT7的酵母Y2HGold分别接种于营养缺陷型培养基SD/-Trp/X-α-Gal、SD/-Ade/-Trp/X-α-Gal、SD/-His/-Trp/X-α-Gal、SD/-Trp/-Leu/X-α-Gal,30℃倒置培养3~5 d,观察酵母Y2HGold在各培养基上的生长情况和菌落颜色变化,检测pGBKT7-TRAP-A对报告基因有无自激活作用。
1.7 pGBKT7-TRAP-A对酵母Y2HGold的毒性检测 从SD/-Trp培养基上分别挑取已转化成功的pGBKT7-TRAP-A和空载体pGBKT7的酵母Y2HGold单克隆接种于5 mL SD/-Trp/Kan(含卡那霉素50 μg/μL)液体培养基中,30℃、250 r/min震荡培养15~20 h,测定培养物的OD600值。若OD600<0.8,说明pGBKT7-TRAP-A对酵母Y2HGold可能有毒性;若OD600≥0.8,说明没有毒性。
1.8 重组诱饵蛋白TRAP-A的表达情况检测 挑取带有空载体质粒pGBKT7和诱饵质粒pGBKT7-TRAP-A的酵母菌落至1.5 mL的离心管中,加入1 mL预冷的超纯水,4℃、8000×g离心2 min。弃上清,加入100 μL Yeast Protein Extraction Regent混匀,置于30℃水浴孵育30 min,4℃、12 000×g离心5 min;弃上清,加入25 μL PBS重悬即为提取酵母总蛋白。蛋白加loading buffer混匀经SDS-PAGE电泳后转移到NC膜上,用5%的脱脂奶粉封闭过夜,孵育的一抗为原核表达重组蛋白免疫新西兰大白兔制备的抗TRAP-A多克隆抗体;二抗为碱性磷酸酶标记的抗兔IgG,最后用ECL避光显色。
2 结果
2.1 TRAP-A基因的PCR扩增及诱饵质粒的构建和鉴定 以环形泰勒虫裂殖子cDNA为模板,经PCR扩增后,获得1条576 bp左右的目的条带(图1),PCR产物经纯化后克隆到pGEM-T-Easy载体上送南京金斯瑞生物工程有限公司测序分析,确定为环形泰勒虫TRAP-A基因片段;构建好的诱饵质粒pGBKT7-TRAP-A经EcoR I和BamH I双酶切,得到7300 bp左右的载体条带和576 bp左右的目的条带(图2)。测序结果显示,TRAP-A基因按正确的编码阅读框插入到pGBKT7载体多克隆位点,且碱基未产生突变,说明诱饵质粒pGBKT7-TRAP-A构建成功。
2.2 诱饵质粒pGBKT7-TRAP-A转化酵母Y2HGold在SD/-Trp缺陷性培养基上,可见含有诱饵质粒pGBKT7-TRAP-A的白色克隆长出。随机挑取4个白色单克隆进行菌落PCR验证,经电泳检测,在576 bp附近得到很亮的目的条带,表明诱饵质粒pGBKT7-TRAP-A成功转化到酵母Y2HGold细胞中(图3)。
2.3 pGBKT7-TRAP-A对报告基因自激活的检测 转化诱饵质粒pGBKT7-TRAP-A的酵母Y2HGold在SD/-Trp/X-α-Gal平板上可见白色菌落生长,而在SD/-Ade/-Trp/X-α-Gal、SD/-His/-Trp/X-α-Gal和SD/-Trp/-Leu/X-α-Gal平板上未见菌落生长,其生长特性与空载体pGBKT7转化的酵母Y2HGold一致(图4)。表明pGBKT7-TRAP-A在酵母细胞中对报告基因Ade、His、Leu和LacZ没有自激活作用,可用于后续的酵母双杂交的筛选工作。
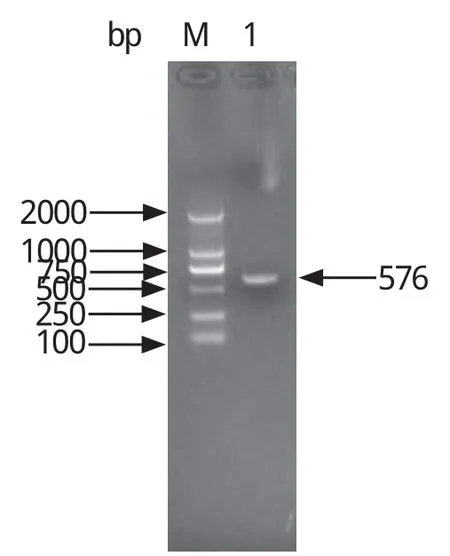
图1 环形泰勒虫TRAP-A基因的PCR扩增Fig.1 PCR ampli fi cation of Theileria annulataTRAP-A gene
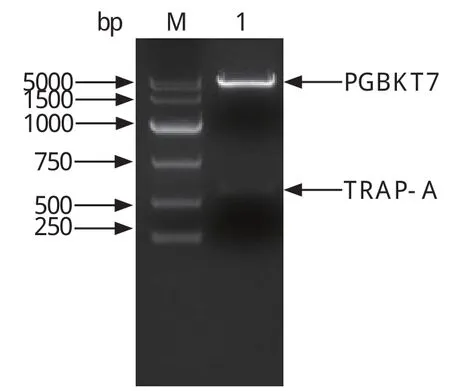
图2 诱饵质粒pGBKT7-TRAP-A酶切鉴定分析Fig.2 Analysis of pGBKT7-TRAP-A by enzymatic digestion
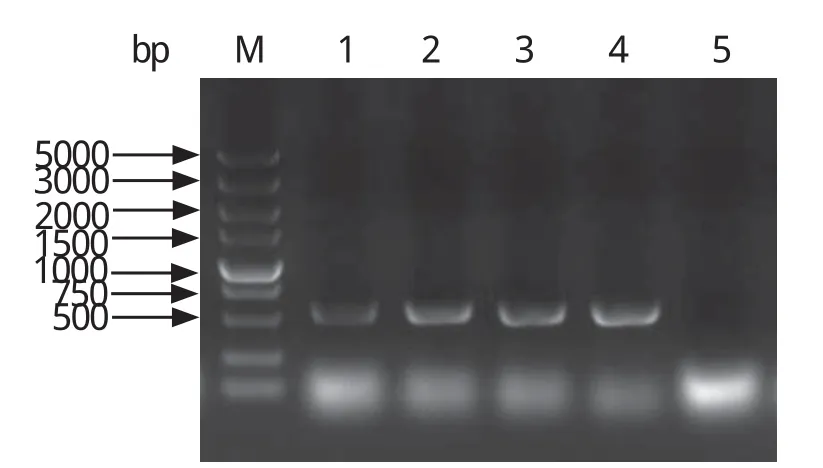
图3 诱饵质粒pGBKT7-TRAP-A的菌落PCR鉴定Fig.3 Identi fi cation of bait plasmids pGBKT7-TRAP-A by PCR
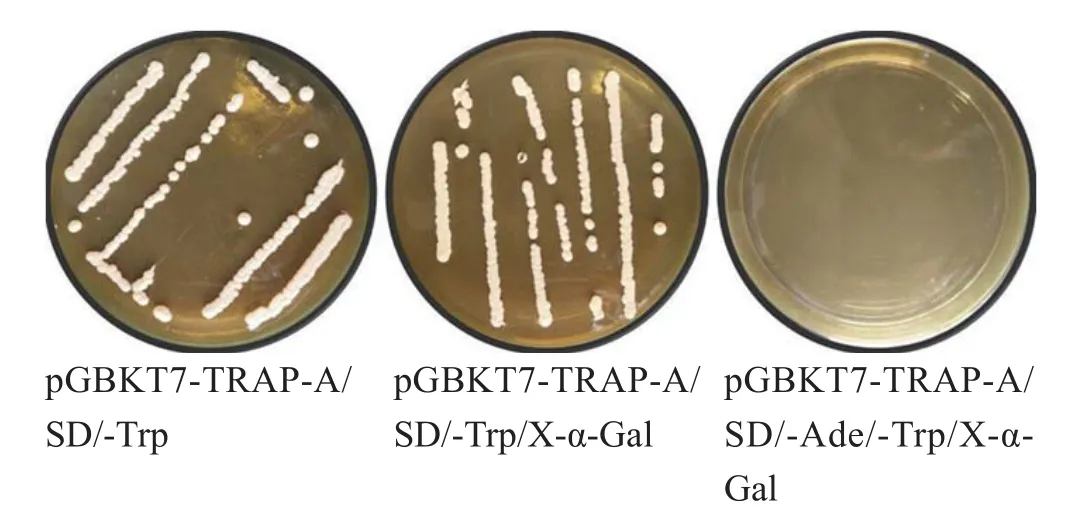
图4 白色菌落Fig.4 White bacterial colony

表1 诱饵质粒pGBKT7-TRAP-A对报告基因自激活的检测Table 1 Autoactivity test of bait plasmid pGBKT7-TRAP-A to the reporter gene
2.4 pGBKT7-TRAP-A对酵母Y2HGold的毒性检测 从SD/-Trp培养基上分别挑取已转化成功的pGBKT7-TRAP-A和空载体pGBKT7的酵母Y2HGold单克隆菌株接种于5 mL SD/-Trp/Kan(含卡那霉素50 μg/μL)液体培养基中,30℃、250 r/min震荡培养18 h,测定其OD600值分别为2.185和2.216,重复2次的OD600值均大于0.8。说明pGBKT7-TRAP-A对酵母Y2HGold的生长没有毒性。
2.5 pGBKT7-TRAP-A在Y2HGold酵母细胞中的表达检测 酵母细胞蛋白提取液经SDS-PAGE电泳后转移到NC膜上,Western blot检测空载体pGBKT7和诱饵质粒pGBKT7-TRAP-A转化的酵母菌,结果表明含pGBKT7空载体的酵母蛋白无特异反应条带;转化诱饵质粒pGBKT7-TRAP-A的酵母蛋白可见1条特异性反应条带, 蛋白分子量大小为40 kDa,与预期结果一致,说明诱饵质粒pGBKT7-TRAP-A在酵母Y2HGold细胞中成功表达(图5)。
3 讨论
顶复门原虫入侵宿主细胞是一个复杂的过程,包括粘附、入侵、宿主细胞内形成纳虫空泡、虫体在纳虫空泡内发育以建立寄生生活,在此过程中一些保守存在的关键性蛋白参与了虫体与宿主细胞的粘附和侵入。顶复门原虫微线体蛋白TRAP在寄生虫与宿主细胞互作方面有较为深入的研究,且在疟原虫入侵蚊虫唾液腺过程中发挥重要的生理功能,与疟原虫在媒介体内生活史相似的环形泰勒虫相比,尽管在环形泰勒虫裂殖子基因组和裂殖体蛋白组中可以找到与其他顶复体原虫同源的TRAP家族成员,且探索了巴贝斯虫裂殖子TRAP蛋白在入侵宿主红细胞过程中的作用机制[8,9],但由于缺乏对泰勒虫在媒介蜱体内发育成熟过程的系统研究,以及在环形泰勒虫子孢子或动合子体外培养技术和反向遗传技术尚有一定困难,限制了环形泰勒虫TRAP蛋白在环形泰勒虫入侵媒介蜱唾液腺过程中的作用研究。
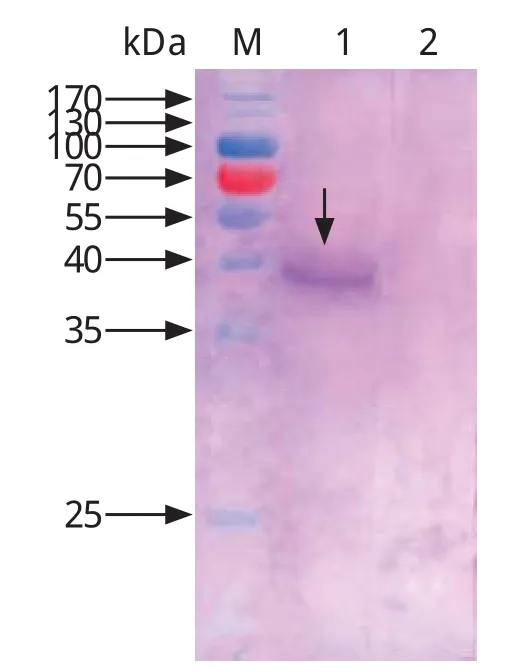
图5 pGBKT7-TRAP-A在酵母细胞中的表达检测Fig.5 The expression of pGBKT7-TRAP-A in yeast cells Y2HGold
本研究以环形泰勒虫入侵粘附素结构域TRAP-A为诱饵蛋白,为了获得TRAP-A的互作蜱源蛋白,选择使用高效传统的酵母双杂交技术来进行筛选。酵母双杂交系统是Fields和Song[10]于1989年建立的基于酵母转录因子GAL4的特性,分析蛋白质-蛋白质相互作用的基因系统。该系统既可以研究两种已知蛋白的相互作用,又可用于研究已知蛋白和未知蛋白的相互作用,而且允许直接克隆未知蛋白的基因。酵母双杂交系统是近年来广泛应用的一种研究蛋白质之间相互作用的强有力方法[11-13],已成为目前研究活细胞内蛋白质相互作用的常用和最有利的工具[12]。
酵母双杂交系统能够被很好应用的前提是构建符合酵母双杂交系统筛选特性的诱饵质粒。为筛选与环形泰勒虫TRAP-A蛋白相互作用的蜱源互作蛋白,本研究构建了用于酵母双杂交系统筛选用的诱饵质粒pGBKT7-TRAP-A,经过PCR、双酶切鉴定和测序比对,证实了插入多克隆位点的TRAP-A基因序列的正确性。通过将转化诱饵质粒的Y2HGold酵母菌培养在不同营养缺陷型培养基上,观察其生长情况和颜色变化,直观地判断诱饵载体对报告基因没有自激活作用,从而排除了假阳性的可能。同时转化诱饵质粒的Y2HGold酵母菌在SD/-Trp/Kan液体培养基中能大量繁殖,说明表达的诱饵蛋白对Y2HGold酵母菌生长无毒性作用。使用实验室已有的抗TRAP-A兔血清对pGBKT7-TRAP-A诱饵质粒在Y2HGold酵母菌株中的蛋白进行了Western blot检测,结果获得了与预期重组TRAP-A蛋白分子量大小相近的特异条带,表明pGBKT7-TRAP-A诱饵质粒在Y2HGold酵母菌中能够稳定表达诱饵蛋白。
本研究构建的pGBKT7-TRAP-A诱饵质粒产生的蛋白对Y2HGold酵母菌的生长无细胞毒性,对Y2HGold酵母菌自带的报告基因无自激活作用,且在Y2HGold酵母菌中能够表达诱饵蛋白。因此可以利用TRAP-A作为诱饵蛋白,为后续利用酵母双杂交技术从小亚璃眼蜱唾液腺酵母文库中筛选与环形泰勒虫TRAP-A蛋白相互作用的蜱源蛋白,探索环形泰勒虫入侵媒介蜱唾液腺及环形泰勒虫在媒介蜱体内的发育成熟分子机制提供了一定的物质基础。
[1]Morahan B J, Wang L, Coppel R L. No TRAP, no invasion[J]. Trends Parasitol, 2009, 25(2): 77-84.
[2]Bhanot P, Frevert U, Nussenzweig V,et al. Defective sorting of the thrombospondin-related anonymous protein(TRAP) inhibits Plasmodium infectivity[J]. Mol Biochem Parasitol, 2003, 126(2): 263-273.
[3]Wan K L, Carruthers V B, Sibley L D,et al. Molecular characterisation of an expressed sequence tag locus ofToxoplasma gondiiencoding the micronemal protein MIC2[J]. Mol Biochem Parasitol, 1997, 84(2): 203-214.
[4]Tomley F M, Clarke L E, Kawazoe U,et al. Sequence of the gene encoding an immunodominant microneme protein ofEimeria tenella[J]. Mol Biochem Parasitol,1991, 49(2): 277-288.
[5]Baum J, Richard D, Healer J,et al. A conserved molecular motor drives cell invasion and gliding motility across malaria life cycle stages and other apicomplexan parasites[J]. J Biol Chem, 2006, 281(8): 5197-5208.
[6]Matuschewski K, Nunes A C, Nussenzweig V,et al. Plasmodium sporozoite invasion into insect and mammalian cells is directed by the same dual binding system[J]. EMBO J. 2002,21(7): 1597-1606.
[7]Malpede B M, Tolia N H. Malaria adhesins: structure and function[J]. Cell Microbiol, 2014, 16(5): 621-631.
[8]Goo Y K, Ueno A, Terkawi M A,et al. Actin polymerization mediated byBabesia gibsonialdolase is required for parasite invasion[J]. Exp Parasitol. 2013,135(1): 42-49.
[9]Terkawi M A, Ratthanophart J, Salama A,et al. Molecular characterization of a newBabesia bovisthrombospondinrelated anonymous protein (BbTRAP2)[J]. PLoS One,2013, 8(12): e83305.
[10]Fields S, Song O. A novel genetic system to detect protein-protein interactions[J]. Nature, 1989, 340(6230):245-246.
[11]Gietz R D, Woods R A. Screening for protein-protein interactions in the yeast two-hybrid system[J]. Methods Mol Biol, 2002, 185: 471-486.
[12]Coates P J, Hall P A. The yeast two-hybrid system for identifying protein-protein interactions[J]. J Pathol, 2003,199(1): 4-7.
[13]钱小红, 贺福初. 蛋白质组学: 理论与方法[M]. 北京:科学出版社, 2003: 242-249.
CONSTRUCTION AND IDENTIFICATION OF THE PGBKT7-TRAP-A PLASMID
TIAN Zhan-cheng, DU Jun-zheng, GAO Shan-dian, DU Xiao-yue, YU Rui-ming, LIU Guang-yuan,LUO Jian-xun, YIN Hong
(State Key Laboratory of Veterinary Etiological Biology, Lanzhou Veterinary Research Institute, CAAS, Lanzhou 730046, China)
In the present study, the bait plasmid of pGBKT7-TRAP-A were constructed to screen the interactive proteins derived from the salivary glands of Hyalomma anatolicum anatolicum with Theileria annulata TRAP-A protein. The ampli fi cation primers were designed based on the sequence of TRAP-A adhensive domain of annulata merozoite. The fragment with the length of 576 bp was ampli fi ed and ligated into the pGBKT7vector. The pGBKT7-TRAP-A plasmid was con fi rmed using enzyme digestion and sequence analysis and then transformed into yeast cells Y2HGold. The TRAP-A fusion protein was expressed and examined for its autoactiviation and toxicity to yeast growth. Results indicated that the TRAP-A fusion protein was expressed in yeast cells Y2HGold without interruption of cellular growth. In addition, the recombinant protein had no transcription activity of reporter genes or toxicity to the yeast cells Y2HGold.Therefore, the pGBKT7-TRAP-A plasmid may be used for the screening of the interactive proteins from Hyalomma anatolicum anatolicum in yeast two-hybrid system.
Yeast two-hybrid system; Theileria annulata; TRAP-A Protein; autoactiviation; toxicity
S852.723
A
1674-6422(2017)06-0060-06
2017-03-13
国家自然科学基金(31201899)
田占成,男,副研究员,预防兽医学专业
殷宏,E-mail:yinhong@cass.cn; 田占成,E-mail:tianzhancheng@caas.cn
