链球菌2型对恩施黑猪和美系纯种长白猪的致病性研究
2018-03-01刘国平杨小林胡利群谭仕旦赵书红
刘国平,刘 健,杨小林,胡利群,谭仕旦,赵书红
(1.长江大学动物科学学院,荆州434025;2.生猪健康养殖协同创新中心,武汉430070;3.恩施职业技术学院,恩施445000)
链球菌2型对恩施黑猪和美系纯种长白猪的致病性研究
刘国平1,2,刘 健1,杨小林1,2,胡利群1,2,谭仕旦3,赵书红2
(1.长江大学动物科学学院,荆州434025;2.生猪健康养殖协同创新中心,武汉430070;3.恩施职业技术学院,恩施445000)
猪链球菌(Streptococcus suis,S.suis)病是一种能够引起人和多种动物发病的重要人畜共患病,其中以2型(SS2)流行最广,致病力最强,不仅可引起猪脑膜炎、关节炎、心内膜炎、败血症、肺炎和突然死亡,还可以感染人并致其死亡,严重地威胁着人类的公共卫生安全。本研究对恩施黑猪和美系长白猪进行猪链球菌2型的攻毒试验,观察其病理损害,进而探讨其致病机制。20头猪分A、B、C、D四个组,A组为 5头恩施黑猪,B组为5头美系长白猪,C、D两组作为空白对照组。A、B组感染猪链球菌2型菌株,攻毒后都出现出现体温升高、跛行和神经症状,但A组恩施黑猪更加明显,出现3头死亡,解剖后各组织器官病变也比美系长白猪明显。通过对病理器官组织切片、细菌学检验、细菌计数等结果,恩施黑猪对链球菌2型的易感性比美系长白猪更强,从而证实了猪链球菌2型对鄂西黑猪的致病性比美系长白猪更强。
猪链球菌2型;恩施黑猪;美系长白猪;致病机理
猪链球菌病(Streptococcus suis,S.suis)是一种重要的人兽共患病,根据其荚膜抗原的差异,猪链球菌分为 35 个血清型(1~34型和 1/2 型)。其中猪链球菌 2型(Strptococcus suisserotype 2,SS2)被认为是猪链球菌35个血清型(1~34型和1/2型)中分布最广、致病性最强的一个血清型[1]。SS2感染人之后可以引起人的化脓性关节炎、脑膜炎、心内膜炎和中毒性休克综合症等[2]。1998 年、2005 年分别在我国江苏海安县和四川省资阳市暴发两次猪链球菌病。不仅造成生猪死亡,引起养殖户巨大经济损失,还导致人感染及死亡,严重地威胁着人类的公共卫生安全[3]。
猪链球菌2型的毒力因子较为复杂,溶菌酶释放蛋白(muramidase-released protein,MRP)、胞外因子(extracellular factor,EF)、血凝素、溶血素haemolysin(猪溶素suilysin)及多糖夹膜(capsularpolysaccharide)、44 kDa蛋白、IgG结合蛋白、纤毛、粘着素等各种细菌组分,都被认为是毒力因子[4-6]。然而,这些成分在猪链球菌2型致病机制中的实际作用有待研究。
通过系统的流行病学监测发现,猪链球菌通常与猪繁殖与呼吸综合征病毒混合感染,发病率和死亡率有逐年上升趋势,给养猪业可造成极大地损失[7]。有研究显示地方品种猪对疾病的抵抗力比外来品种猪要强[8-10]。鄂西黑猪(恩施黑猪)是湖北省西部山区“南型黑猪”的总称[11]。随着养猪业集约化的发展,我国许多猪场从国外大量引种,其中新美系是养殖户主要引进的种猪。新美系长白猪具有体型丰满、生长速度快、杂交效果显著和瘦肉率高的特点[12,13],受到广大养猪企业的欢迎。
国内外学者在猪链球菌的标准化动物模型方面作了大量工作,无菌仔猪、各种小鼠、家兔等被试用,但由于要求条件高、价格昂贵,或发病不规律等而受到局限[14,15]。有鉴于此,本试验对地方代表品种猪恩施黑猪及外来品种美系长白猪进行致病性研究,对试验过程中的临床指标、病理学表现、致病性及致死性、炎性因子的表达等进行监测,探讨上述两种猪对链球菌2型的易感性和先天性免疫机可能存在的差异。
1 材料与方法
1.1 菌株 猪链球菌2型山东分离株[4]由长江大学动物科学学院分离鉴定并保存。
1.2 试剂及实验动物 TSA、TSB购自上海生工公司,培养基按说明书制备;生化鉴定用试剂购自杭州天河微生物有限公司;猪链球菌2型高免血清由长江大学动物科学学院制备并保存[5]。选取30日龄纯种恩施黑猪及纯种美系长白猪。纯种恩施黑猪(♂)由长江大学试验猪场提供;美系纯种长白猪(♂)购自宜昌正大种猪场。恩施黑猪和美系纯种长白猪各10头,在21日龄时购回,使用无抗饲料饲喂。恩施黑猪及长白猪在30日龄开展动物实验前,均重为10 kg,差异不具有统计学意义。
1.3 实验动物选择 选择临床表现健康,采食量正常的21日龄猪。购猪及试验前用灭菌拭子采集鼻腔、扁桃体样本检测SS2病原为阴性,同时对颈静脉采血,用ELISA方法检测其抗SS2抗体均为阴性。
1.4 菌种的复苏与菌液的制备 室温下解冻菌种,无菌条件下用接种环挑取少许菌种,以分区划线法接种在TSA平板上,37℃恒温培养24 h。眼观复苏菌种在TSA平板上的菌落大小、边缘整齐度、湿润度、隆起度、表面光滑度、颜色等。挑选单个可疑菌落作标记后,挑取少许按常规方法进行革兰氏染色(革兰氏阳性菌呈蓝紫色,革兰氏阴性菌呈红色),观察革兰氏染色后细菌在显微镜下的状态。取镜检后确认的细菌按常规方法接种于TSA平板中,37℃恒温培养24 h备用。挑取单菌落接种TSB培养基中,37℃培养18 h。各菌平板法计数后,调整菌液浓度至1×109CFU/mL,备用。
1.5 实验猪的感染与临床观察 将20头猪分A、B、C、D 4个组,A组为5头恩施黑猪,B组为5头美系长白猪,C组为5头恩施黑猪,D组为5头美系长白猪,分别饲养在独立的栏中。攻毒前测量每头猪的体温。取1.4中制备好的菌液,对A、B两组采用颈部肌肉注射,每头注射4 mL(计4×109CFU),C、D两组不注射作为对照组。攻毒后,保障充足的无抗饲料和饮水,每天观察猪的临床表现如饮食情况、体温变化、跛行和神经症状等。每4 h测量全部猪的直肠温度。
1.6 病料采集与处理 猪死亡后立即解剖、拍照,无菌采取其肝脏、脾脏、心血、脑脊液、胃大小弯水肿液、肠系膜淋巴结等,将这些器官分别放入液氮罐和甲醛中固定。当死亡猪少于2只时,随机挑选3只未死实验猪在感染后人工处死,进行病理学及组织病理学观察以及细菌学检验。液氮罐样本进行炎性因子测定。
1.7 免疫器官的细菌计数 取肝脏、脑、肺脏、肾脏称重后按10 mL/g加灭菌生理盐水充分研磨,进行10倍系列稀释至10-8、10-9、10-10、10-11、10-12、10-13。每个稀释度取10μL涂布接种3个TSA平板,37℃恒温箱培养24 h检验平板。
1.8 免疫器官的病理学观察 将实验猪主要病变组织按常规技术进行细胞病理学及组织病理学检验,然后记录结果。
1.9 免疫器官的相关因子芯片分析 使用一个周期的目标标签和控制试剂(Affymetrix公司生物素标记的cRNA合成,加利福尼亚州圣克拉拉,美国)为杂交猪全基因组Affymetrix公司的芯片。从2 μg的总RNA中抽提12.5~20 mg的cRNA被用于进一步的碎片化,10 μg cRNA10用于杂交。杂交洗涤、染色和扫描芯片按照说明书进行,芯片分析用到的引物见表1。使用GeneSpring软件进行数据分析。通路分析是使用基于Web的基因组分析工具包(Webgestalt)(Zhang等,2005)。所有芯片已提交的数据MIAME遵守下到ArrayEx按提交电子MEXP-1756(http://www.ebi.ac.uk/microarray-as/ae/)。
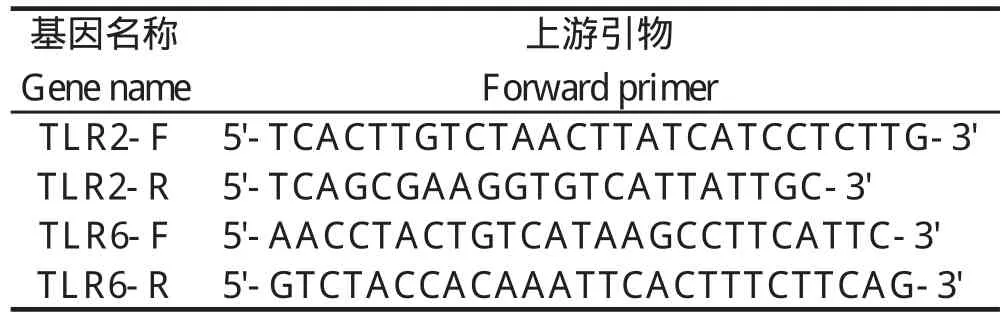
表1 引物序列Table 1 Primer sequnce
2 结果与分析
2.1 临床症状 接种后未采样猪的临床观察期为15 d。接种后3 h,A、B组猪表现出不同的临床症状,较轻微的如扎堆、精神委顿、食欲不振或废食、结膜潮红、流泪;颈部、耳廓、腹下及四肢下端皮肤呈紫红色,并有出血点;喜卧、便秘、粪便干燥,个别带血。严重的出现关节肿大、跛行,全身发抖、共济失调、角弓反张、转圈运动等。A组猪的神经症状更为明显,其中3头猪在接种35~50 h内相继死亡,B组未出现死亡。攻毒后A、B两组均出现体温上升,上升趋势见图1,详细体温数值见表1和表2。空白对照组C、D两组饮食、体温等均正常,无明显的临床症状。感染50 h后至整个观察期结束,4组再无发生死亡。
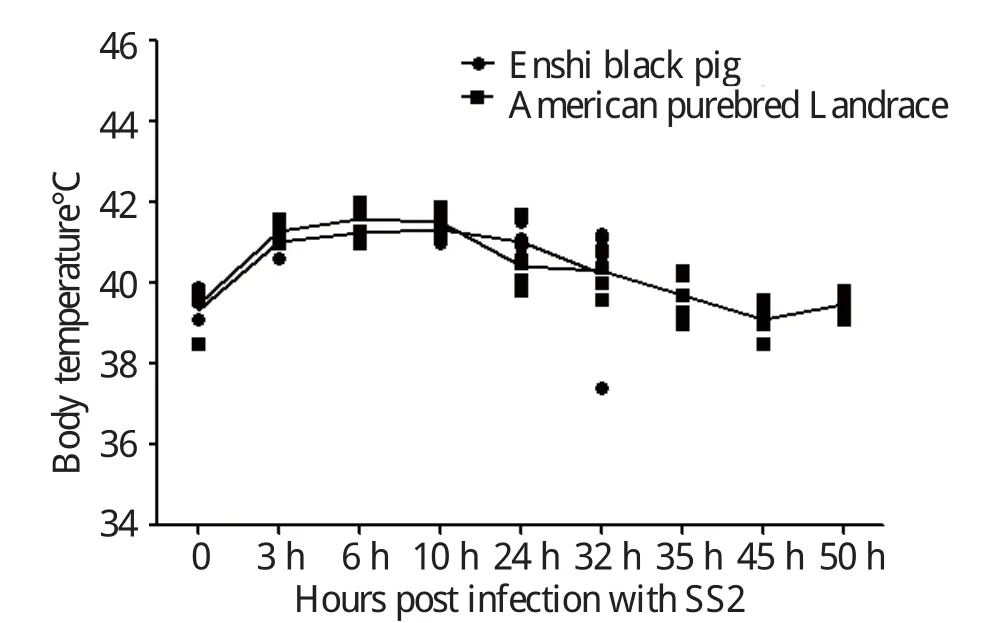
图1 攻毒后猪体温变化趋势Fig.1 Body temperature changes of pigs after infection
2.2 病理变化 对空白对照组进行剖检,眼观和显微镜下观察组织切片均为正常组织状态,无病变。各组织器官病理切片及解剖结果见图2。
2.2.1 尸体剖检病变 对已经死亡的动物及濒死期的病猪进行剖检,病变主要表现为败血症症状(图B):病猪腹部皮下有出血点,血液凝固不良;肾脏有点状出血点,被膜难剥离,肾皮质弥散性出血;肝脏肿大,表面有出血点,质度变脆;肺脏水肿;全身淋巴结肿大、出血,尤其颌下淋巴结、腹股沟淋巴结和肠系膜淋巴结表现最为明显(图C、图D);心脏内膜有出血点;脾脏肿大、出血;扁桃体肿大,有出血点;胃内膜出血(图E)。
2.2.2病理组织学观察
2.2.2.1 心脏 心肌组织结构破坏,闰盘消失;心肌细胞颗粒变性,心肌细胞肿大,胞浆中见大量红色蛋白性颗粒(图 F);心肌细胞水泡变性,心肌细胞肿胀、淡染,有的细胞呈空泡状(图 G)。对照组心肌结构清晰(图 H)。
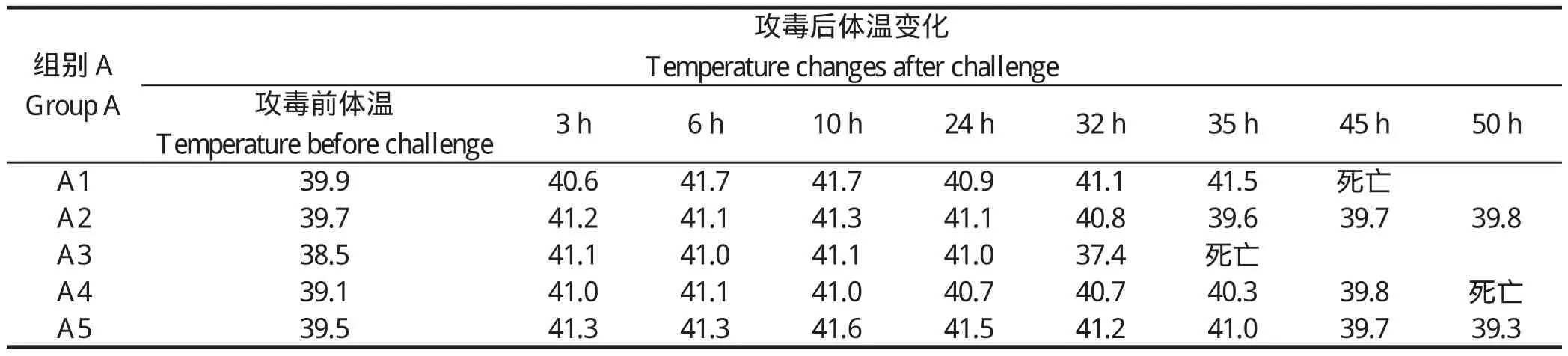
表1 攻毒后恩施黑猪的体温变化情况Table 1 Temperature changes of Enshi black pigs after challenge
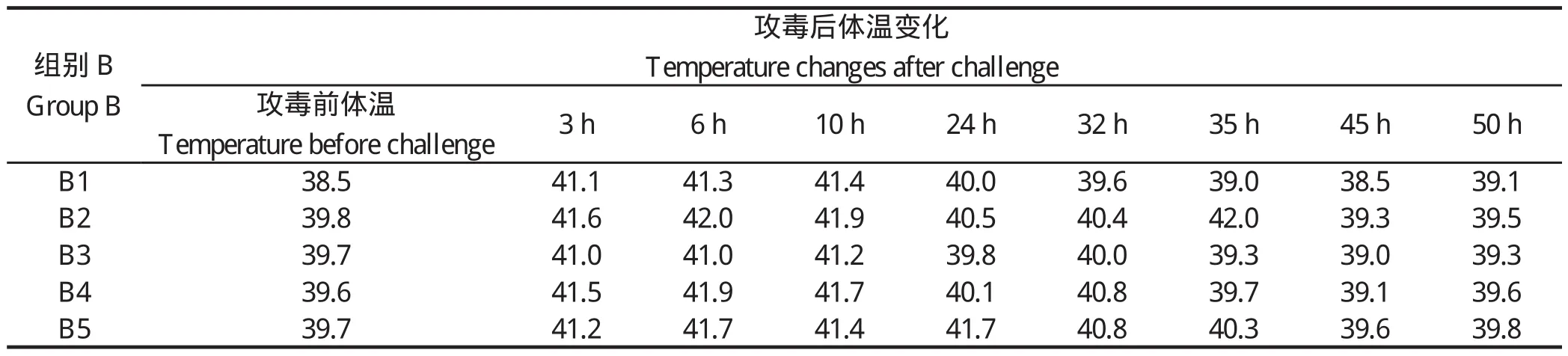
表2 攻毒后美系长白猪的体温变化情况Table 2 Temperature changes of American landrace after challenge
2.2.2.2 肝脏 肝小叶结构被破坏,索状结构消失,肝窦扩张,充满红细胞和其他血细胞(图I);细胞核凝固溶解,肝细胞肿胀,出现空泡样变性,中央静脉发生淤血(图G)。对照组肝细胞索明显可见(图K)
2.2.2.3 脾脏 脾脏可见大面积出血,红白髓混乱,脾小结不明显,嗜中性粒细胞浸润,淋巴细胞减少(图 L);坏死性脾炎,出血坏死部分细胞脱落。2.2.2.4 肺脏 肺脏可见间质性肺炎、肺泡隔充血、水肿,炎性细胞浸润,间隔明显增宽,肺泡缩小;有的在肺泡间质可见大量纤维素渗出物和少量中性炎性粒细胞,脱落的肺泡上皮细胞。对照组肺泡壁薄,肺泡腔内没有粘液等异物。
2.2.2.5 肾脏 肾小球体积肿大,充满整个肾小囊(图M);肾小管出血,肾小管上皮细胞肿胀,管壁增厚,局部肾小管上皮细胞开始脱落(图N、图O)。对照组肾小球、肾小管清晰可辨,未见异常(图P)。
2.3 细菌学检测结果 A组猪的脑、肝脏、肺脏及脑积液、胸腔积液中均分离出了病原菌;B组在脑和脑积液中未分离到病原菌;C、D组均未分离到病原菌(表3)。
2.4 免疫器官的相关因子芯片分析 TLR2及TLR6的表达呈正相关,72 h采集样本芯片分析结果表明,感染组肝脏及脾脏中TLR2及TLR6上调,美系长白猪组上调幅度更大(表4)。
2.5 分析 猪链球菌2型感染动物模型的建立是国内外学者一直探讨的难题。迄今为止,由于猪链球菌2型的致病性复杂多变,是否由于品种的差异而对猪链球菌2型遗传抗性不同并不清楚。
虽然鼻腔感染途径更接近自然感染,但是缺乏重复性,因此我们选择了静脉方式感染。通过临床观察,攻毒后恩施黑猪体温上升最终导致3头猪死亡,而美系长白猪体温上升后又经72 h慢慢恢复正常,没有出现死亡。这一现象说明了恩施黑猪对链球菌2型比美系长白猪更易感。组织病理学观察结果进一步证实,恩施黑猪在感染后呈现以多器官组织出血为主的急性败血症变化,特别是肺脏、胃内膜、淋巴结、脾脏和肾脏出血较为严重,此外也呈现脑膜炎、心外膜炎和关节炎等特征性病变,这与崔立等[16]用SPF巴马小型猪研究结果比较一致。通过细菌学检验结果,从恩施黑猪的实质器官中都分离到了病原菌;美系长白猪在脑和脑积液中未分离到病原菌;对照组C、D各器官中均未分离到病原菌,表明恩施黑猪对链球菌2型的易感性比美系长白猪要强。攻毒后通过对免疫器官中细菌计数发现,恩施黑猪免疫器官中细菌分部明显比美系长白猪中要多。最后对免疫器官的相关因子芯片进行分析,TLR2及TLR6的表达呈正相关,72 h采集样本芯片分析结果表明,肝脏及脾脏中,试验感染组TLR2及TLR6上调,美系长白猪组上调幅度更大。由此可见,恩施黑猪对猪链球菌2型的易感性比美系长白猪更强。总之,通过本研究即两种猪对链球菌2型的易感性和先天性免疫机存在差异,这将为进一步探讨地方品种猪和外来品种猪的易感性和先天性免疫机的差异、易感性可能存在的遗传特性、猪链球菌2型感染不同猪群的感染机制可能存在的差异提供实验依据及思路,为进一步可能进行的优良候选抗病基因筛选提供理论依据。
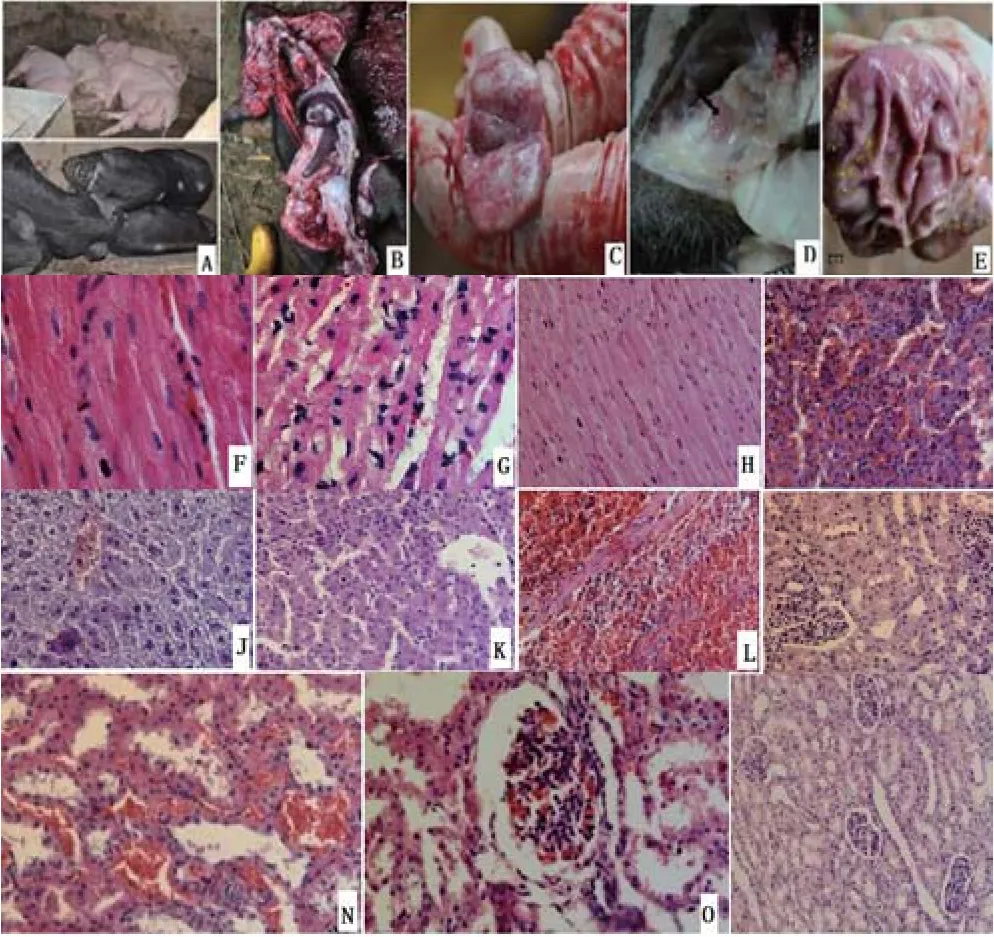
图2 攻毒后猪的尸体剖检病变图Fig.2 The autopsy of pigs after challenge
[1]Hill J E, Gottschalk M, Brousseau R,et al. Biochemical analysis, cpn60 and 16S rDNA sequence data indicate thatStreptococcus suisserotypes 32 and 34, isolated from pigs, are Streptococcus orisratti[J]. Vet Microbiol, 2005,107(1-2): 63-69.
[2]Tang J, Wang C, Feng Y,et al. Streptococcal toxic shock syndrome caused byStreptococcus suisserotype 2[J].PLoS Med, 2006, 3(5): e151.
[3]Yu H, Jing H, Chen Z,et al. HumanStreptococcus suisoutbreak, Sichuan, China[J]. Emerg Infect Dis, 2006,12(6): 914-920.
[4]刘国平, 梁雄燕, 李江华, 等. 猪链球菌2型昆明鼠动物病理模型的建立[J]. 中国兽医学报, 2008, 28(7): 795-798.
[5]Segura M, Fittipaldi N, Calzas C,et alCriticalStreptococcus suisVirulence Factors: Are They All Really Critical?[J] Trends Microbiol,2017, 25 (7): 585-599. .
[6]Liu H, Zhu S, Sun Y,et al. Selection of potential virulence factors contributing toStreptococcus suisType 2 penetration into the Blood Brain Barrier in anin vitroco-culture model[J]. J Microbiol Biotechnol,2016. doi:10.4014/jmb. 1606.06018.
[7]刘国平, 胡利群, 杨小林, 等. 猪链球菌2型高免血清的制备及临床应用[J]. 黑龙江畜牧兽医, 2008(10): 86-88.
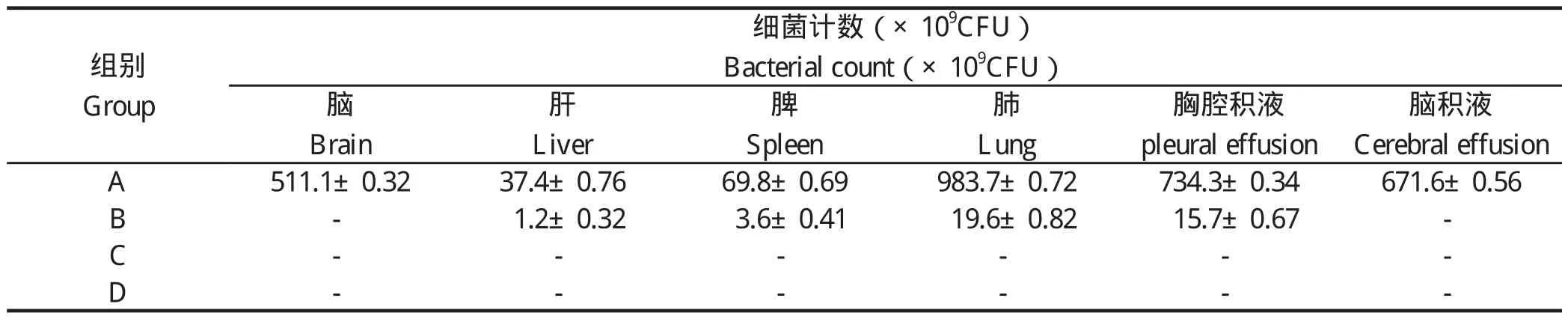
表3 实质器官的细菌计数检测结果Table 3 The results of bacterial count test of solid organs
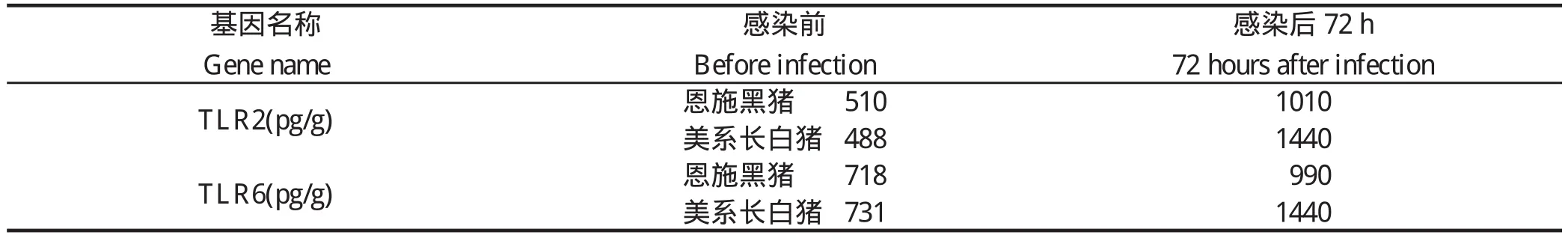
表4 感染前后TLR芯片分析结果Table 4 TLR analysis results before and after infection
[8]彭中镇, 刘榜, 赵书红, 等. 对中国地方猪种本品种选育做法的设想与建议[J]. 中国猪业, 2013(S1): 10-15.
[9]王艳明. 中国优良地方猪种及其种质特性[J]. 畜牧与饲料科学, 2009, 30(4): 162-165.
[10]杨荣昆. 保山猪遗传资源研究与应用[A]//中国畜牧业协会.全国畜禽遗传资源保护与利用学术研讨会论文集[C].中国畜牧业协会, 2005: 6.
[11]王文丽, 易志恩, 高本安. 鄂西黑猪生产性能及选育保种技术措施[J]. 中国畜禽种业, 2010, 6(1): 35-38.
[12]Xiao Y, Li K, Xiang Y,et al.The Fecal Microbiota Composition of Boar Duroc, Yorkshire, Landrace and Hampshire Pigs[J]. Asian-Australasian J Anim Sci, 2017,30(10): 1456-1463.
[13]Wingen L U, West C, Leverington-Waite M,et al. Wheat Landrace Genome Diversity[J]. Genetics, 2017, 205(4):1657-1676.
[14]Velikova N, Kavanagh K, Wells J M. Evaluation of Galleria mellonella larvae for studying the virulence ofStreptococcus suis[J]. BMC Microbiol, 2016, 16(1): 291.
[15]Jiao J, Mao R, Teng D,et al.In vitroandin vivoantibacterial effect of NZ2114 againstStreptococcus suistype 2 infection in mice peritonitis models[J]. AMB Express, 2017, 7(1): 44.
[16]崔立, 朱建国, 华修国, 等. 猪链球菌2型四川株与江苏株对SPF猪的致病性[J]. 上海交通大学学报(农业科学版),2006, 24(1): 54-57.
STUDY ON PATHOGENIC MECHANISM OF STREPTOCOCCUS SUIS SEROTYPE 2 TO BLACK PIGS IN ENSHI AND AMERICAN LANDRACE
LIU Guo-ping1,2, LIU Jian1, YANG Xiao-lin1,2, HU Li-qun1,2, TAN Shi-dan3, ZHAO Shu-hong2
(1. College of Animal Science, Yangtze University, Jingzhou 434025, China; 2. The Cooperative Innovation Center for Sustainable Pig Production, Wuhan 430070, China; 3. Enshi Vocational and Technical College, Enshi 445000, China)
Streptococcus suis disease is an important zoonotic disease in humans and animals. Serotype 2 is the most prevalent and virulent, causing meningitis, arthritis, in fl ammation, sepsis, pneumonia and sudden death in pigs. In the present study, the pathogenicity of S. suis Serotype 2 was investigated in the Enshi black pigs native to western Hubei province and American Landrace. Twenty pigs were divided into four groups, 5 pigs each. Five Enshi black pigs and other 5 American Landrace pigs were infected with S. suis Sero type 2 strain. Non-infected controls included 5 Enshi black pigs and 5 American Landrace pigs. All infected pigs developed high body temperature, lameness and neurological signs. The Enshi black pigs showed more severe disease and pathological changes than American Landrace pigs. Three Enshi black pigs died. Examinations for clinical signs, histopathology and bacteriological isolation indicated that the Enshi black pigs were less susceptibility to S. suis Sero type 2 infection than American Landrace pigs.
Streptococcus suis serotype 2; Ensh black pig; American Landrace; pathogenicity
S852.611
B
1674-6422(2018)01-0071-06
2017-03-24
国家自然科学基金(36120006)
刘国平,男,副教授,主要从事动物传染病学研究
刘国平,E-mail:hhaajjeerr@163.com
