MMP-2,MMP-9和E-cadherin在皮肤恶性黑素瘤中的表达及意义
2018-01-26万慧颖徐敏燕
万慧颖,徐敏燕
(四川省医学科学院·四川省人民医院皮肤病性病研究所,成都610031)
皮肤恶性黑素瘤是一种起源于表皮正常黑素细胞的恶性肿瘤,其恶性程度高,发展迅速且预后较差。浸润及转移是其重要的生物学行为,肿瘤细胞向周围组织浸润,并远处转移,需具备降解细胞外基质的能力。
基质金属蛋白酶家族(MMPs)是细胞外基质降解必须的锌离子依赖性内源性蛋白酶,能够特异性降解基底膜的成分[1]。MMPs中的明胶酶是唯一能够降解基底膜和细胞外基质中的Ⅵ型胶原成分的酶,其中的MMP-2和MMP-9发挥着重要的作用,可以使肿瘤细胞易于突破结构屏障,与肿瘤内血管生成、侵袭及转移相关[2]。上皮型钙黏附蛋白(E-cadherin)是重要的上皮细胞黏附分子,E-cadherin黏附功能的丧失与肿瘤细胞的发生发展、侵袭过程密切相关[3]。目前也有研究表明,细胞膜表面的E-cadherin与MMPs在代谢方面有相关性[4]。因此本研究采用免疫组织化学方法检测恶性黑素瘤及色素痣组织中MMP-2、MMP-9和E-cadherin的表达,探讨与恶性黑素瘤的发生和转移的相关性。
1 资料与方法
1.1 研究对象 32例标本均来自四川省人民医院皮肤病性病研究所2008年—2014年确诊为恶性黑素瘤患者的皮损组织(石蜡包埋组织块),其中男18例,女14例,年龄36~78岁,平均57岁,所有标本均行病理组织学检查并经2位皮肤病理医生明确诊断。按照有无淋巴结转移分为2组,有淋巴结转移者18例,无淋巴结转移者14例。另设10例确诊为色素痣的组织为对照组。
1.2 仪器及试剂 德国SHANDON组织包埋机由德国SHANDON公司生产,Yamato病理组织切片机由日本大和光机工业株式会社制造。兔抗人MMP-2和MMP-9多克隆抗体购自武汉博士德公司,鼠抗人E-cadherin单克隆抗体和SP试剂盒购自福州迈新公司。
1.3 实验方法与步骤 采用免疫组化SP法染色和DAB显色,用已知MMP-2、MMP-9和E-cadherin阳性的组织切片作实验阳性对照,相同切片以PBS代替一抗作空白对照。实验步骤:石蜡切片常规脱蜡至水,将其放进水浴锅中(100℃)40 min进行抗原热修复,加3%过氧化氢孵育20 min以消除内源性过氧化物酶活性。分别滴加MMP-2、MMP-9和E-cadherin一抗工作液(工作浓度 1∶100),4℃冰箱中过夜,再按试剂盒说明书进行操作,DAB显色,光镜下控制,显色充分后用自来水终止。苏木精复染1 min,常规梯度脱水至封片。
1.4 结果判断 MMP-2和MMP-9主要表达于细胞浆内,部分胞膜也有表达,出现棕黄色或棕褐色反应物颗粒即为阳性。E-cadherin主要表达在细胞膜及部分胞浆上。显微镜下随机检测5个独立高倍视野(×400倍),统计阳性细胞数并记录阳性细胞率。根据阳性细胞染色程度及染色细胞所占百分率进行综合评分。无任何细胞着色为0分,淡黄色为1分,棕黄色为2分,黄褐色为3分。阳性细胞数≤5%判定为0分,6%~25%为1分,26%~50%为2分,>50%为3分。每张切片的平均着色程度与平均阳性细胞百分率得分相加,得分≤1分者为阴性(-),2~3分者为弱阳性(+),4~6分者为阳性(++),>6分者为强阳性(+++)。所有的结果均由2位皮肤病理医生进行双盲读片决定。
1.5 统计学方法 应用SPSS 15.0统计软件对实验数据进行统计学分析,各组样本间的比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 MMP-2免疫组化染色结果 MMP-2阳性反应主要定位于细胞浆,部分胞膜也有表达,阳性着色呈淡黄色至棕褐色。MMP-2在恶性黑素瘤组织中阳性表达明显高于色素痣对照组,差异有统计学意义(χ2=26.98,P=0.001,P<0.01),见表 1、图 1。
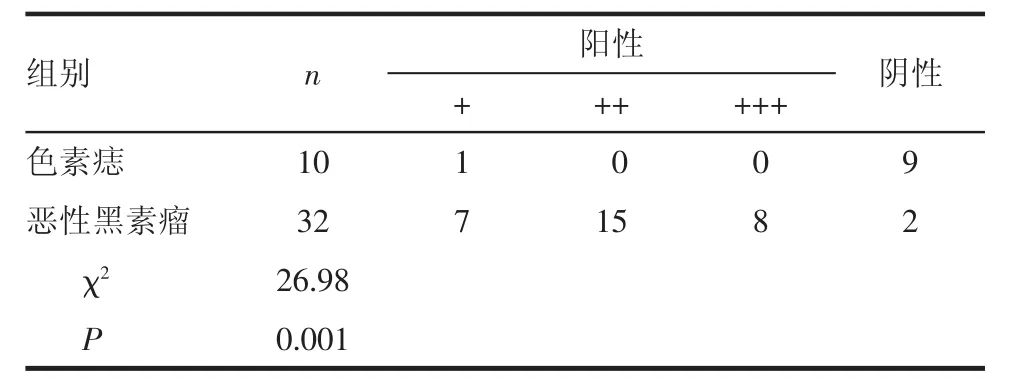
表1MMP-2免疫组化染色结果 例
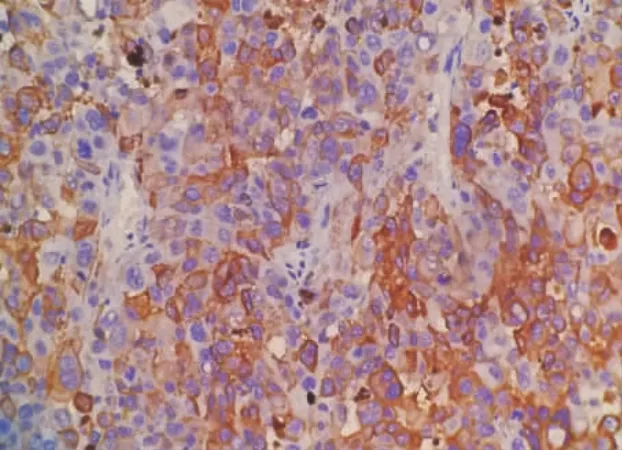
图1 MMP-2在恶性黑素瘤中主要表达于细胞浆,部分胞膜也有表达(SP染色×400)
2.2 MMP-9免疫组化染色结果 MMP-9阳性反应主要定位于细胞浆,部分胞膜也有表达,阳性着色呈淡黄色至棕褐色。MMP-9在恶性黑素瘤组织中阳性表达明显高于色素痣对照组,差异有统计学意义(χ2=20.91,P=0.001,P<0.01),见表 2、图 2。

表2MMP-9免疫组化染色结果 例
2.3 E-cadherin免疫组化染色结果 E-cadherin阳性反应定位于细胞膜及部分胞浆,阳性着色呈淡黄色至棕褐色。E-cadherin在恶性黑素瘤组织中阳性表达明显低于色素痣对照组,差异有统计学意义(χ2=7.75,P=0.005,P<0.01),见表 3 及图 3、4。
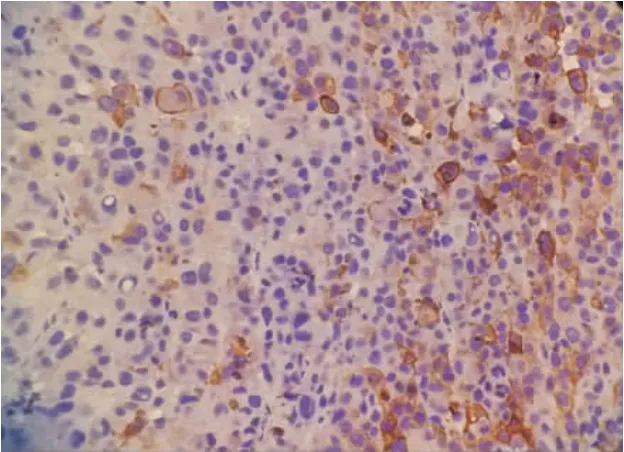
图2 MMP-9在恶性黑素瘤中主要表达于细胞浆,部分胞膜也有表达(SP染色×400)
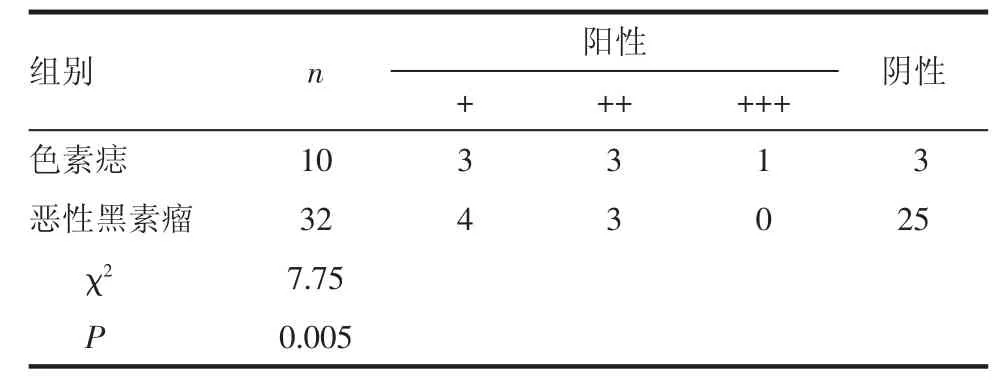
表3 E-cadherin免疫组化染色结果 例
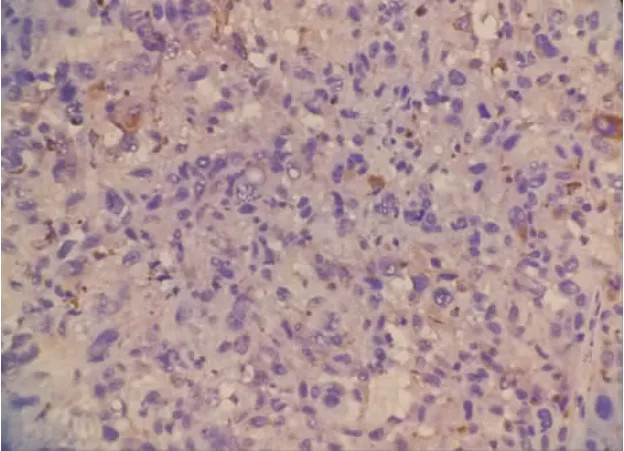
图3 E-cadherin在恶性黑素瘤中主要表达于细胞膜及部分细胞浆(SP染色×400)
2.4 MMP-2、MMP-9和E-cadherin在有淋巴结转移的恶性黑素瘤中的表达 MMP-2与MMP-9在有淋巴结转移的恶性黑素瘤中阳性表达率均高于无淋巴结转移者(P<0.05,P<0.01)。E-cadherin在有淋巴结转移者中阳性表达率低于无淋巴结转移者(P<0.05),见表 4。
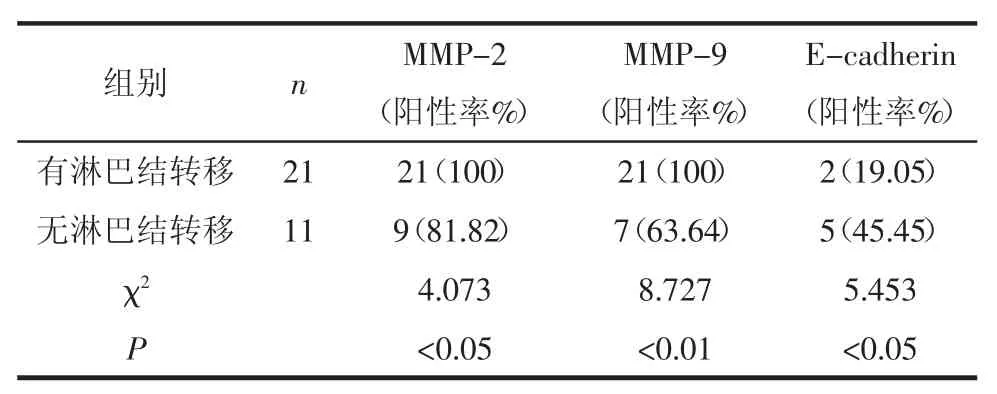
表4MMP-2、MMP-9、E-cadherin在恶性黑素瘤中的表达 例
3 讨论
皮肤恶性黑素瘤可以广泛浸润表皮、真皮及皮下组织,甚至浸润相邻器官或组织,并易于侵入血管和淋巴管向远处转移,其发展迅速,预后差,死亡率高。近年来随着分子生物学和人类基因组学的发展,研究肿瘤发生侵袭和转移的机制,针对肿瘤转移的相关蛋白的研究,对早期诊断与治疗,判断预后均具有重要临床意义。
MMPs是一类能够降解血管基底膜,水解细胞外基质及其他基质成分的重要蛋白酶,具有促进肿瘤侵袭及血管形成等关键作用。目前,已经有20余种MMPs被发现,按照其作用底物不同可以分为4大类:胶原酶、明胶酶、基质降解素和膜型MMPs[5]。多项研究证实,在上皮源性肿瘤组织中,如肺癌、胃癌、结肠癌、乳腺癌及前列腺癌等恶性肿瘤等,均分别发现MMPs的高表达与肿瘤的转移和预后不良有密切关系[6]。明胶酶的2个亚型,MMP-2和MMP-9,分子质量分别为72 kD和92 kD。MMP-2不仅可以降解细胞外基质中的Ⅳ型胶原,有利于肿瘤细胞扩散,还可以通过新生毛细血管促进肿瘤侵袭与转移[7]。MMP-2的阳性率随着TNM分期逐渐增加,有淋巴结转移的患者阳性表达率高于无淋巴结转移的患者[8]。MMP-9是MMPs中分子量最大的酶,它以酶原形式分泌,能水解细胞基底膜及细胞外基质中Ⅳ型、Ⅴ型胶原和纤维连接蛋白成分,导致基底膜破坏,肿瘤细胞浸润结缔组织、小血管和淋巴管而发生转移[9]。
本研究发现,恶性黑素瘤中MMP-2和MMP-9的表达均显著高于色素痣,并且与淋巴结的转移呈正相关性。国内余忠平[10]研究发现,MMP-9在转移性黑素瘤中阳性表达率显著高于原位黑素瘤与色素痣。张娟等[11]研究报道,MMP-9在皮肤恶性黑素瘤中的阳性表达率高于交界痣和正常皮肤组织,并随肿瘤浸润深度的增加而增高,且有淋巴结转移者阳性表达率大于无淋巴结转移者。均与笔者的研究结果一致。
E-cadherin蛋白主要存在于人和动物的上皮细胞中,是钙黏附蛋白分子家族中的一种跨膜糖蛋白。E-cadherin蛋白通过N端胞外区钙离子依赖的同型黏附与邻近细胞形成连接体,以维持细胞的极性,因此其在细胞的黏着连接处集中表达,可以有效地维持上皮细胞的形态和组织结构。E-cadherin蛋白在肿瘤早期浸润中有调控作用,其表达下调或缺失会导致肿瘤细胞连接松散,表达较强的侵袭能力[12]。E-cadherin蛋白表达下调的患者,其生存率下降,可能就是由于肿瘤细胞脱离了原发灶,沿淋巴管、血管及组织间隙浸润并转移,导致死亡率增高[13]。有较多的研究显示,E-cadherin蛋白表达强度与患者的年龄、性别及病理类型无关,但与不同TNM分期、肿瘤分化程度及淋巴结转移情况有显著相关性。在有淋巴结转移、临床TNM分期晚和肿瘤分化程度差的组织中,E-cadherin蛋白表达显著下调或缺失,从而使肿瘤细胞之间的黏附力下降,导致恶性肿瘤的浸润和转移[14]。这与笔者的研究结果也是完全一致的。
综上所述,MMP-2和MMP-9在恶性黑素瘤中高表达,E-cadherin蛋白在恶性黑素瘤中低表达,可能与恶性黑素瘤的发生、发展、分化和转移过程相关,联合检测可以作为评估肿瘤侵袭性的指标,但其参与肿瘤侵袭转移的复杂作用及具体机制仍需要进一步的研究,这些机制的深入研究将对临床治疗与预后判定具有重要的意义。
[1]申颖,郭文奇.基质金属蛋白酶抑制剂的研究[J].内蒙古医学杂志,2007,39(2):263-265.
[2]El-Badrawy MK,Yousef AM,Shaalan D,et al.Matrix metalloproteinase-9 expression in lung cancer patients and its relation to serum mmp-9 activity,pathologic type,and prognosis[J].J Bronchology Interv Pulmonol,2014,21:327-334.
[3]徐娟,唐敏,曹亚.上皮-间质转化与肿瘤的浸润和转移[J].国际病理科学与临床杂志,2008,28(6):504-507.
[4]Nawrocki-Raby B,Gilles C,Polette M,et al.Upregulation of MMPs by soluble E-cadherin in human lung tumor cells[J].Int J Cancer,2003,105:790-795.
[5]Klein T,Bischoff R.Physiology and pathophysiology of matrix metalloproteases[J].Amino Acids,2011,41:271-290.
[6]Bourboulia D,Stetler-Stevenson WG.Matrix metalloproteases(MMPs)and tissue inhibitors of metalloproteases(TIMPs):positive and negative regulators in tumor cell adhesion[J].Semin Cancer Biol,2010,20:161-168.
[7]Chang A,Parikh P,Thongprasert S,et al.Gefitinib(IRESSA)in patients of Asian origin with refractory advanced non-small cell lung cancer:subset analysis from the ISEL study[J].J Thorac Oncol,2006,1:847-855.
[8]赵仲生,张梅,茹国庆.MMP-2和MMP-9在非小细胞肺癌中的表达及预后意义[J].中国肺癌杂志,2000,3(2):107-110.
[9]Li Y,Ma J,Guo Q,et al.Overexpression of MMP-2 and MMP-9 in esophageal squamous cell carcinoma[J].Dis Esophagus,2009,22:664-667.
[10]余忠平.黑素瘤中VEGF-D、MMP-7和MMP-9的表达[J].中国麻风皮肤病杂志,2012,28(7):479-481.
[11]张娟,陈旻静,王大伟,等.组织蛋白酶D和基质金属蛋白酶-9在皮肤恶性黑素瘤中的表达[J].第三军医大学学报,2012,34(10):1002-1005.
[12]Hermiston ML,Wong MH,Gordon DJ.Forced expression of E-cadherin in the mouse intestinal epithelium slows cell migration and provides evidence for nonautonomous regulation of cell fate in a self-renewing system[J].Genes Dev,1996,10:985-996.
[13]Bremnes RM,Veve R,Hirsch FR,et al.The E-cadherin cell-cell adhesion complex and lung cancer invasion,metastasis,and prognosis[J].Lung Cancer,2002,36:115-124.
[14]郭晓峰,杨鲲鹏,崔新征,等.EGFR、CTEN和E-cadherin在非小细胞肺癌中的表达及临床意义[J].西安交通大学学报(医学版),2014,35(3):346-351.
