中枢神经系统中具有脊索样特征肿瘤的临床病理分析
2018-01-15罗庚求
姚 宁,张 楠,罗庚求
脊索样胶质瘤、脊索样脑膜瘤是具有脊索样特征的中枢神经系统肿瘤,脊索瘤及上皮样血管内皮瘤虽不属于中枢神经系统肿瘤,但由于其镜下形态具有脊索样特征且好发于中枢神经系统,故一并分析。目前,国内外文献报道脊索瘤及脊索样脑膜瘤的临床病理分析及鉴别较多,而脊索样胶质瘤及上皮样血管内皮瘤少见,尤其是原发于颅内的上皮样血管内皮瘤,国内外仅有个案报道。本文收集脊索瘤、脊索样胶质瘤、脊索样脑膜瘤及上皮样血管内皮瘤的临床资料和组织学形态,探讨中枢神经系统中具有脊索样特征肿瘤的临床病理特征、诊断及鉴别诊断。
1 材料与方法
1.1材料收集中南大学湘雅医院病理科2010年1月~2016年7月明确诊断的81例脊索瘤、4例脊索样胶质瘤、9例脊索样脑膜瘤及2例上皮样血管内皮瘤。查阅病历获取相关临床病史、影像学资料,多数患者无随访资料。81例脊索瘤中发病高峰年龄为40~50岁,男女比约为2 ∶1;其中18例位于脊柱及骶尾部,3例位于鼻咽及口咽部,余60例均为颅底脊索瘤。4例脊索样胶质瘤中3例为女性,其中3例位于鞍区,1例位于鞍上区。脊索样脑膜瘤9例,男女比为4 ∶5。患者发生部位:2例位于额叶,2例颅内多发,其余分别位于左枕、顶叶、左小脑、第四脑室、第三脑室后部。2例上皮样血管内皮瘤均为男性,病变分别位于左侧额顶叶、左颞部。
1.2方法标本均经10%中性福尔马林固定,常规脱水、石蜡包埋,4 μm厚切片,常规HE染色,光镜观察。免疫组化染色采用EnVision法,一抗包括vimentin、EMA、S-100、CKpan、CK-L、CD31、CD34、Ki-67、GFAP、PR。抗体及试剂盒均购自北京中杉金桥公司,具体操作步骤严格按试剂盒说明书进行。
2 结果
2.1病理检查
2.1.1眼观 手术切除标本多呈灰白或灰红色的碎组织,质中偏软,呈半透明胶冻状或鱼肉样,切面可有黏液感。脊索瘤中部分病例可见钙化、坏死,部分脊索样脑膜瘤附有脑膜组织。
2.1.2镜检 (1)脊索瘤大多为经典型,丰富淡蓝色黏液样基质背景中,瘤细胞散在分布或排列成条索状(图1),胞质红染,内含空泡,形成“液滴”细胞,部分可见体积较小的星芒细胞,间质无炎细胞浸润;软骨样脊索瘤可见软骨细胞岛。(2)脊索样脑膜瘤镜下结构大部分类似于脊索瘤,上皮样或梭形瘤细胞条索状分布于黏液样基质中,病灶局部可见典型脑膜瘤结构,脊索样成分占10%~100%不等,间质可见炎细胞浸润,核分裂象少见(图2)。(3)脊索样胶质瘤中瘤细胞呈多边形或卵圆形,大小较一致,胞质丰富红染,可见Russell小体,核分裂象罕见,间质可见大量炎性细胞浸润(图3)。(4)上皮样血管内皮瘤可见短梭形上皮样瘤细胞构成,浸润性生长,局灶瘤细胞构成微小血管腔样结构,内含红细胞(图4),部分病例核分裂象可见。
2.2免疫表型(1)62例脊索瘤中vimentin均阳性,除2例患者EMA阴性、1例患者S-100阴性、1例患者CKpan阴性外,其余患者EMA、S-100、CKpan(图5)均阳性,部分患者CK-L阳性,3例患者GFAP呈局灶阳性,余均为阴性。Ki-67增殖指数2%~15%。(2)4例脊索样胶质瘤GFAP(图6)、vimentin均阳性,1例CKpan、EMA均为阴性,而S-100阳性,Ki-67增殖指数<1%。(3)6例脊索样脑膜瘤vimentin、PR(图7)均阳性,其中5例EMA阳性,仅1例GFAP灶阳性,余GFAP均阴性,仅1例CKpan阳性,1例S-100阳性,Ki-67增殖指数≤5%。(4)2例上皮样血管内皮瘤中CD31(图8)、CD34、vimentin均阳性,S-100均阴性,1例CKpan为阳性,Ki-67增殖指数分别为3%及30%。
3 讨论
3.1临床表现脊索瘤不属于中枢神经系统肿瘤,但好发于颅底及骶尾部。脊索瘤为原发性低度恶性骨肿瘤,占原发性骨肿瘤的1%~4%,大多数累及中轴骨,主要发生于骶尾部及蝶枕联合区,发生于除脊柱外其他部位的脊索瘤又称周围性脊索瘤。目前认为脊索瘤来源于脊索胚胎组织残余物,胚胎时期脊索诱导椎体的间充质成分软骨化及分节。脊索瘤可见于所有年龄段,40岁以上为高发年龄,患者中男性多于女性,有报道显示约为2 ∶1,颅底脊索瘤的男女比大致相等[1]。脊索瘤的生长缓慢,早期症状不明显,患者的主要就诊原因为病变相应区域疼痛,骶尾部脊索瘤主要表现为腰骶部疼痛、麻木;颅底脊索瘤最常见的症状为头痛,当肿瘤压迫脑神经时可产生相应临床表现,常见有复视、内斜视、视物模糊等,面部或肢体麻木、吞咽困难、听力下降等也较常见。
脊索样胶质瘤属于罕见的生长缓慢的神经系统原发肿瘤,属于WHO Ⅱ级,其起源尚不清楚。脊索样胶质瘤好发于第三脑室及周围区,WHO(2016)神经系统肿瘤分类中将其命名为“第三脑室脊索样胶质瘤 ”,以女性多见[2]。由于肿瘤进展缓慢,患者早期多无症状,后期可表现为视觉障碍、内分泌紊乱或行为改变,患者症状主要取决于肿瘤的位置、生长速度及其侵犯的结构,位于第三脑室内的肿瘤还可能导致梗阻性脑积水,引起颅高压症状,发生恶心、呕吐等[3]。 脊索样脑膜瘤占脑膜瘤的0.5%~1.0%,属于WHO Ⅱ级,其好发部位及临床特征与良性脑膜瘤相似,最常见于幕上,可发生于颅底、椎管,一般认为脊索样脑膜瘤发病无明显性别差异,但脊索样脑膜瘤具有侵袭性呈浸润性生长,常浸润骨质[4]。患者症状也与其不同的发病部位及生长程度有关,但多数患者主诉为头痛、恶心呕吐或首发症状为癫痫。有文献报道儿童脊索样脑膜瘤患者常并发Castleman综合征,即患有小细胞性贫血或γ球蛋白型贫血,在肿瘤切除肿瘤后患者的贫血症状消失。
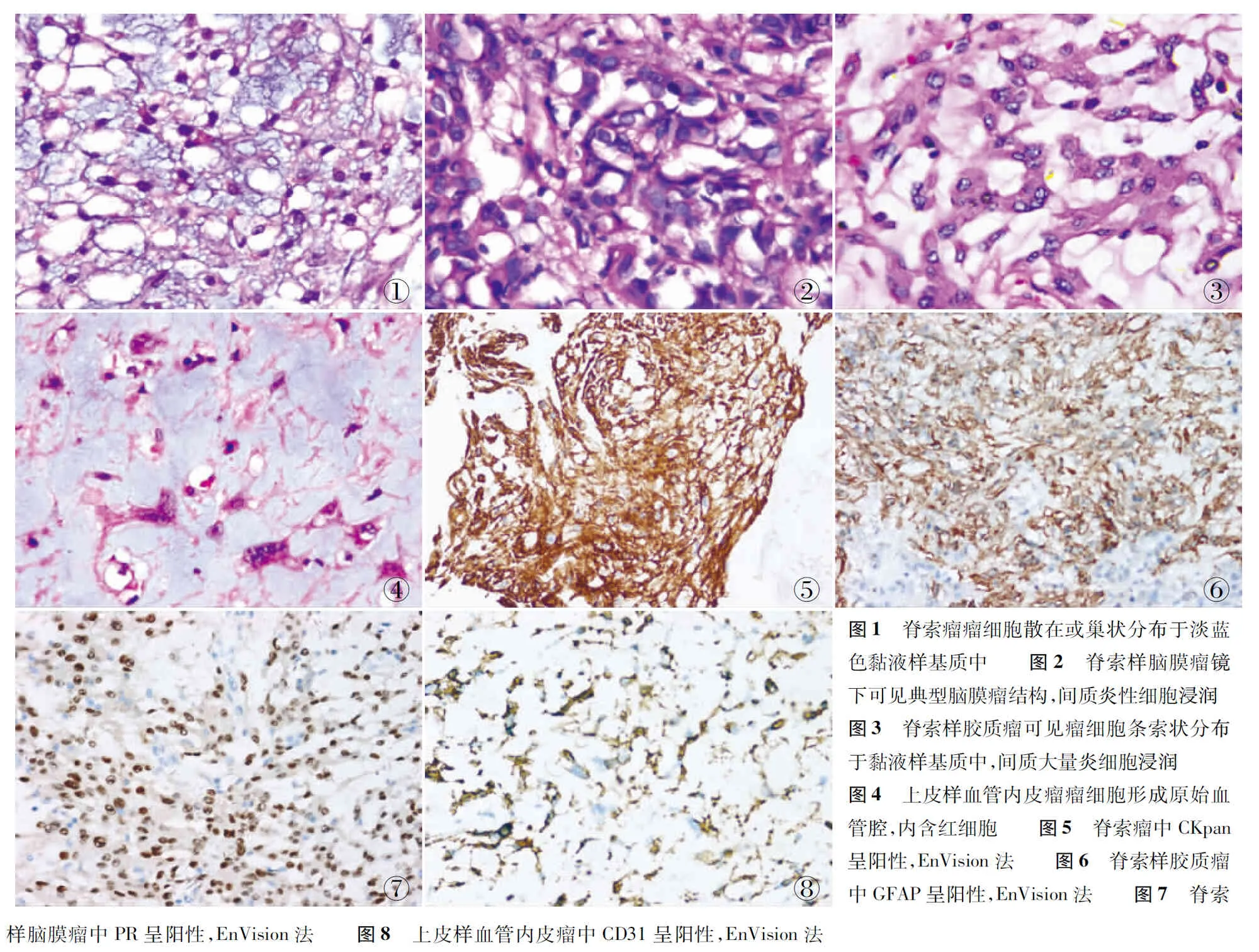
①②③④⑤⑥⑦⑧图1 脊索瘤瘤细胞散在或巢状分布于淡蓝色黏液样基质中 图2 脊索样脑膜瘤镜下可见典型脑膜瘤结构,间质炎性细胞浸润图3 脊索样胶质瘤可见瘤细胞条索状分布于黏液样基质中,间质大量炎细胞浸润图4 上皮样血管内皮瘤瘤细胞形成原始血管腔,内含红细胞 图5 脊索瘤中CKpan呈阳性,EnVision法 图6 脊索样胶质瘤中GFAP呈阳性,EnVision法 图7 脊索
上皮样血管内皮瘤是介于血管瘤与血管肉瘤的低度恶性血管肿瘤,临床少见,多发于肝、肺、骨及软组织等,发生于实质器官的上皮样血管内皮瘤易转移[5]。原发于颅内的上皮样血管内皮瘤属于脑膜间质的非脑膜上皮细胞肿瘤,临床较罕见,国内外仅为个案报道,常见原发于颅内的部位为额、颞、顶叶;其临床表现与发生部位有关,无明显特异性。
3.2诊断及鉴别诊断
3.2.1影像学特点 颅底脊索瘤可侵袭周围骨质,高分辨CT显示骨质破坏情况,CT示其为颅底溶骨性或膨胀性骨质变化,肿块与正常骨质分界不清,少数病例可见反应性骨硬化缘。MRI对软组织分辨率高,因此可准确显示肿瘤的位置和侵袭情况。脊索瘤常伴出血、囊变、钙化等,故MRI多表现为不均匀信号,T1WI呈稍低或等信号,T2WI显示增高信号,瘤周常无或轻度水肿。由于脊索瘤呈典型分叶状,高信号的瘤细胞和基质被低信号的纤维分隔,故增强扫描呈蜂房样明显不均匀强化,偶表现为无强化或轻度强化。
脊索样脑膜瘤的影像学表现与良性脑膜瘤相似,MRI显示肿块边缘清晰,信号较均匀,T1WI多呈等信号,T2WI多为稍高信号。增强扫描可见明显均匀强化,多数患者显示特征性“脑膜尾征”,常可见瘤周水肿。
脊索样胶质瘤好发于第三脑室,MRI示第三脑室内边缘清晰的球形包块,T1WI示稍高信号,脊索样胶质瘤的囊性变和钙化少见,增强扫描呈均匀致密强化,瘤周可见水肿带。
不同部位的上皮样血管内皮瘤影像学表现也不尽相同,发生于颅内的上皮样血管内皮瘤易与脑膜瘤混淆,CT示多为等密度或高密度,MRI表现为T1WI等信号或低信号,T2WI呈高信号,增强扫描后显示不均匀明显增强。
3.2.2组织学特征 脊索瘤的镜下形态大体相似,瘤细胞呈簇状或条索状排列,分布于黏液样基质中,瘤细胞可见胞质内空泡。根据肿瘤细胞分化程度及形态学特点可分为3种亚型:经典型、软骨样型、去分化型。经典型多见,镜下结构类似于正常脊索组织,呈分叶状,大量黏液基质中有典型的空泡化的“液滴细胞”,细胞体积较大,胞质丰富、红染,被纤维血管分隔成小叶状;除液滴细胞外,还可见细胞呈星形,体积小的星芒状细胞,胞质内不含空泡。软骨样型向软骨分化,具有经典型脊索瘤结构和软骨样的双重特征。去分化型具有经典型或软骨样型脊索瘤成分同时具有肉瘤样成分,可出现双核、多核,部分病例可见核分裂象。
脊索样脑膜瘤镜下可见上皮样的瘤细胞排列成条索状或巢状,分布于黏液样基质中,胞质红染,部分可见胞质内空泡,核分裂象少见;还可见不同程度的淋巴细胞、浆细胞等炎细胞浸润,可形成淋巴滤泡。鉴别要点为镜下常可见典型脑膜瘤区域,瘤细胞排列成漩涡状,偶可见砂砾体形成,细胞核为圆形或卵圆形,染色质呈细颗粒状[6]。
脊索样胶质瘤镜下为空泡样黏液基质中呈簇状、条索状排列,大小较一致的短梭形或卵圆形的瘤细胞,胞质嗜伊红。瘤细胞可呈明显胶质细胞分化,伴胶质原纤维突起,无坏死或小血管增生。瘤周组织中可见较多Russell小体,常有大量炎性细胞浸润,但通常不形成淋巴滤泡,瘤体周围组织可见反应性星形细胞增生及Rosenthal纤维[7-8]。
上皮样血管内皮瘤的瘤细胞呈上皮样,排列成小巢状或条索状分布于黏液样基质中,可见胞质内空泡及胞质内血管分化,内含红细胞。电镜下可见内皮细胞特征性W-P小体。
3.2.3免疫表型 绝大多数脊索瘤CKpan、EMA、vimentin、S-100均阳性,CEA、GFAP通常为阴性,部分病例呈局灶阳性;PAS黏液染色阳性;Brachyury在部分病例可呈阳性,其也被用作脊索瘤与骨肉瘤及软骨肉瘤的鉴别诊断。
脊索样脑膜瘤的免疫組化标记vimentin、EMA、PR均阳性,S-100、CK、GFAP通常为阴性,部分病例报道D2-40在脊索样脑膜瘤中有较高的阳性率,具有鉴别意义[6]。Ki-67增殖指数为3%~10%,平均5.3%[9]。
脊索样胶质瘤中GFAP、EMA、vimentin均阳性,其中GFAP为脊索样胶质瘤特征性表达,部分患者S-100局灶阳性,CK、ER、PR、D2-40均阴性,Ki-67增殖指数<1%,PAS黏液染色阳性[10-11]。此外,国内外部分研究表明甲状腺转录因子-1在第三脑室胶质瘤中呈阳性,提示可作为新的诊断标准[12-13]。
上皮样血管内皮瘤中血管内皮标志物CD31、CD34、FVIII-Rag至少一项阳性,免疫组化标记均表达vimentin。
3.3遗传学特点脊索瘤特异性表达T基因,目前认为Notch通路等在脊索瘤的发展过程中起重要作用。脑膜瘤中核型异常发生率高,有学者报道脊索样脑膜瘤会出现t( 1; 3) ( p12-13; q11) 基因异常。国外有研究表明上皮样血管内皮瘤具有特定的染色体移位t(1; 3)(p36.3; q25),可能介导肿瘤的发生[14]。目前,暂无脊索样胶质瘤中染色体异常及抑癌基因异常的发现。
3.4治疗及预后手术是治疗脊索瘤的主要方法,但因解剖位置、周围组织粘连等原因,手术不易完整清除病灶,术后复发率高。本组81例患者中,超过半数复发。有研究认为术后放疗可减少复发率,但对于放、化疗效果尚无定论。有报道指出患者手术年龄与预后也有很大相关性,40~49岁术后生存率最高。不同病理类型的脊索瘤预后也不相同,Wu等[15]通过对106例脊索瘤随访资料分析,认为软骨样型脊索瘤预后最好,其次为经典型,未分化型的预后最差。脊索瘤较少出现转移,但也有部分病例可转移至肺、肝、淋巴结等部位,当脊索瘤发生转移时,预后更差。
通常认为影响脊索样脑膜瘤预后的因素包括手术是否完整切除、脊索样成分所占比例、Ki-67增殖指数等,但大多数研究认为手术行次切除术时复发率高,而脊索样成分所占比例及Ki-67增殖指数与复发率无明显相关性。当病变位于颅底时不易完整切除,易复发。
脊索样胶质瘤为低级别肿瘤,但因肿块多位于第三脑室,常与周围组织粘连,手术难以完整清除病灶,预后不良。
上皮样血管内皮瘤属低-中度恶性血管肿瘤,手术治疗为主要手段,组织学有恶性表现及手术未完整切除的应该采取术后放、化疗。此外,还有部分病例应用介入栓塞、微波射频消融等辅助治疗。原发于颅内的上皮样血管内皮瘤罕见,其预后尚不明确。
[1] Chambers K J, Lin D T, Meier J,etal. Incidence and survival patterns of cranial chordoma in the United States[J]. Laryngoscope, 2014,124(5):1097-1102.
[2] Louis D N. The 2007 WHO classification of tumours of the central nervous system[J]. Acta Neuropathol, 2007, 114(2):97-109.
[3] Morais B A, Menendez D F, Medeiros R S,etal. Chordoid glioma: case report and review of the literature[J]. Int J Surg Case Rep, 2015,7:168-171.
[4] 王 科,张俊廷. 脊索样脑膜瘤[J]. 国际神经病学神经外科学杂志, 2013,40(1):37-40.
[5] 杨文博. 上皮样血管内皮瘤239例文献分析[J]. 中国实用内科杂志, 2015,35(S1):28-30.
[6] Sangoi A R, Dulai M S, Beck A H,etal. Distinguishing chordoid meningiomas from their histologic mimics: an immunohistochemical evaluation[J]. Am J Surg Pathol, 2009,33(5):669-681.
[7] 潘斌才,肖冠英,王春华,等. 脊索样脑膜瘤及脊索样胶质瘤临床病理诊断对比分析及文献复习[J]. 中国医学工程, 2013,12(12):12-13.
[8] Cui Y, Du J, Wang J M,etal. Clinicopathologic study of chordoid glioma of third ventricle: a report of 5 cases [J]. Zhonghua Bing Li Xue Za Zhi, 2016,45(8):575-576.
[9] 张安莉,孙思柏,丁 敏. 脊索样脑膜瘤7例临床病理分析[J]. 临床与实验病理学杂志, 2016,32(3):341-344.
[10] Kobayashi T, Tsugawa T, Hashizume C,etal. Therapeutic approach to chordoid glioma of the third ventricle [J]. Neurol Med Chir (Tokyo), 2013,53(4):249-255.
[11] Destefani M H, Mello A S, de Oliveira R S,etal. Chordoid glioma of the third ventricle[J]. Radiol Bras, 2015,48(5):338-339.
[12] Bielle F, Villa C, Giry M,etal. Chordoid gliomas of the third ventricle share TTF-1 expression with organum vasculosum of the lamina terminalis[J]. Am J Surg Pathol, 2015,39(7):948-956.
[13] 晋 薇,宋 欣,桂秋萍. TTF-1在第三脑室脊索样胶质瘤中的表达及临床意义[J]. 诊断病理学杂志, 2017,24(5):330-333.
[14] Patel N R, Salim A A, Sayeed H,etal. Molecular characterization of epithelioid haemangioendotheliomas identifies novel WWTR1-CAMTA1 fusion variants[J]. Histopathology, 2015,67(5):699-708.
[15] Wu Z, Zhang J, Zhang L,etal. Prognostic factors for long-term outcome of patients with surgical resection of skull base chordomas-106 cases review in one institution[J]. Neurosurg Rev, 2010,33(4):451-456.
