乳腺浸润性导管癌中Axl蛋白的表达及意义
2018-01-15黄一凡
周 萍,王 莉,黄一凡,侯 俊,汤 梅,王 琼
Axl蛋白属于跨膜酪氨酸激酶受体蛋白,其基因最早在慢性粒细胞白血病患者体内发现,该受体包含1个胞内(C末端)激酶结构域和1个独特的胞外(N末端)结构域,前者包含3个自磷酸化位点(Tyr779、Tyr821、Tyr886),后者由2个免疫球蛋白样结构域和2个重复纤维连接蛋白Ⅲ组成,类似于神经细胞黏附分子结构[1-2]。Axl蛋白的过表达能促进肿瘤形成和演进,包括肿瘤的浸润、转移、细胞存活、血管生成、对化疗和靶向治疗药物耐药、细胞转化及细胞增殖等均有促进作用[3-4]。已有文献报道[5]Axl蛋白在甲状腺、食管、胃、肺、肝脏、乳腺等多种肿瘤组织中高表达,并认为其是有效的靶向治疗基因位点[6]。本文通过检测乳腺浸润性导管癌中Axl蛋白的表达,进一步明确其与临床病理特征的相关性,为靶向治疗提供参考。
1 材料与方法
1.1材料收集川北医学院附属医院病理科2012年1月~2013年6月存档的乳腺浸润性导管癌(invasive ductal carcinoma, IDC)石蜡样本151例,排除术前进行新辅助治疗的病例,从中筛选有完整临床资料和随访资料的70例IDC,由两位有经验的乳腺病理医师根据WHO(2012)乳腺肿瘤分类标准对所有纳入病例共同阅片,并进行组织学分级。70例患者中位年龄47.5岁,平均49.9岁(35~68岁),其中左侧乳腺31例(44.3%),右侧乳腺39例(55.7%)。48例(68.6%)患者伴同侧腋窝淋巴结转移,转移淋巴结数目1~31枚不等,1例患者伴骨转移,1例肺转移。Nottingham组织学分级:Ⅰ级5例(7.1%),Ⅱ级41例(58.6%),Ⅲ级24例(34.3%)。肿瘤临床分期:1期6例(8.6%),2期39例(55.7%),3期23例(32.9%),4期2例(2.9%)。70例患者随访时间10~52个月,其中61例(87.1%)存活,9例死于该病(12.9%)。
1.2方法
1.2.1免疫组化 采用免疫组化EnVision两步法进行染色[7],除Axl抗体购自Abclonal公司外,其余抗体及试剂均购自北京中杉金桥公司。Axl为兔多克隆抗体,ER、PR、HER-2、Ki-67为兔单克隆抗体,CK5/6为鼠单克隆抗体。定位于细胞膜和细胞质的抗体,采用枸橼酸水浴修复组织;定位于细胞核的抗体,采用EDTA水浴修复组织。Axl抗体以试剂公司提供的阳性切片作为阳性对照;ER、PR、CK5/6以乳腺内正常乳腺组织为阳性对照;HER-2以IDC中的3+病例作阳性对照;Ki-67以淋巴结生发中心为阳性对照;所有病例均以PBS代替一抗作为空白对照。
1.2.2荧光原位杂交 所有免疫组化染色评估为HER-2(2+)的病例,均进行荧光原位杂交检测。HER-2双色荧光探针购自广州安必平公司。石蜡组织4 μm厚切片,依次经二甲苯脱蜡,梯度乙醇水化,灭菌纯水洗涤后煮沸20 min,胃蛋白酶消化5~15 min后梯度乙醇脱水,杂交仪中85 ℃变性5 min,37 ℃杂交10~18 h,杂交完成后洗涤,DAPI复染细胞核,封固观察。以组织中≥75%的细胞核显示双色信号时视为杂交成功。
1.3结果判定HER-2蛋白表达结果由两位有经验的乳腺病理医师,根据2013年美国临床肿瘤学会/美国病理学家学会(ASCO/CAP)推荐的HER-2检测指南标准进行判读[8]:肿瘤细胞无包膜着色或≤10%的肿瘤细胞膜不完整的微弱阳性为0;>10%的肿瘤细胞膜不完整的微弱阳性为1+;>10%的肿瘤细胞膜不完整的弱到中等强度阳性或≤10%的肿瘤细胞膜完整的强阳性为2+;>10%的肿瘤细胞膜完整的强阳性为3+。荧光原位杂交检测结果由具有分子检测资质的病理医师根据2013年ASCO/CAP推荐的HER-2检测指南标准进行判读[8],连续计数40个浸润癌细胞,HER-2/CEP17比值≥2.0,或HER-2/CEP17比值<2.0,但平均HER-2拷贝数/细胞≥6.0均为HER-2阳性;HER-2/CEP17比值<2.0,且平均HER-2拷贝数/细胞<4.0为HER-2阴性;HER-2/CEP17比值<2.0,平均HER-2拷贝数/细胞≥4.0,但<6.0为HER-2原位杂交不确定。Axl蛋白阳性定位于细胞膜,根据肿瘤细胞膜着色强度计分:无着色为0分,弱着色为1分,中等强度为2分,强着色为3分;根据肿瘤阳性细胞所占比例计分:<5%为0分,5%~25%为1分,26%~50%为2分,50%~75%为3分,>75%为4分;将着色强度与阳性百分比评分相加得到肿瘤细胞阳性评分,≥4分即为高表达[9]。ER、PR、Ki-67蛋白以细胞核棕褐色着色为阳性,根据Allred评分标准[10]对染色结果进行判读:Allred评分总分为百分比评分与强度评分总和,总分≤2分为阴性,≥3分为阳性。按阳性百分比评分:无阳性细胞为0分,<1/100为1分,>1/100且<1/10为2分,≥1/10且<1/3为3分,≥1/3且<2/3为4分,≥2/3为5分;按阳性强度评分:无着色为0分,弱阳性为1分,中等阳性为2分, 强阳性为3分。肿瘤分子分型采用2015年St.Gallen国际专家共识推荐的乳腺癌分子分型标准进行分类[11]。
1.4统计学方法采用SPSS 16.0软件进行统计学分析,以P<0.05为具有统计学意义。Axl蛋白在不同分子亚型组、不同组织学级别及不同临床分期的表达差异采用方差分析,Axl蛋白与临床病理特征的相关性采用Spearman等级相关分析,生存分析采用Kaplan-Meier检验法。
2 结果
2.1肿瘤分子分型70例乳腺IDC免疫组化标记显示:51例(72.9%)ER(+),40例(57.1%)PR(+),4例(5.8%)CK5/6(+),19例(27.1%)HER-2(+),其中11例(15.7%)为HER-2(3+),8例为HER-2(2+),经荧光原位杂交证实为扩增病例。根据2015年St.Gallen国际专家共识推荐的乳腺癌分子分型标准[12],管腔A型8例(11.4%);管腔B型,HER-2(-)37例(52.9%);管腔B型,HER-2(+)7例(10.0%);HER-2亚型12例(17.1%);三阴型6例(8.6%),其中基底亚型4例(5.8%)。
2.2Axl蛋白表达与乳腺IDC临床病理特征的关系70例患者的肿瘤细胞膜均不同程度表达Axl蛋白,其中29例(41.4%)为高表达(≥4分),41例(58.6%)呈低至中等表达(<4分),且在浸润癌中的表达高于浸润灶旁的导管内癌(ductal carcinoma in situ, DCIS),高级别浸润癌中的表达高于低级别浸润癌(图1)。Axl蛋白表达在不同组织学级别(P<0.001)和不同分期(P=0.005)均有统计学意义,在不同分子分型间的表达差异无统计学意义(P=0.273)。采用相关性分析进一步提示Axl蛋白的表达与肿瘤级别(rs=0.651、P<0.001)、有无淋巴结转移(rs=0.474、P<0.001)以及转移数目(rs=0.550、P<0.001)、肿瘤分期(rs=0.355、P=0.003)、Ki-67增殖指数(rs=0.402、P=0.001)均呈正相关,与患者年龄(P=0.457)、肿瘤大小(P=0.682)、ER(P=0.416)、PR(P=0.574)、HER-2(P=0.150)状态及肿瘤的分子分型(P=0.344)均无相关性。
2.3生存分析70例患者中高表达Axl蛋白的患者总生存率(79.3%)低于中~低表达组患者(92.7%)(χ2=3.877,P=0.049,图2A),淋巴结转移数目<4的患者总生存率显著优于转移数目≥4的患者(χ2=4.783,P=0.029,图2B),但在淋巴结有无转移两组间,总生存率差异无统计学意义(χ2=0.001,P=0.980)。不同组织学级别与不同临床分期患者的总生存率,在本组中差异无统计学意义(χ2=0.058,P=0.809;χ2=2.425,P=0.119,图2C、D)。
3 讨论
酪氨酸激酶家族蛋白是一组跨膜蛋白,由受体酪氨酸激酶(receptor tyrosine kinases, RTKs)和非受体酪氨酸激酶(non-receptor tyrosine kinases, NRTKs)组成,RTKs被认为参与肿瘤形成,可作为肿瘤治疗的靶点[12]。RTKs中存在受体激酶TAM(包括Tyro-3、Axl、Mer),其中Axl最初分离自慢性粒细胞白血病细胞染色体19q13.2和20外显子[13],目前已在多种肿瘤组织中发现Axl蛋白过表达。本组乳腺IDC肿瘤细胞的细胞膜均有不同程度Axl蛋白表达,其表达在浸润性癌高于周边DCIS,在高级别浸润性癌中表达高于低级别浸润性癌,在不同组织学级别的表达具有差异性,且与肿瘤级别呈正相关,提示Axl蛋白的活化具有调节肿瘤细胞分化、促进肿瘤向高级别演进的作用,但其分子机制和演进过程尚不完全清楚。文献报道Axl与多个信号通路相关,其中PI3K/Akt通路是其主要的细胞内信号通路[2]。Axl是TGF-β1下游的效应器,可通过TGF-β1介导其表达对乳腺癌细胞进行调节,从而增强肿瘤细胞的浸润能力,降低细胞对化疗的敏感性,该调节作用部分依赖于PI3K/Akt-PAK1信号通路[6]。
图1A.Axl蛋白在DCIS中的表达,EnVision两步法;B.Axl蛋白在低级别IDC中的表达,EnVision两步法;C. Axl蛋白在高级别IDC的表达,EnVision两步法;D.Axl蛋白在淋巴结转移灶中的表达,EnVision两步法
既往体外实验研究还发现上调Axl蛋白的表达,能促进前列腺癌细胞的迁徙[14-15]和胰腺癌的远处转移[16]。本组伴淋巴结转移的患者Axl蛋白表达高于无转移者,且其表达与转移数目、临床分期和Ki-67增殖指数呈正相关,进一步提示Axl蛋白的高表达是肿瘤转移、演进和增殖的重要促进因素。文献报道Axl蛋白的表达上调与乳腺癌患者肿瘤分化、淋巴结转移及临床分期密切相关,认为Axl作为生长因子,在促进肿瘤浸润和转移中起重要作用[6,12],与本实验结果一致。Axl蛋白表达的上调可能与PI3K/Akt-PAK1信号分子的蛋白磷酸化水平有关,但其具体机制尚待进一步分析[6]。
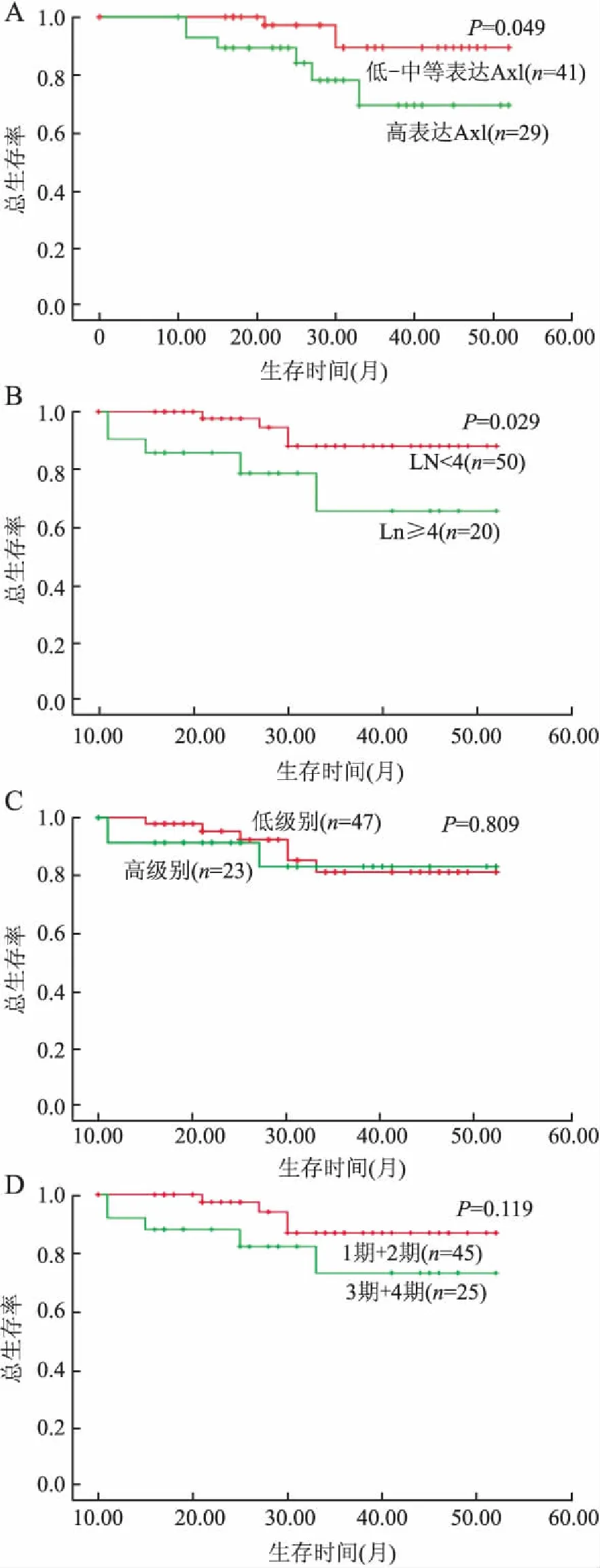
图270例浸润性乳腺癌患者不同Axl表达状态(A)、淋巴结转移状态(B)以及不同组织学分级(C)和不同临床分期(D)的Kaplan-Meier生存曲线
本组患者年龄、肿瘤大小、ER、PR及肿瘤分子分型与Axl蛋白的表达无相关性,文献报道ER能促进Axl的表达,两者的相互作用在乳腺上皮细胞增殖、分化和凋亡过程中起重要作用[17],同时PRB能使Axl的配体Gas6表达上调20倍。另有研究认为HER-2可活化Axl,具有重要的临床意义,但在本组中未发现ER、PR表达以及HER-2状态与Axl具有明确相关性,由于本组有完整随访资料的病例有限,有待进一步扩大样本深入分析。
本组生存分析显示,Axl蛋白的高表达预示患者总生存率下降,是预后的不良因素,Dunne等[18]在早期结肠癌患者中发现Axl水平的上调提示临床预后差,与本组结果一致。淋巴结转移对肿瘤患者预后具有提示作用,本组发现当淋巴结转移数目<4时,患者总生存率与无淋巴结转移者差异无显著性,但当转移数目≥4时,患者的总生存率显著下降,提示淋巴结转移状态对乳腺IDC患者预后的影响并不直接取决于是否有淋巴结转移,而是主要取决于转移数目,转移数目≥4提示患者预后不佳。
Axl蛋白作为跨膜酪氨酸激酶受体蛋白,在乳腺IDC中其高表达提示具有促进肿瘤演进的作用,包括向高级别肿瘤分化、增殖、浸润、转移等,提示患者预后不佳,对患者预后评估具有一定指导作用。目前,本实验在蛋白水平对Axl进行初探,在后续工作中将扩大样本量,并从分子水平进一步分析Axl及其配体在乳腺癌中的作用机制和对临床治疗的指导意义。
[1] Sasaki T, Knyazev P G, Clout N J,etal. Structural basis for Gas6-Axl signalling[J]. EMBO J, 2006,25(1):80-87.
[2] Korshunov V A. Axl-dependent signalling: a clinical update[J]. Clin Sci, 2012,122(8):361-368.
[3] Linger R, Keating A K, Earp H S,etal. TAM receptor tyrosine kinases: biologic functions, signaling, and potential therapeutic targeting in human cancer[J]. Adv Cancer Res, 2008,100:35-83.
[4] Lee H J, Jeng Y M, Chen Y L,etal. Gas6/Axl pathway promotes tumor invasion through the transcriptional activation of slug in hepatocellular carcinoma[J]. Carcinogenesis, 2014,35(4):769-775.
[5] D′Alfonso T M, Hannah J, Chen Z,etal. Axl receptor tyrosine kinase expression in breast cancer[J]. J Clin Pathol, 2014,67(8):690-696.
[6] Li Y, Jia L, Liu C,etal. Axl as a downstream effector of TGF-β1 via PI3K/Akt-PAK1 signaling pathway promotes tumor invasion and chemoresistance in breast carcinoma[J]. Tumor Biol, 2015,36(2):1115-1127.
[7] 张 莹,任占平,张 芫. Ki-67表达与乳腺癌分子分型及临床病理特征的关系[J]. 临床与实验病理学杂志, 2014,30(11):1220-1223.
[8] Wolff A C, Hammond M E, Hicks D G,etal. Recommendations for human epidermal growth factor receptor 2 testing in breast cancer: American Society of Clinical Oncology/College of American pathologists clinical practice guideline update[J]. J Clin Oncol, 2013,31(31):3997-4013.
[9] Ren D, Li Y, Gong Y, Xu J,etal. Phyllodes tumor of the breast: role of Axl and ST6GalNAcII in the development of mammary phyllodes tumors[J]. Tumor Biol, 2014,35(10):9603-9612.
[10] Allred D C, Harvey J M, Berardo M,etal. Prognostic and predictive factors in breast cancer by immunohistochemical analysis[J]. Mod Pathol, 1998,11(2):155-168.
[11] Coates A S, Winer E P, Goldhirsch A,etal. Tailoring therapies-improving the management of early breast cancer: St Gallen International Expert consensus on the primary therapy of early breast cancer 2015[J]. Ann Oncol, 2015,26(8):1533-1546.
[12] Wu X, Liu X, Koul S,etal. AXL kinase as a novel target for cancer therapy[J]. Oncotarget, 2014,5(20):9546-9563.
[13] Verma A, Warner S L, Vankayalapati H,etal. Targeting Axl and mer kinases in cancer[J]. Mol Cancer Ther, 2011,10(10):1763-1773.
[14] Paccez J D, Vasques G J, Correa R G,etal. The receptor tyrosine kinase Axl is an essential regulator of prostate cancer proliferation and tumor growth and represents a new therapeutic target[J]. Oncogene, 2013,32(6):689-698.
[15] Shiozawa Y, Pedersen E A, Patel L R,etal. GAS6/AXL axis regulates prostate cancer invasion, proliferation, and survival in the bone marrow niche[J]. Neoplasia, 2010,12(2):116-127.
[16] Song X, Wang H, Logsdon C D,etal. Overexpression of receptor tyrosine kinase Axl promotes tumor cell invasion and survival in pancreatic ductal adenocarcinoma[J]. Cancer, 2011,117(4):734-743.
[17] Mackiewicz M, Huppi K, Pitt J J,etal. Identification of the receptor tyrosine kinase AXL in breast cancer as a target for the human miR-34a microRNA[J]. Breast Cancer Res Treat, 2011,130(2):663-679.
[18] Dunne P D, Mcart D G, Blayney J K,etal. AXL is a key regulator of inherent and chemotherapy-induced invasion and predicts a poor clinical outcome in early-stage colon cancer[J]. Clin Cancer Res, 2014,20(1):164-175.
