卵巢癌中gC1qR的表达及其凋亡机制
2018-01-15张静敏郭凌川
王 伟,纪 捷,程 雪,张静敏,郭凌川
卵巢癌在女性生殖系统恶性肿瘤中发病率位居第3位,病死率位居首位,近年其发病率呈逐年上升趋势[1]。目前,卵巢肿瘤细胞减灭术加辅助化疗是晚期卵巢癌的规范性治疗方案,但治疗过程中易出现卵巢癌细胞的原发性和获得性多药耐药现象。球状C1q受体(gC1qR)属于线粒体膜蛋白,具有多重生物学功能,在机体抗感染、炎症、细胞增殖、凋亡等生物学过程中发挥重要作用[2]。本文着重探讨gC1qR基因在卵巢癌中的表达及其生物学意义,为临床和病理医师提供参考。
1 材料与方法
1.1材料收集2013年6月~2016年5月南京医科大学附属妇产医院诊治的48例卵巢癌患者,经病理学确诊,临床资料完整。患者年龄33~67岁,平均(52.1±14.2)岁;浆液性囊腺癌35例,黏液性囊腺癌12例,子宫内膜样癌1例。另收集癌旁组织48例无癌细胞浸润作为对照。所有标本取材后均置于-79 ℃保存。
1.2试剂及仪器MEM培养基、胎牛血清、胰蛋白酶购自Gibco公司;T4DNA连接酶、各种限制性内切酶由Invitrogen公司提供;Trizol、Taq DNA酶、RNA酶抑制剂、逆转录酶M-MLV、Oligo(dT)15及dNTPs购自美国Sigma公司;gC1qR和β-actin基因引物由上海博亚公司合成。Prime 7300荧光定量PCR仪购自美国ABI公司。
1.3卵巢癌细胞培养卵巢癌细胞株SKOV3由杭州赫贝公司提供。卵巢癌细胞株SKOV3接种于含有10%小牛血清的DMEM完全培养液中,置于37 ℃ 5%CO2饱和湿度培养箱内培养,显微镜下观察,待细胞贴壁生长,3天后换液,除去非贴壁细胞。当卵巢癌细胞布满瓶底时,可继续传代。
1.4RT-PCR检测取100 mg肿瘤组织研磨成粉末后加入定量Trizol。按常规提取总RNA,以β-actin为内参照进行gC1qR的定量检测,gC1qR引物与探针的设计是根据GenBank上gC1qR cDNA序列,其上游序列:5′-AATCACACGGTAGACACTGAAATGCC-3′,下游序列为:5′-CATCATCCCATCTAAAATGTCCCCTG-3′,探针序列:5′-TGCTCCAGTTCAACCAACGTCCTTCTC-3′。β-actin引物上游序列:5′-TCACCCACACTGTGCCCATCTATGA-3′,下游序列:5′-CATCGGAACCGCTCATTGCCGATA-3′,探针序列:5′-ACGCGCTCCCCCATGCCATCCTGCGT-3′。PCR反应体系在ABI Prime 7300定量PCR检测仪,参数设为50 ℃ 2 min、95 ℃ 5 min、95 ℃ 20 s、60 ℃ 2 min,33个循环,单点荧光在60 ℃进行检测。选择FAM荧光检测模式,对于实验数据,以下公式进行计算:2-ΔΔCT=2-(CT.gC1qR-CT.actin)Time x+(CT.gC1qR-CT.actin)Time 0。
1.5gC1qR质粒转染与分组将培养的卵巢癌细胞分为3组,分别为pcDNA3.1-gC1qR载体、pcDNA3.1空载体及不经任何处理的空白组。转染前将0.8 μg质粒DNA稀释在50 μL Opti-MEM液体中,充分混匀,室温放置5 min;将2.0 μL Lipofectamine稀释在50 μL Opti-MEM液体中,充分混匀,室温放置10 min。将上述两种液体混合,室温放置30 min,将混合液分别加入卵巢癌细胞培养瓶中,37 ℃ 5%CO2孵箱培养6~8 h,换液,加入完全培养液继续培养24 h,以pcDNA3.1载体中的绿色荧光蛋白(GFP)的表达判断质粒的转染效率,确定最佳收获卵巢癌细胞的时间。
1.6Westernblot法检测取卵巢癌组织剪碎加入细胞裂解液均匀裂解,以1 500 r/min离心5 min,取上清液定量,备用。每个标本取100 μg总蛋白上样置于SDS-PAGE胶的样孔内,进行电泳。目的蛋白被适当分离后,将转膜后的PVDF膜放入含5%的脱脂奶粉TBS中封闭2 h;加入5%脱脂奶粉稀释一抗,摇床上37 ℃孵育4 h,以TBS洗3次,每次15 min,加入HRP结合的二抗(购自Cell Signaling公司),37 ℃孵育1 h。TBST洗涤后,化学发光、显影、定影。以Bio-Rad凝胶成像分析仪,对印迹条带进行灰度扫描,采用以下公式计算:目的蛋白/内参蛋白。
1.7免疫组化染色所有组织均经10%中性福尔马林固定,石蜡包埋,4 μm厚连续切片,免疫组化采用SP法染色。微波抗原修复后,依次加入3%过氧化氢和正常非免疫动物血清封闭,温育15 min;滴加一抗50 μL,4 ℃过夜;PBS冲洗,加二抗(购自美国Santa Cruz公司)37 ℃,1 h,DAB显色并适时终止,苏木精复染2 min,盐酸甲醇分化后脱水,透明,中性树胶封固,镜下观察。免疫组化结果判断以细胞质内有棕褐色颗粒为阳性。
1.8卵巢癌细胞线粒体功能检测
1.8.1卵巢癌细胞内活性氧(ROS)的测定 将卵巢癌细胞接种至6孔培养板,实验如上述分组,卵巢癌细胞培养至指定时间,加入终浓度为10 μmol/L H2DCFDA孵育20 min,经37 ℃ 5%CO2培养箱中静置0.5 h,以PBS洗涤细胞3次;倒置荧光显微镜检测细胞内ROS产生(激发光488 nm、发射光530 nm),以对照组的荧光强度作为细胞内ROS水平。
1.8.2卵巢癌细胞内线粒体膜电位的测定 将卵巢癌细胞接种至6孔培养板,实验如上述分组,卵巢癌细胞培养至指定时间,加入终浓度为10 μmol/L的JC-1,37 ℃ 20 min;荧光显微镜下检测JC-1单体时的变化(激发波长485 nm、发射波长530 nm),以对照组的荧光强度作为细胞内线粒体膜电位。
1.8.3卵巢癌细胞线粒体内Ca2+测定 将卵巢癌细胞消化,PBS液重悬细胞,1 000 r/min离心5 min,弃上清;用PBS重悬细胞1~2 mL,加入Fluo-3/AM-DMSO,调整终浓度为5 μmol/L,混匀,37 ℃避光孵育45 min;1 000 r/min 离心5 min,弃上清,PBS调整细胞浓度为每毫升1×106个细胞,流式细胞仪检测。
1.9卵巢癌细胞增殖活性的测定MTT比色法:用含10%胎牛血清配成单个细胞悬液,接种至96孔板;5%CO2、37 ℃培养48 h,每孔加入MTT溶液20 μL,继续培养4 h,终止培养,弃上清。每孔加DMSO 150 μL,震荡10 min,采用OD 490 nm波长,在酶联免疫检测仪上测定各孔的吸光度值,以时间为横坐标、吸光度值为纵坐标绘制卵巢癌细胞生长曲线。
1.10卵巢癌细胞迁移的测定采用Transwell实验,实验前将卵巢癌细胞饥饿24 h,用含BSA的无血清培养基调整细胞密度为每毫升5×105个细胞。取卵巢癌细胞悬液100 μL置于Transwell小室,小室下室加入600 μL含20%FBS培养基,培养24 h,以0.1%结晶紫染色20 min,通过细胞染色,显微镜下直接计数“贴壁”细胞,计算卵巢癌细胞的迁移能力。
1.11卵巢癌细胞凋亡检测取对数生长期的卵巢癌细胞,1 000 r/min离心5 min,弃上清。PBS充分洗涤细胞2次,用250 μL结合缓冲液重新悬浮细胞。取100 μL的细胞悬液重悬细胞,加入5μL Annexin FITC和10 μL的PI溶液,室温避光孵育30 min。加入400 μL结合缓冲液,1 h内流式细胞仪分析检测。采用激发光488 nm,用一波长为515 nm的通带滤器检测FITC荧光,另一波长大于560 nm的滤器检测PI。

2 结果
2.1卵巢癌组织中gC1qR的表达PCR检测结果显示,42例(87.5%)卵巢癌组织中gC1qR mRNA表达水平下调,癌旁组织中3例(6.25%)gC1qR mRNA表达水平下调(P<0.001);同期以Western blot法检测gC1qR蛋白表达,结果显示44例(91.7%)卵巢癌组织中蛋白表达水平下调,而癌旁组织中仅5例(10.4%)蛋白表达下调,差异有统计学意义(P<0.001,图1);采用免疫组化SP法检测gC1qR蛋白,其主要表达于细胞质中;gC1qR基因在卵巢癌组织中的表达明显低于其相应的癌旁组织,两者差异具有显著性(P<0.05)。
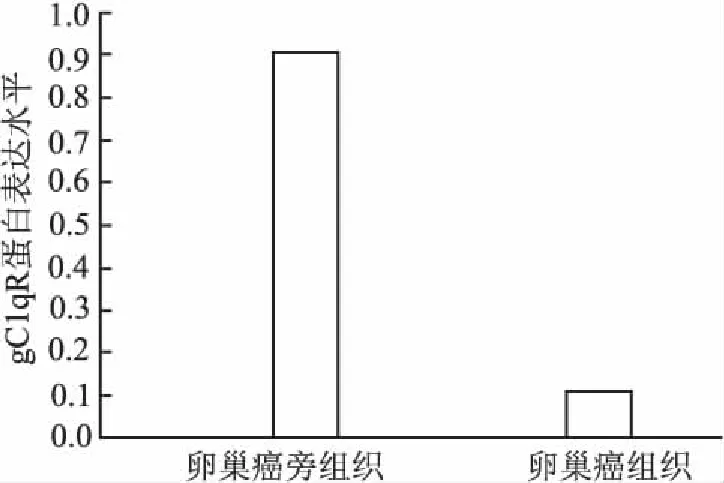
图1 gC1qR 蛋白表达
2.2卵巢癌细胞株SKOV3的形态与质粒转染
2.2.1光学显微镜形态 卵巢癌细胞形态为多角形或短梭形,胞核居中呈圆形或椭圆形,核仁多为2~3个。质粒转染培养至48 h,pcDNA3.1-gC1qR质粒转染组,卵巢癌细胞形态变小、变圆,胞质回缩,细胞间隙显著增大,细胞核变小、变圆,细胞质相对较大,核质比例变小,核仁数量显著减少,随着转染时间的延长,贴壁生长的细胞数量明显减少,溶解与死亡的细胞数目显著较多,伴随出现大量细胞溶解碎片。空载体组与PBS组,细胞排列密集,间隙小,细胞形态正常,核质比大,核仁多见,两者形态无明显差异。
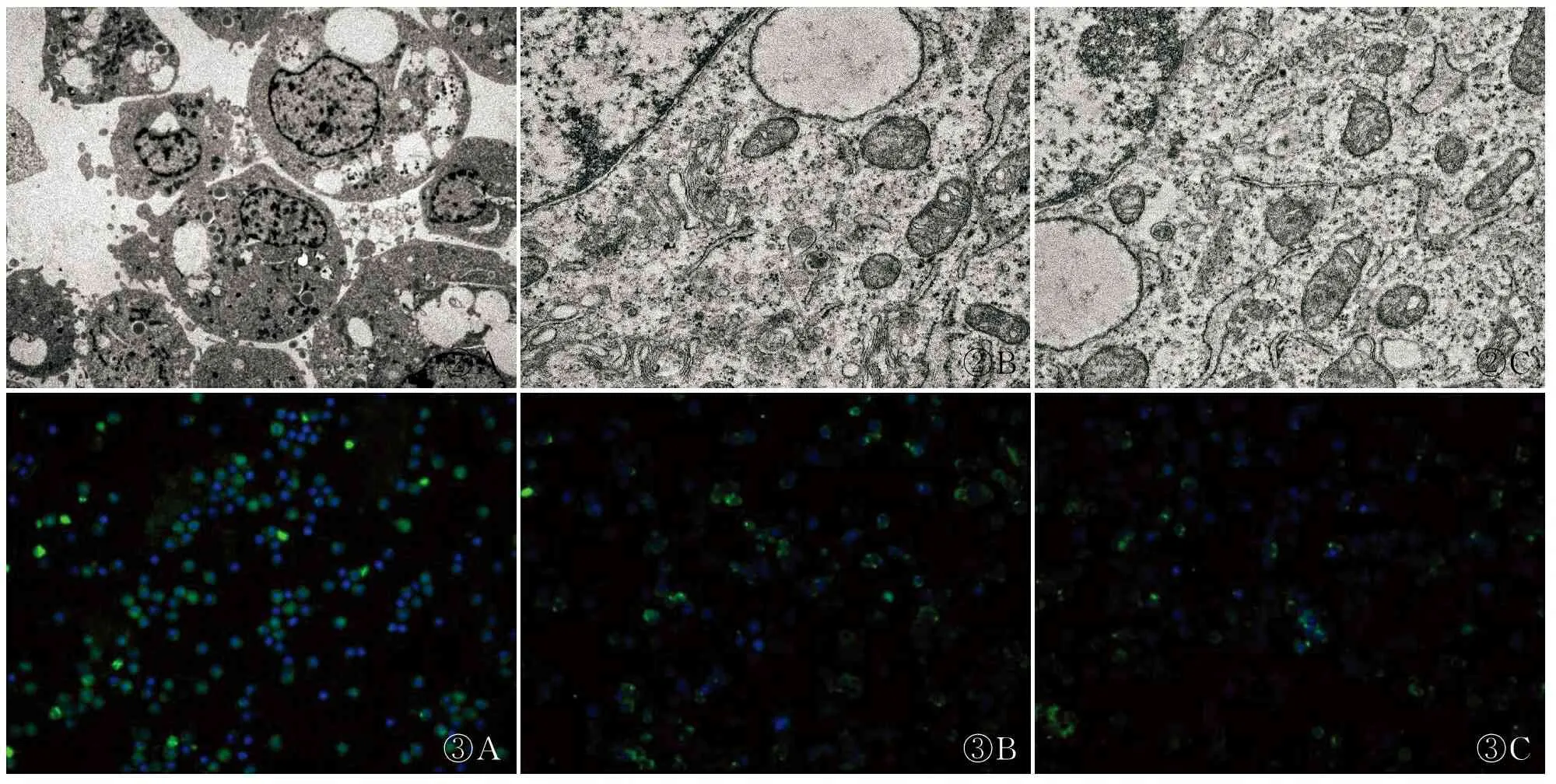
2.2.2透射电镜形态 质粒转染48 h后,观察pcDNA3.1空载体组显示,细胞核质比较大,核仁多为2~3个,且体积较大,细胞表面有大量微绒毛,与PBS组比较,细胞形态基本正常,无显著改变。观察pcDNA3.1-gC1qR质粒组显示,细胞形态出现显著改变:细胞表面微绒毛明显减少,细胞质体积相对增大,出现大量空泡,部分细胞器变性,形成凋亡小体,细胞核边缘化,核凝缩并发生断裂,细胞核内染色质增多且边缘化(图2)。
2.2.3细胞免疫荧光 将培养的SKOV3细胞分别转染pcDNA3.1-gC1qR质粒和pcDNA3.1空载体,绿色荧光为系统指示标记荧光,蓝色荧光为gC1qR蛋白表达,48 h后荧光显微镜观察显示,与PBS组比较,pcDNA3.1-gC1qR质粒组,蓝色荧光表达量显著增多,且主要富集于细胞质中;而与pcDNA3.1-gC1qR质粒组比较,pcDNA3.1空载体组,蓝色荧光表达量显著减少(图3)。
2.2.4gC1qR蛋白的表达 实验结果表明,pcDNA3.1-gC1qR质粒组蛋白表达水平显著升高,其升高分别为pcDNA3.1空载体组与PBS组的5.06倍(P<0.001)和3.34倍(P<0.001);pcDNA3.1空载体组与PBS组之间,差异无统计学意义(P>0.05)。
2.3卵巢癌细胞SKOV3的生物学功能检测
2.3.1gC1qR基因对SKOV3细胞增殖及凋亡的影响 MTT法实验结果表明,与PBS组比较,转染pcDNA3.1-gC1qR质粒48 h,SKOV3细胞增殖率呈显著下降,两组差异有统计学意义(P<0.01),而pcDNA3.1空载体组与PBS组比较,差异无统计学意义(P>0.05)。
Transwell实验数据表明,转染pcDNA3.1-gC1qR质粒48 h后,发生迁移的SKOV3细胞数量仅为PBS组的47.3%,两组比较差异有显著性(P<0.01),而pcDNA3.1空载体作用于卵巢癌细胞,实验结果显示与PBS组比较,差异无统计学意义(P>0.05)。
②A②B②C③A③B③C
图2SKOV3细胞超微结构:A.pcDNA3.1-gC1qR质粒;B.pcDNA3.1空载体;C.PBS组图3SKOV3细胞荧光定位:A.pcDNA3.1-gC1qR质粒;B.pcDNA3.1空载体;C.PBS组
流式细胞技术检测所得数据表明,与PBS组比较,pcDNA3.1-gC1qR质粒组卵巢癌细胞凋亡数量显著增多,差异有统计学意义(P<0.001);与PBS组相比,pcDNA3.1空载体组卵巢癌细胞凋亡数量未见明显增多,差异无统计学意义(P>0.05,图4)。
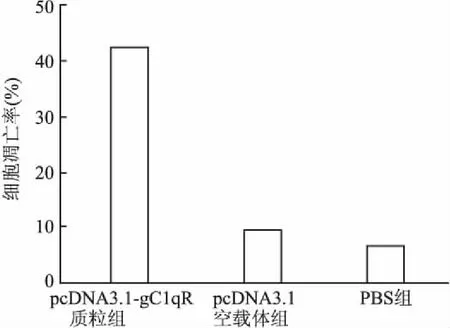
图4 SKOV3细胞凋亡检测
2.3.2gC1qR基因对SKOV3细胞线粒体功能的影响 转染48 h后,透射电镜观察卵巢癌细胞线粒体形态的改变。pcDNA3.1空载体组与PBS组电镜下可见卵巢癌细胞线粒体形态基本正常,无显著改变,线粒体嵴清晰可见;gC1qR基因质粒转染组电镜下可见线粒体形态发生显著改变,线粒体嵴断裂、消失、基质呈疏松状态,部分线粒体明显肿胀,围绕在细胞核周围呈密集排列,小部分线粒体甚至呈空泡状(图5)。
本实验检测线粒体的功能指标:PCR对线粒体拷贝数进行检测,结果发现与PBS组相比,gC1qR基因过表达可显著减少线粒体拷贝数,两组相比差异有统计学意义(P<0.01);pcDNA3.1空载体组卵巢癌线粒体拷贝数与PBS组相比,差异无统计学意义(P>0.05)。Fluo-3/AM荧光检测细胞线粒体内Ca2+浓度,与PBS组相比gC1qR基因过表达,卵巢癌细胞线粒体内Ca2+负荷显著增多,差异有统计学意义(P<0.01);空载体质粒组与PBS比较,Ca2+浓度差异无显著性(P>0.05)。
应用H2DCFDA、JC-1荧光探针,观察细胞内的ROS含量及线粒体膜电位改变。所得实验数据表明,与PBS对照组比较,转染质粒组gC1qR基因过表达能显著诱导SKOV3细胞ROS的产生(P<0.001,图6);同时,gC1qR基因过表达能显著降低SKOV3线粒体膜电位,与PBS对照组相比,差异有统计学意义(P<0.001)。pcDNA3.1空载体质粒组,ROS的产生、线粒体膜电位与PBS组比较,差异均无统计学意义(P>0.05)。
3 讨论
细胞凋亡、增殖是多细胞生物体保持细胞数量作为锚定在线粒体膜表面的gC1qR蛋白,具有多向性调节作用,如参与了细胞周期的进程、细胞的增殖、蛋白质的加工翻译以及细胞衰老与凋亡等生理功能[4-5]。研究发现,作为补体C1q受体,在外源性化学毒物作用下,gC1qR可介导单核细胞的凋亡,影响单核细胞的生物学功能[6]。文献报道,gC1qR基因可诱导p53表达,致使子宫颈癌细胞凋亡[7-8]。本组实验数据显示,pcDNA3.1-gC1qR载体转染卵巢癌细胞48 h,SKOV3细胞增殖、迁移率明显降低,而细胞的凋亡率显著增加,且细胞呈显著的凋亡特征;同期透射电镜下观察卵巢癌细胞形态有显著改变:细胞表面微绒毛明显减少,细胞质体积相对增大,出现大量空泡,部分细胞器变性,形成凋亡小体,细胞核边缘化,核凝缩并发生断裂,细胞核内染色质增多且边缘化;以上结果提示:gC1qR基因过表达对卵巢癌细胞的凋亡有促进作用。

ABC
图5SKOV3细胞线粒体形态:A.pcDNA3.1-gC1qR质粒组;B.pcDNA3.1空载体组;C.PBS组

图6 SKOV3细胞线粒体ROS总量
动态平衡的重要生理过程[3],因细胞凋亡有别于病理条件下细胞坏死,研究者积极探索细胞凋亡的本质,以期发现细胞凋亡在多种疾病中的重要作用,实现治疗、预防疾病的临床意义。
线粒体作为引发细胞内源性凋亡途径的主要执行细胞器,应激因素作用下,线粒体膜通透性增高,释放的Cyt C与Apaf-1结合,激活Caspase家族引发细胞最终凋亡程序[9]。已知线粒体可以通过以下途径实现细胞凋亡:(1)释放相关的凋亡因子引发细胞凋亡;(2)损坏电子传递链,扰乱氧化磷酸化过程,抑制ATP的产生;(3)破坏细胞的抗氧化能力[10-11]。当外源性物质刺激细胞时,线粒体作为ROS产生的重要场所,ROS产生量明显增多[12]。高水平的ROS致使线粒体损伤,进而引发线粒体膜电位的改变,释放p21、Bax及Caspase 3等各种促凋亡因子诱导细胞,引发凋亡[13]。gC1qR作为锚定在线粒体上的膜蛋白,其过表达可显著诱导卵巢癌上皮细胞的凋亡,同时gC1qR还能有效诱导卵巢癌细胞线粒体功能的改变。首先,实验结果发现gC1qR质粒转染卵巢癌细胞,其线粒体拷贝数显著减少;且线粒体嵴断裂、消失、基质呈疏松状态,部分线粒体明显肿胀,围绕在细胞核周围呈密集排列,小部分线粒体甚至呈空泡状;其次,gC1qR基因过表达,卵巢癌细胞线粒体内Ca2+负荷显著增多;最后,gC1qR基因可显著诱导卵巢癌细胞ROS的产生、降低线粒体膜电位,本实验结果与文献报道高度一致。
综上所述,本组结果表明,gC1qR基因在卵巢癌细胞凋亡中发挥重要作用,在该过程中gC1qR基因可通过引发线粒体功能障碍,诱导卵巢癌细胞凋亡。
[1] Yin H, Kristensen S G, Jiang H,etal. Survival and growth of isolated pre-antral follicles from human ovarian medulla tissue during long-term 3D culture[J]. Hum Reprod, 2016,31(7):1531-1539.
[2] Liu Z, Ruan H J, Gu P Q,etal. The roles of p38 MAPK and ERK1/2 in coplanar polychlorinated biphenyls-induced apoptosis of human extravillous cytotrophoblast-derived transformed cells[J]. Cell Physiol Biochem, 2015,36(6):2418-2432.
[3] Zhang J, Zhu D, Wang Y, Ju Y. Andrographolide attenuates LPS-induced cardiac malfunctions through inhibition of IκB phosphorylation and apoptosis in mice[J]. Cell Physiol Biochem, 2015,37(4):1619-1628.
[4] Paasonen L, Sharma S, Braun G B,etal. New p32/gC1qR ligands for targeted tumor drug delivery[J]. Chembiochem, 2016,17(7):570-575.
[5] She Z G, Hamzah J, Kotamraju V R,etal. Plaque-penetrating peptide inhibits development of hypoxic atherosclerotic plaque[J]. J Control Release, 2016,238:212-220.
[6] Santa K, Ohsawa T, Sakimoto T. Para-nonylphenol induces apoptosis of U937 human monocyte leukemia cells in vitro[J]. Endocr Metab Immune Disord Drug Targets, 2016,16(3):213-223.
[7] Chen Z L, Gu P Q, Liu K,etal. The globular heads of the C1q receptor regulate apoptosis in human cervical squamous carcinoma cells via ap53-dependent pathway[J]. J Transl Med, 2012,10:255.
[8] 马玉着, 胡建鹏, 吴生兵,等. 子宫颈鳞癌组织中Toll样受体4、7、9蛋白表达及意义[J]. 临床与实验病理学杂志, 2013,29(11):1198-1202.
[9] Zhao X, Ren X, Zhu R,etal. Zinc oxide nanoparticles induce oxidative DNA damage and ROS-triggered mitochondria-mediated apoptosis in zebrafish embryos[J]. Aquat Toxicol, 2016,180:56-70.
[10] Bell K, Wilding C, Funke S,etal. Protective effect of 14-3-3 antibodies on stressed neuroretinal cells via the mitochondrial apoptosis pathway[J]. BMC Ophthalmol, 2015,15:64.
[11] Kanemura S, Tsuchiya A, Kanno T,etal. Phosphatidylinositol induces Caspase-independent apoptosis of malignant pleural mesothelioma cells by accumulating AIF in the nucleus[J]. Cell Physiol Biochem, 2015,36(3):1037-1048.
[12] Gu Z T, Li L, Wu F,etal. Heat stress induced apoptosis is triggered by transcription-independent p53, Ca2+dyshomeostasis and the subsequent Bax mitochondrial translocation[J]. Sci Rep, 2015,5:11497.
[13] Cai J, Cao S, Chen J,etal. Progesterone alleviates acute brain injury via reducing apoptosis and oxidative stress in a rat experimental subarachnoid hemorrhage model[J]. Neurosci Lett, 2015,600:238-243.
