67例儿童先天性肺囊性病变影像学特征
2018-01-05项蔷薇潘知焕
项蔷薇,潘知焕
(1.温州医科大学附属第二医院育英儿童医院 变态反应与免疫科,浙江 温州 325027;2.苍南县人民医院儿科,浙江 温州 325800)
67例儿童先天性肺囊性病变影像学特征
项蔷薇1,潘知焕2
(1.温州医科大学附属第二医院育英儿童医院 变态反应与免疫科,浙江 温州 325027;2.苍南县人民医院儿科,浙江 温州 325800)
目的:总结67例儿童先天性肺囊性病变影像学特征,为临床早期正确诊断先天性肺囊性病变提供依据。方法:选择温州医科大学附属第二医院育英儿童医院2000年1月至2016年1月收治的67例先天性肺囊性病变患儿作为研究对象,分析患儿临床资料,总结其临床、影像学表现。结果:支气管源性囊肿影像学表现为单发囊肿29例,多发囊肿13例,表现为圆形或类圆形,边界清楚,囊内表现为空洞、液性、气液性,囊壁厚薄不一。先天性肺囊性腺瘤样畸形表现为单侧肺部一叶或多叶多发气囊肿8例,肺部高密度影4例,左肺下叶巨大液气囊肿1例。肺隔离症影像学可见胸腔内扩张肠管与腹腔肠管相延续,健侧肺脏受压明显,另有3例见肺部高密度影,可见多个囊状或蜂窝状透亮影,1例CTA提示左下肺动静脉瘘,1例病变位于左肺下叶,呈蜂窝状囊状改变。结论:先天性肺囊性病变临床表现及体征无明显特异性,若影像学上表现为单发或多发空洞、液性、气液性囊肿需要考虑该疾病的可能。
先天性肺囊性病变;支气管源性囊肿;先天性肺囊性腺瘤样畸形;先天性大叶性肺气肿;肺隔离症
先天性肺囊性病变分为支气管源性囊肿(bronchogenic syst,BC)、先天性大叶性肺气肿(congenital lobaremphysena,CLE)、先天性肺囊性腺瘤样畸形(congenital cystic adenomatoid malformation,CCAM)及肺隔离症(bronchopulmonary sequestration,PS)四大病理类型[1-2]。早期发现及诊断可以避免患儿日后反复肺部感染,解除患儿痛苦。但先天性肺囊性病变临床表现较为相似,缺乏特异性,给诊断带来一定难度。因此,笔者回顾分析我院外科手术切除并经病理确诊的先天性肺囊性病变患儿67例,研究其临床特点及影像学表现,以期早期发现儿童先天性肺囊性病变,作出正确的诊断和治疗。
1 对象和方法
1.1 对象 选取本院2000年1月至2016年1月收治的67例先天性肺囊性病变患儿,年龄1 d~18岁,男41例,女26例。纳入标准:①经手术取得肺组织标本行病理学检查证实为先天性肺囊性病变,或者结合临床表现及胸部X线、胸部CT影像学诊断;②年龄≤18岁;③临床资料完整。排除标准:①临床资料不完整;②继发性肺囊肿性疾病;③年龄>18岁。本研究经本院伦理委员会批准,均获得所有患儿监护人的知情同意。
1.2 方法 在温州医科大学附属第二医院育英儿童医院病案室检索选取67例先天性肺囊性病变患儿临床资料,总结其年龄、性别等一般特点,分析其临床症状、肺部体征,及其胸部X线、胸部CT等资料,归纳分析比较其影像学特点。
1.3 统计学处理方法 应用SPSS17.0统计软件进行统计学分析。计数资料采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 67例先天性肺囊性病变患儿,BC 42例,占63.0%;CCAM 13例,占19.0%;PS 8例,占12.0%;BC合并PS患儿1例,占1.5%;CCAM合并PS患儿2例,占3.0%;CLE 1例,占1.5%。
2.2 各型先天性肺囊性病变患儿临床症状 发热、咳嗽、咯痰是最常见的临床症状,分别占40.3%、73.1%、65.7%,BC呼吸困难发生比例为13/42,CCAM、PS为3/24,差异无统计学意义(χ2=2.832,P=0.09)。2.3 各型先天性肺囊性病变患儿临床体征 临床体征以肺部呼吸音减低和呼吸音粗糙为主,部分患儿可无病理性体征;PS、CCAM呼吸音减低发生比例为5/24,BC为16/42,差异无统计学意义(χ2=2.098,P=0.10)。
2.4 先天性肺囊性病变影像学特征
2.4.1 BC:42例BC患儿中囊肿位于肺内32例,纵隔内8例,其他部位2例(1例位于右侧颈部,1例位于胸骨上窝);影像学表现病变呈单发囊肿病例29例,多发囊肿病例13例,表现为圆形或类圆形,边界清楚,囊内表现为空洞、气液平、液性,囊肿大小不一,部分较大的囊肿存在压迫周围气管、纵隔等正常组织,致其受压向健侧移位;病灶周围感染炎症渗出后表现为囊壁厚度增加,边缘欠清、密度增高。
2.4.2 CCAM:13例患儿中,8例患儿的CT表现为单侧肺部一叶或多叶多发气囊肿(见图1),4例为表现为肺部高密度影,其余1例为左肺下叶巨大液气囊肿。其中10例患儿行胸部X线检查,表现为肺部囊肿5例(其中1例合并有气胸可能),肺大泡和肺炎各2例,支气管扩张伴感染1例。

图1 患儿,男,6岁,CCAM,CT肺窗显示为单侧多发气囊肿
2.4.3 PS:8例PS患儿均行CT检查,其中3例患儿见胸腔内扩张肠管与腹腔肠管相延续,健侧肺脏受压明显,另有3例见肺部高密度影,可见多个囊状或蜂窝状透亮影(见图2),1例CTA提示左下肺动静脉瘘,1例病变位于左肺下叶,呈蜂窝状囊性改变。

图2 患儿,女,9岁,PS,CT肺窗表现为肺部高密度影,伴多个囊状影
2.4.4 BC合并PS:BC合并PS患儿1例,X线胸片表现为两上肺、左下肺炎症性改变,左侧见胸腔积液;CT表现为左侧胸腔内囊性占位,左肺下叶后内基底段示片状蜂窝状囊性高密度改变,边界欠清晰。
2.4.5 CCAM合并PS:CCAM合并PS患儿2例,1例胸片表现为右侧横隔抬高,肺部未见明显异常,CT表现为膈肌膨隆,肺部未见异常,考虑隔离肺;1例为左肺下叶多发囊状改变,囊肿大小不等,最大直径>2 cm,左肺下叶后内基底段见软组织影,密度不均,胸骨下段凹陷明显。
2.4.6 CLE:CLE患儿1例,X线胸片与CT均表现为左肺上叶密度减低,肺纹理稀疏,与中下肺叶边缘清晰,呈阶梯样分界,气管略向右侧移位;右肺下叶炎症性改变(见图3)。
2.5 各型先天性肺囊性病变分布范围 结果显示囊性病变以右肺为多,支气管源性囊肿患儿左右肺发病比例差异无统计学意义(P>0.05),见表1。
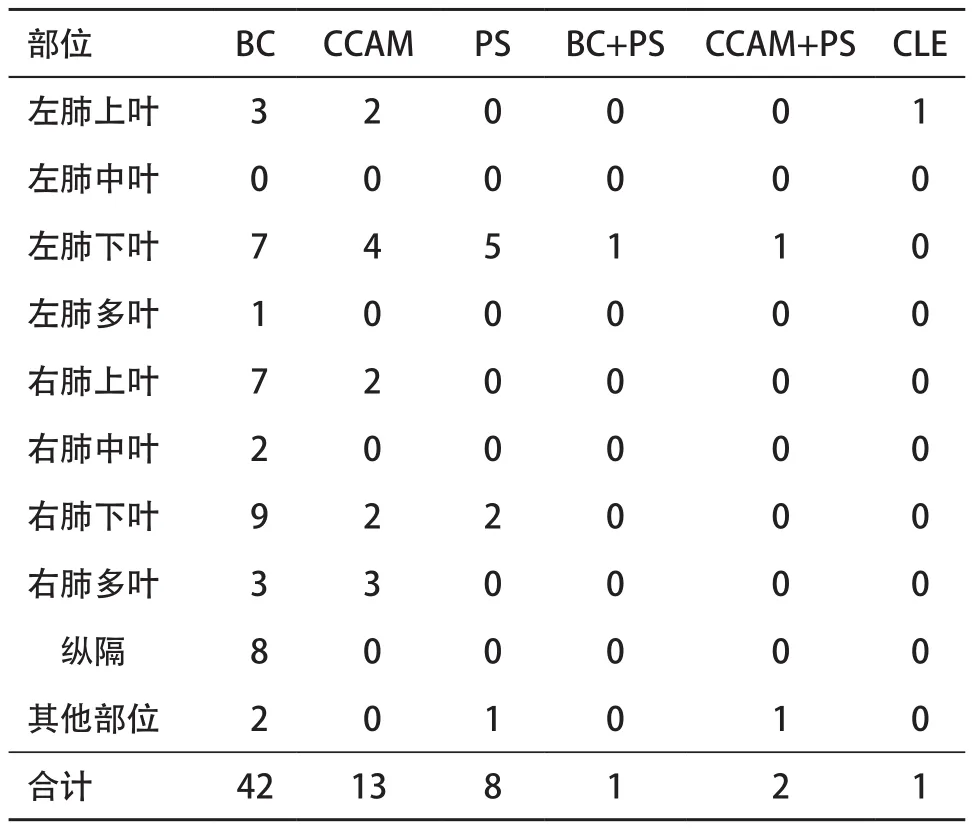
表1 各型先天性肺囊性病变发病部位(例)
3 讨论
先天性肺囊性病变是由于胚胎时期肺部先天发育异常而引起的疾病,临床比较少见。先天性肺囊性疾病均为器质性病变,难以自愈,且存在反复感染,压迫周围正常组织,影响患儿生长发育,因此建议不管有无症状,确诊后均应及时手术治疗[3]。先天性肺囊性病变无明显特异的症状及体征,因此给早期识别与准确诊断带来一定难度。本研究显示各型先天性肺囊性病变最常见的临床症状为发热、咳嗽、咳痰,分别占40.3%、73.1%、65.7%,其次是气促/呼吸困难,占23.9%。根据患儿的囊肿性质、大小及感染情况,先天性肺囊性病变的患儿可出现呼吸音减低、粗糙、干湿啰音及三凹征等体征[4]。本研究发现各型先天性肺囊性病变患儿出现肺部呼吸音减低和呼吸音粗糙等体征,部分患儿无病理性体征。
因此,先天性肺囊性病变的影像学诊断显得尤为重要。不同类型的肺囊肿在影像学表现及病变部位有所区别,一般单发或多发囊肿性改变为多见,囊肿可为气性、液性及气-液混合性,也可表现为肺部高密度影,较大的囊肿可压迫周围气管、纵隔等正常组织,导致受压部位移位。有部分先天性肺囊性畸形病变可混合存在,本研究入组病例中,BC合并PS患儿1例,CCAM合并PS患儿2例。
本研究共有BC患儿42例,其中单发囊肿29例,多发囊肿13例。囊肿表现为圆形或类圆形,边界清楚,囊内表现为空洞、气液平、液性,囊肿大小不一,部分较大的囊肿存在压迫周围气管、纵隔等正常组织,致其受压向健侧移位;病灶周围感染炎症渗出后表现为囊壁厚度增加,边缘欠清、密度增高。CCAM根据形态可分为大囊型、小囊型和实性型[5]。大囊型CCAM的X线表现为占据胸腔的单个含气大囊,类似气胸,少见为大小不等的多发囊状改变。大囊型容易致纵隔移位,或者伴有纵隔疝。小囊型表现为多发蜂窝状小囊样改变,以薄壁的含气囊腔占多数,大小相近,伴发感染时出现囊壁增厚。实性型CCAM可出现肺实变、肺不张的改变,常可见双下肺多发致密突变影,易与肺部感染相混淆。本研究共有CCAM患儿13例,其中有8例患儿的CT表现为单侧肺部一叶或多叶多发气囊肿,肺部高密度影4例,左肺下叶巨大液气囊肿1例。PS分为按解剖部位分为肺内型和肺外型。PS肺内型可见下叶后基底段圆型或椭圆形致密影,少数为分叶状或三角形。PS合并感染时因感染部位与邻近支气管相通,出现单发或多发的含气囊腔。肺外型PS多表现为左下叶后基底段部位的密度均匀的致密软组织影。本研究显示PS的X线表现为肺内高密度影,类似肺部炎症。本研究8例PS患儿均行CT检查,其中3例患儿见胸腔内扩张肠管与腹腔肠管相延续,健侧肺脏受压明显,另有3例见肺部高密度影,可见多个囊状或蜂窝状透亮影,1例CTA提示左下肺动静脉瘘,1例病变位于左肺下叶,呈蜂窝状囊性改变,诊断左肺PS。SFAKIANAKI等[7]报道CT发现PS患者异常血管的敏感性为97%,特异性为47%。有研究报道CCAM和PS有类似的发育起源,常合并存在[8-9]。因此,术前诊断CCAM的患儿常需行CT增强扫描或血管三维重建等予鉴别,本组有2例患儿术后病理检查确诊CCAM合并PS。CLE的X线上可见病变肺叶进行性膨大,透亮度异常增强[6]。本研究CLE患儿1例,X线胸片表现为左肺上叶密度减低,肺纹理稀疏,与中下肺叶边缘清晰,气管略向右侧移位。CT影像学表现为左肺上叶低密度影,肺纹理稀疏,与中下肺叶边缘清晰,呈阶梯样分界,气管略向右侧移位;右肺下叶呈炎症性改变。
不同类型先天性肺囊性病变的好发部位也不一样。BC根据病变部位分为纵隔型、肺内型及异位型,最常见的是纵隔型,其次是肺内型,异位型罕见报道,但国内外曾有直肠后、颈部及左心室等处发病的病例报道[10-12]。本组42例BC病变患儿中肺内型有32例,占76.2%,其中双肺下叶16例(占50%),纵隔型有8例(占19%),其他位置2例(占4.8%,1例位于右侧颈部,1例位于胸骨上窝),与MCADAMS等[13]报道不一致,可能与肺内型因易发生临床症状而被发现,纵隔肿块不易出现临床症状而被忽视有关。CCAM以单侧单叶多见,尤其是下叶,较少累及双侧及多叶。本研究共13例CCAM患儿,其中左肺上叶2例,左肺下叶4例,右肺上叶2例,右肺下叶2例,右肺多叶3例,未见肺外病例。PS有叶外型和叶内型,叶内型约66.4%,最多见于左肺下叶后后基底段[14]。本组8例PS患儿5例病变部位在左肺下叶,与文献报道一致。CLE临床研究报道较少,且呈逐年减少现象,目前文献报道最常见的发病部位为左肺上叶,其次是右肺上叶和右肺中叶[15]。本研究CLE患儿1例,发病部位在左肺上叶。本组先天性肺囊性病变的整体发病情况中,左右肺发病比例差异无统计学意义,双肺下叶发病比例高于双肺上叶,故先天性肺囊性病变患儿在肺内的病变主要见于双肺下叶。
综上所述,先天性肺囊性病变发病率较低,其临床症状及体征缺乏特异表现,因此影像学检查对于该病的诊断非常重要。认真学习和总结各型肺囊性病变的影像学特征,有利于正确诊断,及早治疗。
[1] DURELL J, LAKHOO K. Congenital cystic lesions of the lung[J]. Early Hum Dev, 2014, 90(12): 935-939.
[2] PULIGANDLA P S, LABERGE J M. Congenital lung lesions[J]. Clin Perinatol, 2012, 39(2): 331-347.
[3] GIUBERGIA V, BARRENECHEA M, SIMINOVICH M,et al. Congenital cystic adenomatoid malformation: clinical features, pathological concepts and management in 172 cases[J]. J Pediatr (Rio J), 2012, 88(2): 143-148.
[4] STOCKER J T. Cystic lung disease in infants and children[J]. Fetal Pediatr Pathol, 2009, 28(4): 155-184.
[5] ZHANG Z J, HUANG M X. Children with congenital cystic adenomatoid malfamation of the lung CT diagnosis[J]. Int J Clin Exp Med, 2015, 8(3): 4415-4419.
[6] HANNON E J, CHAKRABORTY A, PLATT K, et al. Finding vessels——accuracy of CT for identifying anomalous feeding vessels in patients with congenital cystic lung lesions[J]. Eur J Pediatr Surg, 2010, 20(3): 169-173.
[7] SFAKIANAKI A K, COPEL J A. Congenital cystic lesions of the lung: congenital cystic adenomatoid malformation and bronchopulmonary sequestration[J]. Rev Obstet Gynecol, 2012, 5(2): 85-93.
[8] LIMA M, GARGANO T, RUGGERI G, et al. [Clinical spectrum and management of congenital pulmonary cystic lesions][J]. Pediatr Med Chir, 2008, 30(2): 79-88.
[9] NEWMAN B, CAPLAN J. Cystic lung lesions in newborns and young children: differential considerations and imaging[J]. Semin Ultrasound CT MR, 2014, 35(6): 571-587.
[10] NOLASCO-DE L R, NUNEZ-TRENADO L A, ROMANGUZMAN E, et al. Neck bronchogenic cyst. Case report and review of the literature[J]. Cir Cir, 2016, 84(3): 235-239.
[11] PASQUER A, DJEUDJI F, HERVIEU V, et al. A rare retrorectal presentation of a bronchogenic cyst: A case report[J].Int J Surg Case Rep, 2016, 24: 112-114.
[12] WANG J, ZHU Q, LIANG B, et al. Left Ventricular Bronchogenic Cyst[J]. Ann Thorac Surg, 2016, 101(2): 744-746.
[13] MCADAMS H P, KIREJCZYK W M, ROSADO-DECHRISTENSON M L, et al. Bronchogenic cyst:imaging features with clinical and histopathologic correlation[J]. Radiology, 2000, 217(2): 441-446.
[14] WEI Y, LI F. Pulmonary sequestration: a retrospective analysis of 2625 cases in China[J]. Eur J Cardiothorac Surg,2011, 40(1): e39-42.
[15] CHINYA A, PANDEY P R, SINHA S K, et al. Congenital lobar emphysema: Pitfalls in diagnosis[J]. Lung India, 2016,33(3): 317-319.
Imaging features of 67 cases of children’s congenital cystic lung lesions
XIANG Qiangwei1, PAN Zhihuan2.
1.Department of Pediatric Allergy and Immunology, the Second Aff i liated Hospital & Yuying Children’s Hospital of Wenzhou Medical University, Wenzhou, 325027; 2.Department of Pediatric, the People’s Hospital of Cangnan, Wenzhou, 325800
Objective: To summarize the imaging features of 67 cases of children’s congenital cystic lung lesions, so as to diagnosis these disease timely. Methods: Sixty seven cases of congenital cystic lung lesions children were collected in the Second Af fi liated Hospital & Yuying Children’s Hospital of Wenzhou Medical University from January 2000 to January 2016. The clinical data and imaging fi ndings were retrospectively analyzed.Results: For patients of bronchogenic cyst, 29 cases showed solitary cyst, 13 cases were found with multiple systs. For patients of congenital cystic adenomatoid malformation, 8 cases were found multiple air syst in unilateral single or multiple lung lobe, 4 cases were showed pulmonary high density shadow, 1 cases were found huge liquid-gas syst in left lower lobe. For patients of pulmonary sequestration, 3 cases were found of pulmonary high density shadow, 1 cases of CTA showed pulmonary arterio-venous fi stula, 1 cases of CTA were showed honeycomb cystic in lower lobe of left lung. Conclusion: There are no speci fi c manifestations and signs in patient with congenital cystic lung lesions. If the imaging performance are solitary or multiple cavities, liquid, or gas-liquid cyst, the possibility of congenital cystic lung lesions may need to be considered.
congenital cystic lung lesions; bronchogenic cyst; congenital cystic adenomatoid malformation;congenital lobar emphysema; pulmonary sequestration
R445
A
10.3969/j.issn.2095-9400.2017.11.013
2017-03-08
项蔷薇(1980-),女,浙江苍南人,主治医师,硕士。
贾建敏)
