在乳腺癌腋窝淋巴结清扫术中应用腋窝反向映像技术的可行性与肿瘤学安全性
2018-01-05施勇温涛黄凯明王科郑晶燕李校堃
施勇,温涛,黄凯明,王科,郑晶燕,李校堃
(1.温州医科大学 药学院 浙江省生物技术制药工程重点实验室,浙江 温州 325035;2.温州医科大学附属第六医院 乳腺疾病诊治中心/甲状腺乳腺外科,浙江 丽水 323000)
在乳腺癌腋窝淋巴结清扫术中应用腋窝反向映像技术的可行性与肿瘤学安全性
施勇1,2,温涛2,黄凯明2,王科2,郑晶燕2,李校堃1
(1.温州医科大学 药学院 浙江省生物技术制药工程重点实验室,浙江 温州 325035;2.温州医科大学附属第六医院 乳腺疾病诊治中心/甲状腺乳腺外科,浙江 丽水 323000)
目的:研究在乳腺癌腋窝淋巴结清扫术中应用腋窝反向映像(ARM)技术的可行性与肿瘤学安全性。方法:选取30例乳腺癌改良根治术患者,应用亚甲蓝溶液进行术前注射染色定位淋巴结;在术中行腋窝淋巴结清扫时,切除蓝染淋巴结进行病理学检测。结果:30例乳腺癌患者中,21例患者成功检出蓝染的淋巴结,失败9例,检出蓝染淋巴结25枚,均未见明显癌转移。切除淋巴结的21例患者无一例出现上肢淋巴结水肿。结论:运用亚甲蓝溶液注射法进行ARM技术进行淋巴结追踪定位是可行的,且肿瘤负荷安全。
腋窝反向映像技术;乳腺肿瘤;上肢水肿;淋巴结切除术;肿瘤学安全性
随着乳腺微创功能化手术理念的变化,前哨淋巴结活检(sentinel lymph node dissection,SLND)技术得到广泛开展,但是对于腋窝淋巴结阳性或者前哨淋巴结转移的浸润性乳腺癌患者还是有必要进行腋窝淋巴结清扫术(axillary lymph node dissection,ALND),但ALND会导致部分手术患者发生患侧上肢淋巴水肿等并发症,其主要原因是术中离断或者结扎了部分引流上肢区域的淋巴管,从而致使上肢淋巴发生回流障碍。腋窝反向映像(axillary reverse mapping,ARM)技术是一种可以相对精确地追踪和展示淋巴管的方法,通过使用亚甲蓝溶液等染料在腋窝处标记定位上肢淋巴引流通路,方便手术医师在乳腺癌腋窝手术中保留染色的淋巴管及淋巴结,从而保持上肢淋巴通道的顺畅,在不增加肿瘤复发与转移的情况下,降低上肢淋巴水肿的发生率[1]。本研究应用亚甲蓝溶液注射法进行ARM的临床研究,探讨ARM的可行性和肿瘤学安全性,现报告如下。
1 资料和方法
1.1 病例资料 选取丽水市人民医院乳腺中心2012年12月至2015年12月收治的女性乳腺浸润性导管癌患者30例,年龄32~69岁,平均(51.6±9.3)岁,肿瘤直径1.2~4.5 cm,平均(2.45±2.56)cm。术前经粗针穿刺病理学证实,30例患者中I IA 11例,IIB 16例,I I IA 3例;管腔上皮A型(luminal A)5例(占16.7%),管腔上皮B型(luminal B)14例(占46.7%),HER2过表达型5例(占16.7%),基底样型(三阴性)6例(占20.0%)。术前体格检查均可扪及腋窝淋巴结肿大,B超引导下细针穿刺细胞学检查证实为腋窝淋巴结癌转移。30例患者术前均未曾接受新辅助内分泌及新辅助化学治疗,存在基础疾病者(如高凝状态)、高龄患者、腋窝既往有手术史者均予剔除。术前所有患者均签署知情同意书,本研究经丽水市人民医院伦理委员会备案通过。
1.2 手术步骤 常规消毒后,距腋窝7 cm露出上臂。手术切开皮肤前30 min在患侧乳房的上臂内侧注射0.5%亚甲蓝溶液5.0 mL(距离腋下6 cm处进针,见图1),注射层次为皮下以及肱二头肌与肱三头肌的肌间沟,注射部位按摩10 min,并抬高上肢。按层次解剖腋窝,电刀切开胸锁筋膜后,钝性分离暴露术野,在腋静脉上下方区域、内侧三角和外侧三角区域探查蓝染的淋巴管和淋巴结(见图2-5)。解离蓝染的淋巴结送标本制作,蓝染的淋巴管尽可能予以保留(见图6)。上述ARM淋巴结手术完成后,继续乳腺的切除手术和ALND。
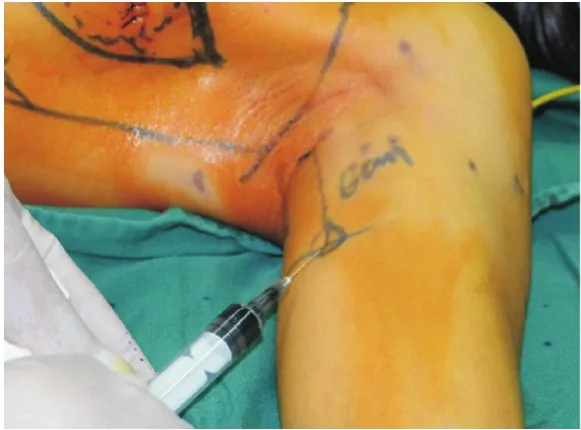
图1 术前亚甲蓝注射位置图
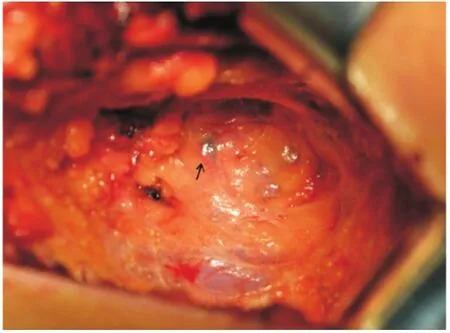
图2 蓝染的ARM淋巴结(箭头标注)
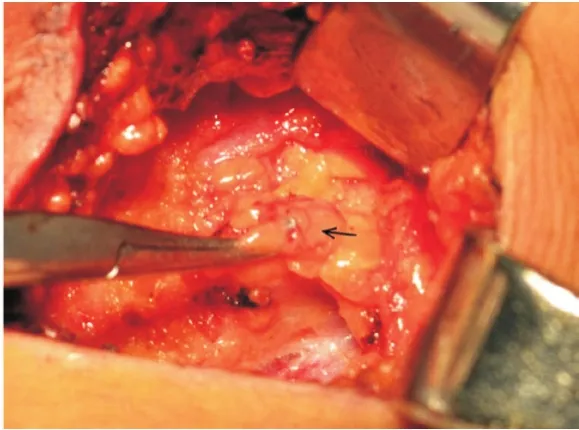
图3 蓝染的ARM淋巴结(箭头标注)
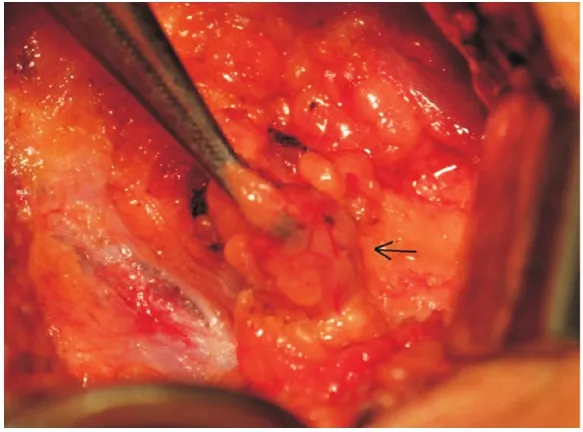
图4 蓝染的ARM淋巴结(箭头标注)
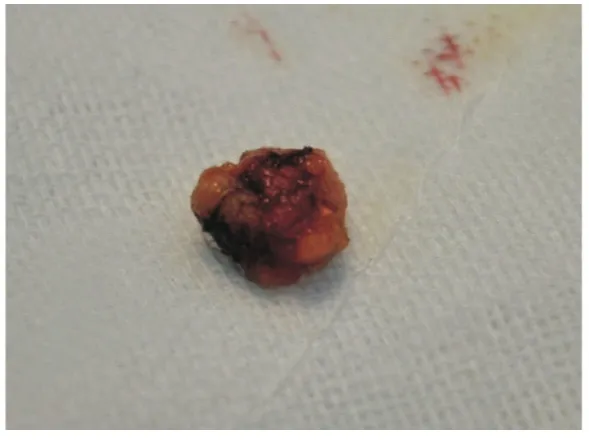
图5 蓝染的ARM淋巴结(离体)
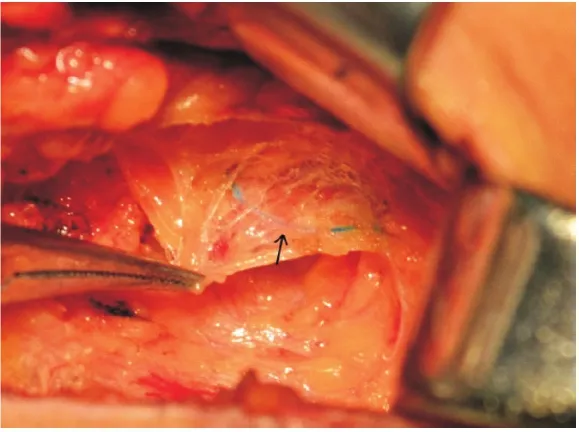
图6 染色淋巴管(箭头标注)
1.3 淋巴结标本制备与免疫组织化学染色判定ARM淋巴结离体后,马上由专人检查标本,收集淋巴结,并记录收集的淋巴结数目,测量淋巴结的直径,将数据录入数据库。将一半的淋巴结标本进行4%中性甲醛固定,石蜡包埋,多层连续切片:每个蜡块间隔40 pm,分别切取3个层面,每个层面之间间隔4 pm,连续切3次,共3层面9张石腊片。每个层面的3张切片分别进行HE常规免疫组织化学染色、EMA和CK20染色。参照阴性和阳性对照,EMA染色以细胞膜及细胞质出现棕黄色颗粒,CK20染色以细胞质出现黄色颗粒判定为阳性,表示存在微转移。
1.4 术后辅助治疗 全部患者接受术后辅助化疗,其中26例患者接受EC-T方案化疗:表阿霉素60 mg/m2,环磷酰胺600 mg/m2,21 d为1个周期,维持4周期后序贯4次多西紫杉醇100 mg/m2,21 d为1个周期,维持4周期;4例患者接受EC-TH方案化疗和靶向治疗:表阿霉素60 mg/m2,环磷酰胺600 mg/m2,21 d为1个周期,维持4周期后序贯4次多西紫杉醇100 mg/m2,联合曲妥珠单抗(赫赛汀)6 mg/kg,21 d为1个周期,维持4周期,化疗完成后继续曲妥珠单抗6 mg/kg,21 d为1个周期,直至维持1年,其中1例HER2过表达型患者由于经济原因放弃靶向治疗,仅接受EC-T序贯化疗。6例患者完成术后辅助化疗后,接受常规术后辅助放疗,5 000 Gy/(25次·5周)。2例患者接受戈舍瑞林卵巢功能抑制+依西美坦片内分泌治疗,3例接受戈舍瑞林卵巢功能抑制+三苯氧胺片内分泌治疗,3例接受单纯三苯氧胺片内分泌治疗,11例绝经后患者接受单纯来曲唑片内分泌治疗。
1.5 淋巴结肿瘤学安全性评估标准 采用病理学来判定ARM淋巴结是否转移,淋巴结是否存在肿瘤负荷。ARM淋巴结常规以HE染色、免疫组织化学染色、EMA和CK20染色来检测。病理学评估标准分宏转移和微转移。宏转移判读标准∶淋巴结完整包膜内可见一个以上直径>2 mm的癌肿病灶。微转移判读标准:癌肿病灶0.2~2.0 mm或者单张组织病理切片不连续或接近连续的细胞簇>200个细胞。孤立肿瘤细胞:单个细胞或最大直径≤0.2 mm的小细胞簇,单张组织病理切片不连续或接近连续的细胞簇≤200个细胞。孤立肿瘤细胞判定为微转移。
2 结果与随访
2.1 结果 30例患者中,21例患者术中探查到蓝染淋巴管及淋巴结,其中发现蓝染淋巴结25枚,蓝染淋巴结数最多患者为4枚。术中见大部分蓝染的淋巴结位于上肢腋静脉的下方和肋间臂神经的上方区域、背阔肌外缘的内侧以及胸长血管的外侧这一区域范围内。30例患者术后病理均证实腋窝淋巴结存在转移,最多转移淋巴结数为34枚,所有病例的蓝染淋巴结均为阴性。
2.2 随访 随访3年,28例患者生存,2例患者死亡(分别生存18个月和23个月),测量上臂周径大于2 cm为上肢淋巴水肿,本组无一例出现上肢淋巴水肿。
3 讨论
2014年Z0011临床试验研究(ACOSOG)结果表明:对于临床体检腋窝淋巴结阴性而SLND阳性的乳腺癌患者,做与不做ALND,其总生存、无病生存和局部复发率无显著差异[2],从而确立了SLND在乳腺癌微创治疗中的地位。对于前哨淋巴结转移阳性负荷严重的患者或术前腋窝淋巴结已经证实转移的患者标准的手术方式还是ALND,ALND可致淋巴管损伤而致上肢淋巴水肿发生[3]。ARM概念的提出就是为了最大限度地保留上肢引流淋巴系统,从而使乳腺癌相关的上肢淋巴水肿发生率下降。
3.1 ARM与上肢淋巴水肿发生率 有报道称,乳腺癌ALND后患侧上肢淋巴水肿的发生率是34%~62%[4-5]。上肢淋巴水肿发生率不同的主要原因是目前没有准确测量淋巴水肿的标准方法,同时也与手术者的习惯及技能相关。有学者认为,过多解剖腋静脉周围会使术后上肢淋巴水肿的发生率增高,仅清扫level I、I I淋巴结时,上肢淋巴水肿发生率只有2.7%~5.0%[6]。1992年MORTON等[7]首次提出了SLND,此技术的出现对ALND的理念产生了冲击,外科医师重新认识ALND的临床价值[1,8]。与ALND相比,SLND明显降低上肢淋巴水肿的发生率,但是仍不能完全消除上肢淋巴水肿的发生,说明在SLND的操作过程中还是可能损伤了引流上肢的淋巴管。本组21患者均切除ARM淋巴结,保留淋巴管,随访6个月以上未发现上肢淋巴水肿发生。虽然预防术后上肢淋巴水肿是ARM技术的最终目的,但目前研究发现,保留ARM淋巴结或淋巴管降低了术后上肢水肿的发生率,而切除ARM淋巴结或淋巴管未必会导致术后上肢水肿的发生。THOMPSON等[9]研究表明,保留ARM淋巴结或淋巴管的18例患者均未发生上肢淋巴水肿;而切除ARM淋巴结和淋巴管的患者中,上肢水肿发生率为7.7%~15.4%[10-12]。切除ARM淋巴结不一定会导致上肢淋巴水肿发生的原因是上肢淋巴管呈网状结构,引流上肢的淋巴通道存在多条,切除其中任何一个淋巴结,不会影响其他通道的阻塞,对上肢淋巴回流障碍影响不大,不至于发生上肢淋巴水肿;另外破坏上肢淋巴通道并不是造成术后上肢水肿的唯一原因,还有其他重要的影响因素:如术前或术后放疗、体型、患肢功能锻炼情况等[13-15]。全面完整评价ARM技术对术后上肢水肿发生率的影响,需考虑上述因素进行综合分析。
3.2 ARM的临床操作技术与检出率 THOMPSON等[9]采用亚甲蓝溶液进行注射染色,18例患者中检出11例ARM相关的淋巴结和淋巴管;HAYES等[16]采用亚甲蓝溶液染色技术,21例患者中15例患者检出ARM相关淋巴结;其他报道用亚甲蓝溶液染色技术定位的淋巴结检出率为65%~82%[17-18]。本组检出率为70%(21/30),与文献报道相似,但是本组最初实验的4例全部失败,术前注射亚甲蓝溶液的时间从15 min延长到30 min后,检出率明显提高。术中未发现蓝染淋巴管及淋巴结的原因一方面考虑可能与亚甲蓝溶液注射技巧以及注射时间有关;另一方面可能与手术室温度以及亚甲蓝溶液在淋巴管的滞留时间长短有关。雷睿文等[19]应用纳米炭示踪行ARM,成功率为97.1%(34/35)。纳米炭混悬液具有优良的嗜淋巴性和时效性,示踪时间是亚甲蓝的6~8倍,在淋巴管有效示踪后,在仔细保护上臂淋巴管的同时,可以对腋窝淋巴结进行清晰、有序、安全的清扫,但纳米炭混悬液价格昂贵,患者经济负担较重。
3.3 ARM肿瘤学相关的安全性 本研究中,虽然ARM淋巴结显影率仅为70%,但21例患者无一例ARM淋巴结转移。对于临床腋窝淋巴结阴性而SLND阳性而进行ALND的患者中,KUMAR等[20]报道未见ARM淋巴结转移,但是部分研究显示,行腋窝ALND的患者中存在ARM淋巴结癌转移,比例为10.0%~36.8%[6,21-24]。至于患者是否存在淋巴结网交集而造成上肢淋巴结转移的可能,目前存在分歧[20,25],ARM的首位提出者[9]认为,上肢淋巴回流的通路和乳腺的淋巴回流通路是相对独立的;假如今后大样本的循证医学证据能够证实乳腺和上肢的淋巴通路是相互独立的,和乳腺癌的转移是没有相关性,肿瘤安全性是良好的,才能使ARM技术在临床广泛推广应用,但是在本组研究中即使切除ARM淋巴结也没有一例发生上肢淋巴水肿,所以保留ARM淋巴结是否可以减少上肢淋巴水肿的发生和提高生存质量,是否可以给乳腺癌患者带来巨大的获益,需要我们以后有更多的临床数据来证实[26-28]。
总之,ARM从技术层面上来说是可行的,但是目前临床研究样本量少,随访时间短,需要更多的前瞻性研究来肯定其技术价值,我们期待有更多的学者关注并深入研究这项技术。
∶
[1] TUMMEL E, OCHOA D, KOROURIAN S, et al. Does axillary reverse mapping prevent lymphedema after lymphadenectomy[J]. Ann Surg, 2017; 265(5): 987-992.
[2] JAGSI R, CHADHA M, MONI J, et al. Radiation fi eld design in the ACOSOG Z0011 (Alliance) Trial[J]. J Clin Oncol, 2014, 32(32): 3600-3606.
[3] WILLIAMS A F, FRANKS P J, MOFFATT C J. Lymphoedema: estimating the size of the problem[J]. Palliat Med,2005, 19(4): 300-313.
[4] MANSEL R E, FALLOWFIELD L, KISSIN M, et al. Randomized multicenter trial of sentinel node biopsy versus standard axillary treatment in operable breast cancer: the ALMANAC Trial[J]. J Nat l Cancer Inst, 2006, 98(9): 599-609.
[5] BLANCHARD D K, DONOHUE J H, REYNOLDS C,et al. Relapse and morbidity in patients undergoing sentinel lymph node biopsy alone or with axillary dissection for breast cancer[J]. Arch Surg, 2003, 138(5): 482-487.
[6] NOGUCHI M, YAGASAKI R, KAWAHARA F, et al. Breast conserving treatment versus modif i ed radical mastectomy in Japanese patients with operable breast cancer[J]. Int Surg,1997, 82(3): 289-294.
[7] MORTON D L, WEN D R, WONG J H, et al. Technical details of intraoperative lymphatic mapping for early stage melanoma[J]. Arch Surg, 1992, 127(4): 392-399.
[8] HSUEH E C, GIULIANO A E. Sentinel lymph node technique for staging of breast cancer[J]. Oncologist, 1998; 3(3):165-170.
[9] THOMPSON M, KOROURIN S, HENRY-TILLMAN R,et al. Axillary reverse mapping (ARM): A new concept to identify and enhance lymphatic preservation[J]. Ann Surg Oncol, 2007, 14(6): 1890-1895.
[10] BONETI C, KOROURIAN S, BLAND K, et al. Axillary reverse mapping:mapping and preserving arm lymphatics may be important in preventing lymphedema during sentinel lymph node biopsy[J]. J Am Coll Surg, 2008, 206(5): 1038-1042.
[11] BONETI C, KOROURIAN S, DIAZ Z, et al. Scientif i c Impact Award: axillary reverse mapping (ARM) to identify and protect lymphatics draining the arm during axillary lymphadenectomy[J]. Am J Surg, 2009, 198(4): 482-487.
[12] HAN J W, SEO Y J, CHOI J E, et al. The eff i cacy of arm node preserving surgery using axillary reverse mapping for preventing lymphedema in patients with breast cancer[J]. J Breast Cancer, 2012, 15(1): 91-97.
[13] AHMED R L, SCHMITZ K H, PRIZMENT A E, et al. Risk factors for lymphedema in breast cancer survivors, the lowa Women’s Health Study[J]. Breast Cancer Res Treat, 2011,130(3): 981-991.
[14] KWAN M L, DARBIBIAN J, SCHMITZ K H, et al. Risk factors for lymphedema in a prospective breast cancer survivorship study: the Pathways Study[J]. Arch Surg, 2010,145(11): 1055-1063.
[15] SHAH C, WILKINSON J B, BASCHNAGEL A, et al. Factors associated with the development of breast cancer-related lymphedema after whole breast irradiation[J]. Int J Radiat Oncol Biol Phys, 2012, 83(4): 1095-1100.
[16] HAYES S B, FREEDMAN G M, LI T, et al. Does axillary boost increase lymphedema compared with supraclavicular radiation alone after breast conservation?[J]. Int J Radiat Oncol Biol Phys, 2008, 72(5): 1449-1455.
[17] PETREK J A, SENIE R T, PETERS M, et al. Lymphedema in a cohort of breast carcinoma survivors 20 years after diagnosis[J]. Cancer, 2001, 92(6): 1368-1377.
[18] KHAN S A. Axillary reverse mapping to prevent lymphedema after breast cancer surgery: def i ning the limits of the concept[J]. J Clin Oncol, 2009, 27(33): 5494-5496.
[19] 雷睿文, 欧林洋, 黄湛,等. 逆行腋窝淋巴结示踪术对预防乳腺癌术后上肢淋巴水肿的作用[J]. 广东医学, 2014, 35(5): 704-707.
[20] KUMAR K S, HEMANTH G N, PANJWANI P K, et al.Feasibility of axillary reverse mapping and clinicopathological features predicting ARM node metastasis in breast cancer-a pilot study[J]. J Surg Oncol, 2017, 8(2): 119-122.
[21] RUBIO I T, CEBRECOS I, PEG V, et al. Extensive nodal involvement increases the positivity of blue nodes in the axillary reverse mapping procedure in patients with breast cancer[J]. J Surg Oncol, 2012, 106(1): 89-93.
[22] NGUI N K, FRENCH J, KILDY C J, et al. Axillary reverse mapping in patients with breast cancer: Is it oncologically safe[J]. J Surg Oncol, 2016, 113(7): 726-731.
[23] GANDHI S J, SATISH C, SUNDARAM P S, et al. Feasibility study of axillary reverse mapping lymphoscintigraphy in carcinoma breast:A concept toward preventing lymphedema[J]. Indian J Nucl Med, 2016, 31(1): 9-13.
[24] BEEK M A, GOBARDHAN P D, KLOMPENHOUWER E G,et al. Axillary reverse mapping (ARM) in clinically node positive breast cancer patients[J]. Eur J Surg Oncol, 2015,41(1): 59-63.
[25] OCHOA D, KORAURIAN S, BOETI C, et al. Axillary reverse mapping: fi ve-year experience[J]. Surgery, 2014, 156(5): 1261-1268.
[26] TAUSCH C, BAEGE A, DIETRICH D, et al. Can axillary reverse mapping avoid lymphedema in node positive breast cancer patients[J]. Eur J Surg Oncol, 2013, 39(8): 880-886.
[27] GEBRUERS N, TJALMA W A. Clinical feasibility of axillary reverse mapping and its inf l uence on breast cancer related lymphedema: a systematic review[J]. Eur J Obstet Gynecol Reprod Biol, 2016, 200: 117-122.
[28] PARKS R M, CHEUNG K L. Axillary reverse mapping in N0 patients requiring sentinel lymph node biopsy-A systematic review of the literature and necessity of a randomised study[J]. Breast, 2017, 33: 57-70.
Feasibility of using axillary reverse mapping technique in breast cancer surgery and oncological safety
SHI Yong1,2, WEN Tao2, HUANG Kaiming2, WANG Ke2, ZHENG Jingyan2, LI Xiaokun1.
1.School of Pharmaceutical Sciences, Wenzhou Medical University, Key Laboratory of Biotechnology Pharmaceutical Engineering of Zhejiang Province, Wenzhou, 325035; 2.Department of Comprehensive Breast Health Center, Thyroid and Breast Surgery, the Six Aff i liated Hospital of Wenzhou Medical University, Lishui, 323000
Objective: To research the feasibility of axillary reverse mapping (ARM) in axillary lymph node dissection for breast cancer patients and the safety of the tumor. Methods: Thirty patients with modi fi ed radical mastectomy for breast cancer were treated with methylene blue solution for lymph node biopsy. The axillary lymph node dissection was performed and the lymph nodes were removed for histopathological examination.Results: The 30 patients with breast cancer, and 21 patients had successfully detected blue-stained lymph nodes,9 cases had failed, and 25 had blue-stained lymph nodes. No obvious cancer metastasis was found. Excision of lymph nodes in 21 cases, no case of upper limb lymph node edema. Conclusion: It is feasible to carry out ARM using methylene blue solution injection method for lymph node tracing and localization, and the oncologically burden is safe.
axillary reverse mapping; breast neoplasms; upper extremity edema; lymph node excision;oncological safety
R737.9
A
10.3969/j.issn.2095-9400.2017.11.005
2017-02-16
浙江省医药卫生科技计划项目(2012KYA193,2013 KYB299);丽水市科技计划项目(2010JYZB24,20110416);丽水市高层次人才培养资助项目(2014RC11)。
施勇(1975-),男,浙江缙云人,副主任医师,硕士生。通信作者:李校堃,教授,博士生导师,Email:wenzhoulxk@163.com。
丁敏娇)
