注意缺陷多动障碍儿童5-HTTLPR长等位基因A-G单核苷酸多态性与静息态脑功能及行为学的相关性
2018-01-05张晓燕梁艳杜松妹林海西王维千陈宏刘惠茹王美豪赵永忠杨闯
张晓燕,梁艳,杜松妹,林海西,王维千,陈宏,刘惠茹,王美豪,赵永忠,杨闯
(1.温州医科大学附属第二医院育英儿童医院 儿童保健科,浙江 温州 325027;2.温州医科大学附属第一医院 精神病与精神卫生科,浙江 温州 325015;3.温州医科大学附属第一医院 放射科,浙江温州 325015)
·论 著·
注意缺陷多动障碍儿童5-HTTLPR长等位基因A-G单核苷酸多态性与静息态脑功能及行为学的相关性
张晓燕1,梁艳2,杜松妹2,林海西2,王维千2,陈宏2,刘惠茹3,王美豪3,赵永忠2,杨闯2
(1.温州医科大学附属第二医院育英儿童医院 儿童保健科,浙江 温州 325027;2.温州医科大学附属第一医院 精神病与精神卫生科,浙江 温州 325015;3.温州医科大学附属第一医院 放射科,浙江温州 325015)
目的:分析注意缺陷多动障碍(ADHD)患儿SLA基因型与SLG基因型间脑低频振荡振幅(ALFF)的差异以及静息态ALFF与行为学的相关性,探讨A-G单核苷酸多态性对5-HTTLPR长等位基因(L)转录活动的影响。方法:22例ADHD患儿通过PCR基因检测技术筛查出SLA基因型(SLA基因组)12例、SLG基因型(SLG基因组)10例,用磁共振扫描仪对患儿进行功能磁共振静息状态扫描,采用ALFF评估静息态脑功能,Conners儿童行为问卷评估行为现状,有意义脑区的ALFF平均信号与Conners儿童行为问卷的各项指标做两两相关分析。结果:SLA基因组在右额上回、左额中回、左脑岛、右边缘扣带回ALFF值高于SLG基因组,其中左额中回的ALFF值与Conners儿童行为问卷的冲动多动评分呈显著负相关(r=-0.359,P=0.020),右边缘扣带回的ALFF值与冲动多动评分、品行问题评分均呈显著负相关(r=-0.479,P=0.024;r=-0.542,P=0.009)。SLA基因组低于SLG基因组的脑区ALFF值差异均无统计学意义。结论:与SLG基因型相比,SLA基因型在大脑的多个区域均表现出更为活跃的功能活动,且倾向于更严重的冲动多动症状和品行问题。
注意缺陷多动障碍;5-羟色胺转运体;多态性,单核苷酸;磁共振成像
五羟色胺转运体基因启动子区(5-HTTLPR)多态性与注意缺陷多动障碍(attention deficit hyperactivity disorder,ADHD)发病是否有关目前研究结果不一致[1-2],原因可能是长等位基因(L)上的腺嘌呤-鸟嘌呤单核苷酸(A-G)多态性(即LA、LG)会影响L等位基因的转录活动。有证据表明,LG可能类似短等位基因(S),只有LA增加5-羟色胺转运体(serotonin transporter,5-HTT)的转录活动[3-4]。但在静息态脑功能方面,LA/LG多态性对ADHD患者的影响尚缺乏可靠的研究资料。本研究从该角度比较ADHD患儿SLA与SLG基因组间的差异,研究A-G单核苷酸多态性对L等位基因转录活动的影响。
1 对象和方法
1.1 对象 22例受检者(男20例,女2例)来源于2013年3月至2014年11月在温州医科大学附属第一医院精神科、儿科门诊就诊的儿童。纳入标准:①符合美国精神疾病诊断标准-IV(diagnostic and statistical manual of mental disorders-IV,DSM-IV)关于ADHD诊断标准;②年龄7~16岁;③汉族,右利手;④中国儿童韦氏智力测验总智力商数IQ≥90;⑤近3个月内未经任何药物治疗。排除标准:有精神活性物质依赖或滥用史;合并器质性精神障碍、精神分裂症、双相障碍、人格障碍等其他精神疾病;重大躯体疾病史;神经系统变性疾病、脑外伤或脑血管病患者;体内有金属异物植入,不能行磁共振检查者;已怀孕者;有精神疾病家族遗传史;听力障碍、阅读障碍不能完成相关测试者;儿童情感障碍和精神分裂症问卷(kiddie-schedule for affective disorders and schizophreniapresent and lifetime version,K-SADS-PL)结果显示存在共病者。所有受检者均已获得其家长或合法监护人的知情同意并签署知情同意书。本研究通过温州医科大学附属第一医院伦理委员会审核批准。
1.2 方法
1.2.1 心理测评:使用K-SADS-PL(国内K-SADS-PL诊断Kappa值为0.87[5])评定儿童和青少年当前和既往精神疾病发作;韦氏儿童智力量表评估智商;Conners儿童行为问卷(父母版)、ADHD-IV父母问卷[6]评估行为现状。
1.2.2 基因型检测及分组:①5-HTTLPR VNTR/SLC6A4(rs4795541,L/S变异):使用引物5’-CAACTCCCTGT ACCCCTCCTA-3’(正向)和5’-GGTTGCAGGGGAGATCCTG-3’(反向),生成两个碱基对47 bp(短等位基因S)和190 bp的PCR片段(长等位基因L)。反应混合物中含有5 ng基因组DNA,2.5 mmol/L MgCl2,60 mmol/L Tris-HCl,15 mmol/L(NH4)2SO4,5 µL Q-solution(荷兰Venlo公司),6.7 nmol正向引物和4.4 nmol反向引物,40 nmol核苷酸,1 U Taq聚合酶(美国Fermentas公司),最开始变性温度是94 ℃ 5 min,然后是30 s的94 ℃变性(45个周期),再然后是30 s的56.8 ℃退火,60 s的72 ℃延长,最后7 min的72 ℃延长。得到的PCR制剂在2%琼脂糖凝胶上电泳分离(100 V 45 min)。②5-HTTLPR VNTR,rs25531(LA/LG/S变异):15 µL以上PCR反应物用2 U MspI酶(美国Fermentas公司)消化分解,产生LA(位点分别在147 bp、190 bp)以及LG(位点分别在83 bp、107 bp)。所得到PCR产物在2%琼脂糖凝胶上电泳分离(100 V,45 min)以及用溴化乙锭染色。
通过上述基因检测方法,筛查出SLA基因型(SLA基因组)12例、SLG基因型(SLG基因组)10例。1.2.3 磁共振扫描及参数获取:运用美国GE公司3.0T磁共振成像系统扫描受检者脑部。结构成像包括T1WI、T2WI,以排除器质性病变。静息态功能磁共振扫描采用全脑血氧水平依赖(brain oxygen level dependent,BOLD)平面回波序列成像(echoplanar imaging,EPI)。
扫描参数设定为:TR=2 000 ms,TE=30 ms;翻转角=90°;层数=31;层厚/层间隔=4.0/0.2 mm,矩阵=64×64。静息态扫描设置要求扫描过程无刺激任务,受检者仰卧、闭眼,保持清醒,全身静止不动,尽量不进行系统思维活动。解剖图像的扫描采用3D梯度回波T1加权序列矢状位扫描(TR=1 900 ms,TE=2.0 ms,反转角=10°,FOV=220 mm×220 mm;矩阵=256×256,平面分辨率=0.87 mm×0.87 mm,层数=124,厚度=1.7 mm)。
1.2.4 静息态图像处理:运用北京师范大学编制的基于SPM8(statistical parametric mapping)、REST(representational state transfer)以及DPARSF2.0(data processing assistant for resting-state fMRI)分析静息脑功能图像。为排除实验过程中过度头部运动的影响,采用以下措施:①为了使受检者适应和T1平衡效果,每个受检者的前10个图层都被放弃,留下230个图层进行进一步分析。②头动校正(realignment):去除位移超过2.0 mm的和(或)旋转在任何方向超过1°的数据。③空间标准化(spatially normalization,SN):由于不同被检大脑的解剖结构具有差异,原始图像需通过SPM的EPI模板标准化。④平滑:使图像数据具有随机高斯场(Gaussian random field,GRF)的性质以及提高信噪比[6]。 通过上述预处理后,测量低频振荡振幅(amplitude of low frequency fluctuation,ALFF)结果。预处理完后,进行去线性漂移和带通滤波。频率为0.01~0.08 Hz[6]。最后用estimation命令生成的SPM图像来生成结果。
1.3 统计学处理方法 采用基于MATLAB软件平台的REST 1.8工具包对组对象的标准化ALFF图像进行比较(使用灰质概念图作为协变量,进一步去除结构差异的影响),得出静息状态下具有统计学差异的ALFF脑图。2组间标准化ALFF图像的t检验分析由“Statistical Analysis”命令得到。ALFF统计脑图差异阈值设定为P<0.05(Alpha校正后),且簇>50个体素。有意义的ALFF脑区均通过“Extract ROI signals”命令导出每位患者每个ALFF脑区的平均信号,然后使用SPSS16.0软件做上述ALFF平均值与Conners儿童行为问卷(父母版)的各项指标(冲动多动、品行问题、学习问题、心身问题、焦虑、多动指数)的两两相关分析。P<0.05为差异有统计学意义。
2 结果
2.1 一般情况比较 ADHD患儿SLA基因组与SLG基因组性别构成、年龄、韦氏智力总智商、受教育年限、家庭经济状况、ADHD-IV父母问卷的注意缺陷评分、多动-冲动评分等比较差异均无统计学意义(P>0.05),见表1。
2.2 2组间各脑区ALFF值的比较 SLA基因组的右额上回、左额中回、左脑岛、右边缘扣带回ALFF值高于SLG基因组,差异有统计学意义(P<0.05),见表2、图1。SLA基因组低于SLG基因组的脑区ALFF值差异均无统计学意义(P>0.05)。
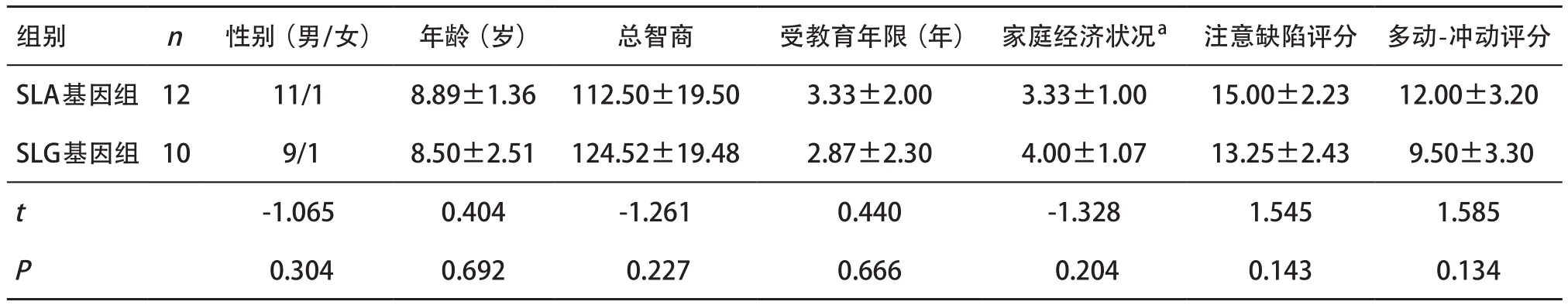
表1 2组对象一般情况比较( ±s)
2.3 相关分析 左额中回的ALFF值与冲动多动评分呈显著负相关(r=-0.359,P=0.020),右边缘扣带回的ALFF值与冲动多动评分、品行问题评分均呈显著负相关(r=-0.479,P=0.024;r=-0.542,P=0.009),见表3。余Conners儿童行为问卷评分(学习问题评分、心身问题评分、焦虑评分、多动指数)与有意义脑区(右额上回、左额中回、左脑岛、右边缘扣带回)的ALFF平均信号的两两相关分析均显示无明显相关性(P>0.05)。

表2 SLA基因组>SLG基因组ALFF值差异显著的脑区
3 讨论
静息态功能磁共振成像能敏感地反映静息状态下大脑网络的异常活动,从而探索大脑功能与神经系统疾病的关系[7],而ALFF被认为是静息态下脑功能的一种自发活动状态,具有稳定而可靠的反应脑功能状态的特点[8]。研究表明,ADHD儿童在前额叶皮质[9-10]、楔前叶[11]、边缘扣带回[12]、脑岛[13]、基底节[14]等脑区功能连接减少。
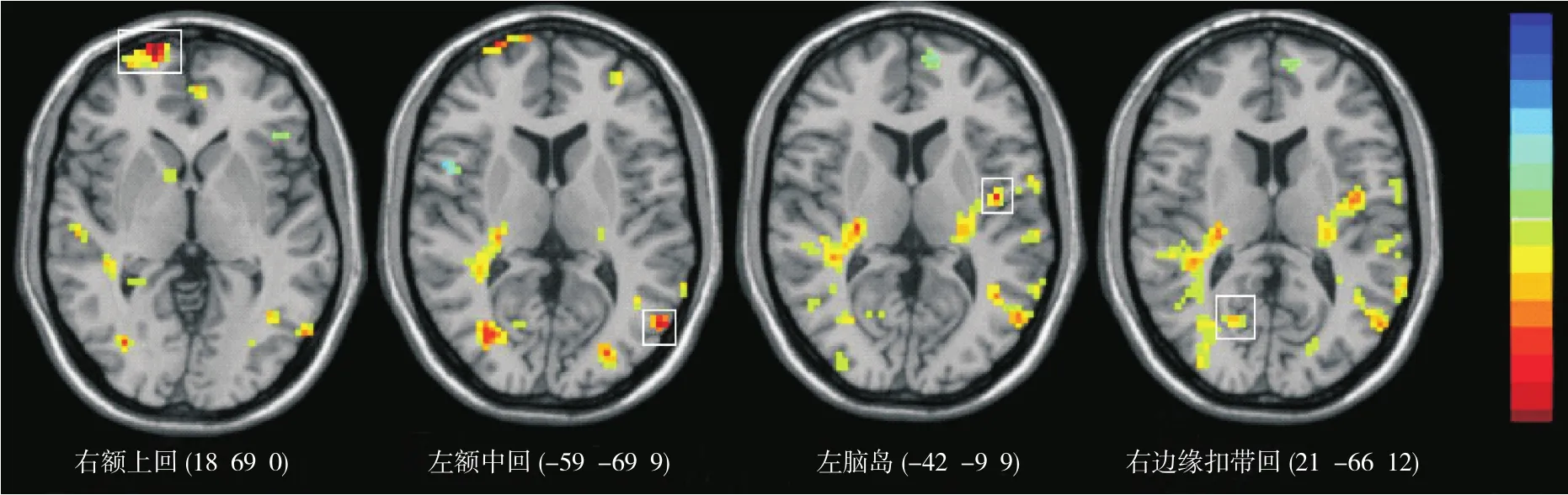
图1 SLA组>SLG组ALFF值差异显著的脑区(红色区域为ALFF值增高,蓝色区域为ALFF值降低,方框表示显著差异脑区)

表3 SLA组与SLG组有显著差异脑区的ALFF值与Conners儿童行为问卷(父母版)各项指标间的相关分析
5-HTT被认为与儿童的冲动行为有关[15],可能在ADHD发病机制中起到重要作用[16]。由于低估了5-HTTLPR基因A-G单核苷酸多态性的作用,对ADHD患儿5-HTTLPR基因的研究大多数仅比较了L及S等位基因的差异,而A-G单核苷酸多态性并没有被列入研究中,因此评价该单核苷酸等位基因的意义的研究非常少,且大多数研究集中在临床药物学、症状学等方面。研究表明,与LA等位基因相比,LG等位基因更接近于S等位基因:THAKUR等[17]考察了ADHD不同5-HTT基因型对哌醋甲酯0.5 mg·kg-1·d-1的反应,结果发现,LA等位基因携带者对哌醋甲酯反应显著,而LG等位基因和S等位基因儿童均较少受益于哌醋甲酯;KENNETH等[18]的研究表明,与LA等位基因的纯合子相比,S或LG等位基因携带者,在不同程度上存在更严重的ADHD症状。
影像学方面的相关研究也非常少,大多数仅比较了L及S等位基因的差异,仅少数类似的研究。如JILLIAN等[19]的研究表明,在正常儿童和青少年中,S/S基因型的儿童和青少年与默认网络(尤其是内侧前额叶皮质)之间的联系最弱,而LA/LA组连接增强最强,其次是杂合子;WILLEIT等[21]回顾分析了8个5-HTTLPR的相关研究,结果显示LA/LA基因型表现出更高的5-HTT基因绑定,因此表现出5-HTT在几个脑区密度更大。但也有不同的研究结果,如BORG等[22]发现,5-HTTLPR各基因型间比较无明显差异,因此仍需要进一步的验证。
本研究表明,与SLG基因组相比,SLA基因组在大脑的多个区域均表现出更为活跃的功能活动,主要在前额叶皮层、脑岛和边缘扣带回,其中左额中回与冲动多动评分呈显著负相关,而右边缘扣带回与冲动多动评分、品行问题评分均呈显著负相关;与SLA基因组相比,SLG基因组倾向于更严重的冲动多动症状和品行问题。这可能与LA等位基因更能增加5-HTT的转录活动有关。
由于SLG型样本量非常少,所以大多数类似的研究[19-20]主要比较了LA/LA型、杂合子(主要为SLA),以及S/S型间的差异,这样无法清楚地呈现A-G单核苷酸多态性对L等位基因表达的影响。为了解决这个问题,本研究扩大了样本量,特征性地选取了ADHD患儿SLA型及SLG型进行比较,能更清楚地明确A-G单核苷酸多态性的可能作用。但由于我们样本量还是偏少,且没有达到严格的1∶1组间配对,未来的研究需进一步扩大样本量,同时需要采集其他基因型(LA/LA、S/S)的脑功能变化,进行多组的比较,综合评估5-HTTLPR基因、AG单基因突变的作用。
[1] KUNTSI J, RIJSDIJK F, RONALD A, et al. Genetic inf l uences on the stability of attention-def i cit/hyperactivity disorder symptoms from early to middle childhood[J]. Biol Psychiatry, 2005, 57(6): 647-654.
[2] RIETVELD M J, HUDZIAK J J, BARTELS M, et al. Heritability of attention problems in children: longitudinal results from a study of twins, age 3 to 12[J]. J Child Psychol Psychiatry, 2004, 45(3): 577-588.
[3] HU X, OROSZI G, CHUN J, et al. An expanded evaluation of the relationship of four alleles to the level of response to alcohol and the alcoholism risk[J]. Alcohol Clin Exp Res,2005, 29(1): 8-16.
[4] LIPSKY R H, HU X Z, GOLDMAN D. Additional functional variation at the SLC6 A4 gene[J]. Am J Med Genet B Neuropsychiatr Genet, 2009, 150B(1): 153.
[5] 刘豫鑫, 刘津, 王玉凤. 简明儿童少年国际神经精神访谈儿童版的信效度[J]. 中国心理卫生杂志, 2011, 25(1): 8-13.
[6] CHAO G Y, YU F Z. DPARSF: A matlab toolbox for “pipeline” data analysis of resting-state fMRI[J]. Front Syst Neurosci, 2010, 4(13): 13.
[7] HSU A L, CHOU K H, CHO Y P, et al. Physiological contribution in spontaneous oscillations: An approximate qualityassurance index for resting-state fMRI signals[J]. PLoS One,2016, 11(2): e0148393.
[8] ZANG Y F, HE Y, ZHU C Z, et al. Altered baseline brain activity in children with ADHD revealed by resting-state functional MRI[J]. Brain Dev, 2007, 29(2): 83-91.
[9] SCHALL J D. On the role of frontal eye fi eld in guiding attention and saccades[J]. Vision Res, 2004, 44(12): 1453-1467.
[10] SUSKAUER S J, SIMMONDS D J, CAFFO B S, et al. fMRI of intrasubject variability in ADHD: anomalous premotor activity with prefrontal compensation[J]. J Am Acad Child Adolesc Psychiatry, 2008, 47(10): 1141-1150.
[11] PARK B Y, PARK H. Connectivity differences between adult male and female patients with attention def i cit hyperactivity disorder according to resting-state functional MRI[J]. Neural Regen Res, 2016, 11(1): 119-25.
[12] MOSTERT J C, SHUMSKAYA E, MENNES M, et al. Characterising resting-state functional connectivity in a large sample of adults with ADHD[J]. Prog Neuropsychopharmacol Biol Psychiatry, 2016, 67: 82-91.
[13] KONARAD K, NEUFANG S, HANISCH C, et al. Dysfunctional attentional networks in children with attention def i cit/hyperactivity disorder: evidence from an event-related functional magnetic resonance imaging study[J]. Biol Psychiatry,2006, 59(7): 643-651.
[14] CAO X, CAO Q, LONG X, et al. Abnormal resting-state functional connectivity patterns of the putamen in medication-naive children with attention def i cit hyperactivity disorder[J]. Brain Res, 2009, 1303: 195-206.
[15] HALPERIN J M, NEWCORN J H, SCHWARTZ S T, et al.Age-related changes in the association between serotonergic function and aggression in boys with ADHD[J]. Biol Psychiatry, 1997, 41(6): 682-689.
[16] OADES R D. Dopamine-serotonin interactions in attentiondef i cit hyperactivity disorder (ADHD)[J]. Prog Brain Res,2008, 172(1): 105.
[17] THAKUR G A, GRIZENKO N, SENGUPTA S M, et al.The 5-HTTLPR polymorphism of the serotonin transporter gene and short term behavioral response to methylphenidate in children with ADHD[J]. BMC Psychiatry, 2010, 10: 50.
[18] KENNETH D G, CARLA J D, VICTORIA I S, et al. Allelespecific associations of 5-HTTLPR/rs25531 with ADHD and autism spectrum disorder[J]. Prog Neuropsychopharmacol Biol Psychiatry, 2013, 40(2): 292-297.
[19] JILLIAN L W, JIRAIR K B, SCOTT J P, et al. The impact of serotonin transporter (5-HTTLPR) genotype on the development of resting-state functional connectivity in children and adolescents: A preliminary report[J]. Neuroimage, 2012,59(3): 2760-2770.
[20] NATALIA J, FRANK P M, JANE F, et al. The inf l uence of 5-HTTLPR and Val66Met polymorphisms on cortical thickness and volume in limbic and paralimbic regions in depression: a preliminary study[J]. BMC Psychiatry, 2016, 16(1):1-10.
[21] WILLEIT M, PRASCHAK R N. Imaging the effects of genetic polymorphisms on radioligand binding in the living human brain: A review on genetic neuroreceptor imaging of monoaminergic systems in psychiatry[J]. Neuro Image,2010, 53(3): 878-892.
[22] BORG J, HENNINGSSON S, SAIJO T, et al. Serotonintransporter genotype is associated with cognitive performance but not regional 5-HT1A receptor binding in humans[J]. Int J Neuropsychopharmacol, 2009, 12(6): 783-792.
The role of A-G single nucleotide polymorphism in the L allele of the 5-HTTLPR gene of attention def i-cit hyperactivity disorder: based on resting-state cereb
ZHANG Xiaoyan1, LIANG Yan2, DU Songmei2, LIN Haixi2, WANG Weiqian2,CHEN Hong2, LIU Huiru3, WANG Meihao3, ZHAO Yongzhong2, YANG Chuang2.
1.Department of Children Healthcare, the Second Aff i liated Hospital & Yuying Children’s Hospital of Wenzhou Medical University, Wenzhou, 325027; 2.Department of Psychiatry and Mental Health, the First Aff i liated Hospital of Wenzhou Medical University, Wenzhou, 325015; 3.Department of Radiology, the First Aff i liated Hospital of Wenzhou Medical University, Wenzhou, 325015
Objective: To study the differences of amplitude of low frequency fl uctuation (ALFF) between genotypes of SLA and SLG with attention def i cit hyeractivity disorder (ADHD) children using functional magnetic resonance imaging (fMRI) and the relationship between ALFF and behavioristic. Methods: Screened out the genotypes of SLA and SLG of ADHD children by PCR gene detection technology. And all of the ADHD children were scanned with fMRI scanner in the resting state, using ALFF to assess the resting state cerebral function.And the Conners children behavior questionnaire was used to assess the behavior status quo. Results: Compared with the SLG genotype, SLA genotype showed ALFF were increased in right superior frontal gyrus, left middle frontal gyrus, left insula, right limbic cingulate gyrus, and no brain region with decreased ALFF. The ALFF of left middle frontal gyrus was signif i cantly negative correlative with impulse-hyperactivity ratings of conners children behavior questionnaire, and ALFF of right limbic cingulate gyrus was signif i cantly negative correlative with impulse-hyperactivity ratings and conduct problem score. Conclusion: Compared with the SLG genotype, the SLA genotype shows more yauld cerebral functional activities, and tend to be more serious impulse-hyperactivity and conduct problem.
attention de fi cit hyperactivity disorder; serotonin transporter; polymorphism, single nucleotide;magnetic resonance imaging
2017-03-04
浙江省自然科学基金资助项目(LY14H090012);温州市科技计划项目(Y20140399,Y20130163)。
张晓燕(1983-),女,浙江温岭人,硕士。
杨闯,副主任医师,Email:dryangchuang@163.com。
R749
A
10.3969/j.issn.2095-9400.2017.11.001
丁敏娇)
