WH706-CLL树脂对白及多糖脱色工艺的研究△
2017-12-26车向前常明泉陈芳江蓉敬
车向前,常明泉,陈芳,江蓉敬
(1.湖北房县人民医院,湖北 房县 442100;2.湖北医药学院附属太和医院,湖北 十堰 442000;3.湖北医药学院 药学院,湖北 十堰 442000)
·中药工业·
WH706-CLL树脂对白及多糖脱色工艺的研究△
车向前1,常明泉2*,陈芳2,江蓉敬3
(1.湖北房县人民医院,湖北 房县 442100;2.湖北医药学院附属太和医院,湖北 十堰 442000;3.湖北医药学院 药学院,湖北 十堰 442000)
目的考察WH706-CLL树脂对白及多糖提取液的脱色效果,建立最佳脱色工艺。方法以提取液浓度、温度、pH值、流速为观察因素,以脱色率、多糖保留率作为考察指标。结果在提取液质量浓度为1 mg·mL-1、温度为50 ℃、pH值为6、流速为1 mL·min-1的条件下,WH706-CLL树脂对白及多糖的脱色率为93.7%,多糖保留率为87.3%。结论在设定工艺条件下WH706-CLL树脂对白及多糖的脱色效果良好,适用于白及多糖的脱色。
白及多糖;色素;脱色;WH706-CLL树脂
白及为兰科植物白及Bletillastriate(Thumb.)Reichb.F.的干燥块茎,具有收敛止血、清热利湿、消肿生肌的功能,常用于咯血、吐血、外伤出血、肺结核出血和治疗手足皲裂[1-2],白及的主要活性成份是一种直链多糖,主要由β-1,4-甘露糖和β-1,4-葡萄糖组成[3],随着对其药理研究的深入,揭示白及所含多糖除具有上述作用外,也具有抗胃溃疡、抗肿瘤作用[4],还可用于介入放射的诊断治疗、肿瘤的栓塞治疗[5-6]、药物制剂的助悬剂、食品添加剂等,市场前景可观。为了获得优良的制剂原材料,本实验研究用WH706-CLL树脂对白及多糖脱色,以脱除其提取液中的植物色素。
1 仪器与材料
TU1901型双光束紫外/可见分光光度计(北京普析通仪器有限责任公司);DHG-9023A型鼓风干燥烘箱(天津市顺诺仪器科技有限公司,300×300×270);FA 2004分析天平(天津天才精密仪器厂,精度:0.000 1 g);WGA-UNI-10型超纯水器(功率:300 W,北京普析通仪器有限责任公司)。
无水葡糖糖对照品(天津市科密欧化学试剂开发中心,批号:200120728);WH706-CLL树脂(西安维华科技有限公司,批号:20150712);层析柱(上海亚荣生化仪器厂,50 cm×3 cm);蒽酮(上海叶缘生物有限公司,批号:20150222);SSW型电热恒温水浴槽(上海博讯实业有限公司医疗器械厂,700 W);纯化水(湖北医药学院附属太和医院新鲜制备);硫酸、盐酸、氢氧化钠为分析纯。
白及购自湖北神农本草公司,经湖北医药学院附属医院叶立红教授鉴定为兰科植物白及。
2 方法与结果
2.1 白及多糖提取液的制备
取白及饮片,在60 ℃烘箱中干燥,粉碎,过10目筛,称取粗粉50 g,加入纯化水(药液比1∶15)750 mL,浸泡60 min,煎煮提取45 min,过滤,收集滤液,药渣加入纯化水(1∶10)500 mL,煎煮提取90 min,过滤,集中滤液,药渣加入纯化水(1∶10)500 mL,煎煮提取90 min,过滤,集中滤液,稀释至2000 mL,混匀,使成含多糖为1 mg·mL-1的提取液。
2.2 WH706-CLL层析柱脱色
取WH706-CLL树脂,用纯化水浸泡24 h,洗至澄清,倾去水后加2~3倍量浓度为2 mol·L-1的HCl,混匀,浸泡2 h,倾去HCl,加纯化水洗至中性,加4~5倍量2 mol·L-1NaOH溶液,混匀,浸泡2 h,水洗至中性;取层析柱,将处理好的树脂湿法装柱,装柱量占层析柱内容量的2/3,加盖垫,用纯化水透析至澄清,层析柱(带恒温套的层析柱)恒温至50 ℃,取适宜白及多糖提取液加入层析柱中,以1 mL·min-1的流速收集脱色液,对收集液用α-萘酚浓硫酸法[7]动态监测,显阳性反应时则可收集脱色液,脱色完毕,以pH为6的稀盐酸溶液为洗脱液洗脱,收集洗脱液至用α-萘酚浓硫酸法动态监测显阴性反应时终止,集中脱色液和洗脱液,即得。
2.3 脱色率的测定
分别取脱色前后的样品溶液,以相应试剂为空白,用紫外分光光度计在450 nm波长处测定吸光度值,取3次测定的平均值,计算脱色率[8]。
脱色率(%)=(A前-A后)/A前×100%
(1)
A前为脱色前提取液的吸光度值,A后为脱色后提取液的吸光度值。
2.4 多糖保留率的测定
2.4.1 溶液的制备 密称精取在105 ℃干燥至恒重的无水葡糖糖对照品适量,加纯化水溶解,制备成质量浓度为0.051 5 mg·mL-1的对照品储备液,分别精密吸取该对照品溶液、白及多糖脱色液、纯化水各2 mL于3支10 mL的刻度试管中,各加入0.2%蒽酮-硫酸试液6 mL,静置30 min使反应充分,温度降至室温,即为对照品溶液、供试品溶液和空白溶液。
2.4.2 方法学的建立
2.4.2.1 标准曲线方程 取质量浓度为0.150 mg·mL-1的对照品溶液0.1、0.3、0.6、0.9、1.2、1.5、1.8 mL于10 mL刻度试管中,各加纯化水至2 mL,再分别加入0.2%的蒽酮-硫酸试液6 mL,静置30 min使反应充分,温度降至室温,摇匀,既得每mL含无水葡萄糖对照品1.88、5.63、11.25、16.88、22.50、28.12、33.75 μg的对照品溶液,以2.4.1项下空白溶液校仪器零点,在589 nm波长处测定吸收度,以吸收度值为纵坐标,浓度为横坐标,得标准曲线方程Y=0.022X-0.002(r=0.999),无水葡萄糖在1.88~33.75 μg·mL-1线性关系良好。
2.4.2.2 精密度 取2.4.1项下的对照品溶液,在589 nm处测定吸收度5次,结果RSD为0.79%。
2.4.2.3 稳定性 取2.4.1项下的对照品溶液在589 nm处于0.5、1、3、6 h测定吸收度,结果RSD为1.07%。
2.4.2.4 重复性 按2.4.1项下方法平行制备供试品溶液5份,在589 nm波长处分别测定吸收度,结果RSD为1.51%。
2.4.2.5 回收率 精密吸取已测含量的白及多糖脱色液1 mL于10 mL刻度试管中,共9份,每3份1组,分别按供试液含量的120%、100%和80%加入适宜对照品溶液,加纯化水至2 mL,各加入0.2%蒽酮-硫酸试液6 mL,静置30 min使反应充分,温度降至室温,摇匀,在589 nm波长处测定吸收度,计算多糖含量,结果平均回收率为96.3%,RSD为1.61%。
2.4.3 测定 取2.4.1项下的供试品溶液在589 nm波长处测定吸收度,计算多糖保留率[7-8]。
多糖保留率(%)=M后/M前×100%
(2)
M前为脱色前提取液中多糖的含量,M后为脱色后提取液中多糖的含量。
2.5 脱色影响因素的考察
分别考察WH706-CLL树脂在脱色时提取液浓度、温度、pH值、流速对脱色率、多糖保留率的影响,比较各因素条件下的脱色效果。
2.5.1 浓度的影响 取白及多糖提取液分别配制成含糖量为0.5、1、2、3、4 mg·mL-1的溶液,每份样品配制100 mL,用稀盐酸调pH值为6,将样品溶液在50 ℃水浴中加温,按2.2项下的方法在50 ℃条件下以1 mL·min-1流速收集脱色液,分别按2.3、2.4项下的方法测定脱色率和多糖保留率。结果,当多糖含量在0.5~1 mg·mL-1时脱色率比在2~4 mg·mL-1时平均高23.2%,多糖保留率差异则不显著,取1 mg·mL-1为最佳脱色浓度,见表1和图1。

表1 不同浓度、温度、pH值、流速对白及多糖提取液脱色率和多糖保留率测定结果
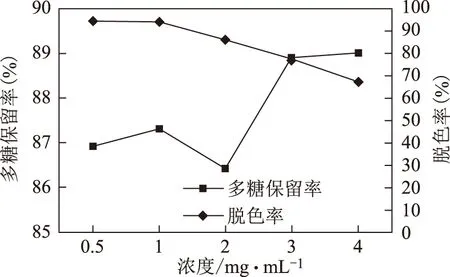
图1 浓度因素图
2.5.2 温度的影响 取白及多糖提取液配制成多含糖为1 mg·mL-1的溶液,共5份,每份样品配制100 mL,用稀盐酸调pH值为6,分别将样品溶液上于设定温度为30、40、50、60、70 ℃的层析柱(带恒温套的层析柱)中恒温30 min,使样品溶液达到设定脱色温度。然后按2.2项下方法以1 mL·min-1流速收集脱色液,分别按2.3、2.4项下的方法测定脱色率和多糖保留率,结果,当脱色液温度在50~70 ℃时,脱色率趋于稳定,平均比30~40 ℃时高9.3%,多糖保留率在此温度范围也趋于稳定,取50 ℃为最佳脱色温度。见表1和图2。
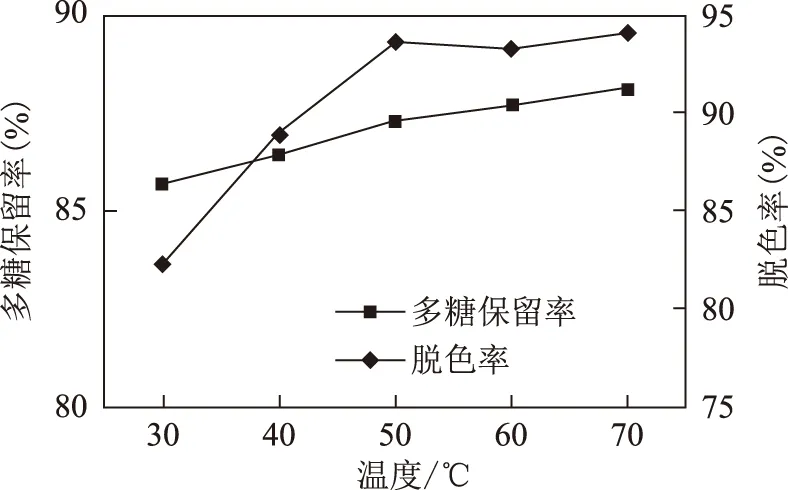
图2 温度因素图
2.5.3 pH的影响 取白及多糖提取液配制成含糖为1 mg·mL-1的溶液,共5份,每份样品配制100 mL,分别用稀盐酸及氢氧化钠溶液调pH为4、5、6、7、8,将样品溶液在50 ℃水浴中加温,按2.2项下的方法在50 ℃条件下以1 mL·min-1流速收集脱色液,分别按2.3、2.4项下的方法测定脱色率和多糖保留率,结果,当pH在6~8范围时脱色率平均比pH在4~5时高9.6%,多糖保留率高8.0%,取pH 6为最佳脱色pH值,见表1和图3。
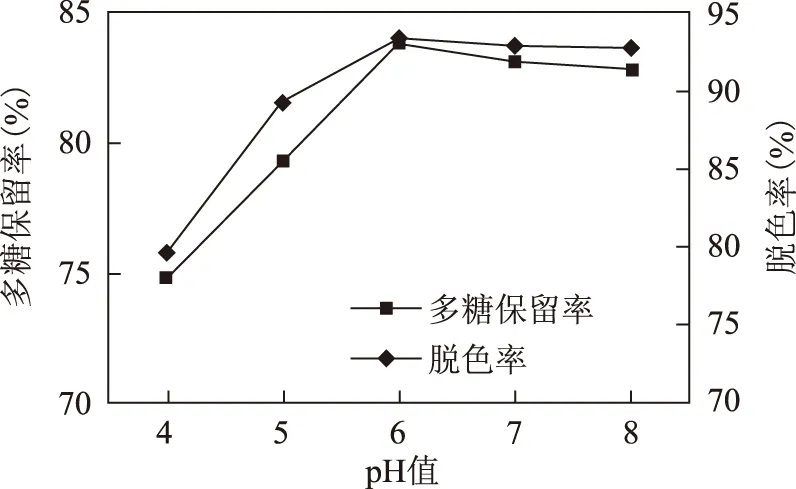
图3 pH因素图
2.5.4 流速的影响 取白及多糖提取液配制成含糖为1 mg·mL-1的溶液,共5份,每份样品配制100 mL,分别用稀盐酸调pH值为6,将样品溶液在50 ℃水浴中加温,按2.2项下的方法在50 ℃条件下分别以0.5、1、1.5、2、2.5 mL·min-1流速收集脱色液,分别按2.3、2.4项下的方法测定脱色率和多糖保留率,结果,当流速在0.5~1 mL·min-1时脱色率平均比流速处于1.5~2.5 mL·min-1时高19%,多糖保留率变化不明显,取1 mL·min-1为最佳脱色流速。见表1和图4。
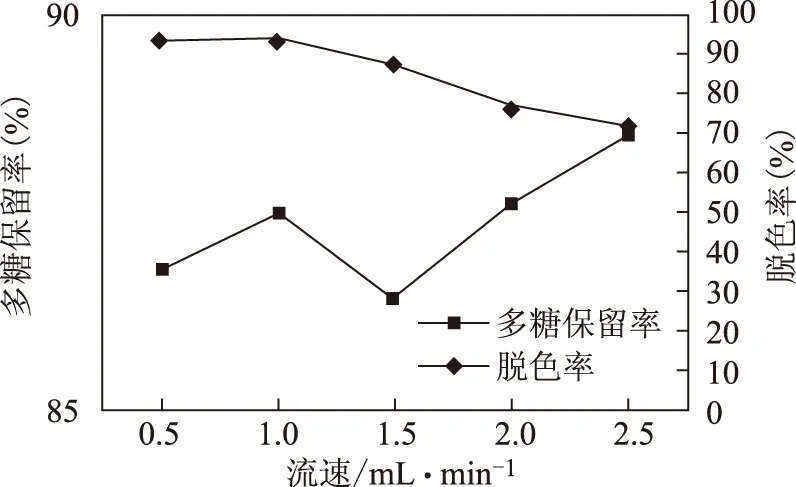
图4 流速因素图
2.6 验证试验
根据上述试验结果,为了验证WH706-CLL树脂层析柱对白及多糖脱色工艺的可靠性,取同一批次含白及多糖为1.0 mg·mL-1的提取液,将pH值调至6,在50 ℃条件下以1 mL·min-1的流速按2.2项下的方法收集脱色液,样品溶液按2.3、2.4项下的方法测定脱色率与多糖保留率,结果脱色率为93.7%,多糖保留率为87.3%。该工艺为WH706-CLL树脂层析柱用于白及多糖脱色的最佳工艺。
3 讨论
白及多糖提取液浓度过高,在相对低的温度环境下(室温)粘性增强,脱色过程中会堵塞树脂孔槽,而提高温度有利于多糖溶解降低粘性,在实验中当多糖浓度在1.5 mg·mL-1以上、脱色液收集至1/4时树脂孔槽堵塞,几乎没有脱色液流出,当脱色液浓度在1 mg·mL-1以下、温度达到40 ℃以上时脱色液流出顺畅,脱色率和多糖保留率趋于稳定状态。脱色液流速对脱色效果有明显影响,1.5 mL·min-1是脱色效果的分界点,流速高于此时脱色率明显下降,可能是流速过快色素未被树脂充分吸附或脱吸附所致。由于植物色素与多糖结合形式不同,对于不同植物中的多糖,其色素和多糖含量也有差别,多糖提取液中如果存在结合性色素则难以脱除,将pH值调至6可能促使植物色素细胞破壁[9-10],破坏与多糖的结合形态,有利于色素与多糖的分离,从而增强脱色效果。
笔者曾参考文献[11]实验,在提取液中加入1.5%~3%的活性炭对白及多糖进行脱色,但脱色率仅为62.5%,多糖保留率为75.7%,脱色后残留活性炭难以完全去除,活性炭的吸附性是多糖损失率增多的原因;实验用H2O2对白及多糖脱色[12],结果脱色率为66.8%,多糖保留率为56.4%,H2O2氧化剂性在氧化色素时也氧化部分多糖,降低其保留率,两者脱色效果均没有WH706-CLL树脂理想,WH706-CLL树脂对多糖脱色是利用其对色素成分的选择吸附性和筛分性而达到去除白及多糖中色素的目的,它用于白及多糖的脱色,较之活性炭和H2O2具有显著的优越性能。WH706-CLL树脂层析柱适用于白及多糖的脱色,所制定工艺可获得良好的脱色效果,为白及精加工提供了可借鉴的方法。
[1] 国家药典委员会.中华人民共和国药典:一部[S].北京:中国医药科技出版社,2015.
[2] 何秀丽,陈林,常明泉,等.复方白及乳膏治疗手足皲裂的疗效观察[J].药学与临床研究,2013,21(6):648-650.
[3] 刘福强,王艳萍,韩丹,等.白及多糖的提取及其相对分子质量测定和结构研究[J].中成药,2013,35(10):2291-2293.
[4] 吕小波,黄春球,武正才,等.白及多糖对胃溃疡大鼠防治作用的实验研究[J].云南中医学院学报,2012,35(1):30-32.
[5] 罗仕华,郑传胜,黎维勇,等.白及多糖体外抗肿瘤实验研究[J].中成药,2014,36(1):165-167.
[6] 柴建中,刘向军,于凤英,等.白芨加明胶海绵栓塞治疗子宫肌瘤的临床应用[J].介入放射学杂志,2001,10(6):336-337.
[7] 李玲,常明泉.天然高分子白及溶胶的制备及质量控制[J].海峡药学,2015,27(1):51-53.
[8] 陆毅,任爱农.用过氧化氢对野菊花碱性多糖进行脱色的工艺研究[J],中南药学,2012,10(3):185-188.
[9] 李志浩,陈银华,李鹏,等.大孔吸附树脂对金银花脱色工艺研究[J],国际中医中药杂志,2015,37(4):345-347.
[10] 付学鹏,杨晓杰.植物多糖脱色技术的研究[J].食品研究与开发,2007,28(11):166-169.
[11] 李元元,李鑫,廉宜,等.沙枣多糖脱色材料及脱色条件的优选[J].食品科技,2012,37(2):210-213.
[12] 于雷,王保奇,张华锋,等.首乌藤多糖脱色脱蛋白纯化工艺研究[J],中药新药与临床药理,2012,23(2):215-217.
DecolorizationofBletillastriataPolysaccharidebyWH706-CLLResin
CHE Xiangqian1,CHANG Mingquan2*,CHEN Fang2,JIANG Rongjing3
(1.HubeiFangxianPeople’sHospital,Fangxian,Hubei,442100,China;2.TaiheHospitalAffiliatedtoHubeiMedicalUniversity,442000,China;3.ThepharmacyinstituteofHubeiMedicalUniversity,442000,China)
Objective:To investigate the decoloring effect ofBletillastriatapolysaccharide extract by WH706-CLL resin,and establish the optimum process of decolorization.MethodsWith extract concentration,temperature,pH value,flow rate as observation factors,the decolorization rate and polysaccharide retention rate were examined.ResultsWhen the extract concentration was 1 mg·mL-1,the temperature was 50 ℃,the pH value was 6,and the flow rate was 1 mL·min-1,the decoloring rate of WH706-CLL resin reached 93.7% and the polysaccharide retention rate was 87.3%.ConclusionUnder the conditions of setting process,the WH706-CLL resin has good effect on the decolorization ofB.striatapolysaccharide,and is suitable for the decolorization ofB.striatapolysaccharide.
Bletilla striata polysaccharide;pigment;decolorization;WH706-CLL resin
10.13313/j.issn.1673-4890.2017.9.018
太和科研基金资助项目(2013JJXM021);湖北省科技厅鉴定成果(2014D150024000699)
*
常明泉,副主任药师,研究方向:药物制剂;E-mail:907622985@qq.com
2016-11-18)
