层析介质Capto Core400 和Sephacryl S-1000纯化乙型肝炎病毒核心蛋白病毒样颗粒效果的比较
2022-07-19郎艺洁王云龙李玉林王继创王旭东王晓军周丽钱鹏
郎艺洁,王云龙,李玉林,王继创,王旭东,王晓军,周丽,钱鹏
1.郑州大学生命科学学院,河南 郑州 450001;2.河南省生物工程技术研究中心,河南 郑州 450010;3.郑州职业技术学院,河南 郑州 451460;4.河南省职工医院,河南 郑州 450002
病毒样颗粒(virus-like particles,VLPs)是由一种或多种病毒结构蛋白组装成的颗粒,其形态与真病毒粒子相似,但不含病毒基因组结构,又称“伪病毒或假病毒”[1]。基于乙型肝炎病毒核心蛋白(hepatitis B virus core protein,HBc)基因序列的C-末端、N-末端及主要免疫原区(main immunogenic region,MIR)在插入外源基因后,仍可进行正确折叠和组装,因此,HBc VLPs 成为目前众多领域中研究最为广泛的纳米载体[2]。
层析介质Capto Core400 是基于核心微球的一种纯化介质,每个微球均含有1 个由辛胺配体激活的核心[3],该核心被一层无配体的外层包围,可阻止大颗粒物质与配体结合,较小的杂质可自由进入,被微球捕获。蛋白质的截留相对分子质量约为4 × 105,大于该值的目标蛋白将随着洗脱液流出层析柱。层析介质Sephacryl S-1000 是葡聚糖交联N,N-亚甲基二乙酰胺形成的一种纯化介质,所能分离蛋白质的截留相对分子质量为5×105~1×108,具有良好的机械性能。两种介质在生物制品纯化中均有较广阔的应用价值[4]。本研究采用两种层析介质纯化HBc VLPs蛋白粗提液,并对纯化效果进行比较,以期为HBc VLPs的纯化选择一种简便可靠的纯化工艺。
1 材料与方法
1.1载体及菌株 载体pET-43.1a(+)及感受态E.coliBL21(DE3)均由河南省生物工程技术研究中心提供。
1.2主要试剂及仪器 核酸内切酶NdeⅠ、XhoⅠ均购自宝日医生物技术(北京)有限公司;IPTG 及BCA蛋白浓度测定试剂盒购自上海索莱宝生物科技有限公司;氨苄西林购自北京梦怡美生物科技有限公司;Tris、NaCl 及NaOH 购自国药集团化学试剂有限公司;层析介质Sephacryl S-1000、Capto Core400 及空层析柱Column XK50 / 100、Column XK26 / 30 均购自美国GE Healthcare 公司;Ultrahydrogel 2000 购自美国Waters 公司;马尔文粒径仪购自英国马尔文仪器有限公司。
1.3HBc VLPs 蛋白的诱导表达 根据NCBI 中登录的HBc基因序列(944568),由生工生物工程(上海)股份有限公司合成该基因序列。HBc基因序列经NdeⅠ和XhoⅠ双酶切后,插入至经同样酶酶切的载体pET-43.1a(+)中,构建重组质粒。转化感受态E.coilBL21(DE3),于26 ℃培养过夜;挑取单菌落,加入含100 μg / mL 氨苄西林的LB 液体培养基中,37 ℃,210 r/min 摇床振荡培养10 h;加入IPTG 至终浓度50 μg / mL,25 ℃诱导表达12 h;2 000 ×g离心4 min,取沉淀,超声破碎,用20%及40%硫酸铵沉淀,获得HBc VLPs 蛋白粗提液。
1.4HBc VLPs 蛋白的纯化
1.4.1Sephacryl S-1000 层析 将Sephacryl S-1000层析介质装入空层析柱Column XK50 / 100 中,用缓冲液1(含300 mmol / L NaCl 的20 mmol / L Tris)常温平衡层析柱2 个柱体积,上样HBc VLPs 蛋白粗提液,蠕动泵上样流速为:4 r / min,上样量为:600 mg。用缓冲液1 洗脱层析柱,280 nm 处吸光度值升至20 ~30 mAU 时开始收集第1 峰,吸光度值达峰顶值后下降至70 ~80 mAU 时停止收集;用缓冲液1 洗脱层析柱,当吸光度值上升至90 mAU 时开始收集第2 峰,下降至70 ~80 mAU 时停止收集;缓冲液1 冲洗半个柱体积,再用0.5 mol / L NaOH 洗涤,缓冲液1 平衡至流出液pH 为8。每管收集50 mL,共收集14 管,共上样3 个批次的HBc VLPs。
1.4.2Capto Core400 层析 将Capto Core400 层析介质装入空层析柱Column XK26 / 30 中,用缓冲液1常温平衡层析柱2 个柱体积,上样HBc VLPs 蛋白粗提液,蠕动泵上样流速为:4 r/min,上样量为:600 mg。上样后用缓冲液1 洗脱层析柱,280 nm 处吸光度值升至20 ~30 mAU 时开始收集,吸光度值达峰顶值后下降至70 ~80 mAU 时停止收集;缓冲液1 冲洗半个柱体积,再用0.5 mol / L NaOH 洗涤,缓冲液1 平衡至流出液pH 为8。每管收集50 mL,共收集8 管,上样批次同1.4.1 项。
1.5HBc VLPs 浓度检测 BCA 法测定蛋白浓度,并按下式计算回收率。

1.6HBc VLPs 纯度检测 采用体积排阻色谱法。色谱柱为:Ultrahydrogel 2 000;紫外PDA 检测器,检测波长为:280 nm;流动相为:20 mmol/L PBS,150 mmol/L NaC;上样量为:20 μL;流速为:0.6 mL / min;检测时间为:30 min;柱温为:25 ℃。
1.7HBc VLPs 粒径检测 将两种层析介质纯化的HBc VLPs 稀释至相同浓度,通过马尔文粒径仪对HBc VLPs 进行粒径检测。
1.8HBc VLPs 形态观察 取适量相同浓度的两种层析柱纯化后的HBc VLPs 滴至铜网上,静置2 min,用滤纸从铜网的一边吸取液体,滴加1%磷钨酸,静置2 min;用滤纸从铜网的一边吸取液体,放入玻璃平皿中,待铜网上的液体自然晾干;将制备好的铜网固定在样品握持杆的样品台上,插入至样品室内,抽真空后,置透射电子显微镜观察,并拍照。
2 结 果
2.1两种层析介质纯化HBc VLPs 的洗脱曲线 Sephacryl S-1000 的洗脱曲线可见2 个流穿峰,第2 峰为主要目的蛋白;Capto Core400 的洗脱曲线可见1 个流穿峰,为目的蛋白。取其中1 批HBc VLPs 的纯化结果绘制洗脱曲线,见图1 和图2。将Sephacryl S-1000 层析柱纯化后的第5 ~12 管HBc VLPs 进行合并作为目的蛋白,Capto Core400 层析柱纯化后的第1 ~8 管全部合并作为目的蛋白,用于后续检测。
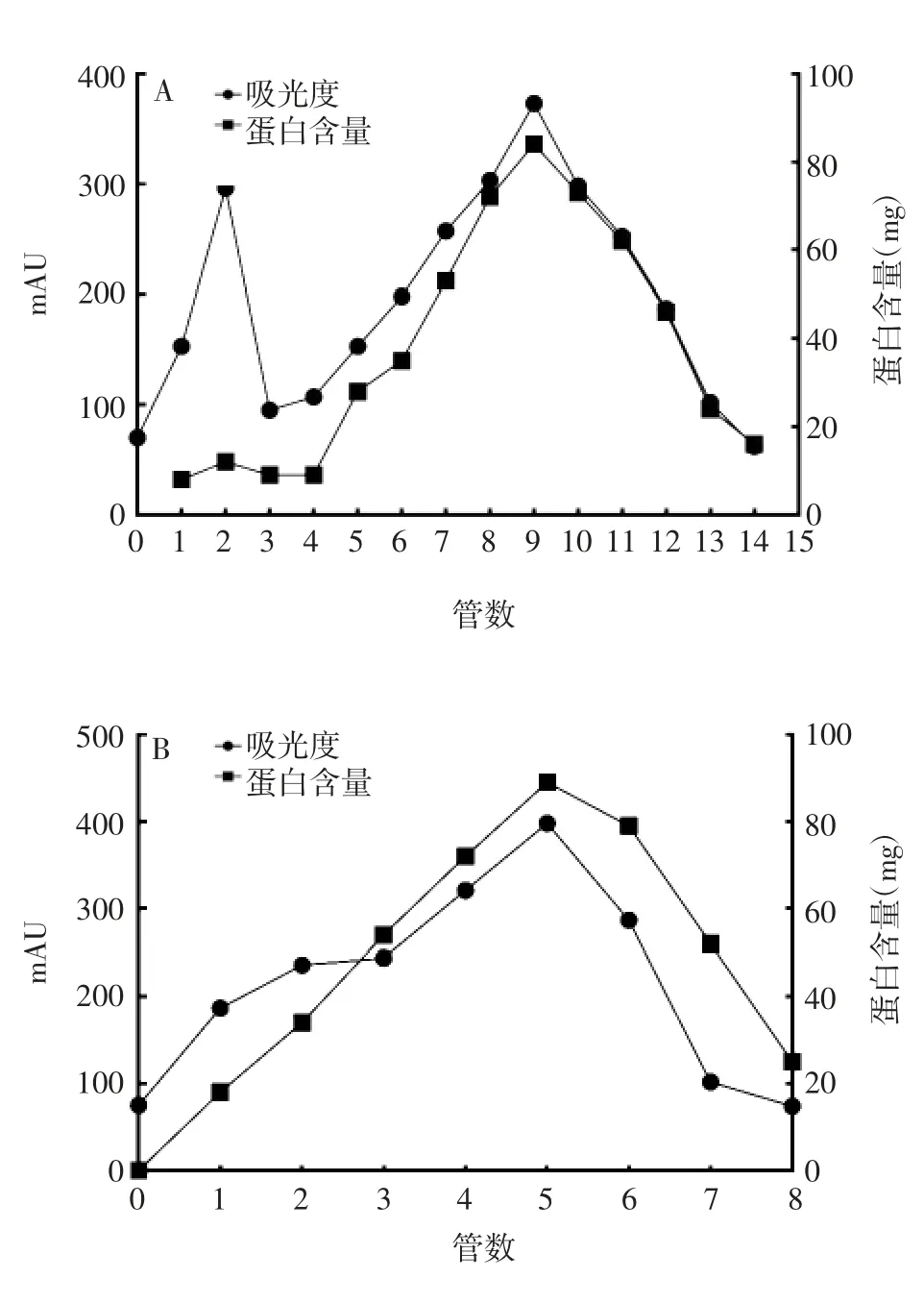
图1 层析介质Sephacryl S-1000(A)及Capto Core400(B)纯化HBc VLPs 的洗脱曲线Fig.1 Elution curves of HBc VLPs purified with Sephacryl S-1000(A)and Capto Core400(B)
2.2两种层析介质纯化HBcVLPs 的蛋白回收率 层析介质SephacrylS-1000 和CaptoCore400 纯化HBcVLPs的蛋白回收率分别为75.5%和70.5%。
2.3两种层析介质纯化HBc VLPs 的纯度 层析介质Sephacryl S-1000 和Capto Core400 纯化HBc VLPs的蛋白纯度分别为87%和99%,见图2。

图2 体积排阻色谱法检测层析介质Sephacryl S-1000(A)及Capto Core400(B)纯化HBc VLPs 的纯度Fig.2 Determination of purity of HBc VLPs purified with Sephacryl S-1000(A)and Capto Core400(B)by size-exclusion chromatography
2.4两种层析介质纯化HBc VLPs 的粒径 经两种层析介质纯化后,HBc VLPs 均出现单一粒径峰,粒径大小均为(30 ± 4)nm,均一性良好,颗粒分布均匀,见图3。
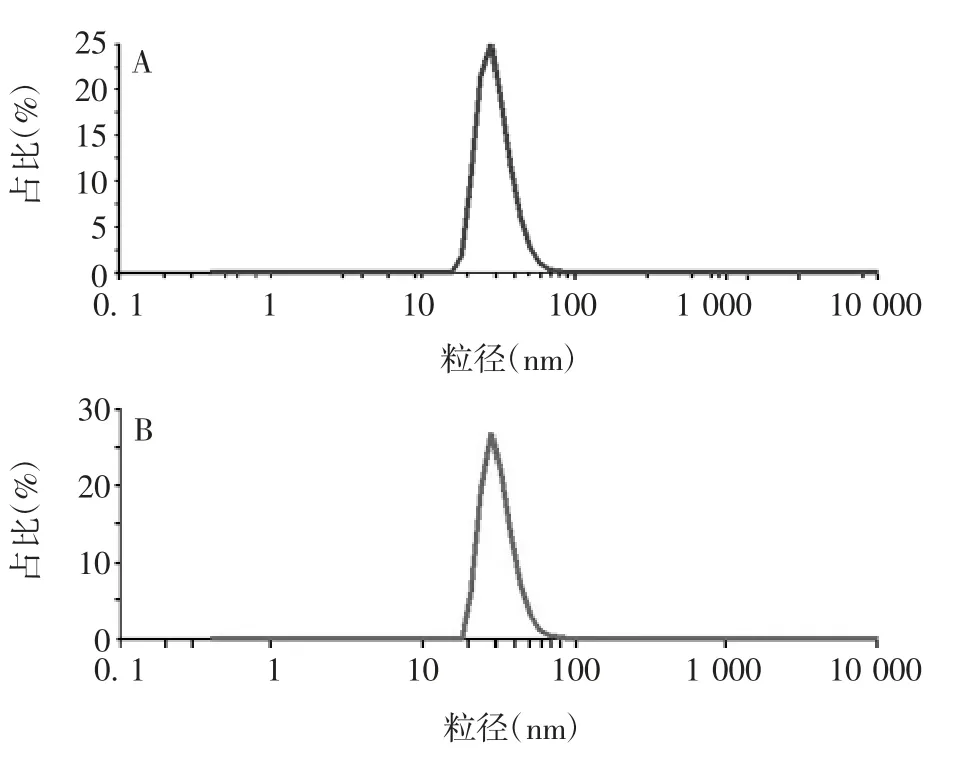
图3 层析介质Sephacryl S-1000(A)及Capto Core400(B)纯化HBc VLPs 的粒径图Fig.3 Sizes of HBc VLPs purified with Sephacryl S-1000(A)and Capto Core400(B)
2.5两种层析介质纯化HBc VLPs 的形态 透射镜下观察可见,与Sephacryl S-1000 比较,经Capto Core400纯化的HBc VLPs 分布更均匀,见图4。
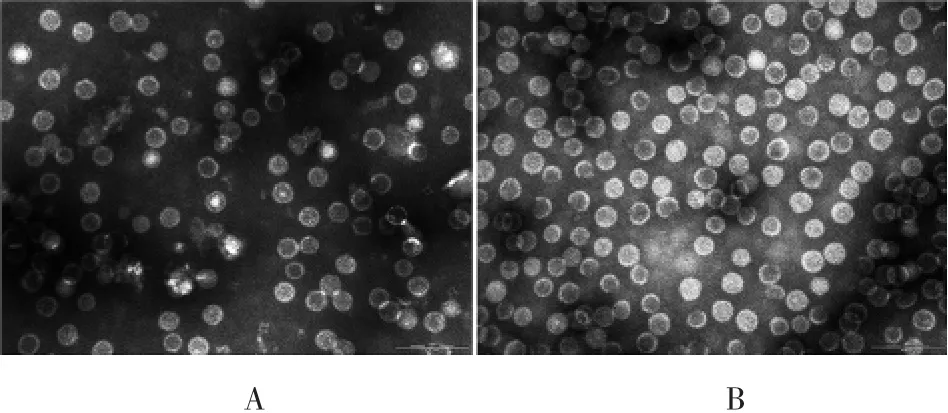
图4 层析介质Sephacryl S-1000(A)及Capto Core400(B)纯化HBc VLPs 形态的镜下观察(× 200 000)Fig.4 Electron microscopy of morphologies of HBc VLPs purified with Sephacryl S-1000(A)and Capto Core400(B)(×200 000)
3 讨 论
目前,国内厂家生产HBc VLPs 采用多种方法结合的形式进行纯化,如盐析、分子筛层析及离子交换层析联用[5],凝胶过滤层析、离子交换与蔗糖密度梯度离心联用[6-7];另外,还可通过改变温度的热处理法进行纯化[8]。多种纯化方法联用的过程较复杂[9],且可重复性较低,不适用于大规模生产。
Capto Core 系列层析介质具有双层结构,表层是带有小孔的惰性层,可截留大分子,使之直接流穿,小分子通过小孔进入填料内部核心区域。核心区域-Core 带有复合模式的辛氨基团,可吸附结合杂质分子,因此,Capto Core 填料具有分子筛与吸附层析(电荷+ 疏水性)的双重特点,可用于纯化多种物质。Capto Core700 可以流动模式提纯较大的生物分子和生物制品[10],如用于登革热嵌合减毒活疫苗的大量纯化[11],还可用于多种病毒的纯化[12-15],其中对轮状病毒的纯化可有效去除宿主蛋白,病毒收率达80%以上[16-17]。目前,用Capto Core400 层析介质进行HBc VLPs 纯化的研究鲜见报道。本研究用Sephacryl S-1000 和Capto Core400 两种层析介质纯化3 批HBc VLPs 粗提液,并对纯化效果进行对比,结果表明,层析介质Sephacryl S-1000 和Capto Core400 纯化HBc VLPs 的蛋白回收率分别为75.5%和70.5%,蛋白纯度分别为87%和99%,粒径大小均为(30 ± 4)nm,均一性良好;与Sephacryl S-1000 比较,经Capto Core400 纯化的HBc VLPs 分布更均匀。另外,Capto Core400 层析柱的柱床体积(133 mL)远小于Sephacryl S-1000 层析柱(1 570 mL),且Capto Core400 层析柱的线性流速(45 cm/h)也高于Sephacryl S-1000 层析柱(12 cm / h),节约了层析介质及缓冲液用量,缩短了纯化时间。因此,层析介质Capto Core-4 00 更适用于HBc VLPs 的规模化生产,有望成为HBc VLPs 及其衍生物纯化的新工艺。
