超声波协同复合酶提取菟丝子总黄酮工艺优化△
2017-12-26孙艳玲李泽琦冯冠英郑彧
孙艳玲,李泽琦,冯冠英,郑彧
(辽宁中医药大学 药学院,辽宁 大连 116600)
·中药工业·
超声波协同复合酶提取菟丝子总黄酮工艺优化△
孙艳玲,李泽琦,冯冠英,郑彧*
(辽宁中医药大学 药学院,辽宁 大连 116600)
目的将酶解法和超声波法联用,通过工艺优化提高菟丝子总黄酮的含量。方法实验采用紫外分光光度法测定总黄酮提取率,选取酶解pH、酶解温度和超声时间3个指标为影响因素,菟丝子总黄酮提取率为响应值,Design-Expert 8.0统计分析软件的响应面分析法安排试验后获得最适合工艺参数。结果最适合的工艺参数是PH为4.0,酶解温度为52.6 ℃,超声时间为20.3 min,在此条件下得到的总黄酮质量分数为23.39 mg·g-1。结论此工艺操作简单、稳定性好、总黄酮提取率高,可为菟丝子总黄酮的相关工业生产提供技术支持。
菟丝子总黄酮;复合酶;超声波;响应面分析法
菟丝子(Cuscutae semen)系旋花科植物菟丝子CuscutachinensisLam.的干燥成熟种子,其味辛、甘,性平,归肝肾经,具有滋补肝肾、益精安胎、固精缩尿、明目止泻的功能。菟丝子作为补肾药中不可或缺的一味药[1],其总黄酮具有促进下丘脑-垂体-性腺轴[2]的功能。菟丝子质地较硬,其有效成分不易被充分提取或提取率较低[3]。酶解法可以破坏植物细胞壁,在此基础上超声波进行二次破坏,使细胞内有效成分容易溶出。因此,本实验目的是通过酶解法和超声波法联用来提高菟丝子总黄酮产率,为其开发利用提供参考。
1 材料
1.1 试药
菟丝子经辽宁中医药大学药用植物教研室翟延君教授鉴定为菟丝子;芦丁对照品(成都普菲德生物技术公司);纤维素酶(1万U·g-1,阿拉丁试剂);果胶酶(3万U·g-1,阿拉丁试剂);氢氧化钠(NaOH)、亚硝酸钠(NaNO2)、硝酸铝[AL(NO3)3]、无水乙醇、冰乙酸(分析纯)。
1.2 仪器
SPD-10AVP紫外检测器(日本岛津公司);AE240十万分之一分析天平(瑞士MettLer公司);50 g手提式高速万能粉碎机(温岭市林大机械有限司);KQ-250DB数控超声波清洗器(昆山市超声仪器有限公司,功率:300 W,频率:50 kHz);pH计(PHS-3C型,上海仪电科学仪器股份有限公司);DF-101S集热式恒温加热磁力搅拌器(巩义市予华仪器有限公司)。
2 方法
2.1 对照品溶液的制备
精密称取105 ℃条件下干燥至恒重的芦丁对照品10 mg置于50 mL的容量瓶中,用70%的乙醇定容,摇匀,配成质量浓度为0.2 g·L-1的芦丁对照品溶液[4]。
2.2 标准曲线的制备
依次吸取对照品溶液0、1.2、1.4、1.6、1.8、2.0 mL置于EP管中,加水至2.6 mL,加入5%亚硝酸钠0.2 mL,摇匀,静置6 min,加入10%硝酸铝0.2 mL,摇匀,静置6 min,加入4%氢氧化钠2 mL,加水至5 mL,摇匀,静置15 min,在510 nm处测得吸光度,以吸光度为纵坐标,溶液浓度为横坐标绘制标准曲线[4],得到回归方程Y=6.412 5X-0.039 4,r=0.999 5,结果表明,芦丁质量浓度在0.092 3~0.153 8 g·L-1线性关系良好。
2.3 样品溶液的制备
将菟丝子饮片置于60 ℃的烘箱中干燥至恒重,粉碎之后过4号筛,装入干燥袋,置于干燥皿中备用。精密称取菟丝子粉末0.5 g,精密称取2%纤维素酶和2%果胶酶,精密吸取pH为4.5的冰乙酸溶液10 mL,依次置于100 mL的烧瓶中,加热搅拌[3],停止酶解后加入无水乙醇(V无水乙醇∶V冰乙酸=2∶1),超声10 min,补足失重,静置10 min,吸取上清液,离心,即得样品溶液。
2.4 总黄酮含量的测定
精密吸取2.3项下制备的提取液0.6 mL置于EP管中,按照2.2项制备供试品溶液后测得吸光度,代入标准曲线中得到样品溶液总黄酮的浓度。总黄酮含量计算公式:总黄酮含量=X×5÷0.6×V÷0.5×0.75(V为提取总黄酮时冰乙酸和无水乙醇总体积)。
2.5 方法考察
2.5.1 稳定性试验 精密吸取2.3项下制备的提取液0.4 mL,按照2.2项制备供试品溶液,6 h内每隔1 h测定一次吸光度,RSD为1.12%,表明供试品溶液在6 h内稳定。
2.5.2 精密度试验 精密吸取2.3项下提取液6份,各0.4 mL,按照2.2项制备供试品溶液,测得吸光度,RSD为0.88%,表明精密度良好。
2.5.3 重复性试验 精密吸取2.3项下得到提取液0.4 mL,按照2.2项制备供试品溶液,测得吸光度,测定6次,RSD为0.89%,表明重复性良好。
2.5.4 加样回收试验 精密称取菟丝子粉末0.5 g,6份,制备提取液方法同2.3项,在提取液中加入一定量的芦丁对照品,按照2.2项制备供试品溶液,测得吸光度,结果见表1,回收率为97.88%,RSD为1.25%。

表1 加样回收试验结果(n=6)
2.6 总黄酮提取工艺优化
2.6.1 提取方法的选择 首先考察不同提取方法对菟丝子总黄酮含量的影响。按照表2中方法制备提取液,按照2.2项方法制备供试品溶液后测得吸光度。结果显示,单用超声波提取比单用酶解法提取和无酶提取效果好,酶解提取联用超声波提取相对于其他提取方法菟丝子总黄酮提取率高。

表2 不同提取方法对菟丝子总黄酮含量的影响
2.6.2 酶解pH单因素试验 按照2.3项下方法制备提取液时,酶解所用冰乙酸的pH分别为3.5、4.0、4.5、5.0、5.5,总黄酮提取量依次为21.75、23.61、21.00、19.84、19.80 mg·g-1。结果表明,pH为4.0时菟丝子提取效果最佳,酸的浓度过大或者过小都会抑制酶的活性。见图1。

图1 酶解pH单因素试验结果
2.6.3 酶解时间单因素试验 在采用2.3项中的操作方法制备提取液时,酶解时间分别为10、30、60、90、120 min,总黄酮提取量依次为18.32、23.61、23.82、23.68、22.03 mg·g-1。结果表明,酶解时间为30 min提取效果最佳,虽然时间增加为60 min总黄酮产率稍微提高,但是从经济方面考虑,酶解时间无需延长至60 min。见图2。

图2 酶解时间单因素试验结果
2.6.4 酶解温度单因素试验 在采用2.3项中的操作方法制备提取液时,酶解温度分别为30、40、50、60、70 ℃,总黄酮提取量依次为19.78、21.97、23.62、23.59、21.89 mg·g-1。结果表明,酶解温度为50~60 ℃提取效果最佳,温度过高或者过低可能会抑制酶活性,高温甚至有可能使酶失去活性。见图3。
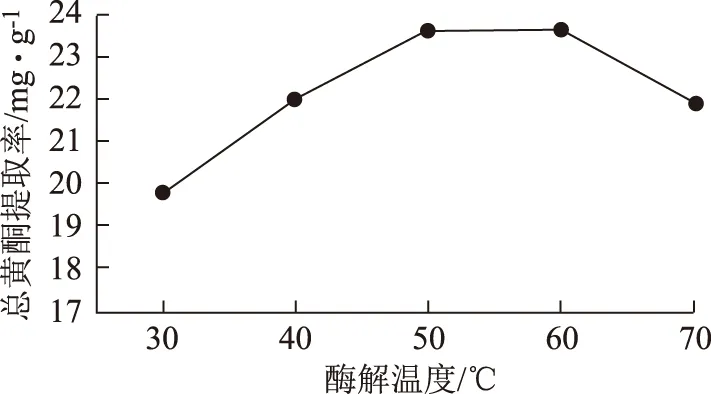
图3 酶解温度单因素试验结果
2.6.5 超声时间单因素试验 在采用2.3项中的操作方法制备提取液时,超声时间分别为0、10、20、30、40 min,总黄酮提取量依次为21.26、23.61、23.39、22.00、21.57 mg·g-1。结果表明,超声时间为20 min时提取效果最佳,时间过长可能是杂质的含量增加导致总黄酮提取率下降。见图4。
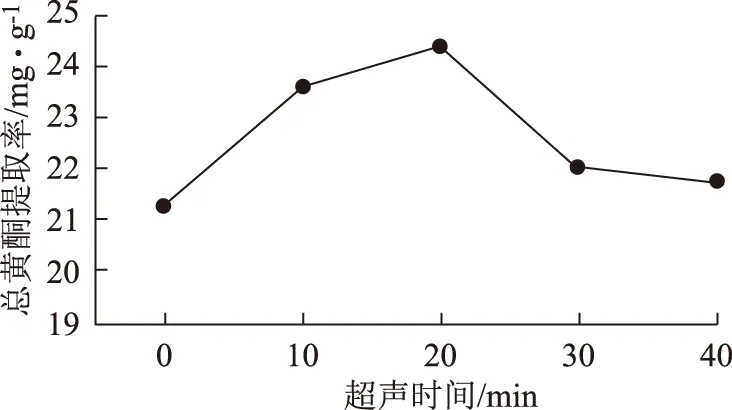
图4 超声时间单因素试验结果
2.6.6 料液比单因素试验 在采用2.3项中的操作方法制备提取液时,冰乙酸体积分别为5、10、15、20、25 mL,则无水乙醇体积相应地为10、20、30、40、50 mL,总黄酮提取量依次为19.58、23.61、23.87、24.00、24.40 mg·g-1。结果表明,料液比对总黄酮提取率没有太大影响,从经济角度和提取率两方面考虑,1∶20料液比最佳。见图5。

图5 料液比单因素试验结果
3 响应面分析法优化提取工艺
在单因素试验的基础上,选取酶解pH(X1)、酶解温度(X2)、酶解时间(X3)为考察对象,以菟丝子总黄酮含量为响应值(Y),采用Design-Expert.8.0统计分析软件的响应面分析法安排试验,最后获取最适合工艺参数[5]。采用3因素3水平的响应面分析方法进行试验设计,因素水平设计见表3。

表3 因素分析水平表
菟丝子总黄酮提取工艺优化结果见表4,共17个试验,1~12为析因试验,13~17为中心试验,用来分析试验误差。经回归拟合后,研究因素与响应值回归方程为Y=23.50+0.14X1+0.34X2+0.05X3+0.16X1X2+0.38X1X3-0.017X2X3-0.87X12-0.72X22-1.37X32。
菟丝子总黄酮响应面方差分析见表8,由方差分析结果可知,各因素中A2、B2和C2是高度显著的,B和AC是显著的(A为酶解pH,B为酶解温度,C为超声时间),表明各试验因子对响应值的影响不是简单的线性关系。上述回归方程中,F检验来判定各变量对响应值影响的显著性。从实验整体分析,回归模型F检验是高度显著的,决定系数r=0.963 2,说明预测值与实测值之间具有高度相关性,其失拟项检验不显著,说明具有统计学意义。该模型可以较好地描述研究因素与响应值之间的关系,可用此模型对菟丝子总黄酮提取率进行分析预测。

表4 响应面分析法方案和结果
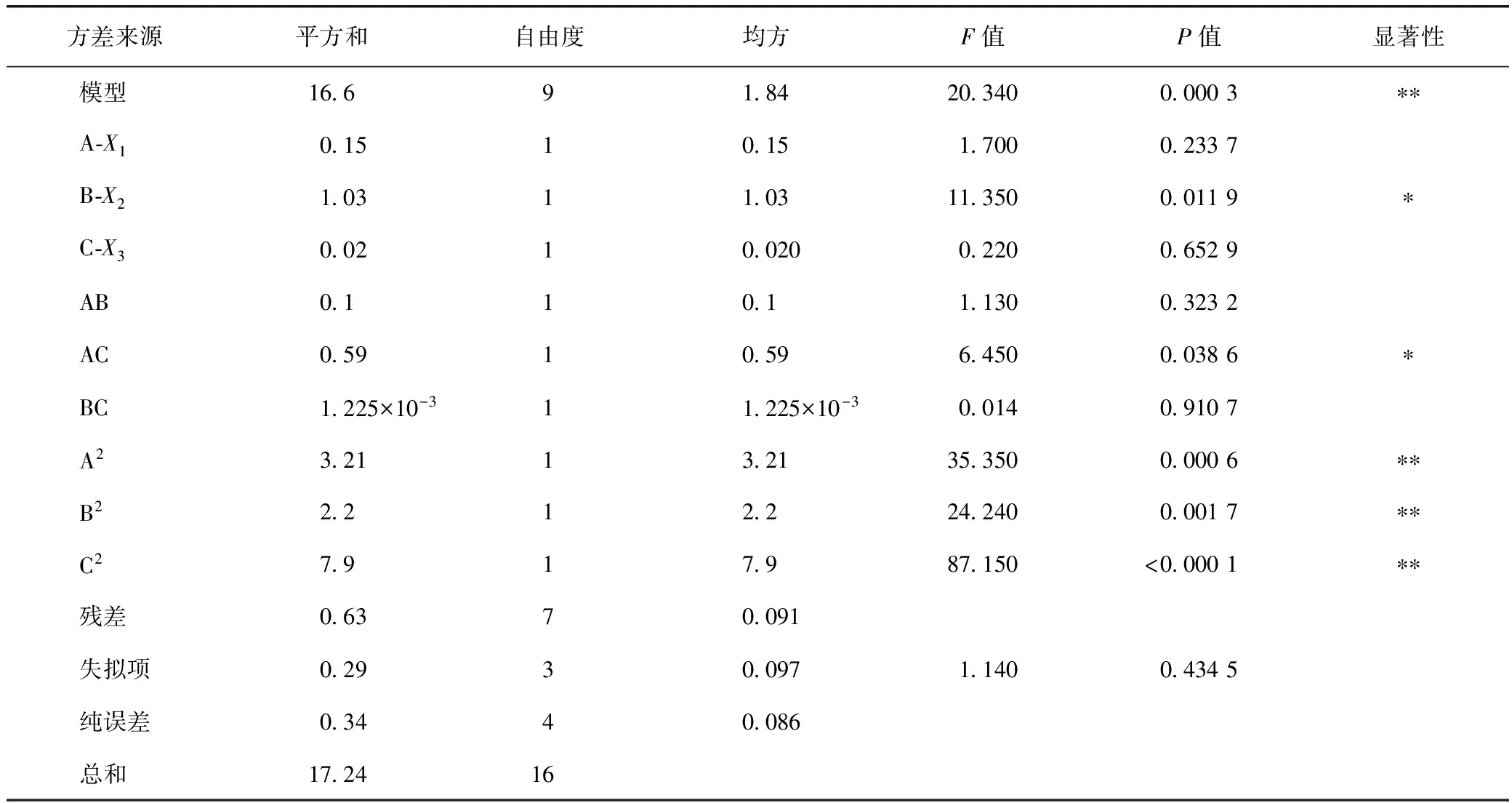
表5 方差分析结果
注:*表示显著差异(P<0.05),**表示极显著差异(P<0.01)。
研究因素酶解温度和pH值对菟丝子总黄酮提取率产生的影响见图6。图中曲面的弯曲程度反应两选取因素交互作用的显著程度,曲面越平,交互作用越不显著。从响应面的最高点和等高线可以看出,在所取试验参数范围内存在极值,其是响应面的最高点和等高线的中心点。

图6 影响因素间交互作用对菟丝子总黄酮提取率影响
4 结论与讨论
通过数据分析最后得到最佳条件:pH为4.05,酶解温度为52.59 ℃,超声时间为20.32 min,此条件下菟丝子总黄酮质量分数为23.555 1 mg·g-1。在此条件下重复实验,重复实验值为23.39 mg·g-1(n=3),与理论预测值误差为0.7%。说明该情况与实际情况相符,印证了实验结果的可靠性,此工艺参数可靠,具有实用价值。
近些年,很多新技术在天然成分提取方面应用广泛。彭金年等[6]比较了回流提取法、索式提取法、微波辅助萃取法和闪氏提取法对总黄酮提取率的影响,索式提取法和常规回流法虽然提取效果较好,但是提取时间过长。综合考虑,微波辅助法最佳,但是提取率较低,总黄酮的质量分数为13.44 mg·g-1。周蓉等[4]采用酶解法,总黄酮的质量分数为26.96 mg·g-1,提取率很高但是酶解时间过长。林晓等[7]采用超声辅助提取法,超声15 min,工艺很简单但是总黄酮量较低,为14.10 mg·g-1。植物细胞壁的主要组成成分是纤维素和果胶,酶解法利用纤维素酶和果胶酶破坏细胞壁[8],超声波产生空化现象,进一步造成植物细胞壁破裂[9],双重作用加速有效成分溶出,可缩短提取时间。本实验表明,酶解法和超声提取法确实具有协同作用,将两种提取方法联用可以提高总黄酮产率,缩短提取时间。此外,提取工艺简单,后处理容易,方法稳定可行,为有关菟丝子总黄酮的工业生产提供一定的技术支持。但是,该工艺下总黄酮中单体成分含量的变化情况还有待进一步研究。
[1] 刘成标.菟丝子大势看涨[J].中国现代中药,2006,8(3):45.
[2] 王建红,王敏璋,欧阳栋,等.菟丝子黄酮对心理应激雌性大鼠下丘脑β-EP和腺垂体FSH和LH的影响[J].中药材,2002,25(12):886-887.
[3] 伍晓春.超声波提取菟丝子总黄酮的工艺研究[J].食品研究与开发,2009,30(3):34-37.
[4] 周蓉,王洛临,徐文杰,等.菟丝子的酶法提取工艺优选[J].中国实验方剂学杂志,2014,20(22):33-36.
[5] 武婧,宋忠兴,古川,等.星点设计-响应面法优化黄柏提取工艺研究[J].中国现代中药,2015,17(9):953-957.
[6] 彭金年,李银保,成庚金生,等.菟丝子总黄酮不同提取方法的比较[J].西北林学院学报,2010,25(2):140-142.
[7] 林晓,练立婷,罗丽丹,等.菟丝子总黄酮超声提取工艺的研究[J].广州化工,2014,42(2):57-59.
[8] 高文秀,杨艳艳,赵文卓,等.复合酶解法协同超声波法提取山楂中总黄酮的工艺条件优化[J].食品工业科技,2014,35(2):175-178,182.
[9] 黄秀香,赖红芳,李植伟.复合酶辅助超声提取穿破石中黄酮苷工艺优化[J].医药导报,2013,32(5):664-666.
ExtractionOptimizationofTotalFlavonoidsfromCuscutachinensiswithCompoundEnzymeunderUltrasonicWave
SUN Yanling,LI Zeqi,FENG Guanying,ZHENG Yu*
(ThePharmaceuticalSciencesofLiaoninguniversityoftraditionalChinesemedicine,DaLianLiaoning, 116600,China)
Objective:Total flavonoids fromCuscutachinensiswere extracted with compound enzyme under ultrasonic wave aiming at improving the rate of extraction.MethodsThe pH,temperature and hydrolysis time were selected as influencing factors based on single factors,and the extraction rate of total flavonoids was selected as response value.The effects of all variables and their interactions on extraction rate of total flavonoids fromC.chinensiswere investigated through Box-Behnken experiment design method.ResultsThe optimum extraction conditions of total flavonoids were as follows:pH 4.05,temperature at 52.6 ℃,and ultrasonic time of 20.3 min.Under the optimized conditions,the maximum extraction yield of total flavonoids was 23.39 mg·g-1.ConclusionThe optimized extraction process has the advantages of less time,easy operation,the higher rate of the extraction of total flavonoids.
Total flavonoid fromCuscutachinensis; enzyme hydrolysis; ultrasonic; response surface analysis
10.13313/j.issn.1673-4890.2017.9.017
辽宁省大学生创新创业训练计划项目(201510162000048)
*
郑彧,副教授,研究方向:中药分析、中药炮制工艺、炮制机制;E-maiL:zhengyu1982@ aLiyun.com
2017-01-08)
