含辅酶Q10和洛伐他汀的红曲胶囊对老年性骨质疏松大鼠腰椎骨丢失的改善作用
2017-12-19吕思敏于琼司徒永立孙金影崔燎吴铁
吕思敏+于琼+司徒永立+孙金影+崔燎+吴铁
[摘要]目的 評价含有辅酶Q10以及洛伐他汀的红曲胶囊对老年性骨质疏松模型腰椎骨骨药理学的作用。方法 采用3月龄SPF级雌性SD大鼠45只,根据体重随机分为5组:假手术组(CON组),去卵巢组(OVX组),模型组(MOD组),己烯雌酚组(DES组)以及红曲胶囊组(RYR组),每组9只。取材前第13、14天和第3、4天进行皮下注射7 mg/kg钙黄绿素进行骨荧光标记。给药60 d后,取第四腰椎进行Micro CT扫描,之后制成不脱钙的骨切片,进行骨形态计量学检测。结果 与CON比较,MOD组Micro CT指标:骨体积分数(BV/TV),骨小梁厚度(Tb.Th),骨小梁数量(Tb.N),连接密度(Conn-Dens)以及骨密度(Density)均显著下降(P < 0.01),而骨小梁分离度(Tb.Sp)和结构模型指数(SMI)显著增大(P < 0.01);形态计量学参数:骨小梁面积百分数(%Tb.Ar)和Tb.N均显著降低(P < 0.01),而Tb.Sp和破骨细胞周长百分率(%Oc.Pm),单位骨小梁面积破骨细胞数(Oc.N),以及骨形成率(BFR/BS、BFR/BV、BFR/TV)和荧光周长百分数(%L.Pm)均显著增加(P < 0.01)。与MOD组比较,RYR组Micro CT指标:BV/TV,Tb.Th,Tb.N,Conn-Dens以及Density均显著增加(P < 0.01),而Tb.Sp和SMI均显著降低(P < 0.01);形态计量学参数:%Tb.Ar和Tb.N均显著增加(P < 0.01),而Tb.Sp和%Oc.Pm,Oc.N以及BFR/BS、BFR/BV、BFR/TV和%L.Pm均显著下降(P < 0.01)。结论 去卵巢合并D-半乳糖可导致大鼠出现老年性骨质疏松症状,含辅酶Q10和洛伐他汀的红曲胶囊改善去卵巢合并D-半乳糖致大鼠腰椎骨丢失效果显著。
[关键词] 辅酶Q10;洛伐他汀;红曲;去卵巢;D-半乳糖
[中图分类号] R965 [文献标识码] A [文章编号] 1673-7210(2017)11(a)-0031-06
Effect of Red Yeast Rice Capsules containing coenzyme Q10 and Lovastatin on lumbar vertebral in elderly osteoporosis rats
LV Simin1 YU Qiong2 SITU Yongli2 SUN Jinying2 CUI Liao2 WU Tie1,2▲
1.Guangdong Medical University·Guangdong Runhe Biological Technology Co., Ltd. Coenzyme Q10 Research Institute, Guangdong Province, Dongguan 523808, China; 2. School of Pharmacy, Guangdong Medical University, Guangdong Province, Dongguan 523808, China
[Abstract] Objective To investigate the effects on lumbar of Red Yeast Rice Capsules containing coenzyme Q10 and Lovastatin in elderly osteoporosis rats. Methods 45 three-month old female Sprague-Dawley rats were randomly divided into sham group (CON group), ovariectomized group (OVX group), model group (MOD group), diethylstilbestrol group (DES group), and Red Yeast Rice Capsules group (RYR group) according the weigh, and each group of 9 rats. All rats were received subcutaneous injection of calcein (7 mg/kg) on day 14, day 13, and day 4, day 3 before drawing the tissue samples. After 60 days, the fourth lumbar was performed on Micro CT, and then was measured in undecalcified sections for static and dynamic histomorphometric analysis. Results Compared with the CON group, in MOD group the Micro CT indexes of BV/TV, Tb.Th, Tb.N, Conn-Dens, Density decreased significantly (P < 0.01), Tb.Sp and SMI increased significantly (P < 0.01), and the histomorphometry indexes of %Tb.Ar and Tb.N were reduced significantly (P < 0.01), but Tb.Sp, %Oc.Pm, Oc.N, BFR/BS, BFR/BV, BFR/TV, %L.Pm, increased significantly (P < 0.01). Compared with the MOD group, in RYR group BV/TV, Tb.Th, Tb.N, Conn-Dens, Density increased significantly (P < 0.01), Tb.Sp and SMI were reduced significantly (P < 0.01), and the histomorphometry indexes of %Tb.Ar, Tb.N increased significantly (P < 0.01), while Tb.Sp, %Oc.Pm, Oc.N, BFR/BS, BFR/BV, BFR/TV, %L.Pm decreased significantly (P < 0.01). Conclusion The bone loss was less significant and serious degradation of the bone microstructure were observed in lumbar vertebralin the rats treated with ovariectomy combined with D-galactose. Red yeast rice capsules containing coenzyme Q10 and Lovastatin showed effective prevention effects on osteoporosis induced by ovariectomy combined with D-galactose in rats.endprint
[Key words] Coenzyme Q10; Lovastatin; Red yeast rice; Ovariectomy; D-galactose
骨质疏松症是一种以低骨量和骨组织微结构破坏为特征、导致骨脆性增加、骨折危险性增加的全身性疾病,这种低骨量和微结构破坏在脊柱的表现较在外周骨更早、更为广泛[1]。去卵巢后由于雌激素的缺乏导致骨量的快速丢失,而D-半乳糖在代谢中产生过多的自由基可以破坏胶原蛋白形成,从而影响骨的代谢[2-3],造成老年骨质疏松。因此,去卵巢合并D-半乳糖可作为一种新的骨质疏松动物模型[4],模拟65岁以上妇女的“老年性骨质疏松”。辅酶Q10可以调节成骨细胞和破骨细胞的分化[5],可以增加骨密度,他汀类药物在抗骨质疏松的治疗中起到积极作用,而且辅酶Q10可以有效减轻和预防他汀类药物对横纹肌、肝的副作用而起到协同的作用[6]。因此,本研究把红曲中的他汀成分及红曲菌丝体中的辅酶Q10提取出来后,按传统的胶囊生产工艺,制备为“红曲胶囊”,采用大鼠去卵巢合并D-半乳糖诱导老年性骨质疏松模型的椎骨,对其进行评价,探讨其抗骨质疏松的骨药理作用,现报道如下。
1 材料与方法
1.1 实验动物
45只SPF级3月龄SD大鼠,雌性,体质量(231.11±18.96)g。由广东省中山大学实验动物中心提供,实验动物质量合格证号:SCXK(粤)2011-0029。动物实验研究遵循了广东医科大学所制定的有关实验动物保护和使用的指南,并经广东医科大学的实验动物伦理委员会批准。
1.2 药品与试剂
红曲胶囊由广东医科大学湛江广医医药科技开发有限公司提供(每粒红曲胶囊含有1.31 mg洛伐他汀,6.28 μg辅酶Q10);D-半乳糖由天津市光复精细化工研究所提供(批号:20120928);己烯雌酚注射液由上海通用制药股份有限公司提供(批号:100204);甲苯胺蓝和钙黄绿素购于美国Sigma公司。
1.3 仪器与设备
Micro CT仪(SCANCO Medical AG,瑞士);光学显微镜(Nikon,日本);荧光显微镜和显微照相机(Nikon,日本);Osteomeasure测量和分析系统(Osteo Metrics,Inc. USA);硬组织切片机;碳化钨钢刀;慢速锯;赛多利斯BT 25S电子天平;石膏打磨机;恒温磁力搅拌器;电热恒温鼓风干燥箱。
1.4 实验方法
45只SD大鼠经适应性饲养1周,之后根据体重随机分成5组,每组9只。分组情况:①假手术组(CON):5 mL/(kg·d)蒸馏水灌胃;②去卵巢组(OVX):双侧去卵巢后,5 mL/(kg·d)蒸馏水灌胃;③模型组(MOD):双侧去卵巢后,100 mg/(kg·d)D-半乳糖皮下注射;④己烯雌酚组(DES):同模型组造模,给予30 μg/(kg·d)己烯雌酚灌胃;⑤红曲胶囊组(RYR):同模型组造模,给予0.5 颗/(kg·d)红曲胶囊灌胃。每组大鼠均自由饮水和摄食,连续给药60 d。所有的大鼠在取材前的第13、14天和第3、4天皮下注射7 mg/kg的钙黄绿素各1次,进行骨荧光标记。大鼠的体重每周称1次,并依照体重的变化来调整给药的剂量。取材时,腹腔注射给予3%戊巴比妥钠(1.5 mL/kg)麻醉大鼠,并且右心室彻底抽血以处死大鼠。之后取第四腰椎进行Micro CT扫描,再将第四腰椎制成不脱钙的骨切片進行骨组织形态计量学的研究。
1.5 大鼠腰椎的测定方法
1.5.1 大鼠腰椎的Micro CT检测及分析方法 大鼠处死后,迅速取出第四腰椎,置于4%多聚甲醛中,24 h后换上75%乙醇浸泡。将处理好的第四腰椎放入Micro CT仪,对腰椎进行X线扫描。扫描条件为:电压70 kVp,电流114 μA,扫描时间为24.8 min(单层),间隔时间为200 ms,分辨率为中度(Medium)。扫描同一样品,进行角度为180°的投射,获得1024×1024像素的500张不同截面的图片。对于腰椎选取矢状面两侧骨骺线下0.5 mm之间的次级松质骨作为兴趣区域(ROI),并进行三维重建。图像二值化完成之后,对选定ROI内的松质骨进行三维可视化呈现。使用其软件进行定量分析,参数包括:骨体积分数(BV/TV),骨小梁分离度(Tb.Sp),骨小梁厚度(Tb.Th),骨小梁数量(Tb.N),连接密度(Conn-Dens),骨密度(Density)以及结构模型指数(SMI)等[7]。
1.5.2 大鼠腰椎骨组织形态计量学检测方法 将Micro CT扫描后的第四腰椎用慢速据沿额状面锯开干骺端,暴露骨髓腔,按照文献进行脱水、透明、渗透,包埋,切片,染色,封片,制成不脱钙骨切片,以矢状面两侧骨骺线下0.5 mm之间的次级松质骨为观察范围,测量松质骨骨组织形态计量学参数。用半自动的图象数字化仪直接测量出的参数后,根据国际通用公式进行计算分析,包括静态参数:骨小梁面积百分数(%Tb.Ar),Tb.Sp,Tb.N,Tb.Th;动态参数:骨形成率(BFR/BS、BFR/BV、BFR/TV),骨矿化沉积率(MAR),荧光周长百分数(%L.Pm);吸收参数:破骨细胞周长百分率(%Oc.Pm),单位骨小梁面积破骨细胞数(Oc.N)[8]。
1.6 统计学方法
采用SPSS 13.0统计学软件进行数据分析,计量资料数据用均数±标准差(x±s)表示,多组间比较采用ANOVA单因素方差分析,若Levene检验方差齐性,则组间采用LSD检验;若方差不齐则采用Welch校正后做方差分析,组间采用Dunnett′s T3多重检验;以P < 0.05为差异有统计学意义。
2 结果
2.1 含辅酶Q10和洛伐他汀的红曲胶囊对去卵巢合并D-半乳糖诱导的老年性骨质疏松大鼠腰椎骨形态的影响endprint
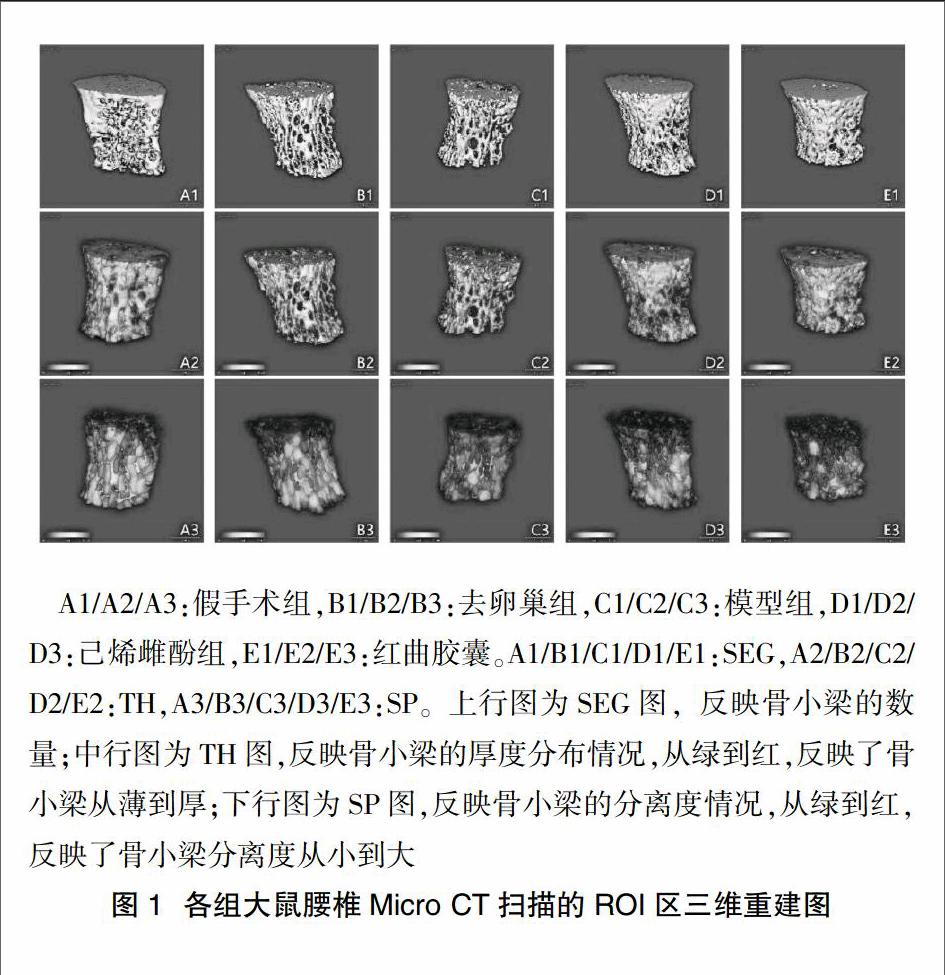
2.1.1 Micro CT扫描ROI区三维重建图的变化 图1中A为CON组,从图中可见动物骨小梁的结构比较紧密,骨小梁的粗细比较均匀,而且骨小梁的连续性比较好;B为OVX组,可见该组骨小梁出现断裂、变短,并且骨小梁之间有较大的空隙;C为MOD组,可见该组动物的骨小梁变短,且断裂,有很大的空隙;D为DES组,图中可见动物骨小梁较MOD组明显地增粗,数量明显增多,而且紧密性较好,一定程度上恢复连续性;E为RYR组,该组动物的骨小梁排列均匀紧密有序,且骨小梁之间间隙较小,连续性好,在小梁骨的数量、厚度、以及分布上均较MOD组有明显的改善。
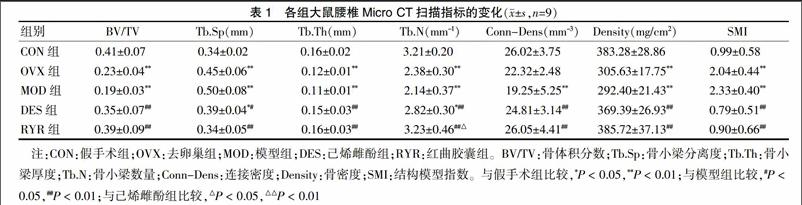
2.1.2 Micro CT扫描指标的变化 与CON组比较,MOD组的BV/TV、Tb.Th、Tb.N、Conn-Dens、Density均显著降低(P < 0.01),Tb.Sp和SMI均显著升高(P < 0.01)。而与MOD组比较,DES组的BV/TV、Tb.Th、Tb.N、Conn-Dens、Density均显著增加(P < 0.01),Tb.Sp明显降低(P < 0.05)和SMI显著降低(P < 0.01);RYR组的BV/TV、Tb.Th、Tb.N、Conn-Dens、Density指标均显著增加(P < 0.01),Tb.Sp和SMI均显著降低(P < 0.01)。与DES组比较,RYR组的Tb.N明显地增加(P < 0.05)。以上结果提示,去卵巢合并D-半乳糖可以导致大鼠的腰椎骨量大量丢失,红曲胶囊可有效地预防骨丢失。见表1。
2.2 含辅酶Q10和洛伐他汀的红曲胶囊对去卵巢合并D-半乳糖诱导的老年性骨质疏松大鼠腰椎骨形态计量学的影响
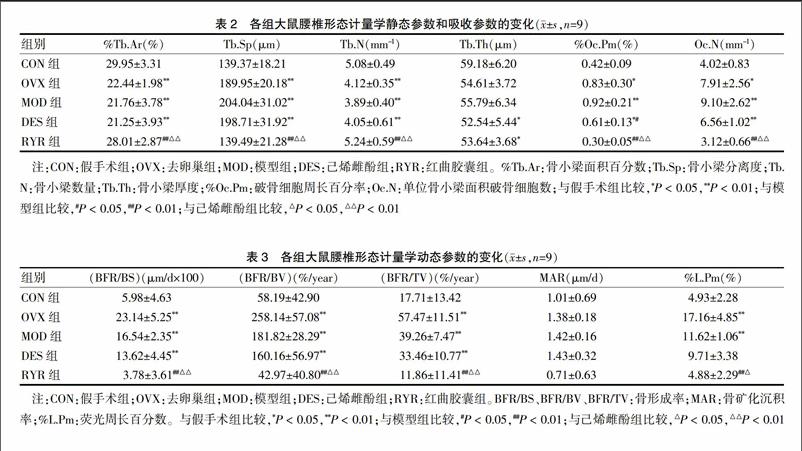
2.2.1 形态计量学静态参数和吸收参数的变化 与CON组比较,MOD组的%Tb.Ar和Tb.N显著降低(P < 0.01),Tb.Sp和%Oc.Pm、Oc.N显著增大(P < 0.01),以上说明模型组大鼠的腰椎松质骨骨小梁的数量显著减少,骨小梁的微观结构严重退化,并且破骨细胞的破骨作用很强。与MOD组比较,DES组的%Oc.Pm明显降低(P < 0.05);RYR组的%Tb.Ar、Tb.N显著性增加(P < 0.01),Tb.Sp和%Oc.Pm、Oc.N显著降低(P < 0.01)。与DES组比较,RYR组的%Tb.Ar、Tb.N显著性增加(P < 0.01),Tb.Sp和%Oc.Pm、Oc.N显著降低(P < 0.01)。以上结果提示,红曲胶囊可以有效地对抗去卵巢合并D-半乳糖对大鼠腰椎骨小梁数量的减少以及骨显微结构的破坏,并且能有效地抑制破骨细胞的破骨作用。见表2。
2.2.2荧光标记的动态变化 图2(封四)中A为CON组,该组的动物腰椎骨片荧光较稀疏。B为OVX组,该组荧光较CON多,且明亮,有双荧光。C为MOD组,该组动物的荧光较CON组丰富,绿色的钙黄绿素荧光清晰可见,而且双荧光清晰明亮,说明骨形成较活跃,促骨形成的作用较强。D为DES组,荧光较MOD组少,有双荧光。E为RYR组,荧光均较MOD少,荧光零星点点,说明骨形成不活跃,促骨形成作用较弱。
2.2.3 形态计量学动态参数的变化 与CON组比较,MOD组的BFR/BS、BFR/BV、BFR/TV和%L.Pm均显著升高(P < 0.01),以上提示去卵巢合并D-半乳糖可使得动物的促骨形成作用和促骨矿化能力增强,为高骨转换率,但其骨吸收作用远远大于骨形成作用,因而出现骨丢失。与MOD组比较,DES组的上述指标差异均无统计学意义(P > 0.05);RYR组的BFR/BS、BFR/BV、BFR/TV和%L.Pm均顯著性降低(P < 0.01)。另,与DES组比较,RYR组的%L.Pm明显降低(P < 0.05),而BFR/BS、BFR/BV、BFR/TV均显著性降低(P < 0.01)。见表3。说明红曲胶囊组动物腰椎松质骨的骨形成作用较弱。
3 讨论
3.1 去卵巢合并D-半乳糖可致大鼠腰椎出现明显的骨质疏松
本实验研究发现,去卵巢合并D-半乳糖可导致大鼠腰椎的BV/TV、Tb.N、Tb.Th、Density和Conn-Dens均显著降低,Tb.Sp和SMI均显著增加,骨小梁断裂,变短,并出现很大的间隙,表明去卵巢合并D-半乳糖大鼠骨小梁的结构明显稀疏,骨量严重丢失,骨微结构明显破坏,骨质疏松症状显著。而且,去卵巢合并D-半乳糖大鼠腰椎的%Tb.Ar和Tb.N降低,Tb.Sp、Oc.N和%Oc.Pm均增加,该组荧光丰富,绿色的钙黄绿素荧光清晰可见,而且双荧光清晰明亮,表明该组动物腰椎骨量丢失严重、骨微结构退化严重,破骨细胞数量增加,活性增强,破骨细胞的吸收作用增强,间接提示溶解骨质的速度加快,提示去卵巢合并D-半乳糖可明显促进大鼠的骨形成的作用和矿化的作用,属于高骨转换率,但由于骨吸收作用远远大于骨形成作用,使得骨重建处于负平衡状态,从而出现骨丢失严重。
去卵巢合并D-半乳糖使得大鼠的腰椎骨骨代谢发生异常改变:骨量丢失严重,破骨细胞的破骨作用活动增强,虽然成骨细胞促进骨形成的功能代偿性增强,但由于破骨细胞的破骨作用远远大于成骨细胞的成骨作用,从而使得骨重建处于负平衡而出现骨丢失严重。这是以骨吸收为主的高转换型骨代谢,骨量明显减少,骨组织形态学以及超微结构受到严重破坏。当雌激素下降时,高骨转换导致松质骨丢失严,而D-半乳糖可使骨形成受到抑制,促进了骨吸收,骨转换率明显的降低,出现“骨形成不足”的骨丢失,即低转换型骨质疏松,但在本实验中,可观察到去卵巢合并D-半乳糖的大鼠腰椎骨转换为高转换型,可能是因为双侧去卵巢之后,雌激素骤停,直接刺激了骨吸收,从而引起骨形成代偿性增加,其作用强于D-半乳糖所起的作用。
3.2 红曲胶囊可改善去卵巢合并D-半乳糖大鼠腰椎的骨质疏松
Micro CT是检测骨微结构的有效手段,当BV/TV、Tb·Th、Tb·N、Conn·D降低,而Tb·Sp增加时,提示骨量减少,骨小梁变薄、变细、变稀疏,骨微结构退化[9]。与模型组比较,红曲胶囊组的Micro CT参数BV/TV、Tb.N、Tb.Th、Density、Conn-Dens指标均显著增加,Tb.Sp、SMI均显著降低;且骨小梁分布排列均匀有序,紧密,且空隙较小,连续性比较好,说明红曲胶囊能增加腰椎骨量,并且增加骨小梁数量的效果比己烯雌酚好,提示红曲胶囊有抵抗去卵巢合并D-半乳糖导致大鼠腰椎骨量丢失的作用。endprint
Micro CT可精确显示骨组织三维结构特征,但难以获取并反映骨组织局部的细胞形态和骨形成率、吸收率等变化参数[10]。从骨形态计量学参数可见,红曲胶囊组腰椎%Tb.Ar和Tb.N增加,Tb.Sp降低,并且Oc.N和%Oc.Pm均降低,说明红曲胶囊可减少破骨细胞数量和/或减弱破骨细胞破骨功能,表明红曲胶囊能有效地抑制破骨细胞的活性,从而起到预防去卵巢合并D-半乳糖对大鼠腰椎松质骨显微结构的破坏的作用 。
红曲胶囊含有洛伐他汀和辅酶Q10,他汀类和辅酶Q10均具有促成骨潜能。他汀类药物可增加BMP-2表达和活性,促进骨形成及骨的矿化[11];也可通过抑制骨髓多能干细胞成的脂分化,促进骨形成;还可通过降低血清IL-6的分泌水平,抑制骨吸收[12]。另外,他汀类可以促进前成骨细胞、胚胎干细胞、牙周膜细胞等多种细胞的成骨分化[13-14]。刘家寅等[15]研究发现,在缺乏成骨诱导成分的环境下,辛伐他汀可以通过活化p38MAPK信号诱导大鼠BMSCs向成骨细胞分化。本课题组发现[16],洛伐他汀可使CCl4致肝损伤的小鼠增加骨密度,修复骨的显微结构。辅酶Q10是一种具有强大的清除自由基作用的抗氧化剂,本课题组成员[17]在辅酶Q10对10月龄小鼠股骨的Micro CT观察及骨生物力学检测的研究中,发现辅酶Q10能够修复小鼠的股骨微观结构,提高骨生物力学的性能,修复骨量、降低股骨骨折风险。
骨转换是指由破骨细胞侵蚀旧骨释放出骨钙的骨吸收作用和由成骨细胞分泌胶原物质,促進类骨质矿化形成新骨的骨形成作用[18]。成骨细胞的成骨作用与破骨细胞的破骨作用维持着动态平衡,对骨代谢有着关键作用[19-20],因此,提高成骨细胞分化活性,同时降低破骨细胞的活性,是预防和治疗骨质疏松的重要靶点。本实验发现,红曲胶囊主要是通过抑制破骨细胞而起抗骨丢失作用。随着年龄的增长和去卵巢后雌激素的缺乏,血液和组织中辅酶Q10水平不断降低,因此,补充辅酶Q10可有效减轻和预防他汀类药物对横纹肌、肝的副作用,而且辅酶Q10和洛伐他汀同时具有抗骨丢失的作用,起到协同作用。
去卵巢合并D-半乳糖可致大鼠腰椎骨量严重丢失,骨显微结构严重退化,给予含辅酶Q10和洛伐他汀的红曲胶囊后,去卵巢合并D-半乳糖大鼠腰椎骨丢失情况和骨微结构均得到改善,提示该胶囊具有良好的抗骨质疏松作用。
[参考文献]
[1] 王志明,杨雄健,吴俊哲,等.骨质疏松与腰椎退行性变的相关性分析[J].中国骨质疏松杂志,2014,20(2):178-180.
[2] 刘甜甜,李娜,邱服斌,等.去卵巢合并D-半乳糖注射制备大鼠AD模型及戊酸雌二醇对其记忆改善的作用[J].中国预防医学杂志,2013,14(9):641-645.
[3] 李红波,彭磊.氧自由基失衡微环境对骨关节炎进展的影响[J].中国骨与关节杂志,2016,5(12):939-942.
[4] 司徒永立,柯行,刘义,等.三种小鼠骨质疏松模型骨组织形态计量学观察与评价[J].中国药理学通报,2014,30(9):1281-1287.
[5] Moon HJ,Ko KW,Jung MS,et al. Coenzyme Q10 Regulates Osteoclast and Osteoblast Differentiation [J]. J Food Sci,2013,7(5):785-791.
[6] 王文娜,陈明.辅酶Q10心血管病防治应用进展[J].心血管病学进展,2017,38(2):184-189.
[7] Follet H,Farlay D,Bala Y,et al. Determinants of micro?鄄damage in elderly human vertebral trabecular bone [J]. PLoS One,2013,8(2):e55232.
[8] 崔燎,吴铁.骨质疏松药理学-动物实验与图谱[M].北京:科学出版社,2011:43-44.
[9] 徐明,夏雪山,刘丽,等.辛伐他汀干预对骨质疏松兔骨密度及腰椎骨微结构的影响[J].昆明理工大学学报,2013, 38(3):89-94.
[10] 齐进,徐海峰,王晋申,等.骨组织形态计量学和微CT测量技术在骨质疏松研究中的应用[J].国际骨科学杂志,2012,33(3):157-159.
[11] Xie Y,Tan X,Huang J,et al. Atorvastatin-loaded micelles with bone-targeted ligand for the treatment of osteopo?鄄rosis [J]. Drug Deliv,2017,24(1):1067-1076.
[12] Lazzerini PE,Capperucci C,Spreafico A,et al. Rosuva?鄄statin inhibits spontaneous and IL-1β-induced interleukin-6 production from human cultured osteoblastic cells [J]. Joint Bone Spine,2013,80(2):195-200.
[13] Kim IS,Jeong BC,Kim OS,et al. Lactone form 3-hydroxy-3-methylglutaryl- coenzyme A reductase inhibitors (sta?鄄tins) stimulate the osteoblastic differentiation of mouse periodontal ligament cells via the ERK pathway [J]. J Periodontal Res,2011,46 (2):204-213.
[14] Qiao LJ,Kang KL,Heo JS. Simvastatin promotes osteogenic differentiation of mouse embryonic stem cells via cano?鄄nical Wnt/β-catenin signaling [J]. Mol Cells,2011,32(5):437-444.
[15] 刘家寅,刘光源,田发明,等.辛伐他汀通过p38MAPK信号通路诱导BMSCs成骨分化的研究[J].中国骨质疏松杂志,2016,22(2):125-130.
[16] 吕思敏,于琼,夏海珊,等.应用Micro CT观察洛伐他汀和秋水仙碱对CCl4致肝损伤后小鼠骨代谢的影响[J].中国药理学通报,2014,30(8):1116-1122.
[17] 黄志荣,朱丽斌,吴海游,等.辅酶Q10对10月龄小鼠股骨的Micro CT观察及骨生物力学检测[J].中国骨质疏松杂志,2016,22(3):366-371.
[18] 刘庆思.中西医结合诊治骨质疏松症[M].北京:中国中医药出版社,2001:19-20.
[19] 吕伟,厉小梅.类风湿关节炎骨代谢研究进展[J].中国骨质疏松杂志,2012,18(6):579-582.
[20] 裴雅松,唐汉庆,郑豪芬,等.附子注射液对去卵巢骨质疏松大鼠骨代谢及骨密度的影响[J].医药导报,2015, 34(2):185-189.
(收稿日期:2017-08-15 本文编辑:任 念)endprint
