山楂消脂胶囊超微粉与细粉中大黄酸在大鼠体内的药代动力学差异研究
2017-12-19梁秀清沈晓李子鸿李怀国刘东文王利胜
梁秀清+沈晓+李子鸿+李怀国++刘东文+王利胜
[摘要] 目的 比较大鼠灌胃山楂消脂胶囊超微粉和细粉后大黄酸的药代动力学特征差异。 方法 大鼠分别灌胃给予超微粉混悬液或细粉混悬液,用高效液相色谱法测定大黄酸的血药浓度变化。色谱柱为Uranus C18(250 mm× 4.6 mm,5 μm),流动相为甲醇-0.1%磷酸水溶液(85∶15),流速为1 mL/min,检测波长为254 nm,血药浓度-时间数据采用PKSolver2.0药代动力学软件进行分析。 结果 大黄酸血药浓度在0.16~40.00 μg/mL线性关系良好。大鼠灌胃给予山楂消脂胶囊超微粉混悬液及细粉混悬液后大黄酸血浆-时间曲线均符合二房室模型,山楂消脂胶囊超微粉及山楂消脂胶囊细粉的主要药动学参数AUC分别为(4.08±4.96)μg/(mL·h)和(0.74±0.06)μg/(mL·h)(P < 0.05),药峰浓度(Cmax)分别为(0.79±0.15)μg/mL和(0.17±0.02)μg/mL(P < 0.05)。 结论 超微粉碎能使大黄酸在大鼠体内的吸收更完全,提高生物利用度。
[关键词] 山楂消脂胶囊;超微粉;细粉;大黄酸;药代动力学
[中图分类号] R284.1 [文献标识码] A [文章编号] 1673-7210(2017)11(a)-0027-04
Pharmacokinetic study of rhein from the ultra-micro and fine powder of Shanzha Xiaozhi Capsules in rats
LIANG Xiuqing1 SHEN Xiao2 LI Zihong1 LI Huaiguo1 LIU Dongwen1 WANG Lisheng2
1.Preparation Center, Foshan Hospital of TCM, Guangdong Province, Foshan 528000, China; 2.College of Traditional Chinese Medicine, Guangzhou University of Chinese Medicine, Guangdong Province, Guangzhou 510006, China
[Abstract] Objective To compare the differences of pharmacokinetic characteristics of rhein after rats received ultra-micro and fine powder of Shanzha Xiaozhi Capsules by gavage. Methods The experimental rats were given suspensions of the ultra-micro and fine powder of Shanzha Xiaozhi Capsules. The plasma concentration of rhein in rats was measured by high performance liquid chromatography. Uranus C18 (250 mm× 4.6 mm, 5 μm) was used as the analytical column. The mobile phase was methanol-water-0.1% phosphoric acid (85∶15), the wavelength of detection was set at 254 nm, and the flow rate was 1.0 mL/min. Serum concentration-time data was processed by pharmacokinetics software PKSolver 2.0. Results The linear range of rhein was from 0.16 to 40.00 μg/mL. The concentration-time curves of rhein in rats fitted well into two compartment model. The main pharmacokinetic parameters of the AUC of rhein from the ultra-micro and fine powder of Shanzha Xiaozhi Capsules were (4.08±4.96) μg/(mL·h) and (0.74±0.06) μg/(mL·h) (P < 0.05), the maximum plasma concentration of rhein from the ultra-micro and fine powder of Shanzha Xiaozhi Capsules were (0.79±0.15) μg/mL and (0.17±0.02) μg/mL (P < 0.05). Conclusion The ultra-micro porphyrization can make the absorption of rhein more complete in rats and improve bioavailability.
[Key words] Shanzha Xiaozhi Capsules; Ultramicra-power; Fine-power; Rhein; Pharmacokinetics
山楂消脂膠囊由山楂和大黄两味中药组成,具有行气化痰、消积除滞等作用[1-2]。研究发现,山楂消脂胶囊临床上具有降低冠心病患者动脉斑块中的脂质含量、改善心绞痛发作症状等作用[3-5]。为提高山楂消脂胶囊的生物利用度,现采用超微粉碎技术对其工艺进行改革。大黄作为君药,故选用有效成分大黄酸进行超微粉与细粉相对生物利用度的比较研究,从而对山楂消脂胶囊进行超微粉碎是否合理以及有效性进行客观评价,为更深入的临床研究及医院其他制剂超微粉技术的引入提供理论基础。endprint
1 仪器与试药
1.1 仪器
戴安summitP680液相色谱仪(戴安公司);PDA-100二级管阵列检测器;Chromelon色谱工作站;湘仪高速离心机(H1850)(湖南湘仪有限公司);XW-80A涡旋混合器(上海精科实业有限公司);AUW120D分析天平(SHIMADZU);KQ5200DE型超声振荡仪(昆山市超声仪器有限公司);DP-MD200-2/亚欧德氮吹仪(广州海沥生物科技有限公司);FC160F粉碎机粉碎(上海坤麟制药机械有限公司);BFM-6BI型贝利微粉机(济南倍力粉技术工程有限公司)。
1.2 试药
山楂消脂胶囊(院内制剂,由广东省佛山市中医院提供,批号0431503);大黄酸(批号0757-200206)购于中国药品生物制品检定所;甲醇:色谱纯(DiKMA公司);水为超纯水;磷酸:色谱纯(成都市客龙化工试剂厂);乙酸乙酯:分析纯(天津市津东天正精细化学试剂厂);盐酸:分析纯(天津市津东天正精细化学试剂厂)。
1.3 动物
SPF级SD大鼠,雄性,体重220~260 g,1.6月龄,在室温20~-23℃,相对湿度65%~75%条件下喂养,自由进食、饮水,适应性培养1周。由广州中医药大学实验动物中心提供,合格证号:SKXK粤2008-0020,粤监证字2008A002。
2 方法与结果
2.1 色谱条件
Uranus C18(250 mm× 4.6 mm,5 μm),流动相甲醇-0.1%磷酸溶液(85∶15),检测波长254 nm,流速1.0 mL/min,柱温为室温,进样量为20 μL[6]。
2.2 对照品溶液的制备
精密称取1.6 mg大黄酸对照品于10 mL容量瓶中,用甲醇溶解,定容,浓度为160 μg/mL。经倍数稀释配成0.24、0.48、0.96、24.00、36.00、48.00、60.00 μg/mL共7个浓度的对照品溶液。
2.3 山楂消脂胶囊超微粉与细粉及其混悬液的制备
将山楂、大黄药材打成粗粒,再通过FC160F粉碎机粉碎,即得粒径为100目的细粉;将山楂、大黄药材打成粗粒,再通过BFM-6BI型贝利微粉机粉碎,即得粒径为200目的细粉。分别称取2.5 g的超微粉及细粉于50 mL容量瓶中,加超纯水超声溶解,定容,即为供试品溶液,浓度为0.05 g/mL。
2.4 血浆样品预处理
将血浆样品置于肝素管,4000 r/min,离心5 min(离心半径为9.16 cm),取上清液0.2 mL,加入0.1 mol/mL盐酸0.05 mL酸化,再加入1.5 mL乙酸乙酯,涡旋混合振荡10 min,8000 r/min,离心8 min(离心半径为9.16 cm),沉淀蛋白,吸取乙酸乙酯层1 mL,于40℃氮气吹干,残渣加甲醇0.1 mL,漩涡混合振荡溶解,12 000 r/min,离心10 min(离心半径为12.84 cm),取上清液0.07 mL,低温保存,用时过滤供液相检测。
2.5 动物分组与给药
将SD大鼠10只随机分为超微粉组和细粉组。实验前12 h禁食不禁水。超微粉组灌胃给予超微粉混悬液,细粉组灌胃给予细粉混悬液,两组均按0.5 g/kg的剂量给药。于给药后5 min、15 min、30 min、45 min、1 h、1.5 h、2 h、4 h、6 h、9 h、12 h、24 h于大鼠眼眶取血0.5 mL于肝素管中,4000 r/min离心8 min,取上清液0.2 mL,按“2.4”项下操作,测定大黄酸峰面积,并计算相应大黄酸的浓度。
2.6 方法专属性
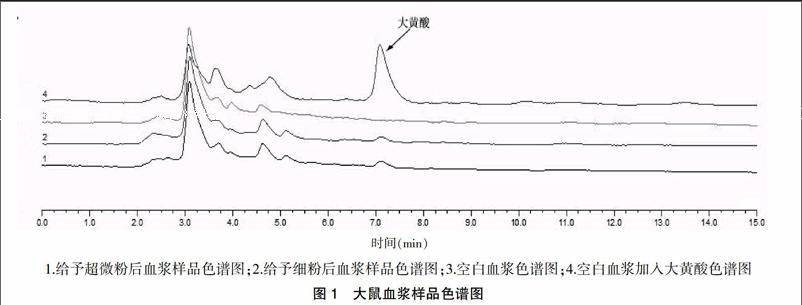
在选定的色谱条件下,山楂消脂胶囊中的其他成分和血浆中内源性成分不干扰大黄酸的测定,见图1,其中大黄酸的出峰时间在7 min左右。
2.7 标准曲线
精密量取系列大黄酸对照品溶液于离心管中,加入0.1 mL大鼠空白血浆,制成大黄酸质量浓度分别为0.16、0.32、0.64、16.00、24.00、32.00、40.00 μg/mL的血浆样本,按“2.1”项下操作,以大黄酸的峰面积Y对大黄酸血药浓度X进行线性回归,得回归方程Y = 1107.4X-0.0015(r = 0.9996),大黄酸在0.16~40.00 μg/mL线性关系良好。
2.8 精密度试验
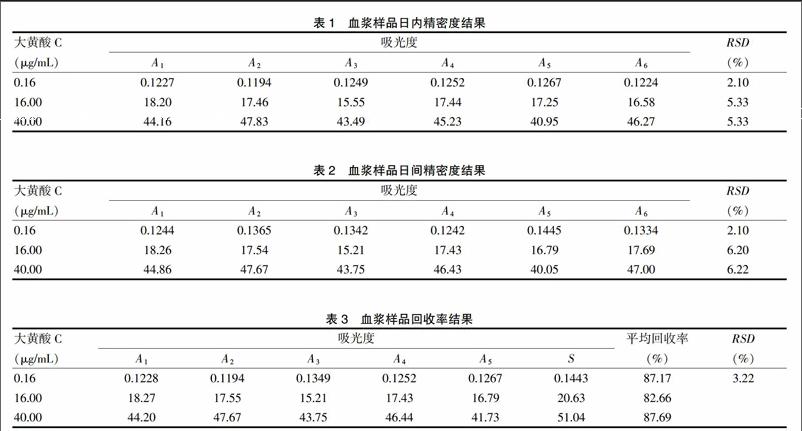
分别取大黄酸对照品溶液制成0.16、16.00、40.00 μg/mL的血浆样品,每个浓度平行作6份,按“2.1”项下操作,在1 d内测定6次。结果测得3种不同浓度血浆样品的平均RSD为4.26%,见表1。日间精密度的测定,同上法制备血浆样品,在1 d内测定1次,连续测定6 d。结果测得3种不同浓度血浆样品的平均RSD为6.08%,见表2。
2.9 回收率试验
精密量取空白血浆0.10 mL于离心管中,分别加入大黄酸对照品溶液0.2 mL,制成大黄酸质量浓度分别为0.16、16.00、40.00 μg/mL的血浆样本,每个浓度平行5份,按“2.1”项下操作,测定的大黄酸峰面积为S,另取浓度为0.24、24.00、60.00 μg/mL大黄酸对照品溶液0.2 mL,加入0.1 mL甲醇,按“2.1”项下操作,测定的大黄酸峰面积为A,回收率=S/A×100%,计算得到其平均提取回收率为85.85%,大于85%,符合药代动学研究的要求,见表3。
2.10 药动学研究
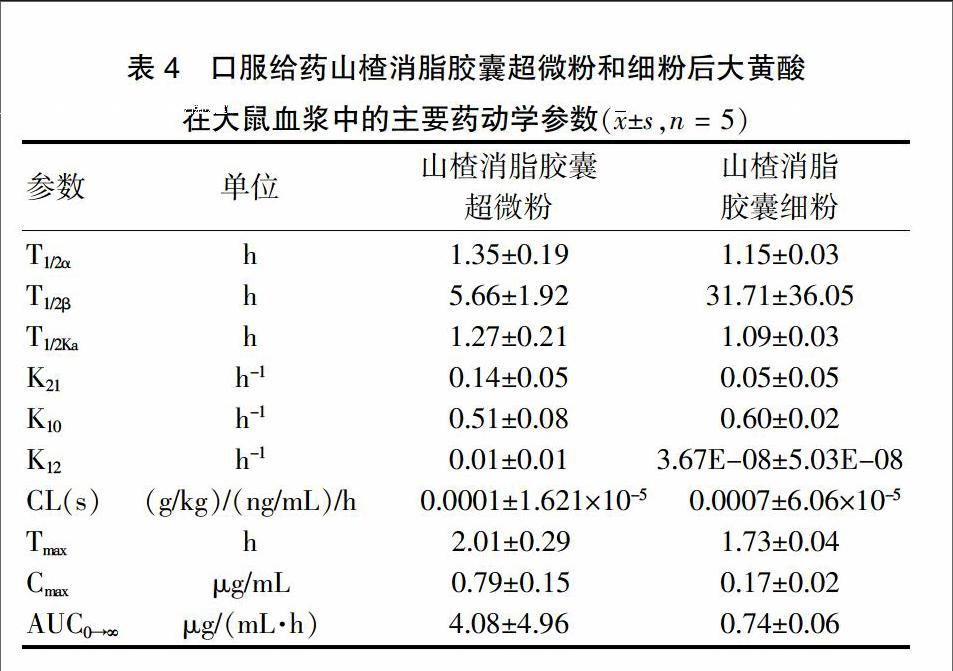
大鼠灌服山楂消脂胶囊超微粉混悬液及山楂消脂胶囊细粉混悬液后,于不同时间点进行采样处理并测定相应大黄酸峰面积,数据经PKSolver 2.0程序药代动力学模型拟合,以理论血药浓度与实测血药浓度相关系数最大且AIC值最小为原则,确定山楂消脂胶囊超微粉与细粉中大黄酸在大鼠体內均符合二室模型,主要药动学参数见表4,平均血药浓度-时间曲线见图2。采用t检验对超微粉与细粉之间的差异进行统计分析。研究结果表明,山楂消脂胶囊超微粉和细粉中大黄酸在大鼠体内均呈开放二室模型;统计学处理,山楂消脂胶囊超微粉及山楂消脂胶囊的主要药动学参数AUC分别为(4.08±4.96)μg/(mL·h)和(0.74±0.06)μg/(mL·h),药峰浓度(Cmax)分别为(0.79±0.15)μg/mL和(0.17±0.02)μg/mL。对两样本进行t检验,结果可得Cmax、AUC和清除率(CL)的差异均有统计学意义(P < 0.05)。其中大鼠灌服山楂消脂胶囊超微粉所得Cmax、AUC值大于灌服山楂消脂胶囊细粉,说明山楂消脂胶囊中药物经过超微粉碎后,其有效成分大黄酸在体内的吸收利用程度有所提高。通过计算相对生物利用度,超微粉为细粉的5.51倍,表明山楂消脂胶囊经超微粉碎后,吸收速度加快,生物利用度提高。endprint
表4 口服给药山楂消脂胶囊超微粉和细粉后大黄酸
在大鼠血浆中的主要药动学参数(x±s,n = 5)
3 讨论
超微粉碎通过将固体物质粉碎成直径小于10 μm粉体,使药物具粒径细且分布均匀,从而提高利用率,减少物料[6-10]。然而,对含有不稳定成分的药材,采用超微粉碎技术时需采用低温粉碎来减少药物的损失[11-12]。
山楂消脂胶囊由大黄与山楂两味中药组成,大鼠给予山楂消脂胶囊超微粉及细粉后,在选定色谱条件下大黄酸与其他成分达到基线分离,说明该条件下山楂消脂胶囊中其他成分及血浆内源性物质对大黄酸的测定均不产生干扰,可作为测定的指标。
本研究采用反相高效液相色谱法[13-14],通過比较山楂消脂胶囊超微粉与细粉中大黄酸在大鼠体内的药代动力学差异,探讨超微粉碎技术对药物有效成分吸收的影响。山楂消脂胶囊经超微粉碎后,吸收速度加快,生物利用度提高,可能是由于药物经过超微粉碎后,细胞破壁率增加,表面积增大,吸收量和吸收速度也随之提高[15-17]。这与文献报道的一致,即大黄经过超微粉碎后其有效成分大黄酸的溶出度明显增加[18-19]。T1/2β为药物消除半衰期,实验结果表明细粉的消除半衰期大于微粉组,说明山楂消脂胶囊经过超微粉碎后其吸收速度加快,消除速度提高。
[参考文献]
[1] 李影雄,李子鸿,刘东文,等.山楂消脂胶囊中大黄蒽醌类成分一测多评法的建立[J].中国中医药信息杂志,2016, 23(1):89-90.
[2] Sun H,Luo G,Chen D. A Comprehensive and System Review for the Pharmacological Mechanism of Action of Rhein,an Active Anthraquinone Ingredient [J]. Front Pharmacol,2016, 7:247.
[3] 赵华云,王文会,陈伟强,等.山楂消脂胶囊对冠心病患者颈动脉IMT和心脑血管事件发生率的影响[J].中西医结合心脑血管病杂志,2014,12(2):132-133.
[4] 赵华云,王文会,陈伟强,等.山楂消脂胶囊对非急性期冠心病痰瘀证患者Hcy及Hs-CRP影响的研究[J].新中医,2011,43(10):9-11.
[5] 洪建康,侯晓亮,陈浩生,等.山楂消脂胶囊治疗冠心病不稳定型心绞痛合并高脂血症38例[J].湖南中医杂志,2017,33(1):42-43.
[6] 沈洁,李华,高锦明,等.超微粉碎技术在中药和保健食品中的应用[J].食品研究与开发,2005,26(6):178-179.
[7] 舒朝晖,刘根凡,马孟骅,等.中药超微粉碎之浅析[J].中国中药杂志,2004,29(9):823-827.
[8] 高丽霄,林汉卿,刘梅森.超微粉碎技术在食用与药用农产品加工中的应用[J].食品工业,2013,34(6):164-165.
[9] 谢瑞红,王顺喜,谢建新,等.超微粉碎技术的应用现状与发展趋势[J].中药粉体技术,2009,15(3):64-65.
[10] 赵亚,赖小平,姚海燕,等.响应曲面优化超微粉碎参须中人参总皂苷的溶出工艺[J].中药材,2014,37(3):494-498.
[11] 赵国巍,梁新丽,廖正根,等.超微粉碎技术对中药粉体性质的影响[J].世界中医药,2015,10(3):315-317,321.
[12] 陈力,吴羌平,张乐福.超微粉碎技术及其在中药加工中的应用[J].中药材,2002,25(1):55-57.
[13] 蒋波,高珣,毕开顺,等.HPLC法同时测定六味安消胶囊中蒽醌类成分含量[J].中药材,2009,32(6):975-977.
[14] Qu H,Ma Y,Yu K. Simultaneous determination of eight active components in Chinese medicine 'YIQING' capsule using high-performance liquid chromatography [J]. J Pharm Biomed Anal,2007,43(1):66-72.
[15] 顾轶,王广基,孙建国,等.LC-MS法测定Beagle犬血浆中人参皂苷20(R)-RH2及其药动学研究[J].中国临床药理学与治疗学,2006,11(3):256.
[16] 黄广菊.中药制剂中超微粉碎技术的应用[J].中国中医药指南,2011,9(35):43-44.
[17] 邓雯,夏荃,詹若挺,等.中药超微粉碎技术的研究进展[J].食品与药品,2007,9(11):59-62.
[18] 张明,侯连兵,杨洁.超微粉碎技术与普通粉碎技术对大黄蒽醌提取率的比较性研究[J].中药材,2006,29(7):728-729.
[19] 张红刚,汪妮,李顺祥,等.超微粉碎技术对中药有效成分提取效果影响研究[J].广州化工,2013,43(16):63-64.
(收稿日期:2017-06-14 本文编辑:张瑜杰)endprint
