肝癌切除术后辅助性经肝动脉化疗栓塞术对患者生存的影响及预后相关因素分析
2017-12-16邢志祥沈世强
邢志祥, 沈世强, 秦 峰, 杨 强, 叶 子
(武汉大学人民医院 肝胆腔镜外科, 武汉 430060)
肝癌切除术后辅助性经肝动脉化疗栓塞术对患者生存的影响及预后相关因素分析
邢志祥, 沈世强, 秦 峰, 杨 强, 叶 子
(武汉大学人民医院 肝胆腔镜外科, 武汉 430060)
目的探讨肝切除术后辅助性经肝动脉化疗栓塞术(TACE)对肝细胞癌(HCC)患者生存的影响,并分析影响其预后的相关因素。方法回顾性分析2007年1月-2012年12月武汉大学人民医院收治的215例HCC患者的临床资料。根据肝切除术后是否联合TACE治疗分为单纯组(95例)及联合组(120例)。单纯组采用单纯肝切除术治疗,联合组先行肝切除术,术后1个月给予TACE治疗。记录2组患者一般情况、治疗情况及相关临床指标,比较2组患者术后1、3、5年生存率及无瘤生存率。计量资料组间比较采用独立样本t检验,计数资料组间比较使用χ2检验。组间生存比较采用Kaplan-Meier生存分析,采用单因素分析及Cox多因素回归分析肝切除术后预后的影响因素。结果联合组术后1、3、5年生存率分别为96.5%、67.0%、51.0%,中位生存期为51个月;单纯组分别为84.0%、49.5%、36.5%,中位生存时间为39个月,2组生存率差异有统计学意义(χ2=5.540,P=0.018)。联合组术后1、3、5年无瘤生存率均分别为91.7%、62.5%、37.5%,单纯组分别为84.0%、42.1%、26.3%,差异有统计学意义(χ2=4.942,P=0.027)。术前AFP≥400 μg/L、TNM分期Ⅲ期、肿瘤多发、肿瘤直径>5 cm 、HBsAg阳性及发生血管侵犯是影响患者肝癌切除术后预后的独立危险因素,而TACE则是患者长期生存的保护因素。结论肝切除术后行辅助性TACE治疗可明显提高HCC患者的生存率及无瘤生存率,对提高手术疗效具有重要意义。
癌, 肝细胞; 化学栓塞, 治疗性; 肝切除术; 预后; 危险因素
肝切除是治疗原发性肝癌的主要方法,然而即使是早期肝癌患者,术后复发率仍很高。据报道[1]巴塞罗那分期A期肝癌患者的术后复发率达50%~70%。对于不可手术切除的原发性肝癌主要行经肝动脉化疗栓塞术(TACE)治疗,但目前对肝癌术后辅助性TACE的价值尚存在不同意见,有研究[2]认为术后辅助性TACE能够改善肝癌患者术后的预后,可降低肝癌患者的复发率,提高生存率。本文通过回顾性分析肝细胞癌(HCC)患者的临床资料,对比肝癌切除术后行辅助性TACE与单纯手术切除对HCC患者的治疗效果,并分析影响肝癌术后患者生存及预后的相关因素。
1 资料与方法
1.1 研究对象 对2007年1月-2012年12月在本院行肝切除的HCC患者的临床资料进行回顾性分析。患者纳入标准:(1)年龄26~75岁,术后一般情况好,美国东部肿瘤协作组(ECOG)评分0~2分[3];(2)术后病理检查证实为HCC;(3)行根治性手术,达到肉眼观下R0切除,术后病理提示标本切缘无肿瘤残余;(4)患者无肝内多发转移及肝外其他器官转移;(5)术后患者血清AFP水平回落至正常水平;(6)术后患者肝功能储备良好,Child-Pugh分级A级或B级;(7)临床资料完整,治疗后均定期随访,随访记录完整。排除标准:(1)肝切除术前有射频消融、TACE/肝动脉栓塞/肝动脉灌注化疗治疗史;(2)术后行经皮肝穿刺注射无水乙醇、射频消融;(3)术后病理证实为胆管细胞癌、混合细胞癌;(4)BCLC分期为B/C期。按照术后是否行TACE治疗分为联合组与单纯组。
1.2 治疗方法 单纯组行肝切除术,所有患者均达到根治性切除标准,对Child A级、小肝癌患者采取规则性肝切除,对Child B级及肿瘤直径较大、肝功能较差及肝硬化重的患者采取非规则性肝切除,以争取保留较多的残余肝实质,既完成肿瘤切除,又能在一定程度上预防肝衰竭。术中未见门静脉主干及一级分支癌栓,未见肝总管及一级分支、肝静脉主干及下腔静脉癌栓。联合组患者于术后1个月开始行TACE治疗,采用Seldinger法经股动脉穿刺插管。将导管置入腹腔干并通过肝动脉造影,明确需行肝动脉化疗栓塞的区域。明确已插入肿瘤区供血血管后,给予氟尿嘧啶1.0 g加生理盐水100 ml、丝裂霉素40 mg加生理盐水100 ml灌注;如有明显肿瘤染色灶或者异常血管团,再注入化疗药物(吡柔比星注射液8 mg)和超液化碘油配制成5~30 ml悬液栓塞,术后加压包扎24 h,并予止痛等常规处理。每例患者术后辅助性TACE次数平均为1.8次(1~3次)。行TACE治疗的同时常规与数字剪影血管造影同步造影。
1.3 随访情况 联合组患者术后第1个月进行TACE前,以及TACE后每隔1个月进行常规CT/MRI检查及血清AFP测定。单纯组患者术后1个月末常规CT/MRI检查及血清AFP测定,之后每隔3个月检查1次。可疑复发者,结合数字减影血管造影、CT/MRI影像、血清AFP水平变化等确诊。随访开始时间为手术当日,随访终点为患者死亡或随访至2017年2月。

2 结果
2.1 一般资料 共收集215例HCC患者,联合组120例,单纯组95例。联合组:男100例,女20例;年龄38~68岁,平均(54.17±9.06)岁;单发病灶98例,多发病灶22例,肿瘤平均直径(3.6±1.4)cm;肝功能Child-Pugh分级A级18例,B级102例;单纯组:男75例,女20例;年龄39~69岁,平均(53.93±9.16)岁;单发病灶84例,多发病灶11例,肿瘤平均直径(3.5±1.5)cm;肝功能Child-Pugh分级A级13例,B级82例。2组患者性别分布、年龄、ALT、AST、TBil、Alb、AFP、PT、HBsAg、Child-Pugh分级、血管侵犯、肿瘤数目、肿瘤直径、TNM分期比较差异均无统计学意义,具有可比性(P值均>0.05)(表1)。

表1 联合组与单纯组一般临床资料的比较
2.2 2组患者生存率及无瘤生存率的比较 联合组患者术后1、3、5年生存率分别为96.5%、67.0%、51.0%,中位生存期为51个月;单纯组术后1、3、5年生存率分别为84.0%、49.5%、36.5%,中位生存期为39个月;联合组术后1、3、5年生存率均高于单纯组,差异具有统计学意义(χ2=5.540,P=0.018)(图1)。
联合组术后1、3、5年无瘤生存率分别为91.7%、62.5%、37.5%,中位生存期为51个月;单纯组术后1、3、5年无瘤生存率分别为84.0%、42.1%、26.3%,中位生存期为39个月;联合组术后1、3、5年无瘤生存率高于单纯组,差异具有统计学意义(χ2=4.942,P=0.027)(图2)。

图1 联合组与单纯组 生存曲线
2.3 影响HCC患者5年生存期及5年无瘤生存期的单因素分析 单因素分析结果显示,不同年龄、性别、PT、术前ALT、AST、TBil、Alb水平与患者的术后5年生存期及复发无相关性(P值均>0.05),而术前AFP水平、不同的Child-Pugh分级、HBsAg、肿瘤直径、肿瘤数目、TNM分期及是否有血管侵犯、是否术后行TACE是影响患者术后5年生存期的相关因素(P值均<0.05)(表2)。同时,术前AFP水平、HBsAg、肿瘤直径、肿瘤数目、TNM分期、是否有血管侵犯及是否术后行TACE也是影响肝癌患者术后5年无瘤生存期的相关因素(P值均<0.05)(表3)。
2.4 影响HCC患者术后5年生存期及5年无瘤生存期的Cox多因素回归分析 结果显示,肿瘤多发、肿瘤直径> 5 cm 、发生血管侵犯、TNM分期Ⅲ期、术前AFP≥400 μg/L及HBsAg阳性是影响HCC患者5年生存期的独立危险因素(P值均<0.05),术后TACE为HCC患者术后长期生存的保护因素,而Child-Pugh分级并不是影响患者预后的独立危险因素(P>0.05)(表4)。同时肿瘤多发、肿瘤直径> 5 cm、发生血管侵犯、TNM分期Ⅲ期、术前AFP≥400 μg/L及HBsAg阳性是影响HCC患者术后5年无瘤生存期的独立危险因素(P值均<0.05),术后TACE为肝癌患者术后无瘤生存的保护因素(表5)。
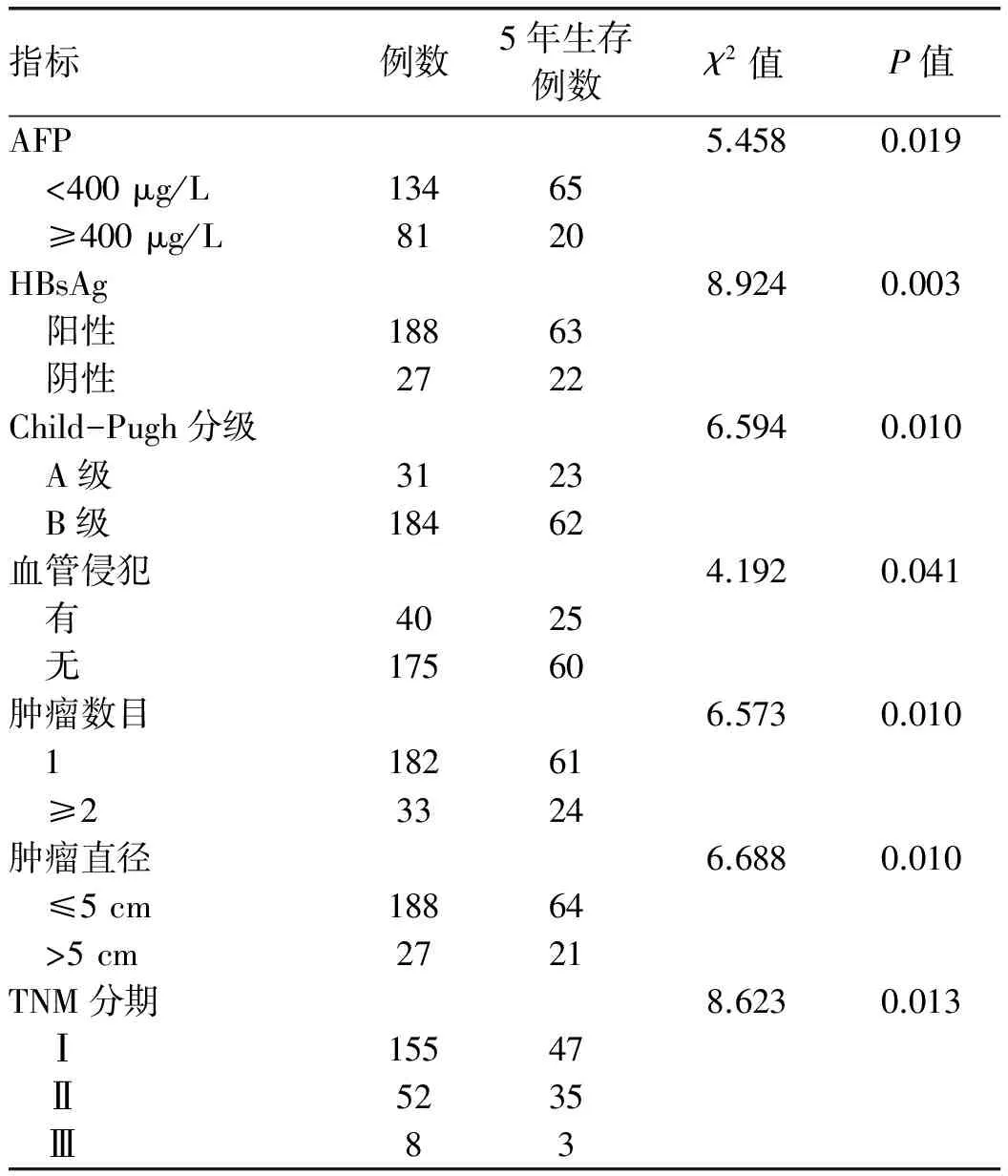
表2 影响患者5年生存期的单因素分析(例)
3 讨论
HCC起病隐匿、进展快,临床上多数患者确诊时已是中晚期,可行手术切除的仅占原发性肝癌患者的20%~30%[4]。近年来,随着手术技巧的不断提高及手术设备的更新,HCC患者的手术切除率较前有所提高,但术后5年生存率仅为30%~50%。本研究中单纯手术组患者5年生存率为36.5%,与此相符。术后复发是影响HCC患者手术疗效及远期生存的主要原因。TACE是巴塞罗那B期及以上肝癌患者的主要治疗方法,多项研究表明术后TACE可降低肝癌患者的复发率和提高生存率[5-6]。
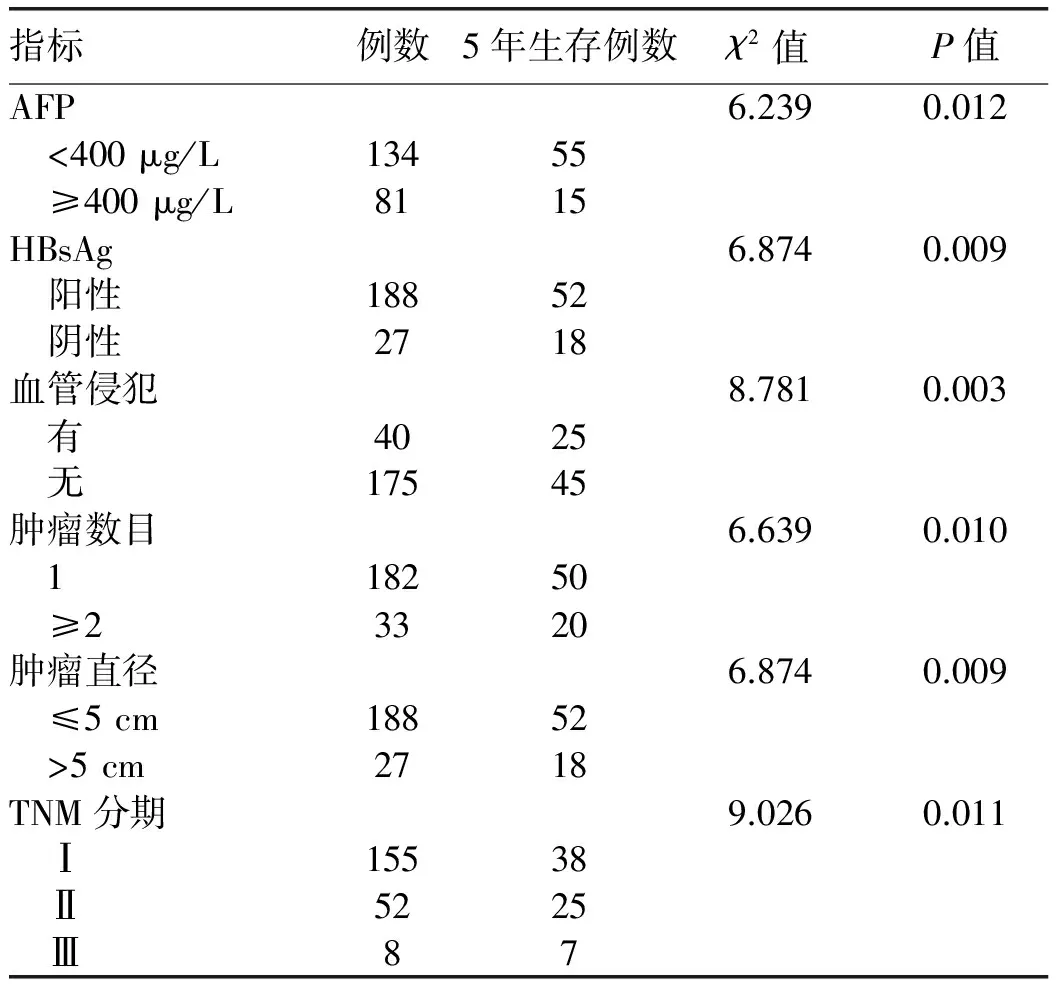
表3 影响患者5年无瘤生存期的单因素分析(例)
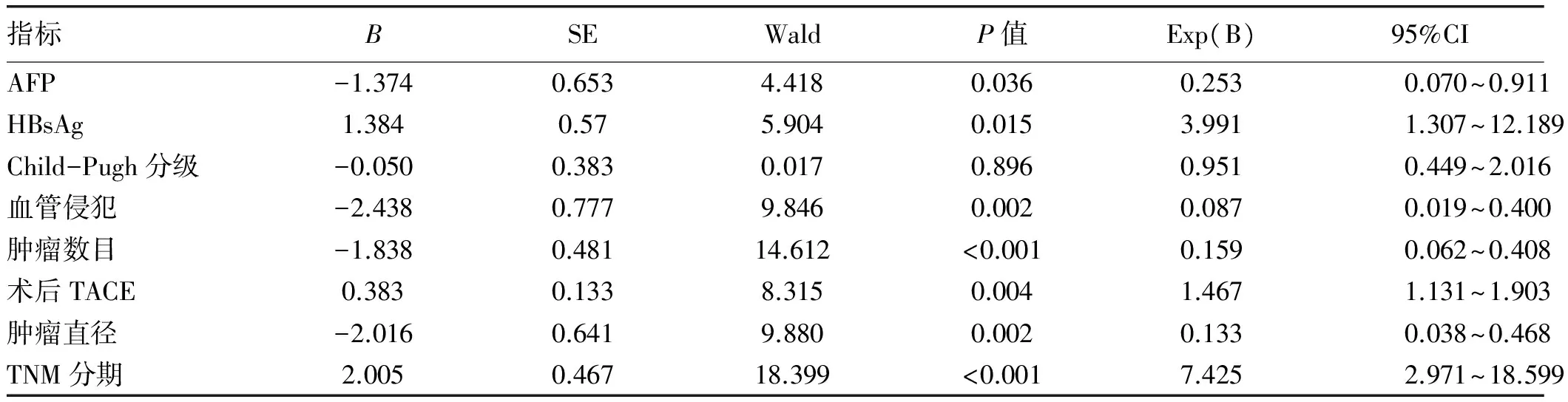
表4 影响患者5年生存期的Cox多因素分析
注:95%CI, 95%可信区间
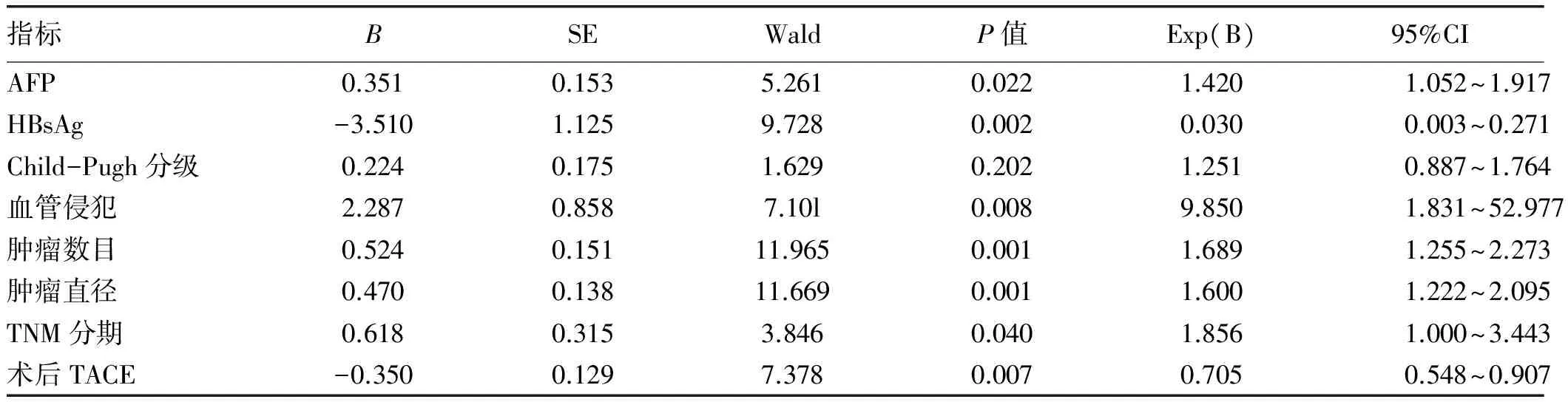
表5 影响患者无瘤生存期的Cox多因素分析
正常肝脏75%的血液供应来源于门静脉,而肝癌患者95%以上的血供来源于肝动脉的分支,TACE的基本原理正是基于肝的特殊血供[7]。行TACE时碘油高选择性地沉积于微小病灶中,将这些微小病灶的供血血管栓塞,并且作为载体将局部化疗药物运送到病灶中使肿瘤细胞坏死。目前有随机对照研究及Meta分析[8-10]表明术后辅助性TACE可通过抑制残癌降低患者的复发率及提高生存率。本研究结果表明术后联合辅助性TACE有助于延长肝癌根治术后HCC患者的生存期,较单纯手术治疗组可明显提高术后的无瘤生存率(P值均<0.05)。TACE不仅是一种治疗方法,更是一种诊断手段。本研究中行TACE治疗的同时常规配合数字血管减影同步造影,发现肝癌切除术后行TACE经肝动脉造影能够较CT、MRI等非侵入性检查更早、更及时地发现微小癌灶和残癌,有助于及时诊断和治疗,进而提高肝癌患者手术疗效及预后,与Yu等[11]研究结果一致。
目前有研究[12]认为肿瘤直径>5 cm 、肿瘤多发为影响HCC患者总生存期的独立危险因素;另有多项回顾性研究[13-15]均表明发生血管侵犯为影响肝癌切除术后预后的独立危险因素。本研究通过Cox多因素分析发现,肿瘤多发、肿瘤直径>5 cm、发生血管侵犯、TNM分期III期、HBsAg阳性、术前AFP≥400 μg/L为影响肝癌切除术后患者预后的独立危险因素,而术后TACE则为肝癌切除术后预后的保护因素,与上述研究基本一致。慢性HBV感染是HCC的首要致病因素,我国HCC患者中约有90%均存在HBV感染,预防肝癌的最有效方法是将HBV载量控制在正常范围,原发性肝癌诊疗规范也提倡肝切除术后行规范的抗病毒治疗。在本研究中,HBsAg阳性与肝癌患者术后复发和预后不良有关,对于HBsAg阳性的患者常规给予抗病毒药物治疗,发现抗病毒治疗可以降低肝癌患者术后的复发率,与目前研究[16-18]观点一致。术前AFP水平对诊断HCC及评价预后有重要意义,本研究发现术前AFP水平高是导致肝癌患者预后不良的独立危险因素,提示术前AFP水平与肿瘤复发转移密切相关,其术后下降水平为影响生存率的重要指标。
综上所述,本研究认为HCC患者行外科手术后给予积极的TACE辅助治疗,有利于控制肝癌的发展,可以降低肝癌的复发率,提高总生存率和无瘤生存率。掌握肝癌术后的预后因素对提高HCC的治疗效果具有积极意义。但本研究为回顾性研究,无法完全控制临床资料的均质性,结果难免偏倚,尚需包括更大样本的临床研究进一步论证。
[1] TATEISHI R, SHIINA S, AKAHANE M, et al. Frequency, risk factors and survival associated with an intrasubsegmental recurrence after radiofrequency ablation for hepatocellular carcinoma[J]. PLoS One, 2013, 8(4): e59040.
[2] HUANG WK, YANG SF, YOU LN, et al. Transcatheter arterial chemoembolisation (TACE) plus S-1 for the treatment of BCLC stage B hepatocellular carcinoma refractory to TACE[J]. Contemp Oncol (Pozn), 2016, 20(6): 468-474.
[3] HINRICH JB, HASDEMIR DB, NORDLOHNE M, et al. Health-related quality of life in patients with hepatocellular carcinoma treated with initial transarterial chemoembolization[J]. Cardiovasc Intertvent Radiol, 2017, 40(10): 1559-1566.
[4] SHEN YN, LU JH, YANG T. Recent advances in molecular mechanisms of hepatocellular carcinoma[J]. J Hepatobiliary Surg, 2014, 22(2): 157-160.(in Chinese)
沈艺南, 卢军华, 杨田. 肝细胞癌相关分子机制研究新进展[J]. 肝胆外科杂志, 2014, 22(2): 157-160.
[5] LIU YY, LIU XX. International controversy in partial hepatectomy for patients in stage B or C of Barcelona Clinic Liver Cancer[J]. Chin J Dig Surg, 2015, 14(8): 609-611.(in Chinese)
刘允怡, 刘晓欣. 巴塞罗那临床肝癌B期和C期患者施行部分肝切除术治疗的国际争议[J]. 中华消化外科杂志, 2015, 14(8): 609-611.
[6] LI SY, WU S, CHEN TS, et al. Effect of portal venous perfusion cinobufacini injection combined with TACE in patients with intermediate hepatocellular carcinoma[J]. Chin J Med Offic, 2017, 45(9): 884-886. (in Chinese)
李淑英, 吴申, 陈挺松, 等. 经导管肝动脉栓塞化疗联合华蟾素门静脉灌注治疗中期原发性肝癌疗效研究[J]. 临床军医杂志, 2017, 45(9): 884-886.
[7] MA M, NIU TT, SHAO L, et al. Hepatic transcatheter arterial chemoembolization combined with stereotactic radiation therapy of primary liver cancer[J]. Trauma Crit Med, 2017, 5(1): 32-35. (in Chinese)
马明, 牛婷婷, 邵亮, 等. 肝动脉化疗栓塞术联合立体定向放疗治疗较大原发性肝癌临床研究[J]. 创伤与急危重病医学, 2017, 5(1): 32-35.
[8] ZHONG C, GUO RP, LI JQ, et al. A randomized controlled trial of hepatectomy with adjuvant transcatheter arterial chemoembolization versus hepatectomy alone for Stage III A hepatocellular carcinoma[J]. J Cancer Res Clin Oncol, 2009, 135(10): 1437-1445.
[9] MATHURIN P, RAYNARD B, DHARANCY S, et al. Meta-analysis: evaluation of adjuvant therapy after curative liver resection for hepatocellular carcinoma[J]. Aliment Pharmacol Ther, 2003, 17(10): 1247-1261.
[10] SUN JJ, WANG K, ZHANG CZ, et al. Postoperative adjuvant transcatheter arterial chemoembolization after R0 hepatectomy improves outcomes of patients who have hepatocellular carcinoma with microvascular invasion[J]. Ann Surg Oncol, 2016, 23(4): 1344-1351.
[11] YU MH, KIM JH, YOON JH, et al. Small hepatocellular carcinoma: diagnostic performance and imaging features at gadoxetic acid-enhanced MR imaging[J]. Radiology, 2014, 271(3): 748-760.
[12] REN ZG, LIN ZY, XIA JL, et al. Postoperative adjuvant arterial chemoembolization improves survival of hepatocellular carcinoma patients with risk factors for residual tumor: a retrospective control study[J]. World J Gastroenterol, 2004,10(19): 2791-2794.
[13] LI C, WEN T, YAN L, et al. Liver resection versus liver resection plus TACE for patients with hepatocellular carcinoma beyond Milan criteria[J]. J Surg Res, 2017, 209: 8-16.
[14] TONG Y, LI Z, LIANG Y, et al. Postoperative adjuvant TACE for patients of hepatocellular carcinoma in AJCC stage I: friend or foe? A propensity score analysis[J]. Oncotarget, 2017, 8(16): 26671-26678.
[15] DONG ZR, ZHANG PF, WANG CH, et al. Postoperative adjuvant transcatheter arterial chemoembolization for resectable multiple hepatocellular carcinoma beyond the Milan criteria: a retrospective analysis[J]. Am J Cancer Res, 2015, 5(1): 450-457.
[16] CHEN J L, LIN X J, ZHOU Q, et al. Association of HBV DNA replication with antiviral treatment outcomes in the patients with early-stage HBV-related hepatocellular carcinoma undergoing curative resection[J]. Chin J Cancer, 2016, 35: 28.
[17] HUANG G, YANG Y, SHEN F, et al. Early viral suppression predicts good postoperative survivals in patients with hepatocellular carcinoma with a high baseline HBV-DNA load[J]. Ann Surg Oncol, 2013, 20(5): 1482-1490.
[18] HUANG G, LAU WY, WANG ZG, et al. Antiviral therapy improves postoperative survival in patients with hepatocellular carcinoma: a randomized controlled trial[J]. Ann Surg, 2015, 261(1): 56-66.
Effectofpostoperativeadjuvanttransarterialchemoembolizationonpostoperativesurvivalofpatientswithlivercancerandrelatedinfluencingfactorsforprognosis
XINGZhixiang,SHENShiqiang,QINFeng,etal.
(DepartmentofHepatobiliary&LaparoscopicSurgery,RenminHospitalofWuhanUniversity,Wuhan430060,China)
ObjectiveTo investigate the effect of postoperative adjuvant transarterial chemoembolization (TACE) on the survival of patients with hepatocellular carcinoma (HCC), as well as influencing factors for prognosis.MethodsA retrospective analysis was performed for the clinical data of 215 HCC patients who were admitted to Renmin Hospital of Wuhan University from January 2007 to December 2012. According to whether TACE was given after hepatectomy, these patients were divided into single group with 95 patients and combination group with 120 patients. A comparative analysis was performed for the two groups. The patients in the single group were given hepatectomy alone, and those in the combination group were given hepatectomy followed by TACE at one month after surgery. General status, treatment condition, and related clinical indices were recorded for both groups, and the two groups were compared in terms of the 1-, 3-, and 5-year survival rates and disease-free survival rates after surgery. The independent samplest-test was used for comparison of continuous data between groups, and the chi-square test was used for comparison of categorical data between groups. The Kaplan-Meier method was used for comparison of survival rates between groups, and univariate analysis and Cox multivariate regression analysis were used to investigate the influencing factors for prognosis after hepatectomy.ResultsIn the combination group, the 1-, 3-, and 5-year survival rates were 96.5%, 67.0%, and 51.0%, respectively, with a median survival time of 51 months; in the single group, the 1-, 3-, and 5-year survival rates were 84.0%,49.5%, and 36.5%, respectively, with a median survival time of 39 months; there was a significant difference in survival rates between the two groups (χ2=5.540,P=0.018). The 1-, 3-, and 5-year disease-free survival rates were 91.7%, 62.5%, and 37.5%, respectively, in the combination group and 84.0%, 42.1%, and 26.3%, respectively, in the single group, and there was a significant difference between the two groups (χ2=4.942,P=0.027). Preoperative alpha-fetoprotein >400 μg/L, TNM stage III, multiple tumors, tumor diameter >5 cm, positive HBsAg, and vascular invasion were independent prognostic factors in patients after hepatectomy, while TACE was a protective factor for long-term survival of these patients.ConclusionAdjuvant TACE after hepatectomy can significantly improve the survival rate and disease-free survival rate of HCC patients and has great significance in improving surgical outcome.
carcinoma, hepatocellular; chemoembolization, therapeutic; hepatectomy; prognosis; risk factors
R735.7
A
1001-5256(2017)12-2331-06
10.3969/j.issn.1001-5256.2017.12.015
2017-06-05;修回日期:2017-07-18。 作者简介:邢志祥(1990-),男 ,主要从事肝胆外科方面的研究。 通信作者:沈世强,电子信箱:swsw2218@hotmail.com。
引证本文:XING ZX, SHEN SQ, QIN F, et al. Effect of postoperative adjuvant transarterial chemoembolization on postoperative survival of patients with liver cancer and related influencing factors for prognosis[J]. J Clin Hepatol, 2017, 33(12): 2331-2336. (in Chinese)
邢志祥, 沈世强, 秦峰, 等. 肝癌切除术后辅助性经肝动脉化疗栓塞术对患者生存的影响及预后相关因素分析[J]. 临床肝胆病杂志, 2017, 33(12): 2331-2336.
(本文编辑:朱 晶)
