高脂饮食诱导非酒精性脂肪性肝病小鼠模型肝脏microRNA表达谱的变化分析
2017-12-16麦静愔陈天阳
麦静愔, 陈天阳, 成 扬
(1 上海浦东新区中医医院, 上海 201299; 2 上海中医药大学附属曙光医院, 上海 201203)
高脂饮食诱导非酒精性脂肪性肝病小鼠模型肝脏microRNA表达谱的变化分析
麦静愔1, 陈天阳2, 成 扬2
(1 上海浦东新区中医医院, 上海 201299; 2 上海中医药大学附属曙光医院, 上海 201203)
目的研究microRNA(miRNA)-384的表达对高脂饮食诱导非酒精性脂肪性肝病(NAFLD)小鼠肝脂肪变性的影响。方法将30只雄性C57BL/6J小鼠适应性喂养7 d,然后随机分成2组,每组15只。对照组中的15只小鼠给予普通饮食,模型组15只小鼠给予HFD,喂养8周后获取肝组织。进行HE和尼罗红染色观察肝组织病理改变。采用微阵序列测序肝组织的全基因组miRNA表达谱,PCR法测定miRNA-384的相对表达水平。计量资料2组间比较采用t检验。结果对照组小鼠肝脏呈红色,边缘锐利,肝小叶结构清晰,肝细胞无脂肪变性;模型组小鼠肝脏呈黄色,边缘变钝,肝细胞明显肿胀,细胞质内可见大量脂肪空泡,脂滴相互融合导致细胞核偏位。与正常小鼠相比,在NAFLD小鼠的肝组织中发现了12个上调和18个下调的miRNA。筛查了对照组和模型组间的一些差异表达的miRNA,获得同样的聚类分析图。在这8个明显改变的miRNA中,miRNA-384具有显著的倍数变化。结论miRNA-384表达的上调与肝脏脂肪变性有着密切关系,但是其作用机制仍需进一步研究。
非酒精性脂肪性肝病; 微RNAs; 基因表达; 高脂饮食; 小鼠, 近交C57BL
非酒精性脂肪性肝病(NAFLD)是指除外酒精和其他明确的肝损伤因素所致的,以弥漫性大细胞性脂肪变和肝细胞内脂肪过度沉积为主要特征的临床病理综合征[1]。流行病学调查显示,NAFLD在世界范围内患病率为2%~4%,与人们的学习、工作压力、不良的饮食及生活习惯有关,随着肥胖及相关代谢紊乱发病逐渐低龄化,并且发病率呈逐渐上升的趋势[2-3],已经严重威胁到人类的健康。由于其发病原因及机制比较复杂,目前对于具体的发病机制仍然不太明确。
microRNA(miRNA)是一类长约18~25个核苷酸序列的内源性非编码单链小分子RNA,研究[4-5]表明其调控人类超过1/3的基因,参与细胞的分化、生长、代谢、增殖、凋亡和病毒感染、肿瘤生成等方面。并且其表达谱分析研究已经确定了组织表达的miRNA可以在人肝脏疾病和多种疾病中进行差异调控,并影响肝脏的病理生理环境[6]。然而,miRNA在高脂肪饮食(high fat diet,HFD)诱导的NAFLD过程中脂肪变性的发生和机制尚不明确。本研究试图观察HFD喂养小鼠肝组织中miRNA谱的变化,初步探讨其在脂肪肝发病机制中的作用。
1 材料与方法
1.1 实验动物 雄性C57BL/6J小鼠(体质量20~25 g)购自上海斯莱克实验动物有限公司,饲养于上海中医药大学实验动物中心。
1.2 试剂与仪器 Trizol试剂(购自加拿大Invitrogen公司)、SYBR Green PCR Master Mix(购自美国Invitrogen公司)、TruSeq polyA(购自美国Illumina公司)、2100 Bioanalyzer(购自加拿大Agilent技术公司)、HiSeq 2000系统(购自美国Illumina公司)、光学显微镜(购自日本Olympus公司)、qPCR仪(购自美国Eppendorf公司)。
1.3 造模与给药 30只雄性C57BL/6J小鼠适应性喂养7 d,然后随机分成2组,每组15只。对照组小鼠给予普通饮食:面粉25%,玉米面30%,麸皮15%,鱼粉8%,骨粉3%,奶粉2%,豆粕11%,食盐0.5%,鱼肝油0.5%,鸡蛋4%,维生素及无机盐1%[7]。模型组小鼠给予HFD:79.5%玉米粉、0.5%胆固醇和20%猪油。喂养8周后收集肝组织。
1.4 标本的采集与检测
1.4.1 体质量与生活状态 每日观察小鼠体质量及生活状态的变化。
1.4.2 肝组织病理观察 实验结束处死动物后,将小鼠的肝脏切除。先观察肝脏大体标本的大小、色泽、质地、切面等情况;再将肝组织用10%的甲醛溶液固定,固定组织常规处理,石蜡包埋,切成4 μm切片,根据标准流程进行脱蜡和水化。所有的组织切片进行HE和尼罗红染色,光镜下观察肝脂肪变性情况。
1.4.3 miRNA表达谱的测定 使用Trizol试剂分离肝组织的总RNA,并根据说明书用DNase处理以除去潜在的基因组DNA污染物。用2100 Bioanalyzer分析RNA的质量。使用Illumina TruSeq polyA +样品制备试剂盒制备RNA-seq的文库。单次读取测序(×100)在Illumina HiSeq 2000系统上进行。测序读数的绘制由MapSplice2进行,并通过RSEM定量基因表达。与对照组相比,NAFLD小鼠肝脏中的差异表达基因通过单尾、未配对的Student′s-t检验进行鉴定。当P≤0.05时,如果它们的倍数变化≥2(或倍数变化≤0.5),则基因被认为显著上调或下调。
1.4.4 定量RT-PCR 在PCR反应管中加入如下反应混合物:10 μl 2×SYBR Green PCR Master Mix,特异性引物2 μl(miRNA-384,上游引物:5′-TATGGTTGTTCTGCTCTCTGTGTC-3′,下游引物:5′-CTCACTCACATCAACAGACATTAATT-3′; U6内参,上游引物:5′-GGAACGCTTCACGAATTTG-3′,下游引物:5′-ATTGGAACGATACAGAGAAGATT-3′)和cDNA模板1.45 μl,加入ddH2O补充体积至20 μl。反应条件为:95 ℃ 10 min,随后40次循环,每次循环95 ℃变性15 s,60 ℃退火1 min和72 ℃延伸1 min。相对表达水平用2-ΔΔCt法测定。

2 结果
2.1 小鼠的生活状态 经过8周喂养,2组小鼠均无死亡记录。整个过程中对照组小鼠生活状态正常;而模型组小鼠在后期逐渐出现反应迟钝,体型增大,活动减少。
2.2 肝脏组织病理结果 对照组小鼠肝脏呈红色,边缘锐利,肝小叶结构清晰,肝细胞无脂肪变性;模型组小鼠肝脏呈黄色,边缘变钝,肝细胞明显肿胀,细胞质内可见大量脂肪空泡,脂滴相互融合导致细胞核偏位(图1)。
2.3 在NAFLD小鼠肝组织中的miRNA表达谱和qPCR验证 在HFD喂养后8周分析对照组和模型组肝组织的全基因组miRNA表达谱。标准化后,与对照组小鼠相比,在模型组小鼠的肝组织中发现了12个上调和18个下调的miRNA。筛查了对照组和模型组间的一些差异表达的miRNA,获得同样的聚类分析图(图2)。在这8个明显改变的miRNA中,miRNA-384具有显著的倍数变化(图3)。
3 讨论
NAFLD的发病原因与遗传、环境、代谢等因素有着密切的关系,其病理类型主要包括单纯性脂肪肝、脂肪性肝炎、肝纤维化和肝硬化,后者可进展为肝癌[8]。随着发病率上升,并且发病逐渐低龄化,现成为最常见的慢性肝病,影响着人类的健康。其发病机制多数学者普遍认同“二次打击”学说[9],即脂类在肝脏细胞的细胞质内的聚集引发了一系列细胞毒素的释放,导致了肝脏的炎症反应。首次打击主要是指脂肪在肝脏实质细胞内的过度聚集。这一过程已经被证实与胰岛素抵抗有关,胰岛素抵抗会导致细胞内甘油三酯的合成与转运功能紊乱。第二次打击为氧化应激反应,是在首次打击的基础上,由活性氧诱导的发生在肝脏实质细胞内的炎症反应[10-11]。虽然该学说被广泛接受,但是其具体的发病机制仍然不明确,所以非常有必要继续对NAFLD 的发病机制进行深入的研究。

图1 小鼠肝脏病理学变化 a、b分别为正常组、模型组,HE

图2 miRNA芯片筛选小鼠肝脏miRNA差异表达的热图
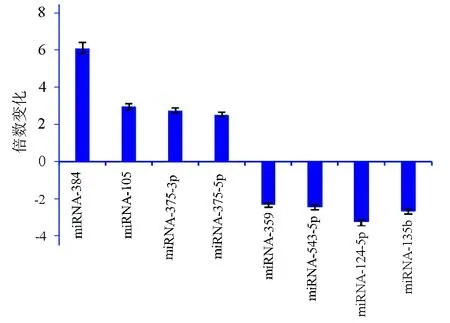
图3 miRNA-384在具有倍数变化的miRNA热图中的表达量
近几年来,miRNA作为科学研究的重要工具,为疾病的诊治提供了全新的手段[12]。同时miRNA在许多肝脏疾病中可以出现特异性改变,反映肝脏组织的病理改变,也可作为肝癌诊断的生物标志物[13-15]。在脂类代谢中,miRNA作用于脂类合成、分解及转运相关的靶基因,调控体内脂类代谢[16]。不仅如此,miRNA数量或功能异常还通过干扰胰岛素信号转导,诱导胰岛素抵抗的发生,从而影响机体正常脂质代谢, 促进脂肪性肝病的形成[17]。
肝脏是动物体内重要的代谢器官,在生长发育过程中,肝细胞中的miRNA表达变化能够在一定程度上影响肝脏的代谢功能[18]。为了研究miRNA-384与NAFLD肝脂肪变性的关系,本课题组通过HFD构建小鼠的NAFLD疾病模型,在造模成功后,观察小鼠肝组织学变化。并且由微阵序列测序分析30种miRNA在NAFLD小鼠肝组织中的显著变化。在这8个改变的miRNA中,miRNA-384具有显著的倍数变化。同时,在小鼠给予HFD过程中,通过qPCR测量小鼠肝脏miRNA-384的表达水平,观察到miRNA-384表达随着时间推移而显著上调。说明miRNA-384在NAFLD中表达上调可导致肝脂肪变性。同时有相关研究[19-20]表明,miRNA的异常表达可能是通过参与调控脂质的合成、脂质细胞分化的调节以及改变肝星状细胞相关的信号转导通路而促进脂肪肝、肝纤维化的形成,但是具体的调控机制仍然不明确。
综上所述,本研究表明miRNA-384表达的上调与肝脂肪变性有着密切关系,但是其作用机制仍需进一步研究加以证实。
[1] CHENG Y, HOU T, PING J, et al. Quantitative succinylome analysis in the liver of non-alcoholic fatty liver disease rat model[J]. Proteome Science, 2016, 14(1): 1-11.
[2] CHENG Y, GONG YH, ZHANG YH, et al. Effect of Jianpi Liqi Huatian Recipe Granule on FFA, HOMA-IR and APRI in patients with spleen deficiency and hypertrophic nonalcoholic steatohepatitis [J]. Chin J Exp Med Formul, 2017, 23(17): 200-204. (in Chinese)
成扬, 龚亚华, 张银华, 等. 健脾理气化湿方配方颗粒治疗脾虚湿热型非酒精性脂肪性肝炎患者疗效及对FFA, HOMA-IR, APRI的影响[J]. 中国实验方剂学杂志, 2017, 23(17): 200-204.
[3] HU ZJ, ZHANG J. China′s non-alcoholic fatty liver disease research status[J]. J Clin Hepatol, 2016, 32(3): 552-556. (in Chinese)
胡中杰, 张晶. 我国非酒精性脂肪性肝病的研究现状[J]. 临床肝胆病杂志, 2016, 32(3): 552-556.
[4] AMBROS V. The functions of animal microRNAs[J]. Nature, 2004, 431(7006): 350-355.
[5] CHEN W, CHEN HH. MicroRNAs and liver diseases[J]. J Commun Med, 2012, 10(24): 40-42. (in Chinese)
陈汶, 陈宏辉. microRNAs与肝脏疾病[J]. 社区医学杂志, 2012, 10(24): 40-42.
[6] TAKAHASHI K, YAN I, WEN HJ, et al. microRNAs in liver disease: from diagnostics to therapeutics[J]. Clin Biochem, 2013, 46(10): 946-952.
[7] PAN L, ZHANG JB, CUI RG, et al. Establishment of nonalcoholic fatty liver C57BL / 6 mouse model [J]. Chin J Tissue Engineer Res, 2016, 20(40): 6054-6059. (in Chinese)
潘磊, 张金彪, 崔荣岗, 等. 非酒精性脂肪肝C57BL/6小鼠模型的建立[J]. 中国组织工程研究, 2016, 20(40): 6054-6059.
[8] ALY FZ, KLEINER D. Update on fatty liver disease and steatohepatitis[J]. Adv Anat Pathol, 2011, 18(4): 294-300.
[9] DAY CP, JAMES OF. Steatohepatitis: a tale of two "hits"?[J]. Gastroenterology, 1998, 114(4): 842-845.
[10] CHEN ZW, CHEN LY, DAI HL, et al. Relationship between alanine aminotransferase levels and metabolic syndrome in nonalcoholic fatty liver disease[J]. J Zhejiang Univ Sci B, 2008, 9(8): 616-622.
[11] XIN SL, XU KS. Non-alcoholic fatty liver disease pathogenesis new understanding[J]. J Clin Hepatol, 2017, 33(8): 1581-1583. (in Chinese)
辛晟梁, 徐可树. 非酒精性脂肪性肝病发病机制新认识[J]. 临床肝胆病杂志, 2017, 33(8): 1581-1583.
[12] LIANG X. The relationship between microRNA-122 and the pathogenesis of fatty liver disease[D]. Guangzhou: Guangzhou Med Coll, 2012. (in Chinese)
梁霞. 微小RNA-122与脂肪性肝病发病关系的实验研究[D]. 广州: 广州医学院, 2012.
[13] ZHANG Y, JIANG Y, QI FX. miRNA in chronic liver disease and its clinical significance [J]. World Chin J Dig, 2014, 22(28): 4257-4262. (in Chinese)
张颖, 江勇, 齐凤祥. miRNA在慢性肝病中的变化及其临床意义[J]. 世界华人消化杂志, 2014, 22(28): 4257-4262.
[14] LI ZW, WU T, FU YX, et al. Expression and roles of MicroRNA-31 in HCC[J]. Chin J Clin Pharmacol Ther, 2015, 20(10): 1098-1101. (in Chinese)
李中文, 吴涛, 付应霄, 等. MicroRNA-31在肝癌中的表达和作用[J]. 中国临床药理学与治疗学, 2015, 20(10): 1098-1101.
[15] FENG M, E CY, LI H, et al. Expression of miR-196a in liver cancer cells and its promotion effect on proliferation[J]. J Jilin Univ: Med Edit, 2015, 41(1), 120-124. (in Chinese)
冯默, 鄂长勇, 李航, 等. miR-196a在肝癌细胞中的表达及其促增殖作用[J]. 吉林大学学报: 医学版, 2015, 41(1): 120-124.
[16] LI M, XIE HQ, XIONG W, et al. The role of MicroRNA in regulation of substance metabolism [J]. J Central South Uni Med Edit, 2013, 38(3): 318-322. (in Chinese)
李明, 谢慧清, 熊武, 等. MicroRNA在调控物质代谢方面的作用[J]. 中南大学学报医学版, 2013, 38(3): 318-322.
[17] WANG YD, ZHAO CY. MicroRNA in liver disease research and application[J]. Basic Clin Med, 2009, 29(2): 216-219. (in Chinese)
王亚东, 赵彩彦. MicroRNA在肝病中的研究与应用[J]. 基础医学与临床, 2009, 29(2): 216-219.
[18] LI S, XU YN, NIU X, et al. MiRNAs were used to screen differentially expressed miRNAs in the liver of different age pigs [J]. China Anim Husb Veter Med, 2017, 44(3): 673-678. (in Chinese)
李升, 许亚楠, 牛熙, 等. 利用miRNA芯片筛选不同月龄香猪肝脏中差异表达的miRNA[J]. 中国畜牧兽医, 2017, 44(3): 673-678.
[19] MA YH, XING HC. MicroRNA in liver fibrosis research progress [J/CD]. Chin J Liver Dis: Electronic Edition, 2017, 9(2): 1-4. (in Chinese)
马艳华, 邢卉春. microRNA在肝纤维化中的研究进展[J/CD]. 中国肝脏病杂志: 电子版, 2017, 9(2): 1-4.
[20] LI ZH. miRNA on molecular control of nonalcoholic fatty liver disease[D]. Beijing: Beijing Univ Chem Technol, 2016. (in Chinese)
李泽浩. miRNA对非酒精性脂肪肝病变的分子调控作用[D]. 北京: 北京化工大学, 2016.
ChangesinmicroRNAexpressionprofileintheliverofmicewithnonalcoholicfattyliverdiseaseinducedbyhigh-fatdiet
MAIJingyin,CHENTianyang,CHENGYang.
(PudongNewAreaHospitalofTraditionalChineseMedicine,Shanghai201299,China)
ObjectiveTo investigate the effect of miRNA-384 (miR-384) expression on hepatic steatosis in mice with nonalcoholic fatty liver disease (NAFLD) induced by high-fat diet (HFD).MethodsA total of 30 male C57BL/6J mice were fed for 7 days to adapt to the environment and then randomly divided into 2 groups, with 15 mice in each group. The mice in the control group were given normal diet, and those in the model group were given HFD for 8 weeks and then the liver tissue was harvested. HE and Nile red staining were used to observe the pathological changes of the liver. Microarray sequencing was performed to determine the whole-genome miRNA expression profile of liver tissue, and PCR was used to measure the relative expression of miR-384. Thet-test was used for the comparison of continuous data between groups.ResultsIn the control group, the liver was red with sharp edges, the lobular structure was clear, and there was no hepatic steatosis; in the model group, the liver was yellow with blunt edges, and the hepatocytes were swollen with a large number of fat vacuoles in the cytoplasm and nuclear deviation caused by the fusion of lipid droplets. Compared with the normal mice, the NAFLD mice had 12 upregulated miRNAs and 18 downregulated miRNAs in liver tissue. Some of the differentially expressed miRNAs between the control group and the model group were screened to obtain the same cluster diagram. Among the 8 miRNAs with significant changes, miR-384 showed a significant fold change.ConclusionThe upregulation of miR-384 is closely associated with hepatic steatosis, but its mechanism still needs further study.
nonalcoholic fatty liver disease; microRNAs; gene expression; high fat diet; mice, inbred C578BL
R575.5
A
1001-5256(2017)12-2372-04
10.3969/j.issn.1001-5256.2017.12.023
2017-08-18;修回日期:2017-09-26。 基金项目:上海浦东新区卫生系统学科带头人培养计划(PWRd2016-01);上海市卫生和计划生育委员会项目(201540181) 作者简介:麦静愔(1979-),女,副主任医师,博士,从事中西医结合临床和基础研究。
引证本文:MAI JY, CHEN TY, CHENG Y. Changes in microRNA expression profile in the liver of mice with nonalcoholic fatty liver disease induced by high-fat diet[J]. J Clin Hepatol, 2017, 33(12): 2372-2375. (in Chinese)
麦静愔, 陈天阳, 成扬. 高脂饮食诱导非酒精性脂肪性肝病小鼠模型肝脏microRNA表达谱的变化分析[J]. 临床肝胆病杂志, 2017, 33(12): 2372-2375.
(本文编辑:王 莹)
