核因子-κB p65在肝细胞癌中的表达及意义
2017-12-16杨晋辉唐映梅石梦琳张峻崎
夏 庚, 祁 飞, 杨晋辉, 唐映梅, 石梦琳, 张峻崎
(昆明医科大学第二附属医院 消化内科二病区, 昆明 650500 )
核因子-κB p65在肝细胞癌中的表达及意义
夏 庚, 祁 飞, 杨晋辉, 唐映梅, 石梦琳, 张峻崎
(昆明医科大学第二附属医院 消化内科二病区, 昆明 650500 )
目的利用肝癌组织芯片观察核因子-κB(NF-κB) p65在癌组织及癌旁组织中的表达,探讨其对肝癌发生、发展的意义。方法肝癌组织芯片(HLivH180Su05)包括81例癌组织和81例癌旁组织,手术时间为2006年5月-2007年5月,随访截止时间为2012年2月,其中复发46例,无复发35例;参考美国癌症联合会胆囊癌TNM分期(第7版)分为:Ⅰ期56例,Ⅱ期25例;有癌栓28例,无癌栓53例。利用免疫组化法检测NF-κB P65蛋白的表达及相关性。依据所检测蛋白在细胞内的定位,分别以检测蛋白表达部位的阳性信号强度和阳性表达细胞数2种观察标准进行综合评分。计数资料组间比较采用χ2检验,采用Kaplan-Meier法进行生存分析,采用log-rank时序检验比较生存率。结果NF-κB p65蛋白在癌组织及癌旁组织表达定位于细胞质及部分细胞核,在癌组织及癌旁组织阳性率分别为90.12%、69.14%,差异有统计学意义(χ2=10.998,P=0.001);癌组织中NF-κB p65蛋白表达与临床分期、癌栓、有无复发无明显相关性(P值均>0.05)。结论NF-κB p65在肝癌组织中的表达高于癌旁组织,调控NF-κB功能的关键在于抑制RelA(p65)对肝肿瘤的促进作用。由此推测,阻断NF-κB p65活性能够发挥抑制肿瘤细胞分化、生长的作用,为临床治疗提供了新的思路。
癌, 肝细胞; NF-κB; 转录因子RelA
肝细胞癌(HCC)是全球第五大常见恶性肿瘤疾病,也是癌症死亡率的第二大原因。2008年,我国HCC发病率男性为37.4/10万人,女性为13.7/10万人[1],其中以41~60岁人群的发病率最高[2]。大多数HCC患者在确诊后的3~6个月内死亡,因此早期发现、早期治疗对控制HCC病死率尤为重要。1986年核因子-κB(NF-κB)被首次发现,其能够与活化B淋巴细胞的免疫球蛋白κ轻链增强子元件结合[3]。异常激活的NF-κB与癌细胞发生、发展相关,可作为癌症的标志物。NF-κB可通过以下方式促进癌细胞的发生、发展:诱导抗凋亡基因的表达,促进癌细胞的存活能力;诱导细胞周期蛋白和原癌基因的表达诱导细胞增殖;调节基质金属蛋白酶和细胞黏附基因的表达促进转移;调节与癌组织新血管生长相关的基因刺激血管生成。本实验通过在肝癌组织芯片上检测NF-κB p65的表达,探讨其与HCC患者癌栓、分期及复发的关系,为HCC的早期诊断和治疗提供新的思路。
1 材料与方法
1.1 实验材料 肝癌组织芯片(HLivH180Su05)购自上海芯超生物科技有限公司,共162芯,包括81例癌组织及81例癌旁组织;手术时间为2006年5月-2007年5月;随访截止时间为2012年2月,复发46例,无复发35例;参考美国癌症联合会胆囊癌TNM分期(第7版)[4]分为:Ⅰ期56例,Ⅱ期25例;有癌栓28例,无癌栓53例。抗NF-κB p65多克隆抗体购自Abcam公司。山羊抗兔二抗及DAB显色试剂盒购自福州迈新生物技术有限公司。
1.2 免疫组化 组织芯片脱蜡至水,PBS洗3次;3% H2O2滴加在切片上,室温静置,PBS洗3次;抗原修复,0.01 mol/L柠檬酸缓冲液95 ℃,自然冷却至室温,PBS洗3次;滴加正常山羊血清封闭液,甩去多余血清;滴加兔抗人NF-κB p65多克隆抗体,4 ℃过夜;37 ℃复温,PBS洗3次;滴加山羊抗兔二抗,PBS洗3次;DAB显色,在显微镜下掌握染色程度,自来水冲洗;苏木精复染,1%盐酸分化,逐级乙醇脱水,二甲苯透明,中性树脂封片。对照用NF-κB p65抗体稀释液,结果应为阴性。
1.3 判定标准 依据所检测蛋白在细胞内的定位,分别以检测蛋白表达部位的阳性信号强度和阳性表达细胞数2种观察标准进行综合评分。阳性表达结果判定标准:(1)根据阳性染色强度判断,细胞无染色记0分;细胞呈浅棕色,弱阳性,记1分;细胞染成棕色,并无背景染色,或细胞呈深棕色、有浅棕色背景,为中等阳性,记2分;细胞呈深棕色,无背景着色,为强阳性,记3分。(2)根据阳性细胞表达数计分,阳性表达细胞<5%,计0分;阳性表达细胞≤25%,计1分;25%<阳性细胞数≤50%,计2分;阳性表达细胞数50%以上,为强阳性,计3分。最终计分结果分别按上述2种判断标准得分乘积。最终判定评分:0分为阴性表达;1、2、3、4、6、9分为阳性表达;按照表达强度:0、1、2、3分为低表达组,4、6、9分为高表达组。
1.4 统计学方法 采用SPSS17.0统计学软件进行数据分析。计数资料组间比较采用χ2检验,采用Kaplan-Meier法进行生存分析,采用log-rank时序检验比较生存率。P<0.05为差异有统计学意义。
2 结果
NF-κB p65蛋白棕黄色阳性表达定位于肝癌组织、癌旁组织中的胞质及部分胞核(图1,2)。肝癌组织中NF-κB p65蛋白表达阳性率高于癌旁组织,差异有统计学意义(P<0.05)(表1);肝癌组织NF-κB p65蛋白阳性表达高于癌旁组织62例,占76.54%;肝癌组织与癌旁组织NF-κB p65蛋白阳性表达一致12例,占14.81%;肝癌组织NF-κB p65蛋白阳性表达较癌旁组织下调7例,占8.64%;肝癌组织Ⅰ期和Ⅱ期NF-κB p65高阳性表达率分别为71.43%(40/56)、84.00%(21/25),NF-κB p65蛋白高阳性表达与肝癌分期无关(χ2=1.469,P=0.226);肝癌组织有癌栓及无癌栓NF-κB p65高阳性表达率分别为67.86%(19/28)、79.25%(42/53),NF-κB p65蛋白阳性表达与是否有癌栓无关(χ2=1.278,P=0.258)。

图1 肝癌组织NF-κB p65蛋白阳性(苏木精伊红染色, ×20)
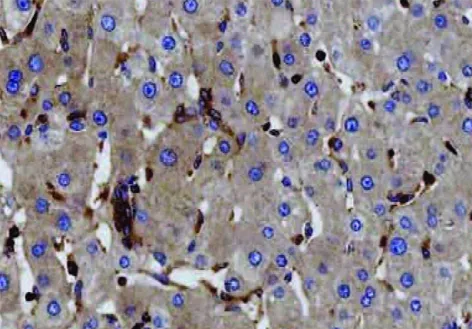
图2 癌旁组织NF-κB p65蛋白阳性(苏木精伊红染色, ×20)

组别例数NF-κBp65蛋白阳性表达(例)阳性率(%)χ2值P值肝癌组织817390.12 10.998 0.001癌旁组织815669.14
本研究失访1例,归入未复发病例。肝癌组织NF-κB p65蛋白高表达与低表达分别为61、20例,其中未复发例数分别为23、12例。肝癌组织中NF-κB p65蛋白高表达与低表达无瘤生存曲线见图3,肝癌组织中NF-κB p65蛋白高表达无瘤生存曲线总体位于NF-κB P65蛋白低表达无瘤生存曲线下方,但二者差异无统计学意义(P=0.123)。

图3 肝癌组织中不同NF-κB p65蛋白表达无瘤生存曲线
3 讨论
NF-κB是一种核蛋白因子,包括5个亚基因,分别为NF-κB1(p50/p105)、NF-κB2(p52/p100)、RelA(p65)、c-Rel和RelB。NF-κB广泛存在于身体的多种细胞中,其参与多个生理、病理的基因调控过程,如炎症反应、免疫应答、细胞分裂、增殖及凋亡过程[5]。NF-κB是介导炎症和肿瘤发生的主要内在途径。研究[6-7]显示NF-κB与淋巴结转移呈正相关,与分化程度呈负相关。另有研究[8]显示NF-κB在HCC组织中的表达水平是肿瘤分化程度和患者生存率的良好预测因子,NF-κB低表达的肿瘤患者比高表达者的存活时间更长。但NF-κB与性别、年龄、肿瘤直径、肝硬化背景、Child-Pugh肝功能分级无明显相关性[9]。NF-κB参与HCC发生、发展的机制尚不清楚。有研究[10]表明NF-κB信号通过控制上皮向间质转化,有助于癌症的进展。有学者[11]提出胆固醇能够进一步激活NF-κB信号通路,促进NF-κB靶基因的表达,NF-κB途径能够提升细胞内胆固醇浓度,显著增加HCC细胞对低密度脂蛋白的摄取。另外,NF-κB信号通路对AngⅡ诱导的HCC细胞增殖和炎症是必不可少的[12],在HCC的发展过程中通过NF-κB的信号转导抑制细胞凋亡。
本实验研究结果显示NF-κB p65蛋白高表达组与临床分期、癌栓及有无复发无明显关系,原因可能与标本的选择及免疫组化的判断方法有关,有待进一步探讨。但NF-κB p65蛋白在癌组织表达高于癌旁组织。在NF-κB的亚基中,p65的磷酸化是调节NF-κB活性的重要机制。Cao等[13]利用迷迭香酸通过调节与炎症和血管生成相关的细胞因子分泌以及抑制异种移植微环境中NF-κB p65的表达能有效抑制肿瘤生长、减少毒性作用。Li等[14]利用小檗碱通过NF-κB p65途径促进凋亡抑制HepG2细胞的生长,实验数据显示NF-κB p65水平以剂量依赖性方式显著低于对照组。另外,当用Pin1抑制剂处理HCC细胞时,磷酸化NF-κB p65表达和NF-κB活化减少,细胞增殖受到抑制[15]。有研究[16]表明NF-κB p65在肝癌组织中的表达高于癌旁组织,调控NF-κB功能的关键在于抑制RelA(p65)对肝肿瘤的促进作用。由此推测,阻断NF-κB p65活性能够发挥抑制肿瘤细胞分化、生长的作用,为临床治疗提供了新的思路。
[1] FERLAY J, SHIN HR, BRAY F, et al. Estimates of worldwide burden of cancer in 2008: GLOBOCAN2008[J]. Int J Cancer, 2010, 127(12): 2893-2917.
[2] ZHAO RR, DENG YD, YUAN H. Epidemiological and clinical features of primary liver cancer: an analysis of 236 patients[J]. J Clin Hepatol, 2016, 32(8): 1538-1542. (in Chinese)
赵荣荣, 邓永东, 袁宏. 236例原发性肝癌患者流行病学及临床特点分析[J]. 临床肝胆病杂志, 2016, 32(8): 1538-1542.
[3] SEN R, BALTIMORE D. Multiple nuclear factors interact with the immunoglobulin enhancer sequences[J]. Cell, 1986, 46(5): 705-716.
[4] EDGE SB, BYRD DR, COMPTON CC, et al. AJCC cancer staging manual[M]. 7th ed. New York: Springer, 2009: 211-217.
[5] YANG XD, YANG GP, HUANG J, et al. Regulatory mechanisms of NF-κB on cytochrome P450 enzymes[J]. Chin J Clin Pharmacol Ther, 2015, 11(20), 1302-1307. (in Chinese)
阳喜定, 阳国平, 黄洁, 等. NF-κB对细胞色素P450调控作用机制研究进展[J]. 中国临床药理学与治疗学, 2015, 20(11): 1302-1307.
[6] SUN DN, HUANG X. Roles and mechanism of NF-κB in hepatocellular carcinoma development[J]. Chin Med Herald, 2016, 13(18): 42-45. (in Chinese)
孙丹妮, 黄洵. NF-κB在肝细胞癌发生发展中的作用及其机制研究进展[J]. 中国医药导报, 2016, 13(18): 42-45.
[7] HAN HB, LIANG NZ, ZHOU YP, et al. Expression and clinical significanceof NF-κB and COX-2 in colorectal cancer[J]. J Clin Exp Med, 2015, 14(16): 1342-1344. (in Chinese)
韩宏斌, 梁宁震, 周怡萍, 等. NF-κB、COX-2在结直肠癌组织中的表达及其临床意义[J]. 临床和实验医学杂志, 2015, 14(16): 1342-1344.
[8] ZHANG M, DONG X, ZHANG D, et al. High expression of snail and NF-κB predicts poor survival in Chinese hepatocellular carcinoma patients[J]. Oncotarget, 2017, 8(3): 4543-4548.
[9] WU LQ, GE HP, WU JB. The expression of NF-κB protein in hepatocellular carcinoma[J]. Clin Med J China, 2007, 14(1): 17-18. (in Chinese)
邬林泉, 戈华平, 吴金宝. NF-κB在肝细胞肝癌组织中的表达及其意义[J]. 中国临床医学杂志, 2007, 14(1): 17-18.
[10] HUBER MA, AZOITEI N, BAUMANN B, et al. NF-κB is essential for epithelial-mesenchymal transition and metastasis in a model of breast cancer progression[J]. J Clin Investig, 2004, 114(4): 569-581.
[11] HE M, ZHANG W, DONG Y, et al. Pro-inflammation NF-κB signaling triggers a positive feedback via enhancing cholesterol accumulation in liver cancer cells[J]. J Exp Clin Cancer Res, 2017, 36(15): 1-13.
[12] JI Y, WANG Z, LI Z, et al. Angiotensin II enhances proliferation and inflammation through AT1/PKC/NF-κB signaling pathway in hepatocellular carcinoma cells[J]. Cell Physiol Biochem, 2016, 39(1): 13-32.
[13] CAO W, HU C, WU L, et al. Rosmarinic acid inhibits inflammation and angiogenesis of hepatocellular carcinoma by suppression of NF-κB signaling in H22 tumor-bearing mice[J]. J Pharmacol Sci, 2016, 132(2): 131-137.
[14] LI M, ZHANG M, ZHANG ZL, et al. Induction of apoptosis by berberine in hepatocellular carcinoma HepG2 cells via downregulation of NF-κB[J]. Oncol Res, 2017, 25(2): 233-239.
[15] SHINODA K, KUBOKI S, SHIMIZU H, et al. Pin1 facilitates NF-κB activation and promotes tumour progression in human hepatocellular carcinoma[J]. Br J Cancer, 2015, 113(9): 1323-1331.
[16] MOLES A, BUTTERWORTH JA, SANCHEZ A, et al. A RelA(p65) Thr505 phospho-site mutation reveals an important mechanism regulating NF-κB-dependent liver regeneration and cancer[J]. Oncogene, 2016, 35(35): 4623-4632.
Expressionofnuclearfactor-kappaBp65inhepatocellularcarcinomaanditssignificance
XIAGeng,QIFei,YANGJinhui,etal.
(SecondDiseaseArea,DepartmentofGastroenterology,TheSecondAffiliatedHospitalofKunmingMedicalUniversity,Kunming650500,China)
ObjectiveTo investigate the expression of nuclear factor-kappa B (NF-κB) p65 in cancer tissue and adjacent tissue using hepatoma tissue microarray, as well as its significance in the development and progression of hepatocellular carcinoma (HCC).MethodsThe hepatoma tissue microarray HLivH180Su05 was used to analyze 81 cancer tissue samples and 81 adjacent tissue samples. Surgery was performed from May 2006 to May 2007, and the patients were followed up to February 2012. Of all patients, 46 experienced recurrence and 35 did not experience recurrence. According to the TNM staging of gallbladder carcinoma developed by the American Joint Committee on Cancer, 56 had stage I tumor and 25 had stage II tumor; 28 had tumor thrombus and 53 had no tumor thrombus. Immunohistochemistry was used to measure the expression of NF-κB p65, and its association with other factors was analyzed. On the basis of the localization of the protein to be measured, a comprehensive evaluation was performed based on the intensity of positive signal and the number of positive cells. The chi-square test was used for comparison of categorical data between groups, the Kaplan-Meier method was used for survival analysis, and the log-rank test was used for the comparison of survival rates.ResultsNF-κB p65 protein was located in the cytoplasm and some nuclei in cancer tissue and adjacent tissue, with positive rates of 90.12% in the cancer tissue and 69.14% in the adjacent tissue, and there was a significant difference in positive rate between the cancer tissue and the adjacent tissue (χ2=10.998,P=0.001). The expression of NF-κB p65 protein in cancer tissue was not associated with clinical stage, tumor thrombus, or the presence or absence of recurrence (allP>0.05).ConclusionHCC tissue has higher expression of NF-κB p65 than adjacent tissue. The key to the regulation of NF-κB function is to inhibit the promotional effect of RelA(p65) on liver tumor. Therefore, inhibiting the activity of NF-κB p65 may suppress the differentiation and growth of tumor cells, providing a new idea for clinical treatment of HCC.
carcinoma, hepatocellular; NF-kappa B; transcription factor RelA
R735.7
A
1001-5256(2017)12-2342-04
10.3969/j.issn.1001-5256.2017.12.017
2017-06-15;修回日期:2017-07-04。 作者简介:夏庚(1988- ),男,主要从事肝病诊疗方面的研究。 祁飞(1992- ),女,主要从事肝病诊疗方面的研究。 二者对本文贡献相同,同为第一作者。 通信作者:唐映梅,电子信箱:tangyingmei_med@163.com。
引证本文:XIA G, QI F, YANG JH, et al. Expression of nuclear factor-kappa B p65 in hepatocellular carcinoma and its significance[J]. J Clin Hepatol, 2017, 33(12): 2342-2345. (in Chinese)
夏庚, 祁飞, 杨晋辉, 等. 核因子-κB p65在肝细胞癌中的表达及意义[J]. 临床肝胆病杂志, 2017, 33(12): 2342-2345.
(本文编辑:邢翔宇)
