新型达比加群酯衍生物的合成及其抗凝血活性
2017-12-15丁海关蔡志强金正盛张利剑
丁海关, 蔡志强*, 金正盛, 张利剑
(1. 沈阳工业大学 石油化工学院,辽宁 辽阳 111003; 2. 山东省药学科学院 化学药物重点实验室,山东 济南 250101)
·研究论文·
新型达比加群酯衍生物的合成及其抗凝血活性
丁海关1, 蔡志强1*, 金正盛1, 张利剑2*
(1. 沈阳工业大学 石油化工学院,辽宁 辽阳 111003; 2. 山东省药学科学院 化学药物重点实验室,山东 济南 250101)
以3-[(3-氨基-4-甲基氨基苯甲酰)吡啶-2-基氨基]丙酸乙酯为原料,经环合、水解、酰胺化等反应合成了6个新型的达比加群酯衍生物(5a~5f),其结构经1H NMR, IR和HR-MS(ESI)表征。研究了5a~5f对凝血活酶抑制活性(IC50)和活化部分凝血活酶时间(aPTT)的抑制作用。结果表明:5a的抗凝血活性最好,其IC50和aPTT分别为1.25±0.1 nmol·L-1和77.2±1.3 s,优于阳性对照药达比加群酯。
Ⅱa因子受体; 达比加群酯; 抗凝血活性; 合成; 抑制活性
达比加群酯是一种新型的直接凝血酶抑制剂。达比加群酯也是达比加群的前体药物,属于非肽类的凝血酶抑制剂,常用于预防非瓣膜性房颤患者的卒中和全身性栓塞[1-3]。美国食品和药品监督管理局于2010年10月19日批准了Pradaxa胶囊(达比加群酯)用于有心律异常(心房颤动)患者的预防中风和凝血。2013年5月,中国批准了该药物上市,商品名为泰毕全。
然而,达比加群酯母核中,苯并咪唑连接的芳环取代脒基导致药物的溶解性较差,口服生物利用度偏低,限制了其药效的充分发挥[4-9]。在前期研究[10-11]的基础上,我们根据生物电子等排原理,将脒基环合成苯并异噁唑,将桥连的氮原子替换为结构更柔的氧原子,同时通过选用不同的氨基酸及其衍生物构建酰胺基团以改变末端酯的结构,以期获得活性更好和生物利用度更佳的达比加群酯衍生物。
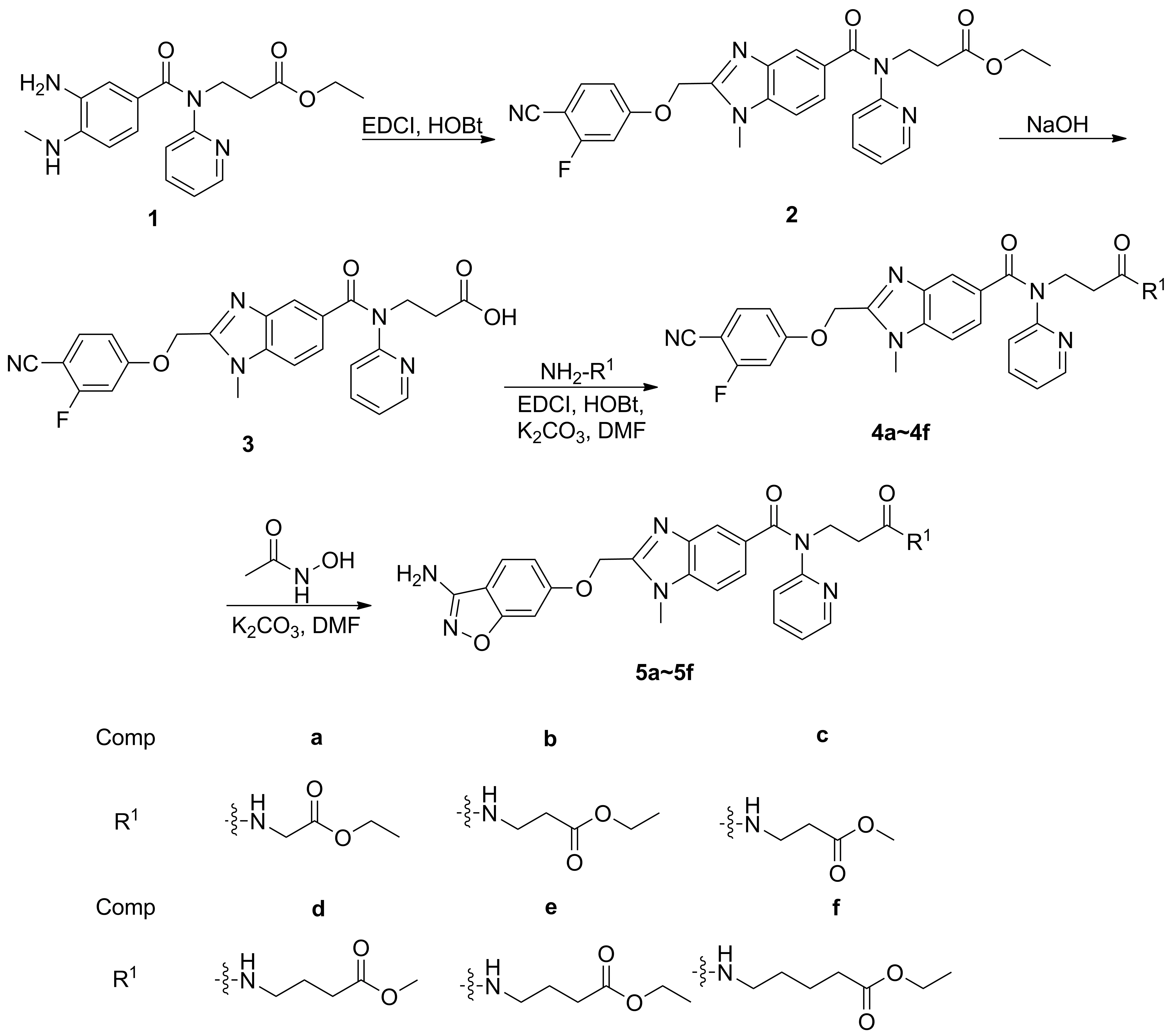
Scheme1
本文在文献[12-15]方法的基础上,以3-[(3-氨基-4-甲基氨基苯甲酰)吡啶-2-基氨基]丙酸乙酯(1)为原料,经环合、水解、酰胺化等反应合成了6个新型的达比加群酯衍生物(5a~5f),其结构经1H NMR, IR和HR-MS(ESI)表征。研究了5a~5f对凝血活酶抑制活性(IC50)和活化部分凝血活酶时间(aPTT)的抑制作用。
1 实验部分
1.1 仪器与试剂
SGWX-4型显微熔点仪;Bruker ARX-400 MHz NMR型核磁共振仪(DMSO-d6为溶剂,TMS为内标);Bruker TENSOR II型傅里叶变换红外光谱仪;Agient 1100型四级杆液质联用仪;Bruker micro-TOF型高分辨质谱仪。
1,实验室自制[11];其余所用试剂均为分析纯。
1.2 合成
(1)2的合成
将2-(4-氰基-3-氟苯氧基)乙酸3.9 g(0.02 mol), 1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐3.8 g(0.02 mol), 1-羟基苯并三唑2.7 g(0.02 mol)加入四氢呋喃(50 mL)和二甲基甲酰胺(10 mL)的混合溶液中,于0 ℃搅拌1 h;升温至30 ℃,滴加16.2 g(0.018 mol)的THF(25 mL)溶液,滴毕,反应10 h。蒸除溶剂,残余物加入乙酸乙酯50 mL,用饱和食盐水(3×40 mL)洗涤,硫酸镁干燥,过滤,滤液浓缩,残余物加入冰乙酸60 mL,回流反应5 h。浓缩,残余物加入浓氨水30 mL,搅拌1 h;蒸除溶剂,残余物加入乙酸乙酯50 mL,用饱和食盐水(3×25 mL)洗涤,无水硫酸镁干燥,过滤,滤液浓缩,残余物经硅胶柱层析(洗脱剂:乙酸乙酯/石油醚=1/3,V/V)纯化得白色固体3-{2-{[(4-氰基-3-氟苯氧基)]甲基}-1-甲基-N-(吡啶-2-基)-1H-苯并咪唑-5-甲酰胺基}丙酸乙酯(2)4.8 g,收率52.9%, m.p.123.7~124.9 ℃;1H NMRδ: 8.39(d,J=4.4 Hz, 1H), 7.88(t,J=8.4 Hz, 1H), 7.53(td,J=6.4 Hz, 8.4 Hz, 3H), 7.36(d,J=8.4 Hz, 1H), 7.23(d,J=8.4 Hz, 1H), 7.13(t,J=6.8 Hz, 2H), 6.92(d,J=8.0 Hz, 1H), 5.53(s, 2H), 4.23(t,J=7.2 Hz, 2H), 3.98(q,J=7.2 Hz, 2H), 3.80(s, 3H), 2.69(t,J=7.2 Hz, 2H), 1.12(t,J=7.2 Hz, 3H); IRν: 3 455.33, 2 998.16, 2 229.82, 1 717.88, 1 220.73, 1 050.73, 905.38, 795.88, 694.75, 560.87, 507.79, 456.06 cm-1; MS(ESI)m/z: 502.5{[M+H]+}。
(2)3的合成
将氢氧化钠0.64 g(16 mmol)的水(10 mL)溶液缓慢滴加至24.80 g(3.0 mmol)的乙醇(60 mL)溶液中,滴毕,搅拌下反应1 h。浓缩,残余物用盐酸调至pH 5~6(析出固体),过滤,滤饼依次用水(3×30 mL)和乙醚(3×20 mL)洗涤,真空干燥得土黄色固体3-{2-{[(4-氰基-3-氟苯氧基)]甲基}-1-甲基-N-(吡啶-2-基)-1H-苯并咪唑-5-甲酰胺基}丙酸(3)4.4 g,收率97.1%, m.p.117.5~119.2 ℃;1H NMRδ: 12.30(s, 1H), 8.38(dd,J=4.8 Hz, 2.4 Hz, 1H), 7.88(t,J=8.4 Hz, 1H), 7.57(s, 1H), 7.53~7.45(m, 2H), 7.36(dd,J=8.4 Hz, 1.2 Hz, 1H), 7.23(dd,J=8.4 Hz, 1.2 Hz, 1H), 7.13(dt,J=8.4 Hz, 2.4 Hz, 2H), 6.98(d,J=8.0 Hz, 1H), 5.53(s, 2H), 4.19(t,J=7.6 Hz, 2H), 3.80(s, 3H), 2.63(t,J=7.6 Hz, 2H); IRν: 3 497.73, 3 059.91, 2 952.72, 2 232.63, 1 702.65, 1 620.70, 1 437.27, 1 307.05, 1 201.78, 750.07, 571.86 cm-1; MS(ESI)m/z: 474.4{[M+H]+}。
(3)4a~4f的合成(以4a为例)
将32.36 g(0.005 mol), 1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐0.95 g(0.005 mol), 1-羟基苯并三唑0.68 g(0.005 mol)和碳酸钾0.69 g(0.005 mol)溶于DMF(15 mL)中,于0 ℃搅拌2 h;升至25 ℃,加入甘氨酸乙酯盐酸盐0.70 g(0.005 mol),反应10 h。蒸除溶剂,加入乙酸乙酯15 mL,用饱和盐水(3×5 mL)洗涤,无水硫酸镁干燥,过滤,滤液浓缩,残余物经硅胶柱层析(洗脱剂:A=二氯甲烷/甲醇=35/1,V/V)纯化得淡黄色固体2-{3-{2-[(4-氰基-3-氟苯氧基)甲基]-1-甲基-N-(吡啶-2-基)-1H-苯并咪唑-5-甲酰胺基}丙酰胺}乙酸乙酯(4a)1.10 g,收率39.5%, m.p.74.6~76.2 ℃;1H NMRδ: 8.43(t,J=5.2 Hz, 1H), 8.36(dd,J=4.8 Hz, 2.4 Hz, 1H), 7.91~7.85(m, 1H), 7.58(td,J=7.6 Hz, 1.2 Hz, 1H), 7.52(d,J=0.8 Hz, 1H), 7.47(d,J=8.4 Hz, 1H), 7.36(dd,J=11.8 Hz, 4.8 Hz, 1H), 7.23(dd,J=8.4 Hz, 1.2 Hz, 1H), 7.16~7.10(m, 2H), 7.01(d,J=8.4 Hz, 1H), 5.53(s, 2H), 4.20~4.14(m, 2H), 4.08(q,J=7.2 Hz, 1.2 Hz, 2H), 3.80(s, 3H), 3.76(d,J=5.6 Hz, 2H), 2.60~2.55(m, 2H), 1.18(t,J=7.2 Hz, 3H); IRν: 3 293.47, 3 037.75, 2 931.33, 2 325.00, 2 229.30, 2 114.92, 1 741.18, 1 643.63, 1 617.07, 1 192.48, 1 114.45, 1 011.14, 743.13, 430.30 cm-1; MS(ESI)m/z: 559.6{[M+H]+}。
用类似的方法合成4b~4f。
(4)5a~5f的合成(以5a为例)
将4a5.58 g(0.01 mol),乙酰氧肟酸2.04 g(0.03 mol)和碳酸钾6.50 g(0.045 mol)溶于DMF(100 mL)和水(30 mL)的混合溶液中,搅拌下反应70 h。加入水100 mL,搅拌12 h,析出固体,抽滤,滤液浓缩,残余物经硅胶柱层析(洗脱剂:A=30/1)纯化得白色固体2-{3-{2-{[(3-氨基苯基异噁唑-6-基)氧基]甲基}-1-甲基-N-(吡啶-2-基)-1H-苯并咪唑-5-甲酰胺基}丙酰胺}乙酸乙酯(5a)3.19 g。
用类似的方法合成白色固体5b~5f。
5a: 收率55.9%, m.p.95.1~96.2 ℃;1H NMRδ: 8.43(t,J=5.6 Hz, 1H), 8.37(dd,J=4.8 Hz, 1.2 Hz, 1H), 7.69(d,J=8.8 Hz, 1H), 7.58(td,J=7.6 Hz, 1.6 Hz, 1H), 7.53(d,J=0.8 Hz, 1H), 7.47(d,J=8.4 Hz, 1H), 7.22(dd,J=10.4 Hz, 1.6 Hz, 2H), 7.12(dd,J=7.2 Hz, 5.2 Hz, 1H), 7.02~6.93(m, 2H), 6.31(s, 2H), 5.44(s, 2H), 4.20~4.14(m, 2H), 4.07(t,J=7.2 Hz, 2H), 3.81(s, 3H), 3.76(d,J=5.6 Hz, 2H), 2.62~2.55(m, 2H), 1.18(t,J=7.2 Hz, 3H); IRν: 3 316.81, 2 941.05, 2 114.24, 1 738.71, 1 615.50, 1 436.52, 1 271.88, 1 153.32, 1 016.16, 705.37, 566.32 cm-1; MS(ESI)m/z: 572.2{[M+H]+}; HR-MS(ESI)m/z: Calcd for C29H30N7O6{[M+H]+}572.591 8, found 572.590 9。
5b: 收率45.6%, m.p.207.6~209.9 ℃;1H NMRδ: 8.39(s, 1H), 7.69(s, 1H), 7.53(d,J=16.4 Hz, 3H), 7.23(s, 2H), 7.12(s, 1H), 6.93(d,J=7.2 Hz, 2H), 6.30(s, 2H), 5.44(s, 2H), 4.23(s, 2H), 3.98(s, 2H), 3.81(s, 3H), 2.69(s, 2H), 1.12(s, 3H); IRν: 3 316.44, 3 185.38, 2 984.25, 2 115.67, 1 755.84, 1 658.07, 1 441.15, 1 271.23, 1 159.36, 1 002.55, 756.13, 564.87, 459.08 cm-1; MS(ESI)m/z: 586.2{[M+H]+}; HR-MS(ESI)m/z: Calcd for C30H32N7O6{[M+H]+}586.618 4, found 586.616 6。
5c: 收率43.5%, m.p.209.4~211.2 ℃;1H NMRδ: 8.35(d,J=3.6 Hz, 1H), 8.07(s, 1H), 7.69(d,J=8.4 Hz, 1H), 7.61~7.43(m, 3H), 7.25~7.15(m, 2H), 7.14~7.08(m, 1H), 6.96(t,J=8.8 Hz, 2H), 6.31(s, 2H), 5.44(s, 2H), 4.16(t,J=6.8 Hz, 2H), 3.81(s, 3H), 3.58(s, 3H), 3.20(d,J=4.8Hz, 2H), 2.59(s, 2H), 2.41(t,J=6.8 Hz, 2H); IRν: 3 213.35, 3 071.60, 2 947.86, 2 324.86, 2 110.37, 1 731.28, 1 643.38, 1 437.11, 1 002.81, 709.93, 469.03 cm-1; MS(ESI)m/z: 572.2 {[M+H]+}; HR-MS(ESI)m/z: Calcd for C29H30N7O6{[M+H]+}572.591 8, found 572.592 5。
5d: 收率36.9%, m.p.179.4~181.2 ℃;1H NMRδ: 8.34(d,J=3.6 Hz, 1H), 8.05(s, 1H), 7.66(d,J=8.6 Hz, 1H), 7.60~7.45(m, 3H), 7.27~7.25(m, 2H), 7.13~7.05(m, 1H), 6.90(t,J=8.8 Hz, 2H), 6.33(s, 2H), 5.43(s, 2H), 4.10(t,J=6.8 Hz, 2H), 3.88(s, 3H), 3.55(s, 3H), 3.23(d,J=4.8 Hz, 2H), 2.54(s, 2H), 2.43(t,J=6.8 Hz, 2H) , 2.38(t,J=6.8 Hz, 2H); IRν: 3 215.34, 3 061.65, 2 944.88, 2 325.84, 2 111.35, 1 730.22, 1 643.36, 1 437.19, 1 002.46, 709.38, 469.44 cm-1; MS(ESI)m/z: 586.2 {[M+H]+}; HR-MS(ESI)m/z: Calcd for C30H32N7O6{[M+H]+}586.618 4, found 586.615 8。
5e: 收率32.7%, m.p.167.6~169.9 ℃;1H NMRδ: 8.35(s, 1H), 7.67(s, 1H), 7.55(d,J=16.0 Hz, 3H), 7.24(s, 2H), 7.11(s, 1H), 6.90(d,J=7.2 Hz, 2H), 6.39(s, 2H), 5.41(s, 2H), 4.27(s, 2H), 3.94(s, 2H), 3.87(s, 3H), 2.88(m, 2H), 2.64(s, 2H), 1.12(s, 3H); IRν: 3 315.43, 3 186.24, 2 984.67, 2 114.77, 1 756.80, 1 653.16, 1 444.60, 1 271.55, 1 153.30, 1 005.59, 752.18, 562.887, 453.04 cm-1; MS(ESI)m/z: 600.2{[M+H]+}; HR-MS(ESI)m/z: Calcd for C31H34N7O6{[M+H]+}600.645 0, found 600.646 2。
5f: 收率26.5%, m.p.127.6~129.4 ℃;1H NMRδ: 8.37~8.32(m, 1H), 7.94(t,J=5.6 Hz, 1H), 7.69(d,J=8.8 Hz, 1H), 7.58(td,J=7.8 Hz, 1.6 Hz, 1H), 7.52~7.44(m, 2H), 7.25~7.19(m, 2H), 7.11(dd,J=7.2 Hz, 5.2 Hz, 1H), 7.02~6.93(m, 2H), 6.31(s, 2H), 5.44(s, 2H), 4.20~4.13(m, 2H), 4.03(q,J=7.2 Hz, 2H), 3.81(s, 3H), 2.97(q,J=6.4 Hz, 2H), 2.26(t,J=7.2 Hz, 2H), 1.52~1.43(m, 2H), 1.34(dt,J=14.4 Hz, 7.2 Hz, 2H), 1.28~1.21(m, 2H), 1.16(t,J=7.2 Hz, 3H); IRν: 3 216.78, 2 930.50, 2 325.88, 2 117.27, 1 728.28, 1 616.43, 1 436.45, 1 271.48, 1 187.58, 1 099.86, 768.32, 610.39, 441.23 cm-1; MS(ESI)m/z: 614.2{[M+H]+}; HR-MS(ESI)m/z: Calcd for C32H36N7O6{[M+H]+}614.671 5, found 614.670 8。
1.3 抗凝血活性测试
(1) 抗凝血活酶活性(IC50)
将待测样品溶解于DMSO后加入到含人源凝血酶(0.042 U·mL-1)的反应体系中,于37 ℃孵育10 min;加入特异性底物Ac-FVR-AMC,酶的浓度为0.003~100 μmol·L-1,使用酶标仪测定波长405 nm处的相对荧光强度变化。以凝血酶抑制剂达比加群酯作为阳性对照药物。经过初步筛选抑制率,再测定IC50。
(2) 活化部分凝血活酶时间(aPTT)
将体重为18~20 g的昆明小鼠随机分组,每组10只,禁食过夜。将达比加群酯和待测目标化合物悬浮或溶解于1%羧甲基纤维素钠的水溶液中,配制为1 mg·mL-1的溶液,按10 mg/kg的剂量灌胃给药,0.5 h后通过心脏穿刺取血,加入4%枸杞酸钠溶液至0.4%终浓度抗凝;于12 000 r·min-1离心5 min,取血浆0.1 mL,加入aPTT试剂0.1 mL,于37 ℃预温3 min后加入氯化钙溶液0.1 mL,用血小板聚集凝血因子分析仪测定凝固时间,该数值即为aPTT值。

表1 5a~5f的抗凝血活性Table 1 The anticoagulant activities of 5a~5f

表2 5a~5f的活化部分凝血活酶时间(aPTT)Table 2 The aPTT of 5a~5f
2 结果与讨论
2.1 合成
合成5的过程中,由于受分子结构中尾端氨基酸侧链的影响,随着氨基酸侧链的增长,苯并噁唑环的环合反应收率呈显著的降低趋势。可能是受中间体4连接不同的氨基酸后溶解度不同或是远程供电性的影响,收率由连接甘氨酸的中间体(4a)环合成5a收率的55.9%降到连接戊氨酸的中间体(4f)环合成5f收率的26.5%。
2.2 抗凝血活性
表1为5a~5f的抗凝血活酶活性(IC50)。由表1可以看出,化合物5a的IC50为1.25±0.1 nmol·L-1,抗凝血活性明显优于阳性药达比加群酯(1.50±0.2 nmol·L-1);5b~5f的活性明显降低,且为线性关系。由此可见,末端的氨基酸或其衍生物的修饰对抗凝血活性影响较大,氨基酸或其衍生物的侧链的增长影响了化合物的活性。
表2为5a~5f的活化部分凝血活酶时间(aPTT)。由表2可见,化合物5a对活化部分凝血活酶的抑制效果最好(aPTT=77.2±1.3 s);5d和5e的活性虽然也较好,但是可能在临床上容易出现出血的风险;5b,5c和5f的活性明显降低。因此可以初步判断侧链氨基酸或其衍生物的最佳碳链长度为两个碳原子。
此外,综合表1和表2可以看出,无论氨基酸甲酯还是乙酯,对IC50和aPTT的影响均不大。
合成了6个新型的苯并咪唑类衍生物(5a~5f)。抗凝血活性实验结果表明:5a的抗凝血活性最好,其IC50和aPTT分别为1.25±0.1 nmol·L-1和77.2±1.3 s,优于阳性对照药达比加群酯,值得进一步研究。
[1] BLECH S, EBNER T, LUDWING-SCHWELLINGER E,etal. The metabolism and disposition of the oral direct thrombin inhibitors,dabigatran,in hunman[J].Drug Metab Dispos,2008,36(2):386-399.
[2] CAI Z Q, HOU X, DU L K,etal. Synthesis,crystal structural, and spectral characterisation of dabigatran etexilate tetrahydrate[J].Journal of Chemical Research,2016,40(8):461-466.
[3] NORBERT H H, HERBERT N, HENNING P,etal. Structure-based design of novel potent nonpeptide thrombin inhibitors[J].J Med Chem,2002,45(9),1757-1766.
[4] LIU H Q, ZHANG W G, CAI Z Q,etal. Dabigatran etexilate tetrahydrate[J].Acta Cryst E,2012,E68:O3385.
[5] 纪红蕊,陈家驹,张茜,等. 双酚A的毒性作用机制[J].沈阳工业大学学报,2015,37(6):710-715.
[6] EIKELBOOM J W, QUINLAN D J, CONNOLLY S J,etal. Dabigatran efficacy-safety assessment for stroke prevention in patients with atrial fibrillation[J].Thromb Haemost,2012,10(5):966-968.
[7] 蔡志强,马维英,候旭,等. 达比加群酯的合成工艺改进[J].精细化工,2015,32(3):308-311.
[8] DOBESH P P, FANIKOS J, DIENER H C,etal. New oral anticoagulants for the treatment of venous thromboembolism:Understanding differences and similarities[J].Drugs,2014,74(17):2015-2032.
[9] JEFFREY I, WEITZ M D, HIRSH J. New anticoagulant drugs[J].Chest,2001,119(1):95-107.
[10] 蔡志强,侯旭,张波,等. 新型苯并咪唑衍生物的合成及其抗凝血活性[J].合成化学,2015,23(10):908-912.
[11] 蔡志强,侯旭,侯玲,等. 达比加群酯中间体3-【【【2-{[(4-氰基苯基)氨基]甲基}-1-甲基-1H-苯并咪唑-5-基】羰基】(吡啶-2-基)氨基】丙酸乙酯的合成[J].合成化学,2016,24(8):709-712.
[12] 郭雅俊,朱雪焱,黄雨,等. 达比加群酯的合成[J].合成化学,2014,22(2):262-264.
[13] 方干,郑永勇,张晓培,等. 达比加群酯合成路线图解[J].中国医药工业杂志,2011,42(9):717-719.
[14] GNAD F, DACH R, HEDDESHEIMER I,etal. Method for producing dabigatran etexilate:WO 2011061080[P].2011.
[15] LUSTIG P, JIRMAN J. A method for the preparation of Dabigatran and its intermediates:WO 2010045900[P].2010.
SynthesisandAnticoagulantActivitiesofDabigatranEtexilateDerivatives
DING Hai-guan1, CAI Zhi-qiang1*, JIN Zheng-sheng1, ZHANG Li-jian2*
(1. School of Petrochemical Engineering, Shenyang University of Technology, Liaoyang 111003, China; 2. Key Laboratory for Chemical Drug Research, Institute of Phamaceutical Sciences of Shandong Province, Jinan 250101, China)
Six novel Dabigatran etexilate derivatives(5a~5f) were designed and synthesized from ethyl 3-[3-amino-4-(methylamino)-N-(pyridin-2-yl)benzamido]propanoate by the reaction of cyclization, hydrolysis, amidation, etc. The structures were characterized by1H NMR, IR and HR-MS(ESI). The clotting enzyme inhibitory activity(IC50) and activated part clotting time(aPTT) of5a~5fwere investigated. The results showed that5aexhibited best anticoagulant activities with IC50of 1.25±0.1 nmol·L-1and aPTT of 77.2±1.3 s, better than Dabigatran etexilate.
Ⅱa factor receptor; Dabigatran etexilate; anticoagulant activity; synthesis; inhibitory activity
2017-09-25;
2017-11-02
辽宁省教育厅科学研究项目( L2015383); 博士科研启动基金(521422)
丁海关(1994-),男,汉族,辽宁朝阳人,硕士研究生,主要从事药物合成的研究。
蔡志强,博士,副教授, E-mail: czq0601@126.com; 张利剑,硕士,主管药师, E-mail: kahongzqc@163.com
O626.29
A
10.15952/j.cnki.cjsc.1005-1511.2017.12.17228
