人乳、牛乳、羊乳中乳清部分氨基酸组成及乳清蛋白中蛋白质二级结构的对比
2017-12-11张熙桐关博元孔繁华陶冬冰武俊瑞岳喜庆
张熙桐,关博元,孔繁华,刘 彪,陶冬冰,武俊瑞,*,岳喜庆,*
人乳、牛乳、羊乳中乳清部分氨基酸组成及乳清蛋白中蛋白质二级结构的对比
张熙桐1,关博元1,孔繁华1,刘 彪2,陶冬冰1,武俊瑞1,*,岳喜庆1,*
(1.沈阳农业大学食品学院,辽宁 沈阳 110866;2.内蒙古伊利实业集团股份有限公司,内蒙古 呼和浩特 010050)
采用全自动氨基酸分析仪分别测定人乳、牛乳、羊乳氨基酸组成。应用模糊识别法和氨基酸比值系数、氨基酸比值系数分等指标全面评价3 种乳乳清部分营养价值。采用傅里叶红外光谱的酰胺Ⅰ带和酰胺Ⅲ带测定3 种乳中乳清蛋白的天然二级构象。结果表明:羊乳乳清部分必需氨基酸与总氨基酸比值为0.450,全鸡蛋蛋白贴近度与联合国粮食及农业组织/世界卫生组织贴近度分别为0.919 7、0.925 0,2 种氨基酸比值系数分分别为68.47、76.56,在氨基酸营养评价上营养价值较高。羊乳乳清蛋白二级结构中的α-螺旋比例为20.26%,与人乳的27.37%更为接近,一定程度上更利于人体吸收。因此,羊乳是相比牛乳较好的婴幼儿功能性食品原料。
氨基酸;营养评价;乳清蛋白;傅里叶变换红外光谱;二级结构
人乳是天然的、最理想的哺育婴幼儿的食品,它含有人体所需的全部营养成分,以及多种生物活性成分,在婴幼儿生长发育过程中起着至关重要的作用[1-3]。牛乳是人类利用最多的动物乳,占乳制品消费量的95%[4]。牛乳主要由水、蛋白质、脂肪、乳糖、矿物质等组成,为人体提供必需营养物质,且其中乳清蛋白约占20%[5-6]。羊乳的基础结构和各项营养元素配比均与人乳相类似,其总热量、干物质、蛋白质、脂肪以及矿物质含量均高于牛乳,具有较高的营养价值[6-9]。
乳清蛋白必需氨基酸种类齐全,组成模式与人体相似,容易消化吸收,具有极高的生物利用效价;乳清蛋白功能多样,来源于天然食品,是可获得的最经济的食物蛋白质资源之一[10-12]。目前,傅里叶变换红外光谱已成为对蛋白质二级结构进行分析的常规方法,但国内外针对人乳、牛乳、羊乳乳清蛋白二级结构的分析还较少。氨基酸是组成蛋白质的主要成分和基本单位,评价营养价值高低的一项重要指标就是食品中的氨基酸含量与种类是否丰富与齐全,而氨基酸自动分析仪早已被国内外专用于分析测定食品中的氨基酸含量[13-14]。
本实验采用L-8900型全自动氨基酸分析仪对人乳、牛乳、羊乳中乳清部分氨基酸组成进行测定,实验结果采用SPSS 18.0数据分析软件进行分析。采用傅里叶变换红外光谱法对人乳、牛乳、羊乳分离出的乳清蛋白进行二级结构的分析,分析结果采用OMNIC 8.2及Peakfit 4.0进行定性、定量分析。深入了解人乳、牛乳、羊乳在以上两方面的异同点,为日后生产婴幼儿食品及功能性食品提供理论依据。
1 材料与方法
1.1 材料与试剂
牛乳、羊乳均采集自沈阳农业大学畜牧场。
采集30 份健康奶牛、奶羊的乳汁低温运回实验室,并在实验前进行混合(防止个体差异)。除当天用乳样放入4 ℃冰箱保存外,其余乳样均置于-80 ℃冰柜冷藏。
人乳:采集某医院正常生产、身体健康、头胎、饮食正常的30 位授乳母亲的乳汁低温运回实验室,并在实验前进行混合(防止个体差异)。除当天用乳样放入4 ℃冰箱保存外,其余乳样均置于-80 ℃冰柜冷藏。由授乳母亲自愿提供。
1.2 仪器与设备
CR-21G高速冷冻离心机、L-8900型全自动氨基酸分析仪 日本日立公司;Nexus 670傅里叶变换红外光谱仪美国Nicolet公司;真空冷冻干燥机 上海比朗仪器制造有限公司。
1.3 方法
1.3.1 氨基酸组成测定
前处理:分别取人乳、牛乳、羊乳各2 mL,4 ℃、6 000×g离心20 min,去除乳脂层,再15 000×g离心60 min,获得乳清部分,除去酪蛋白[15]。处理后样品加入10 mL 6 mol/L盐酸溶液及几滴消泡剂。抽真空状态下(游离氨基酸易氧化)以熔焊机封口,置于110 ℃烘干箱中水解24 h。冷却后液体转入50 mL容量瓶,反复冲洗水解管、漏斗、玻璃棒等,定容至50 mL。取定容后溶液2 mL至蒸发皿中,100 ℃水浴锅加热蒸干,加入2 mL 0.02 mol/L盐酸[16]。
色谱条件:分析柱:2622C磺酸型的强酸性阳离子交换树脂;柱温57 ℃;流动相:pH 3.2、3.3、4.3、4.9柠檬酸-柠檬酸钠缓冲溶液;流动相泵1流速0.40 mL/min;泵压95.000 kgf/cm2;茚三酮泵2流速0.350 mL/min;泵压12.000 kgf/cm2;紫外检测器:脯氨酸在波长440 nm处测定吸光度,其他氨基酸在波长570 nm处测定吸光度[17]。
1.3.2 氨基酸的营养评价
模糊识别法[18]:以全鸡蛋蛋白模式和联合国粮食与农业组织(Food and Agriculture Organization,FAO)/世界卫生组织(World Health Organization,WHO)模式为标准,按照兰氏距离法识别对象u和标准蛋白a的贴近度,如公式(1)所示:

式中:μ为待评价的蛋白,μ(u1,u2,u3)分别代表人乳蛋白、牛乳蛋白、羊乳蛋白;ak表示标准蛋白的7 种必需氨基酸(essential amino acids,EAA)含量/(mg/g Pro),即P(a)=P(al,a2,a3,a4,a5,a6,a7)=P1(54,86,70,57,93,47,66)=P2(40,70,55,35,60,40,50),其中P1代表FAO/WHO模式、P2代表全鸡蛋蛋白模式,al~a7分别代表异亮氨酸(Ile)、亮氨酸(Leu)、赖氨酸(Lys)、含硫氨基酸——蛋氨酸+半胱氨酸(Met+Cys)、苯丙氨酸+酪氨酸(Phe+Tyr)、苏氨酸(Thr)、缬氨酸(Val);uik为第i种乳蛋白中的第k种氨基酸的含量(mg/g Pro),u1k、u2k、u3k分别表示这3 种乳蛋白的7 种EAA含量/(mg/g Pro)。
氨基酸比值系数(ratio coefficient,RC)法[19-20]:根据FAO/WHO提出的EAA标准模式与全鸡蛋蛋白标准模式为参考,分别计算氨基酸比值(ratio of amino acid,RAA)、RC、比值系数分(score of ratio coefficient,SRC)。按公式(2)~(4)计算:


式中:SRD为RC的相对标准偏差。
1.3.3 二级结构的测定
样品前处理:取人乳、牛乳、羊乳各50 mL,4 ℃、6 000×g离心20 min,去除乳脂层,再置于15 000×g离心60 min,获得乳清部分,除去酪蛋白,置入真空冷冻干燥机制得冻干粉。
谱图收集:分别取人、牛、羊样品粉末1 mg,加入150 mg溴化钾粉末,研磨混匀后进行压片处理,处理后及时上样测试[21]。
谱图处理:使用OMNIC 8.2软件,对样品谱图在谱带范围内(酰胺Ⅲ带1 220~1 330 cm-1;酰胺Ⅰ带1 600~1 700 cm-1)进行基线校正,采用5点Savitsk Golay函数平滑后,进行傅里叶去卷积。处理后图谱在Peakfit 4.0软件中,采用Gausse函数进行二阶导数分峰拟合,多次拟合使残差R2最小,当确定了各子峰与不同二级结构的对应关系后,根据其积分面积计算各种二级结构的相对百分比。
2 结果与分析
2.1 氨基酸分析
2.1.1 氨基酸组成分析

表1 不同乳之间氨基酸含量的比较Table 1 Comparison of amino acid composition of whey proteins in different milks mg/g Pro
如表1所示,人乳、牛乳、羊乳中氨基酸总量分别为752.15、870.62、887.15 mg/g Pro,少于宁健婷等[18]所测得的3 种初乳中氨基酸含量为833.9、904.6、954.5 mg/g Pro。EAA与总氨基酸(total amino acids,TAA)含量比值均与FAO/WHO提出的EAA/TAA为0.400相接近,这也与宁健婷等[18]的数据大致相符。这表明3 种乳乳清部分氨基酸含量丰富,种类齐全,富含17 种氨基酸,在氨基酸层面均具有较高的营养价值,但相对初乳来说营养含量还是较低,这也说明初乳相对于常乳还是更有营养。
3 种乳乳清部分中含量最高的2 种氨基酸均为谷氨酸与亮氨酸。谷氨酸可与血氨形成谷氨酰胺,它的作用是清除有毒化合物,此外它还可以为脑细胞提供营养[22]。亮氨酸可以调控机体的蛋白质周转,包括维持机体蛋白质稳态,清除衰老和损伤的各类蛋白,合成热休克和免疫相关蛋白,参与组织修复和更新,并响应各种营养和激素信号等[23]。两者均是对人体非常有益的化合物。
2.1.2 模糊识别分析

表2 人乳、牛乳、羊乳蛋白相对于标准蛋白的贴近度Table 2 Closeness of whey proteins in human, bovine and goat milks to standard proteins
由公式(1)对模糊识别法的计算可知,人乳、牛乳、羊乳与FAO/WHO模式和全鸡蛋蛋白模式的贴近度,如表2所示。人乳FAO/WHO模式贴近度远高于大豆蛋白(FAO/WHO模式贴近度0.896),牛乳与羊乳FAO/WHO模式贴近度与大豆蛋白相接近[24]。3 种乳的全鸡蛋蛋白贴近度均在0.900附近,与鸡蛋蛋白贴近度相近。表明3 种乳都有较高的营养价值,人乳营养价值相对较高,羊乳次之。
2.1.3 RC法分析
RC法是基于氨基酸平衡理论设计的评价蛋白质营养价值的方法,如果氨基酸的含量丰富且与FAO/WHO提出的标准模式相近,说明这种蛋白质接近人体所需的氨基酸比例,能为人体所利用的营养价值越高[25]。
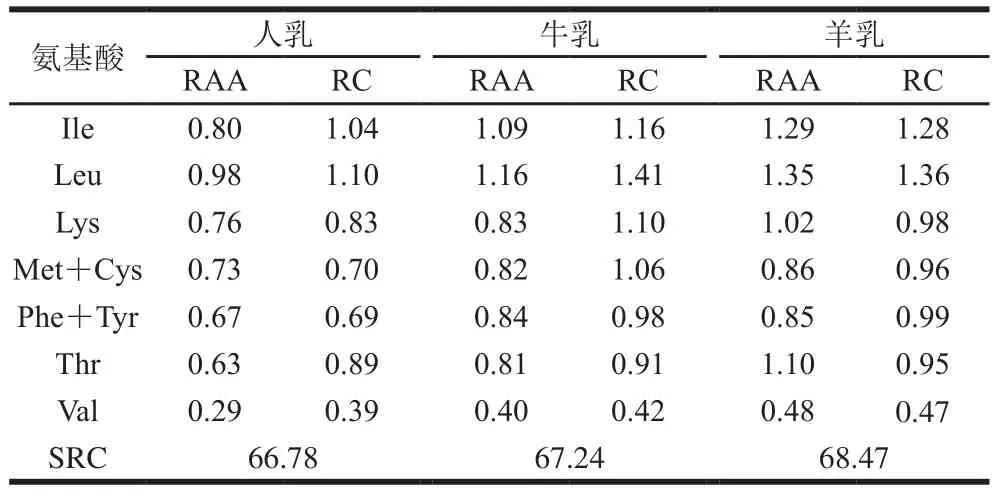
表3 人乳、牛乳、羊乳蛋白质的RAA、RC、SRC的比较(FAO/WHO模式)Table 3 RAA, RC and SRC of whey proteins in human, bovine and goat milks in the FAO/WHO protein pattern
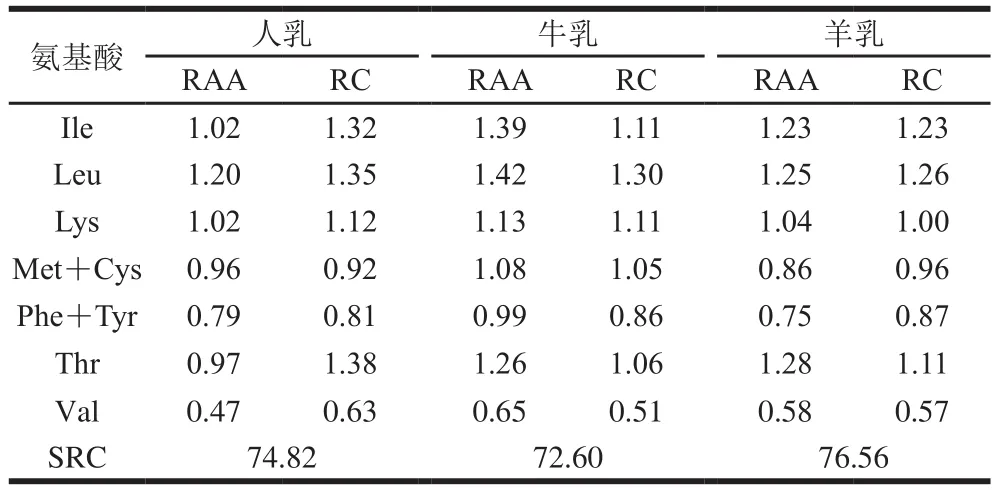
表4 人乳、牛乳、羊乳蛋白质的RAA、RC、SRC的比较(全鸡蛋蛋白模式)Table 4 RAA, RC and SRC of whey proteins in human, bovine and goat milks in the whole egg pattern
RAA及RC的数值越接近1,说明该种初乳蛋白与全鸡蛋蛋白模式(FAO/WHO模式)中EAA推荐值越接近。当RC大于1,说明此种EAA超过标准模式,相对过剩;当RC小于1,说明此种EAA低于全鸡蛋蛋白模式,相对不足。SRC越接近100,说明该种蛋白质营养价值越高,为人体吸收的概率越大。
从表3、4可知,3 种乳中不同EAA的RAA和RC值大多在1附近,说明营养条件满足人体需要。2 种不同模式分析条件下,羊乳SRC都是最高,表明羊乳对于人体吸收利用来说营养价值最高,是婴幼儿功能食品良好的原料。3 种乳中的第1限制氨基酸均为缬氨酸,可根据蛋白质互补法[26],与其他食物蛋白混合利用,从而有效提高不同食物的营养利用价值。
2.2 乳清蛋白二级结构分析
如图1所示,经傅里叶变换红外光谱分析发现,3 种乳走势大致相同,说明实验无明显偏差。将原谱通过OMNIC及Peakfit软件进行处理后,如图2所示,在酰胺Ⅰ带(1 600~1 700 cm-1)通过分析得出3 种乳二级结构的分类和比例,如表5所示,对于酰胺Ⅰ带不易区分的α-螺旋结构与无规卷曲结构,进行酰胺Ⅲ带(1 220~1 330 cm-1)分析确定α-螺旋的含量(表6)[27]。结果显示:从α-螺旋结构来比较人乳最多,羊乳次之,牛乳最少。而从β-转角与β-折叠结构来比较则恰好与α-螺旋结构相反。
α-螺旋是蛋白质中常见的二级结构,肽链主链绕假想的中心轴盘绕成螺旋状,螺旋靠链内氢键维持。α-螺旋在蛋白质相互作用中具有重要性[28]。α-螺旋可使肽链的长度大为缩短,即延伸性较大,同时,α-螺旋也是球状蛋白质构象中最为常见的螺旋盘曲形式。α-螺旋结构对于人体有重要作用。例如,α-螺旋跨膜蛋白具有跨越细胞膜磷脂双分子层的特性,能够穿透生物膜渗透性屏障,因此在许多重要的细胞生理过程中发挥着关键的作用,包括信号和能量转换、主动运输、离子流动以及神经传导等[29-30]。因此,较多的α-螺旋,在一定程度上对人体更有利。
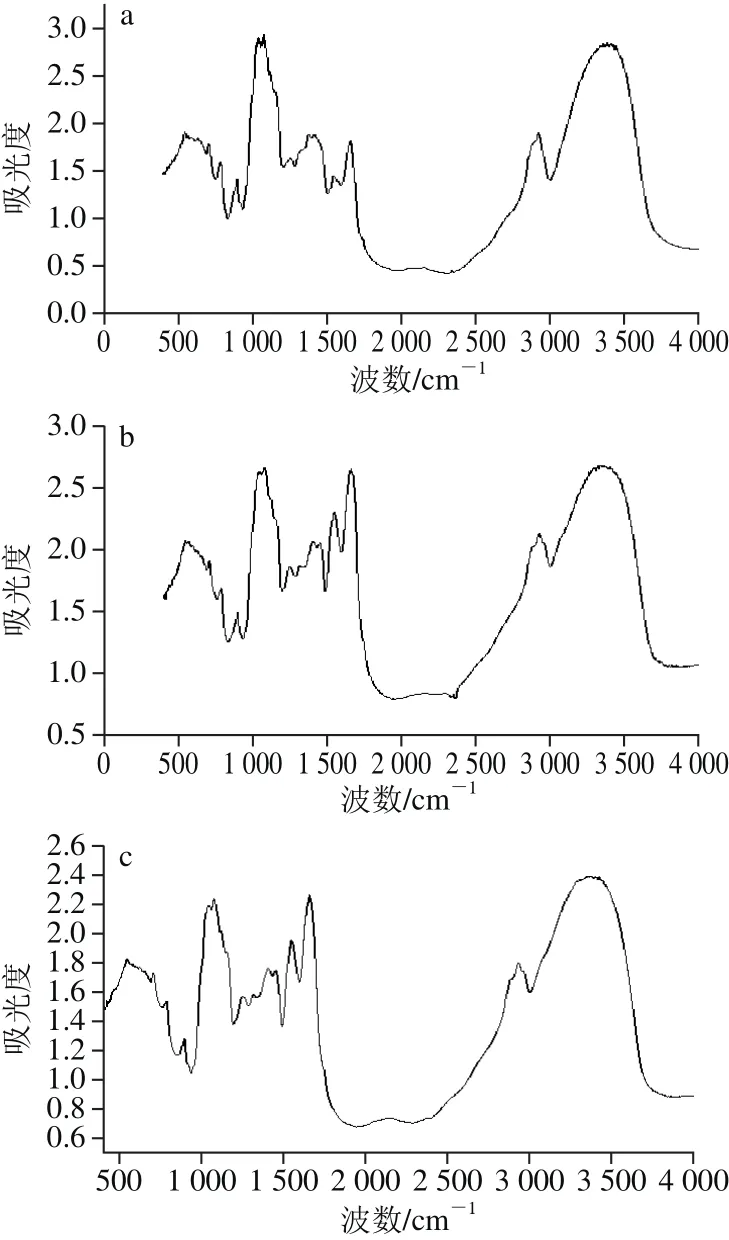
图1 人乳(a)、牛乳(b)和羊乳(c)乳清蛋白二级结构的红外光谱图Fig. 1 Infrared spectra of whey proteins of human, bovine and goat milks
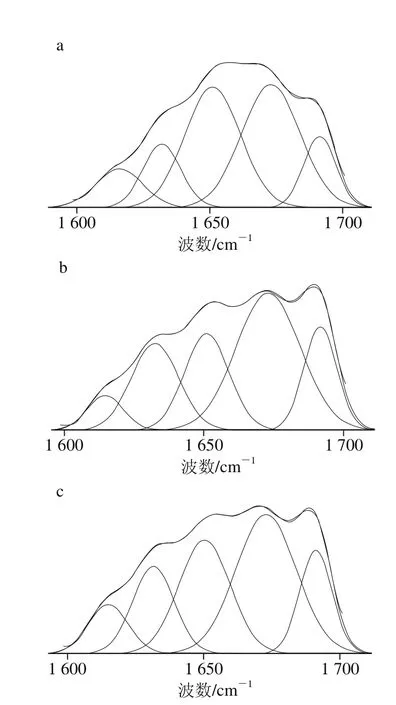
图2 人乳(a)、牛乳(b)和羊乳(c)酰胺Ⅰ带拟合效果Fig. 2 Curve-fitting results of amides I band in infrared spectra of whey proteins in human, bovine and goat milks

表5 酰胺Ⅰ带分析结果Table 5 Secondary structure estimation based on amide I band
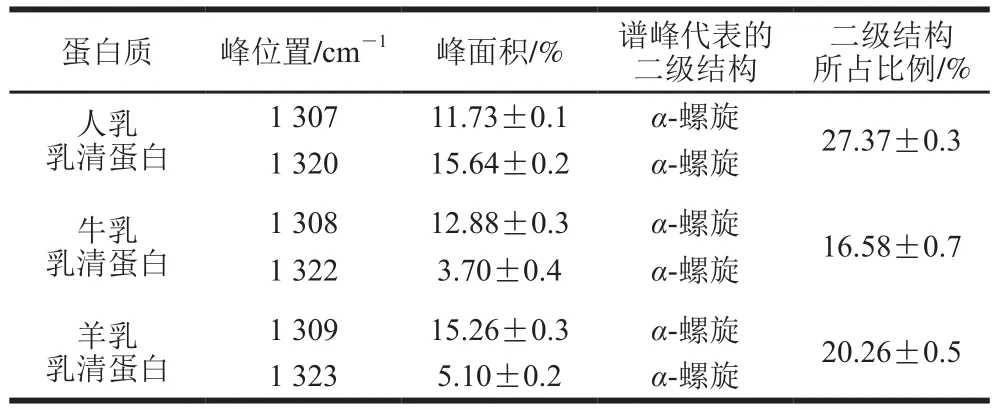
表6 酰胺Ⅲ带对α-螺旋的分析结果Table 6 Analysis of α- helix based on amide III band
β-转角是最常见的数量最大的转角,一个β-转角包含4 个连续的氨基酸残基,其中VIa1、VIa2和VIb类的第i+2个残基为脯氨酸,另外转角Ⅱ的第3个残基往往是甘氨酸[31-32]。研究表明,甘氨酸和脯氨酸的存在,不利于α-螺旋的稳定[33]。因此,较多的β-转角会一定程度上影响α-螺旋所占比例,进而间接影响人体的吸收利用。如表5所示,人乳中α-螺旋比例最高β-转角比例最少,而牛乳完全相反,羊乳介于两者之间,表明羊乳更利于人体的吸收利用。同时,根据表1氨基酸组分的分析可知,牛、羊乳中甘氨酸含量与人乳相近,脯氨酸含量较高,这也与分析结果相印证。
3 结 论
通过分析3 种乳中的氨基酸组成以及上述几种氨基酸营养评价方法结果可知,3 种乳中均氨基酸含量丰富,种类齐全,富含17 种氨基酸,EAA/TAA均与FAO/WHO提出的EAA/TAA值为0.400相接近。FAO/WHO模式贴近度人乳最高为0.944 5,羊乳次之为0.925 0,全鸡蛋蛋白模式贴近度羊乳最高为0.919 7。3 种乳中不同EAA的RAA和RC值大多在1附近,说明营养条件满足人体需要,其中羊乳SRC均为最高。以上结果均表明羊乳相对牛乳来说,营养价值更高,更利于人体吸收。
以酰胺Ⅰ带与酰胺Ⅲ带对几种不同二级结构的分区结果可知,人乳乳清蛋白中α-螺旋含量最高,为27.37%,羊乳次之为20.26%,而人乳乳清蛋白中β-转角与β-折叠含量均为最少,羊乳次之。上述结果表明,羊乳乳清蛋白与人乳乳清蛋白二级结构更为贴近,在一定程度上会利于人体的吸收。综合氨基酸组成分析、氨基酸营养评价以及乳清蛋白二级结构的分析可知,羊乳是相对于牛乳更好的人乳替代品和婴幼儿功能食品原料。
目前,蛋白质的二级研究已较为普遍,但对于乳清蛋白的二级结构研究较少。本次实验通过对3 种乳乳清部分氨基酸组成分析与乳清蛋白二级结构的分析相结合,探究3 种乳的异同,以期能够为其他相关课题研究人员提供数据参考,同时也为日后更深入的研究探索提供理论依据。
[1] KLEIN K, BANCHER-TODESCA D, GRA T, et al. Concentration of free amino acids in human milk of women with gestational diabetes mellitus and healthy women[J]. Breastfeeding Medicine, 2013, 8(1):111-115. DOI:10.1089/bfm.2011.0155.
[2] KOLETZKO B, BEYER J, BRANDS B, et al. Early influences of nutrition on postnatal growth[J]. Nestle Nutrition Institute Workshop Series, 2013, 71: 11-27. DOI:10.1159/000342533.
[3] ELISA C, FRANCESCA G, IOLANDA M, et al. Enteral nutrition and infections: the role of human milk[J]. Early Human Development,2014, 90: 51-59. DOI:10.1016/S0378-3782(14)70019-2.
[4] PARK Y W, HAENLEIN G F W. Handbook of non-bovine mammals[M]. Oxford: Blackwell Publishing Professional, 2006:24-46. DOI:10.1002/9780470999738.
[5] MESTAWET T A, GIRMA A, ADNOY T, et al. Milk production,composition and variation at different lactation stages of four goat breeds in Ethiopia[J]. Small Ruminant Reserch, 2012, 105(1/2/3):176-181. DOI:10.1016/j.smallrumres.2011.11.014.
[6] YANG Y X, BU D P, ZHAO X W, et al. Proteomic analysis of cow, yak, buffalo, goat and camel milk whey proteins: quantitative differential expression patterns[J]. Journal of Proteome Research,2013, 12(4): 1660-1667. DOI:10.1021/pr301001m.
[7] MILANI F X, WENDORFF W L. Goat and sheep milk products in the United States (USA)[J]. Small Ruminant Research, 2011, 101: 134-139.DOI:10.1016/j.smallrumres.2011.09.033.
[8] 陈静廷, 马露, 杨晋辉, 等. 差异蛋白质组学在乳蛋白研究中的应用进展[J]. 动物营养学报, 2013, 25(8): 1683-1688. DOI:10.3969/j.issn.1006-267x.2013.08.004.
[9] TORAL P G, CHILLIARD Y, ROUEL J, et al. Comarison of the nutritional regulation of milk fat secretion and composition in cows and goats[J]. Journal of Dairy Science, 2015, 98(10): 7277-7279.DOI:10.3168/jds.2015-9649.
[10] AARTI S. Efficacy of fermented milk and whey proteins in Helicobacter pylori eradication: a review[J]. World Journal of Gastroenterology, 2014,20(3): 724-737. DOI:10.3748/WJG.v20.i3.724.
[11] WOLFGANG J, FREDI S. HPLC-MS/MS-detection of caseins and whey proteins in meat products[J]. Procedia Food Science, 2015, 5:129-132. DOI:10.1016/j.profoo.2015.09.037.
[12] MARIE C, ALAIN R, CHRISTELLE L, et al. Aggregated whey proteins and trace of caseins synergistically improve the heat stability of whey protein-rich emulsions[J]. Food Hydrocolloids, 2016, 61: 487-495. DOI:10.1016/j.foodhyd.2016.06.009.
[13] 于方园, 岳喜庆, 武俊瑞, 等. 氨基酸分析仪检测牛乳中掺入的大豆蛋白[J]. 食品科学, 2014, 35(22): 238-242. DOI:10.7506/spkx1002-6630-201422046.
[14] ZENG Y H, CAI W S, SHAO X G. Quantitative analysis of 17 amino acids in tobacco leaves using an amino acid analyzer and chemometric resolution[J]. Journal of Separation Science, 2015, 38(12): 2053-2058.DOI:10.1002/jssc.201500090.
[15] YANG M, CAO X Y, WU R N, et al. Comparative proteomic exploration of whey proteins in human and bovine colostrum and mature milk using iTRAQ-coupled LC-MS/MS[J]. International Journal of Food Sciences and Nutrition, 2017, 20: 1-11. DOI:10.1080/09637486.2017.1279129.
[16] 冯志强, 周芳梅, 黄永连, 等. 全自动氨基酸分析仪鉴别不同种类酱油中氨基酸的分析研究[J]. 中国食品添加剂, 2013(5): 198-205.DOI:10.3969/j.issn.1006-2513.2013.05.026.
[17] YAN P M, WANG Q, YAN X Y, et al. Evaluation of amino acid and vitamin B2and E composition of genetically modified antidwarf mosaic maize by automatic amino acid analyzer and HPLC[J].Asian Journal of Chemistry, 2013, 25(6): 3525-3526. DOI:10.14233/ajchem.2013.13815.
[18] 宁健婷, 岳喜庆, 武俊瑞, 等. 梅花鹿初乳主要营养成分及氨基酸组成分析[J]. 食品科学, 2015, 36(6): 173-177. DOI:10.7506/spkx1002-6630-201506032.
[19] FAO/WHO. Energy and protein requirements[C]//FAO Nutrition Meeting Report Series, 1973: 52-63.
[20] FAO/WHO. Protein quality evaluation in human diets[R]. Rome: Food and Agriculture Organization, 1991.
[21] 张元福, 徐怡庄, 翁诗甫, 等. 傅立叶变换中红外光纤光谱技术及其应用[J]. 现代仪器, 2009(5): 27-29; 37. DOI:10.3969/j.issn.1672-7916.2009.05.005.
[22] UGUR K, SEVGI K, HULYA U. Effects of glutamine on wound healing[J]. International Wound Journal, 2013, 12(3): 280-284.DOI:10.1111/iwj.12098.
[23] WONG W. Red cells need leucine for hemoglobin[J]. Science, 2015,348: 298-298. DOI:10.1126/science.348.6232.298-t.
[24] 周丹蓉, 廖汝玉, 方智振, 等. 李果实蛋白质的营养评价与聚类分析[J].福建果树, 2012(4): 1-6. DOI:10.3969/j.issn.1004-6089.2012.04.001.
[25] 王咏星, 钱龙, 吕艳, 等. 白斑狗鱼肌肉氨基酸含量测定及其营养评价[J]. 食品科学, 2010, 31(11): 238-240.
[26] MASAYASU M, TATSUHIKO N, KENTARO U, et al. Development of a split SNAP-tag protein complementation assay for visualization of protein-protein interactions in living cells[J]. The Analyst, 2012,137(20): 4760-4765. DOI:10.1039/C2AN35762C.
[27] 谢孟峡, 刘媛. 红外光谱酰胺Ⅲ带用于蛋白质二级结构的测定研究[J]. 高等学校化学学报, 2003(2): 226-231. DOI:10.3321/j.issn:0251-0790.2003.02.007.
[28] DANIEL J P, MARK R P. Alpha-helix mimetics: progress toward effective modulation of protein-protein complexes[J]. Frontiers in Drug Design & Discovery, 2012, 3: 5-44. DOI:10.2174/978160805201 110703010005.
[29] YANG J, MA Y Q, PAGE R C, et al. Structure of an integrin alphaIIb beta3 transmembrane-cytoplasmic heterocomplex provides insight into integrin activation[J]. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(42): 17729-17734. DOI:10.1073/pnas.0909589106.
[30] ZHU J, LUO B H, BARTH P, et al. The structure of a receptor with two associating transmembrane domains on the cell surface: integrin alphaIIb beta3[J]. Mol Cell, 2009, 34: 234-249. DOI:10.1016/j.molcel.2009.02.022.
[31] KAUR K S, RAGHAVA G P. A neural network method for prediction of beta-turn types in proteins using evolutionary information[J]. Bioinformatics, 2004, 16: 2751-2758. DOI:10.1093/bioinformatics/bth322.
[32] KIRSCHNER A, FRISHMAN D. Prediction of β-turns and β-turn types by a novel bidirectional Elman-type recurrent neural network with multiple output layers[J]. Gene, 2008, 422: 22-29. DOI:10.1016/j.gene.2008.06.008.
[33] 王树青, 刘红, 杜奇石, 等. 依据氨基酸残基的相关性预测蛋白质的结构类型[J]. 物理化学学报, 2004, 20(5): 498-502. DOI:10.3866/PKU.WHXB20040511.
Comparative Study of Amino Acid Composition and Secondary Structure of Whey Proteins in Human Milk,Cow Milk, and Goat Milk
ZHANG Xitong1, GUAN Boyuan1, KONG Fanhua1, LIU Biao2, TAO Dongbing1, WU Junrui1,*, YUE Xiqing1,*
(1. College of Food, Shenyang Agricultural University, Shenyang 110866, China;2. Inner Mongolia Yili Industrial Co. Ltd., Hohhot 010050, China)
This study adopted an automatic amino acid analyzer to measure the amino acid composition of whey proteins in human milk, bovine milk and goat milk. The nutritional value was comprehensively evaluated by the fuzzy recognition method based on ratio coefficient of amino acid (RCAA) and score of ratio coefficient amino acid ratio coefficient score(SRCAA). The secondary structure of whey proteins was measured based on the amide I and amide III bands in Fourier transform infrared (FTIR) spectra. Results showed that the ratio of essential amino acids to total amino acids (EAA/TAA) in goat whey proteins was 0.450, showing a 0.919 7 and 0.925 0 similarity to whole egg protein and United Nations Food and Agriculture Organization/World Health Organization (FAO/WHO) reference protein, respectively, and the SRCAA values were 68.47 and 76.56, respectively in the two patterns indicating high nutritional value. The proportion of α-helix structure in goat whey proteins was 20.26%, which is much closer to that of human whey proteins (27.37%) indicating greater ease of absorption by the human body. Therefore, goat milk is a better source of functional foods for infants and young children.
amino acid; nutritional evaluation; whey protein; Fourier transform infrared (FTIR); secondary structure
10.7506/spkx1002-6630-201724017
TS252.51
A
1002-6630(2017)24-0107-06
张熙桐, 关博元, 孔繁华, 等. 人乳、牛乳、羊乳中乳清部分氨基酸组成及乳清蛋白中蛋白质二级结构的对比[J]. 食品科学, 2017, 38(24): 107-112.
10.7506/spkx1002-6630-201724017. http://www.spkx.net.cn
ZHANG Xitong, GUAN Boyuan, KONG Fanhua, et al. Comparative study of amino acid composition and secondary structure of whey proteins in human milk, cow milk, and goat milk[J]. Food Science, 2017, 38(24)∶ 107-112. (in Chinese with English abstract) DOI∶10.7506/spkx1002-6630-201724017. http∶//www.spkx.net.cn
2017-01-12
“十二五”农村领域国家科技计划课题(2013BAD18B03-02)
张熙桐(1993—),男,硕士研究生,研究方向为动物性食品加工。E-mail:546442323@qq.com
*通信作者:武俊瑞(1977—),男,副教授,博士,研究方向为动物性食品加工。E-mail:junruiwu@126.com
岳喜庆(1966—),男,教授,博士,研究方向为动物性食品加工。E-mail:yxqsyau@126.com
