乳酸菌细菌素Lac-B23对荧光假单胞菌及其生物膜的抑制作用
2017-12-11刘文婷易华西章检明张兰威何胜华
刘文婷,王 伟,易华西*,章检明,韩 雪,张兰威,何胜华
乳酸菌细菌素Lac-B23对荧光假单胞菌及其生物膜的抑制作用
刘文婷1,王 伟1,易华西2,*,章检明1,韩 雪1,张兰威2,何胜华1
(1.哈尔滨工业大学化工与化学学院,黑龙江 哈尔滨 150090;2.中国海洋大学食品科学与工程学院,山东 青岛 266100)
细菌素Lac-B23是由植物乳杆菌Lactobacillus plantarum B23产生的具有广谱抑菌活性的小分子肽,对嗜冷腐败菌荧光假单胞菌具有明显的抑制作用。细菌素Lac-B23对荧光假单胞菌的抑菌作用研究结果表明,细菌素Lac-B23可以使荧光假单胞菌胞内无机磷和三磷酸腺苷(adenosine triphosphate,ATP)发生不同程度的泄漏;细菌素Lac-B23首先破坏荧光假单胞菌的细胞外膜,然后消散了荧光假单胞菌细胞内膜跨膜电位(Δφ)和pH值梯度(ΔpH),细胞外膜渗透性增强,使细胞膜形成孔道。扫描电子显微镜和透射电子显微镜结果表明荧光假单胞菌细胞形态完整性发生改变,细胞膜破坏,从而导致细胞死亡。细菌素Lac-B23能够破坏荧光假单胞菌生物膜中的网络结构,对生物膜具有明显的破坏作用。
乳酸菌细菌素;荧光假单胞菌;生物膜;抑制
为保证食品的安全性和延长食品的货架期,通常向食品中添加化学防腐剂来抑制或杀死病原菌。但是,长时间的使用化学防腐剂可能会对消费者的健康产生负面影响。随着消费者对食品质量与安全意识的不断增强,食品行业正在积极寻找可以替代人工合成的化学防腐剂。近年来,乳酸菌细菌素引起了人们广泛的关注,不仅可以作为食品生物防腐剂应用于食品加工与贮藏中,而且有希望成为抗生素的替代品[1]。乳酸菌细菌素作为生物防腐剂,有望实现最少处理工序来提高食品质量和安全性。Nisin是第一个商业化生产的细菌素,但Nisin存在抗菌谱窄、稳定性差等缺点,限制了其广泛应用,寻找广谱细菌素已成为该领域的研究热点之一[2]。
为了更好地开发和利用乳酸菌细菌素控制食源性病原菌和腐败菌[3],需要深入了解细菌素的作用机制和抗菌特性[4]。目前大多数细菌素抑菌机理的研究主要是针对革兰氏阳性细菌,对革兰氏阴性细菌抑菌机理的研究较少,可能是细菌素对革兰氏阴性细菌、霉菌和酵母没有抑制作用或作用效果不明显[5]。细菌素作用机制与作用细菌的种类、生长条件有关[6]。基于作用机制的方法可以提高杀菌效果,抑制细胞生长[7]。大多数乳酸菌细菌素的主要机制是形成细胞膜孔道,导致了细胞质膜电位的变化[8]。也有一些学者认为,当细菌素结合于目标细菌的细胞膜表面蛋白质受体时,这种机制就会被引发,受体蛋白质对细菌素有结合作用[9-10]。目前,细菌的作用机理被认为主要存在2 种模型。第1种是“barrel-stave”模型(“桶-板”模型),细菌素疏水部分与细胞膜的疏水核心互相作用,导致细胞膜表面上孔道的形成[11]。比如植物乳杆菌Lactobacillus plantarum K25产生的细菌素plantaricin K25作用于蜡样芽孢杆菌时,可定位于靶向细菌细胞上,在细胞质膜上形成孔洞[12];第2种机制是“carpet”模型(“地毯”模型),细菌素不插入到质膜疏水核心,使细胞膜崩解而不造成孔道的形成。比如细菌素PlnEF抑制植物乳杆菌L. plantarum pl2的生长繁殖的作用模式主要是诱导使细胞膜的通透性增大导致电解质流出,PlnEF的积累引起细胞膜损伤[13]。Goh等[14]利用荧光法发现细菌素会引起指示菌细胞膜的破裂。本课题组前期分离获得了一株产广谱细菌素的植物乳杆菌L. plantarum B23,并对其发酵合成进行了研究。嗜冷菌是食品在低温贮藏下的主要腐败微生物,可以产生耐热的蛋白酶或脂肪酶,在食品加工设备及管道以生物膜形式存在,使得对加热、消毒等杀菌方式的耐受性增强,导致食品腐败变质。目前关于利用乳酸菌细菌素抑制嗜冷菌及其生物膜形成的研究报道鲜为少见。本实验以典型嗜冷菌荧光假单胞菌为作用对象,以细胞内外无机磷浓度、三磷酸腺苷(adenosine triphosphate,ATP)浓度、细胞外膜渗透性、细胞跨膜电位、pH值梯度、细胞外膜完整性以及细胞形态为指标,从细胞水平上研究了细菌素Lac-B23对荧光假单胞菌及其生物膜的抑菌作用,为细菌素Lac-B23在食品中的应用提供一定的理论支持。
1 材料与方法
1.1 材料与试剂
指示菌荧光假单胞菌(Pseudomonas fluorescens,CGMCC 1.1802)购于中国工业微生物菌种保藏中心,分离自预过滤池;植物乳杆菌L. plantarum B23由本实验室分离自青海耗牛乳(GenBank登录号为KC292491.1)。细菌素Lac-B23由L. plantarum B23的发酵液经SP Sepherose Fast Flow阳离子交换柱层析和Superdex Peptide 10/300 GL分子筛进行分离纯化。细菌素Lac-B23的最终纯化倍数为2 187.5,质量浓度为0.234 mg/mL。
荧光探针BCECF-AM、DiSC3(5) 美国Sigma公司;缬氨霉素、尼日利亚菌素 美国Merk Millipore公司;萘氨基苯(N-phenyl-1-naphthylamine,NPN)阿拉丁试剂(上海)有限公司;ATP含量测定盒、磷(Pi)测试盒 南京建成生物研究所;4-羟乙基哌嗪乙磺酸(4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid,HEPES) 北京Coolaber试剂公司。
1.2 仪器与设备
F-2700荧光分光光度计、H-7650透射电子显微镜(transmission electron microscope,TEM) 日本日立公司;UV-5100紫外分光光度计 上海广谱仪器有限公司;扫描电子显微镜(scanning electron microscope,SEM)美国FEI公司。
1.3 方法
1.3.1 抑菌特性的测定
采用琼脂扩散法测定乳酸菌细菌素Lac-B23对荧光假单胞菌的抑菌活性。无菌条件下在琼脂培养基中放置5 个牛津杯,将半固体TSB培养基融化,待其冷却至50 ℃,加入荧光假单胞菌(接种量1%),将其倾倒到含牛津杯的琼脂平皿中,冷却25 min,将牛津杯取出,在形成的孔中加入100 μL发酵上清液和不同纯化处理的乳酸菌细菌素Lac-B23溶液,28 ℃培养16 h,根据抑菌圈大小判断乳酸菌细菌素Lac-B23抑菌活性。
1.3.2 菌悬液的制备
将对数生长期的荧光假单胞细菌,6 000 r/min离心10 min,用缓冲液洗涤2 次后,重新悬浮在缓冲液中,制成108CFU/mL的菌悬液,不同缓冲液的制备如下:
缓冲液1:用于测定荧光假单胞菌细胞外膜渗透性的变化,用1 mol/L NaOH溶液调节含有NaN3(5 mmol/L)的HEPES(5 mmol/L)溶液pH值至7.0[15]。缓冲液2:用于测定胞内外无机磷和ATP浓度的变化,用1 mol/L NaOH溶液调节含有葡萄糖(10 mmol/L)的HEPES(2.5 mmol/L)溶液pH值至7.0。缓冲液3:用于测定细胞跨膜电位的变化(Δφ),用40%KOH溶液调节含0.6 mmol/L KCl 0.2%葡萄糖的HEPES(50 mmol/L)溶液pH值至7.0。缓冲液4:用于测定胞内外pH值梯度的变化(ΔpH),用1 mol/L NaOH溶液调节含有葡萄糖(10 mmol/L)Kpi缓冲液pH值至7.0。
1.3.3 细胞内外无机磷浓度的测定
吸取缓冲液2菌悬液,每份2 mL,静置90 min,每隔15 min取样,4 ℃、10 000 r/min离心7 min,吸取上清液测定细胞外无机磷的浓度;菌体细胞用1 mL、5 g/100 mL的三氯乙酸悬浮,-20 ℃冷冻过夜。解冻后,95 ℃温育10 min。10 000 r/min离心15 min,吸取上清液测定胞内无机磷浓度。用磷(Pi)测试盒比色法(磷钼酸法)对无机磷浓度进行测定。
1.3.4 细胞内外ATP浓度的测定
吸取缓冲液2菌悬液,每份2 mL,加入100 μL细菌素Lac-B23,静置90 min,每隔15 min取样,4℃、10 000 r/min离心7 min,吸取上清液用于测定细胞外ATP浓度;收集菌体用细胞破碎仪破碎,10 000 r/min离心7 min后,吸取上清液用ATP含量测定盒测定细胞内ATP浓度。
1.3.5 细胞外膜渗透性的测定
向1.82 mL缓冲液1菌悬液中加入100 μL细菌素,迅速加入终浓度分别为30、40、50、60 μmol/L的荧光探针NPN,检测荧光强度,确定荧光探针NPN的最适浓度。另取2 份1.82mL缓冲液1菌悬液,分别加入100 μL和50 μL细菌素,迅速加入最适浓度的荧光探针NPN,检测荧光强度变化。阴性对照:向1.82 mL菌悬液加入100 μL ddH2O,迅速加入最适浓度的荧光探针NPN。利用荧光分光光度计测定荧光强度,使用全扫描模式进行扫描,激发波长350.0 nm,发射波长420.0 nm,扫描时间12 min。
1.3.6 细胞跨膜电位(Δφ)的测定
Δφ用荧光探针DiSC3(5)进行测定。使用缓冲液3菌悬液,首先加入5 μmol/L缬氨霉素,其目的是为了消除ΔpH对Δφ的影响。作用30 min,加入5 μmol/L DiSC3(5)作用10min后,加入5 μmol/L缬氨霉素或细菌素Lac-B23,立即用荧光分光光度计进行测定,全扫描模式,扫描时间10 min,激发波长622 nm,发射波长670 nm。
1.3.7 胞内外pH值梯度(ΔpH)的测定
ΔpH用荧光探针BCECF-AM进行测定。使用缓冲液4菌悬液,取菌悬液2 mL加入10 μL BCECF-AM荧光探针,室温下静置5 min。进行酸应激[16],加入20~30 μL 0.5 mol/L HCl溶液充分旋涡混合,使探针定位于细胞内。12 000 r/min离心1 min后,可观察到黄色沉淀。之后,加入1 mL缓冲液洗涤,洗涤4 次后,用2 mL缓冲液悬浮细菌。加入5 μmol/L缬氨霉素,作用30 min,加入5 μmol/L尼日利亚菌素或细菌素Lac-B23,用荧光分光光度计进行测定。
1.3.8 SEM与TEM分析
将荧光假单胞菌28 ℃培养12 h,菌悬液在4 ℃8 000 r/min离心10 min。菌体细胞重新悬浮于新鲜的培养基中,用100 μL细菌素Lac-B23处理1 h。SEM与TEM处理参照Lü Xin等[17]的方法。细胞用磷酸缓冲液清洗2 次后,用2.5%戊二醛-磷酸缓冲液重新悬浮固定,4 ℃过夜。磷酸缓冲液清洗固定的菌体3 次,每次10 min。用体积分数50%、70%、80%、90%的乙醇溶液进行梯度脱水,每次脱水10 min。用100%乙醇和100%丙酮分别处理20min。最后用乙酸异戊酯代替乙醇处理10 min,处理2 次后干燥,用SEM进行观察。
1.3.9 最佳成膜时间筛选
活化荧光假单胞菌2 次,将载玻片切成1 cm×1 cm大小,用无水乙醇灭菌,并辅以超声清洗,去除表面杂质后灭菌。将无菌载玻片置于12 孔板中,加入3 mL无菌TSB培养基,每孔以2%的接种量将对数生长期的荧光假单胞菌接入,并做3 个平行实验,28 ℃分别培养12、24、48 h。以培养12 h为例,其他操作与其相同。从孔板中取出载玻片,注意避免损伤已形成的生物膜,对照组加入2 mL磷酸缓冲液,实验组加入等量的细菌素,然后在28 ℃的培养箱中培养24 h。
1.3.10 结晶紫染色观察成膜情况
取出孔板中的载玻片,用蒸馏水或磷酸缓冲液洗掉生物膜上的杂质,然后将其干燥,在每个载玻片上滴1滴结晶紫,15 min后,用蒸馏水或磷酸缓冲液冲洗结晶紫并使其干燥。然后将干燥的载玻片置于显微镜下,在10 倍和40 倍显微镜下观察,然后对形成的生物膜情况进行拍照记录。
2 结果与分析
2.1 抑菌实验结果
以荧光假单胞菌为指示菌,利用琼脂扩散法分别对L. plantarum B23发酵上清液、SP Sepherose Fast Flow阳离子交换柱与Superdex Peptide 10/300 GL分子筛分离纯化的细菌素Lac-B23组分进行抑菌实验,结果见图1。发酵上清液显示出明显的抑菌活性,随着纯化倍数的增加,其抑菌活性也随之增加。

图1 细菌素Lac-B23的抑菌实验Fig. 1 Antibacterial activity of Lac-B23
2.2 细胞内外无机磷浓度的变化
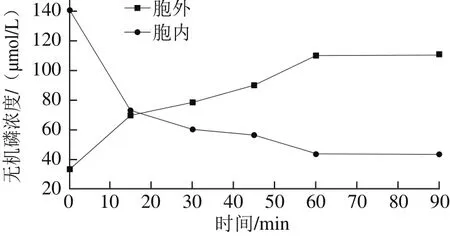
图2 细菌素Lac-B23对胞内外无机磷浓度的影响Fig. 2 Effect of Lac-B23 on intracellular inorganic phosphorus concentration
由图2可以看出,细菌素Lac-B23引起荧光假单胞细菌胞内无机磷浓度的大幅度下降,相应胞外无机磷浓度快速增加。无机磷在1h内降到较低水平,可见细菌素Lac-B23可以快速引起荧光假单胞菌株胞内物质的泄露。
2.3 细胞内外ATP浓度的变化
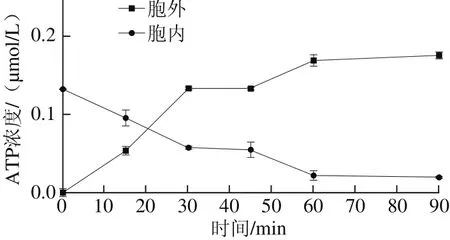
图3 细菌素Lac-B23对胞内外ATP浓度的影响Fig. 3 Effect of Lac-B23 on intracellular ATP concentration
如图3所示,经细菌素Lac-B23作用后的荧光假单胞菌细胞内外ATP与无机磷浓度变化趋势几乎一致。在15 min内ATP浓度急剧下降。1 h后,ATP浓度几乎降到最低,浓度几乎不再改变,验证了细菌素Lac-B23对荧光假单胞菌细胞膜的破坏作用。
2.4 细胞外膜渗透性的变化
利用NPN摄入实验检测细菌素破坏革兰氏阴性细菌细胞外膜的能力[18]。首先确定发射波长和NPN的最佳浓度。如图4所示,固定激发波长为350.0 nm时,不同浓度的NPN溶液均显示发射波长为420.0 nm时荧光强度最高。因此确定实验条件为全扫描模式,激发波长为350.0 nm,发射波长为420.0 nm。当NPN浓度为50 μmol/L时,荧光强度最强。同时也显示并不是NPN浓度越高,荧光强度越强。其原因可能是NPN在细胞疏水表面达到饱和状态时,其荧光强度不再增加。但当NPN浓度为50 μmol/L时,超过了有效测量范围,所以选择40 μmol/L NPN-丙酮溶液作为检测细菌素对细胞外膜渗透性变化的最终浓度。

图4 不同浓度NPN所对应的荧光强度Fig. 4 Fluorescence intensity corresponding to different concentrations of NPN
在亲水环境中,NPN分子荧光强度低,当它进入疏水性环境,如生物膜,荧光强度迅速升高。通常情况下,NPN被革兰氏阴性细菌细胞外膜上的脂多糖层隔离在外,但是当细胞外膜的结构发生改变后,NPN就可以渗透进入细胞,定位于细胞外膜的疏水环境,NPN分子作为一个典型的能够研究生物膜特性的灵敏度较高的荧光探针分子被广泛运用于革兰氏阴性菌细胞外膜渗透性的测定。庆大霉素是一种氨基糖苷类抗生素,主要通过能量依赖性摄取阶段(EDPⅠ和EDPⅡ)进行转运,从而控制细菌蛋白质的合成。NaN3是一种能量抑制剂与KCN的作用相似,可以抑制EDPⅠ和EDPⅡ这2 个阶段。Loh等[15]进行庆大霉素的NPN渗透性实验,结果表明当缓冲液中加入NaN3可以有效抑制庆大霉素对铜绿假单胞菌的破坏作用,使NPN荧光强度保持平稳。然而当细菌素Lac-B23作用于荧光假单胞菌时,缓冲液中加入NaN3并没有使荧光强度保持平稳,而是逐步下降,说明细菌素的作用机理与抗生素的作用不同,细菌素通过破坏细胞膜而达到抑菌的效果。如图5所示,阴性对照有较低的荧光强度,因为此时荧光假单胞菌的细胞外膜处于完整的状态。将100 μL细菌素Lac-B23加到细胞悬浮液后,荧光强度迅速增加,表明细菌素Lac-B23可以迅速破坏荧光假单胞的细胞外膜的脂多糖结构,导致荧光强度的急剧增加。之后荧光强度逐渐下降,说明细菌素Lac-B23在破坏细胞外膜后,可能进一步破坏了细胞内膜导致,细胞部分裂解,从而使NPN无法定植在细胞外膜的疏水环境中,导致荧光强度下降。当细菌素Lac-B23的加入量减少一半,荧光强度有所降低,说明细菌素浓度会影响抑菌效果。
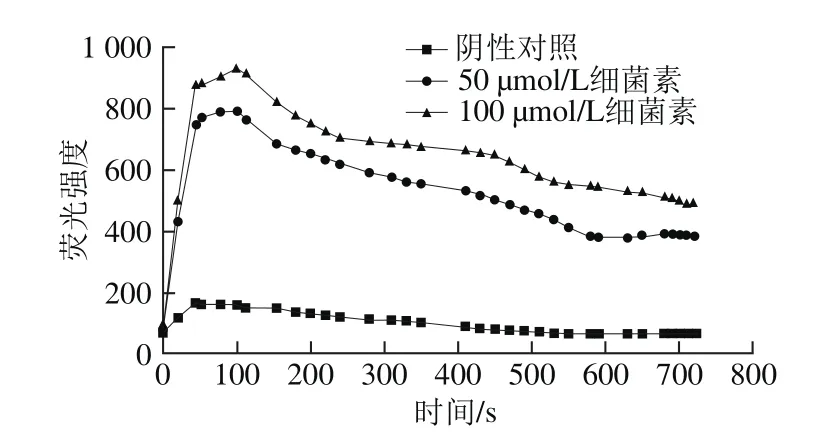
图5 细菌素Lac-B23对细胞外膜渗透性的影响Fig. 5 Effect of Lac-B23 on extracellular membrane permeability
2.5 细胞跨膜电位(Δφ)的变化

图6 细菌素Lac-B23对细胞跨膜电位的影响Fig. 6 Effect of Lac-B23 on transmembrane potential
如果细胞膜受到破坏,膜电势将消散,DiSC3(5)释放到缓冲液中,可引起荧光量上升[19-20]。如图6所示,K+/H+离子交换剂尼日利亚菌素(5 μmol/L)可以维持最大的Δφ,K+离子载体缬氨霉素(5 μmol/L)作为阳性对照,可以完全破坏Δφ。加入100 μL的细菌素Lac-B23后,荧光强度迅速增加,说明细菌素Lac-B23迅速破坏了细胞膜,膜电势消散。将细菌素Lac-B23的加入量减少一半时,总体的趋势是一致的,但荧光强度下降了,再次证明细菌素的浓度会影响对荧光假单胞菌的破坏程度。
2.6 胞内外pH值梯度(ΔpH)的变化

图7 细菌素Lac-B23对细胞ΔpH的影响Fig. 7 Effect of Lac-B23 on ΔpH
BCECF-AM可以作为一种荧光探针监测跨膜pH值的变化[19-20]。如图7所示,K+离子载体缬氨霉素(5 μmol/L)将ΔpH转化成最大ΔpH,K+/H+离子交换剂尼日利亚菌素(5 μmol/L)作为阳性对照,可迅速破坏胞内外ΔpH。加入100 μL细菌素Lac-B23后,荧光强度逐渐增加,说明细菌素Lac-B23破坏了细胞膜,导致跨膜pH值的变化。但这种变化相比较细菌素对膜电势的变化而言是逐步变化的。将细菌素Lac-B23的加入量减少一半时,总体的趋势是一致的,但荧光强度仍然下降,表明不同细菌素浓度会影响荧光假单胞菌的破坏程度。
2.7 SEM与TEM分析
由图8A可以看出,正常的荧光假单胞菌具有完整的细胞膜结构。从图8B可以看出,当细菌素Lac-B23作用后,荧光假单胞菌细胞膜上有多个孔道形成和胞内物质收缩,细胞内的物质泄漏到细胞外,细菌素Lac-B23可能使细胞膜形成孔道,导致荧光假单胞菌死亡;从图9可以看出,经细菌素Lac-B23作用后,有的细胞膜发生破碎。因此当细菌素Lac-B23作用后,荧光假单胞菌的细胞变形、细胞膜上孔道形成和细胞渗透性增大与其他报道的细菌素相似,例如细菌素LXA[21]和细菌素L10[22]。
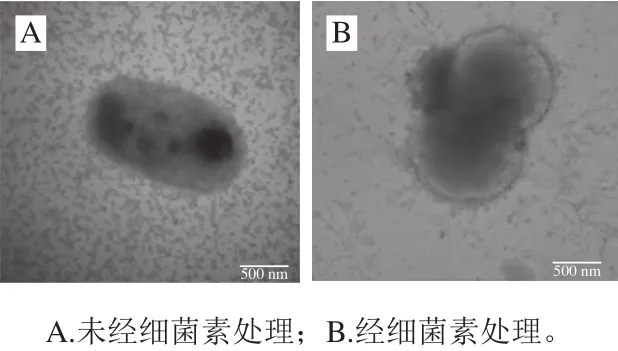
图8 荧光假单胞菌TEM图Fig. 8 TEM observation of Pseudomonas fluorescens

图9 荧光假单胞菌SEM图Fig. 9 SEM observation of Pseudomonas fluorescens
2.8 荧光显微镜观察生物膜形态结果
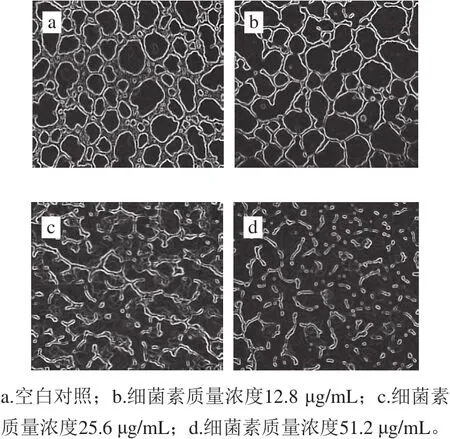
图10 不同质量浓度Lac-B23对荧光假单胞菌生物膜的作用Fig. 10 Effect of Lac-B23 on biofilm formed by Pseudomonas fluorescens
为进一步研究细菌素对生物膜的影响,观察生物膜形态的变化。如图10所示,对照组的生物膜在24h形成后具有三维网络结构,更为规则和平滑,具有蛛网覆盖的结构,并且形成的生物膜较清晰。结果与普通显微镜观察到的结果相似,当向生物膜中加入一定量的细菌素处理24h(实验组),观察到生物膜开始发生破裂,形态变化与对照组相比较为显著,生物膜被破碎成小块并发生完全崩解。
3 讨 论
嗜冷菌污染是现代乳制品加工冷藏中常见的问题[23]。目前原料乳中分离出的嗜冷菌多为荧光假单胞菌。本实验研究了乳酸菌细菌素对荧光假单胞菌及其生物膜的抑制作用。细菌素Lac-B23的作用导致了细胞内无机磷离子的泄露,释放ATP,消散了质子动力势能,增加了细胞膜的通透性,甚至导致细胞膜形成孔道,最终导致细胞的破碎。SEM和TEM分析表明细菌素Lac-B23引起了荧光假单胞菌的变形和细胞膜孔道的形成。这与目前关于其他细菌素的研究报道一致。Herranz等[24]运用DiSC3(5)和BCECF-AM发现Enterocin P可以消散L. monocytogenes的Δφ,但不能破坏其ΔpH。Vasilchenk等[25]使用荧光探针和原子显微镜表明由Enterococcus faeciun ICIS产生的一种新型细菌素的抑菌机制,该细菌素通过改变Escherichia coli和Listeria monocytogenes细胞膜的通透性而达到抑菌的效果。Brogdenk等[26]研究了源于Leuconostoc mesenteroides subsp.的Ⅱa类细菌素Mesenterocin 52A对单核细胞性李斯特菌的作用模式,并发现Mes 52A在细胞膜的不同位置相互作用,有或没有孔形成,暗示Mes 52A可能存在2 种不同的抑菌机制。Zhao Shengming等[27]研究表明细菌素Pantaricin JLA-9阻止Bacillus spp.氧化代谢和破坏细胞膜的完整性来发挥抑菌作用。Céliz等[28]为了确定prunin的抗菌潜力,用SEM和TEM来确定其作用模式。Rybal’Chenko等[29]通过SEM研究表明,Lactobacillus acidophilus产生的细菌素作用于Shigella flexneri会引起其种群和细胞的形态变化破坏其结构。Vijayakumar等[30]研究发现尽可能多地混合不同作用机制的细菌素可以获得强效天然抗菌混合物,以解决熟肉制品容易被L. monocytogenes污染的问题。本研究中同时也发现,细菌素Lac-B23会使荧光假单胞菌生物膜崩解,但其具体机制需要进一步深入研究。
[1] COTTER P D, ROSS R P, HILL C. Bacteriocins-a viable alternative to antibiotics[J]. Nature Reviews Microbiology, 2013, 11(2)∶ 95-105.DOI∶10.1038/nrmicro2937.
[2] SONG D F, ZHU M Y, GU Q. Purification and characterization of plantaricin ZJ5, a new bacteriocinproduced by Lactobacillus plantarum ZJ5[J]. PLoS ONE, 2014, 9(8)∶ 105-549. DOI∶10.1371/journal.pone.0105549.
[3] ZHOU K, WEI Z, LI P, et al. Mode of action of pentocin 31-1∶ an antilisteriabacteriocin produced by Lactobacillus pentosus from Chinese traditional ham[J]. Food Control, 2008, 19(8)∶ 817-822.DOI∶10.1016/j.foodcont.2007.08.008.
[4] LU X, YI L, DANG J, et al. Purification of novel bacteriocin produced by Lactobacillus coryniformis MXJ 32 for inhibiting bacterial foodborne pathogens including antibiotic-resistant microorganisms[J]. Food Control, 2014, 46∶ 264-271. DOI∶10.1016/j.foodcont.2014.05.028.
[5] GAO Y, LI D, SHENG Y, et al. Mode of action of sakacin C2 against Escherichia coli[J]. Food Control, 2011, 22(5)∶ 657-661. DOI∶10.1016/j.foodcont.2010.07.010.
[6] PARADA J L, CARON C R, MEDEIROS A B P, et al. Bacteriocins fromlactic acid bacteria∶ purification, properties and use as biopreservatives[J]. Brazilian Archives of Biology and Technology,2007, 50(3)∶ 521-542. DOI∶10.1590/S1516-89132007000300018.
[7] CINTAS L M, CASAUS M P, HERRANZ C, et al. Review∶bacteriocinsof lactic acid bacteria[J]. Food Science and Technology International, 2001, 7(4)∶ 281-305. DOI∶10.1106/R8DE-P6HU-CLXP-5RYT.
[8] GHRAIRI T, CHAFTAR N, HANI K, et al. Bacteriocins∶ recent advances and opportunities[M]//Progress in Food Preservation. 2012∶485-511. DOI∶10.1002/9781119962045.ch23.
[9] CHEN Y, SHAPIRA R, EISENSTEIN M, et al. Functional characterization of pediocin PA-1 binding to liposomes in the absence of a protein receptor and its relationship to a predicted tertiary structure[J]. Applied and Environmental Microbiology, 1997, 63(2)∶524-531.
[10] JACK R W, TAGG J R, RAY B. Bacteriocins of Gram-positive bacteria[J]. Microbiological Reviews, 1995, 59(2)∶ 171-200.
[11] 刘文丽, 张兰威, 易华西, 等. Ⅱa类乳酸菌细菌素构效关系的研究进展[J]. 食品工业科技, 2013, 34(21)∶ 369-373. DOI∶10.13386/j.issn1002-0306.2013.21.033.
[12] LIM S W, KOSHY P, NONI A. Purification, characterization and mode of action of plantaricin K25 produced by Lactobacillus plantarum[J]. Food Control, 2016, 60∶ 430-439. DOI∶10.1016/j.foodcont.2015.08.010.
[13] ZHANG X, WANG Y, LIU L, et al. Two-peptide bacteriocin PlnEF causes cellmembrane damage to Lactobacillus plantarum[J].Biochimica et Biophysica Acta, 2012, 1858(2)∶ 274-280. DOI∶10.1016/j.bbamem.2015.11.018.
[14] GOH H F, PHILIP K. Isolation and mode of action of bacteriocin BacC1 produced by nonpathogenic Enterococcus faecium C1[J]. Dairy Science, 2015, 98(8)∶ 5080-5090. DOI∶10.3168/jds.2014-9240.
[15] LOH B, GRANT C, HANCOCK R E. Use of the fluorescent probe 1-N-phenylnaphthylamine to study the interactions of aminoglycoside antibiotics with the outer membrane of Pseudomonas aeruginosa[J].Antimicrobial Agents & Chemotherapy, 1984, 26(4)∶ 546-551.DOI∶10.1128/AAC.26.4.546.
[16] MOLENAAR D, ABEE T, KONINGSW N. Continuous measurement of the cytoplasmic pH in Lactococcus lactis with a fluorescent pH indicator[J]. Biochimica et Biophysica Acta, 1991, 1115(1)∶ 75-83.DOI∶10.1016/0304-4165(91)90014-8.
[17] XIN L, YI L, DANG J, et al. Purification of novel bacteriocin produced by Lactobacillus coryniformis MXJ 32 for inhibiting bacterial foodborne pathogens including antibiotic-resistant microorganisms[J]. Food Control, 2014, 46∶ 264-271. DOI∶10.1016/j.foodcont.2014.05.028.
[18] TANG H, ZHANG P, KIEFT T L, et al. Antibacterial action of a novel functionalized chitosan-arginine against Gram-negative bacteria[J]. Acta Biomaterialia, 2010, 6(7)∶ 2562-2571. DOI∶10.1016/j.actbio.2010.01.002.
[19] LIU H, ZHANG L W, YI H X, et al. Identification and characterization of plantaricin Q7, a novel plantaricin produced by Lactobacillus plantarum Q7[J]. LWT-Food Science and Technology, 2016, 71∶386-390. DOI∶10.1016/j.lwt.2016.04.009.
[20] LIU G, SONG Z, YANG X, et al. Antibacterial mechanism of bifidocin A, a novel broad-spectrum bacteriocin produced by Bifidobacterium animalis BB04[J]. Food Control, 2016, 62∶ 309-316.DOI∶10.1016/j.foodcont.2015.10.033.
[21] YI L, DANG J, ZHANG L, et al. Purification, characterization and bactericidal mechanism of a broad spectrum bacteriocin with antimicrobial activity against multidrug-resistant strains produced by Lactobacillus coryniformis XN8[J]. Food Control, 2016, 67∶ 53-62.DOI∶10.1016/j.foodcont.2016.02.008.
[22] MISHRA B, LEISHANGTHEM G D, GILL L, et al. A novel antimicrobial peptide derived from modified N-terminal domain of bovine lactoferrin∶ design, synthesis, activity against multidrugresistant bacteria and Candida[J]. Biochimica et Biophysica Acta-Biomembranes, 2013, 1828(2)∶ 677-686. DOI∶10.1016/j.bbamem.2012.09.021.
[23] 吕高婧, 刘艳玲, 徐洪军, 等. 冷藏原料乳中荧光假单胞茵的分离鉴定及其产蛋白酶特性研究[J]. 西北农林科技大学学报, 2013,41(11)∶ 146-153. DOI∶10.13207/j.cnki.jnwafu.2013.11.007.
[24] HERRANZ C, CHEN Y, CHUNG H J, et al. Enterocin P selectively dissipates the membrane potential of Enterococcus faecium T136[J].Applied & Environmental Microbiology, 2001, 67(4)∶ 1689-1692.DOI∶10.1128/AEM.67.4.1689-1692.2001.
[25] VASILCHENKO A S, ROGOZHIN E A, VALYSHEV A V.Purification of a novel baceriocin-like inhibitory substance produced by Enterococcus ICIS 8 and characterization of its mode of action[J].Microbial Drug Resistance, 2017, 23(4)∶ 447-456. DOI∶10.1089/mdr.2016.0069.
[26] BROGDEN K A. Antimicrobial peptides∶ pore formers or metabolic inhibitors in bacteria[J]. Nature Reviews Microbiology, 2005, 3(3)∶238-250. DOI∶10.1038/nrmicro1098.
[27] ZHAO S, HAN J, BIE X, et al. Purification and characterization of plantarium JLA-9∶ a novel bacteriocin against Bacillus spp. produced by Lactobacillus plantarium JLA-9 from Suan-Tsai, a traditional Chinese fermented cabbage[J]. Agricultural and Food Chemistry,2016, 64(13)∶ 2754-2764. DOI∶10.1021/acs.jafc.5b05717.
[28] CELIZ G, AUDISIO M C, DAZ M. Antimicrobial properties of prunin, a citric flavanoneglucoside, and its prunin 6”-O-lauroyl ester[J]. Journal of Applied Microbiology, 2010, 109(4)∶ 1450-1457.DOI∶10.1111/j.1365-2672.2010.04773.x.
[29] RYBAL’CHENKO O V, BONDARENKO V M, VERBITSKAIA N B.Ultrastructural changes in Shigella flexneri cells during interaction with bacteriocinogenic Lactobacillus acidophilus[J]. Zhurnal Mikrobiologii Epidemiologii I Immunobiologii, 2006(4)∶ 50-53.
[30] VIJAYAKUMAR P P, MURIANA P M. Inhibition of Listeria monocytogenes on ready-to-eat meats using bacteriocinmixtures based on mode-of-action[J]. Foods, 2017, 6(3)∶ 1-13. DOI∶10.3390/foods6030022.
Anti-Biofilm and Antimicrobial Activity of Bacteriocin Lac-B23 from Lactic Acid Bacteria against Pseudomonas fluorescens
LIU Wenting1, WANG Wei1, YI Huaxi2,*, ZHANG Jianming1, HAN Xue1, ZHANG Lanwei2, HE Shenghua1
(1. College of Chemical Engineering and Chemistry, Harbin Institute of Technology, Harbin 150090, China;2. School of Food Science and Engineering, Ocean University of China, Qingdao 266100, China)
The aim of this study was to elucidate the mode of action of a novel bacteriocin Lac-B23 from Lactobacillus plantarum B23, a small peptide with broad-spectrum antimicrobial activity, on Pseudomonas fluorescens. P. fluorescens was susceptible to bacteriocin Lac-B23 action, leading to the release of intracellular ATP and inorganic phosphate.Bacteriocin Lac-B23 first destroyed the extracellular membrane and then dissipated both transmembrane potential (Δφ)and transmembrane pH gradient (ΔpH), leading to the formation of channels in the cell membrane. Clear changes in the morphological integrity of P. fluorescens were observed under scanning electron microscopy (SEM) and transmission electron microscopy (TEM). The cell membrane was destroyed, leading to the death of cells. Bacteriocin Lac-B23 could affect the network structure of the biofilm produced by P. fluorescens and exhibited anti-biofilm activity.
lactic acid bacteria; bacteriocin; Pseudomonas fluorescens; biofilm; inhibition
DOI∶10.7506/spkx1002-6630-201724001
TS252.4
A
1002-6630(2017)24-0001-07
刘文婷, 王伟, 易华西, 等. 乳酸菌细菌素Lac-B23对荧光假单胞菌及其生物膜的抑制作用[J]. 食品科学, 2017, 38(24)∶1-7. DOI∶10.7506/spkx1002-6630-201724001. http∶//www.spkx.net.cn
LIU Wenting, WANG Wei, YI Huaxi, et al. Anti-biofilm and antimicrobial activity of bacteriocin Lac-B23 from lactic acid bacteria against Pseudomonas fluorescens[J]. Food Science, 2017, 38(24)∶ 1-7. (in Chinese with English abstract)
DOI∶10.7506/spkx1002-6630-201724001. http∶//www.spkx.net.cn
2017-04-26
国家自然科学基金面上项目(31571850;31771988);中国海洋大学“青年英才工程”项目(201712002)
刘文婷(1995—),女,硕士研究生,研究方向为乳品生物技术。E-mail:1280896605@qq.com
*通信作者:易华西(1976—),男,副教授,博士,研究方向为乳品科学。E-mail:yihx@ouc.edu.cn
