苹果酵素天然发酵过程中代谢产物的变化规律
2017-12-11杨小幸周家春陈启明马明月赵黎明
杨小幸,周家春,陈启明,秦 臻,马明月,赵黎明,*
苹果酵素天然发酵过程中代谢产物的变化规律
杨小幸1,周家春1,陈启明1,秦 臻1,马明月2,赵黎明1,*
(1.华东理工大学生物工程学院,华东理工大学发酵工业分离提取技术研发中心,生物反应器工程国家重点实验室,上海 200237;2.重庆邮电大学生物信息学院,重庆 400065)
为研究苹果酵素天然发酵过程中物质代谢变化,对天然发酵过程中pH值、总酸、有机酸(乳酸、醋酸、苹果酸)、糖类(蔗糖、葡萄糖、果糖)、乙醇、总酚含量、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除率的变化进行分析。结果表明,发酵过程中pH值从5.05降至3.88,总酸、乳酸含量呈不断上升趋势,乙酸质量分数由0.018%升至0.23%,苹果酸质量浓度在发酵前14 d由初值0.67 g/L上升至2.45 g/L后略微下降;葡萄糖、果糖质量浓度呈先升后降趋势,且二者均在发酵第21天达到最大值130.6、177.2 g/L,蔗糖质量浓度不断下降趋于0 g/L;乙醇在发酵14~21 d过程中产生,发酵4周后乙醇体积分数可达6.6%;总酚质量浓度与DPPH自由基清除率呈先升后降趋势,均在发酵第21天达到最大值为259.4 mg/L、90.9%。
苹果酵素;天然发酵;代谢物质;DPPH自由基清除率
近年来,随着人们保健意识的加强,酵素发酵饮料越来越受消费者欢迎。酵素是以植物、动物、菌类等为原料,经多种微生物发酵而产生的、富含多种生物活性成分的微生物发酵产品[1]。已有研究表明酵素具有解酒护肝、促进淋巴细胞增殖等作用[2-3]。酵素产品按生产工艺可分为群种发酵酵素和纯种发酵酵素[4]。群种发酵作为一种传统的发酵方式是将原料置于自然条件下利用原料自身所携带的微生物进行发酵,因此又称为天然发酵。与纯种发酵方式相比,天然发酵操作工艺简单,可较大程度地保留原料中的营养成分,在家庭酵素制作中得到广泛应用,多数酵素企业采用天然发酵方式制作酵素产品或将其作为酵素产品制作工艺的重要环节之一。天然酵素中的微生物主要有酵母菌、曲霉及乳酸菌[1],因此发酵周期的控制需要结合发酵过程中多种微生物的基质代谢与产物生成情况综合考虑。目前对酵素天然发酵过程的研究多集中在抗氧化性能变化[5-8]以及多糖的分离鉴定[9-11],对发酵过程中代谢产物变化的研究则相对较少。而原料自身利用程度、生成代谢物的种类产量是酵素产品质量指标的关键所在,也是判定发酵终点的主要依据。因此研究发酵过程中代谢物质的变化规律很有必要。
苹果含有糖类、蛋白质、有机酸、维生素及苹果多酚等营养成分,是日常生活中最常见、消费量最大的水果之一,也是日常饮食中外源性抗氧化物质的主要来源[12],Kris-Etherton等[13]研究表明富含抗氧化成分的食品在防治自由基引起的疾病方面具有重要的作用。因此选择苹果为原料,探究苹果酵素天然发酵过程中pH值、总酸、有机酸、糖类、总酚含量、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-trinitrophenylhydrazine,DPPH)自由基清除率的变化,以期为天然酵素产品发酵工艺的优化及其综合性开发提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
富士苹果、白砂糖(一级品) 市售;DPPH、福林-酚(均为分析纯)、没食子酸 阿拉丁化学试剂有限公司;标准品(蔗糖、葡萄糖、果糖、苹果酸、乳酸、乙酸) 美国Sigma公司;乙腈(色谱纯) 上海泰坦科技有限公司。
1.2 仪器与设备
CP214C电子天平 美国Ohaus公司;5810R大容量高速离心机 德国Eppendorf公司;UV-2000紫外分光光度计 尤尼克(上海)仪器有限公司;FE20精密pH计 瑞士Mettler-Toledo公司;高效液相色谱(high performance liquid chromatography,HPLC)系统(配有LC-10ADvp梯度泵、SPD-10Avp检测器、RID-10A检测器) 日本Shimadzu公司。
1.3 方法
1.3.1 苹果酵素的制备
先用自来水冲洗苹果表面数次,直至去除黏附在苹果表面的杂物,后用纯净水冲洗苹果表面并晾干。白砂糖用紫外灯辐照处理45 min,按苹果与白砂糖质量比2∶1将苹果和白砂糖加入到已灭菌的玻璃瓶中,封口,放在暗处,室温(10~20 ℃)发酵28 d。发酵过程中,分别在第2、5、8、11、14、21、28天取样。取样时先把玻璃瓶中的物料摇匀,后打开玻璃瓶下方阀门,使酵素液体流出,取得样品。将所取苹果酵素样品离心(4 000 r/min,10 min),待测。
1.3.2 pH值的测定
取离心后的不同发酵天数的苹果酵素样品5 mL于10 mL离心管中,使用精密pH计测定各个样品的pH值。
1.3.3 总酸含量的测定
参照GB/T 12456—2008《食品中总酸的测定》的方法测定,测定结果以苹果酸质量浓度(g/100 mL)计。
1.3.4 有机酸含量的测定
有机酸测定参考Molina等[14]方法进行:将发酵不同时间的苹果酵素离心,经0.45 μm微孔滤膜过滤,采用HPLC法对苹果酵素中的乳酸、乙酸、苹果酸进行定量测定,检测条件:色谱柱ODS-C18柱(25 mm×4.6 mm,5 μm),流动相为体积分数0.1%磷酸溶液,等度洗脱30 min,样品进样量20 μL,流速1.0 mL/min,柱温25 ℃;检测波长215 nm。
1.3.5 糖含量的测定
苹果酵素中的糖类测定参考Ghosh等[15]方法,将发酵不同时间的苹果酵素离心稀释后经0.45 μm微孔滤膜过滤,采用HPLC测定。HPLC检测条件为:NH2P-50 ShodexC-NH2色谱柱,流动相为V(乙腈)∶V(超纯水)=70∶30,等度洗脱60 min,进样量20 μL,流速1.0 mL/min,柱温35 ℃;示差折光检测器。
1.3.6 乙醇含量的测定
参照GB/T 5009.225—2016《酒中乙醇浓度的测定》方法测定。
1.3.7 总酚含量的测定
采用福林-酚法[16]测定苹果酵素中总酚含量。取0.1 mL 样品用去离子水1∶1稀释,与1 mL体积分数50%的福林-酚溶液混合均匀并保持5 min,加入2 mL 7.5 g/100 mL Na2CO3溶液,避光条件下反应30 min,于760 nm波长处测吸光度。苹果酵素中总酚的含量以1 L酵素液中含有的没食子酸(gallic acid equivalent,GAE)的质量(mg)计。按照标准曲线线性方程y=5.547x+0.002 2(R2=0.999 6)计算总酚含量。每个样品平行测定3 次。
1.3.8 苹果酵素发酵过程中DPPH自由基清除率的测定
苹果酵素天然发酵过程中DPPH自由基清除率变化测定参考Brand-Williams等[17]方法。取0.3 mL样品中加入3.7 mL 10-4mol/L DPPH溶液,常温下避光反应30 min,于515 nm波长处测定吸光度。0.3 mL无水乙醇和3.7 mL DPPH溶液混合作为空白对照。每个样品平行测定3 次。DPPH自由基清除率由下列公式计算而得:

式中:A0为对照样品吸光度;A1为待测样品吸光度。
1.4 数据统计与分析
使用Sigma Plot 10.0与SPSS 19.0数据处理软件绘制图表及数据处理。实验数据以 ±s表示。使用单因素方差分析、LSD法和Duncan法等多重方法对数据进行比较。
2 结果与分析
2.1 苹果酵素天然发酵过程中pH值、总酸含量变化

图1 天然发酵过程中pH值、总酸变化Fig. 1 Changes in pH value and total titratable acidity during natural fermentation
pH值的变化可以反映发酵过程是否正常,而酸度是衡量酵素成熟度的主要指标,同时也是反映植物酵素质量品质的重要理化指标,苹果酵素发酵过程中pH值、总酸随发酵时间的变化结果如图1所示。pH值在14 d内由初始值5.02±0.05迅速下降至3.69±0.02。总酸含量呈逐渐上升趋势,且在14 d内上升速率较快,后期趋于平缓,质量浓度由初值(0.06±0.008)g/100 mL上升至(0.51±0.02)g/100 mL。这是由于发酵过程中乙酸、乳酸等有机酸含量增加所致[18]。由此说明苹果酵素在14 d内发酵迅速。蒋增良等[5-6]探究发现葡萄酵素与蓝莓酵素天然发酵过程中的pH值均在前8 d内快速下降,之后随着发酵时间的延长,pH值变化不明显,发酵8 周后,葡萄酵素pH值为4.70,蓝莓酵素pH值为4.48,说明葡萄酵素与蓝莓酵素在前8 d内发酵迅速。由此可见,酵素产品在天然发酵过程中的发酵速度与发酵用原料的种类有关。可能是由于不同原料所携带的微生物种类和数量不同,所形成的自然环境会有所差别,而影响发酵速度。
2.2 苹果酵素天然发酵过程中乳酸、乙酸、苹果酸含量变化
有机酸是苹果中的天然产物,其种类和含量严重影响产品的风味,而在天然发酵过程中有机酸的种类和数量会发生变化,因此有机酸是发酵制品的重要指标之一[19]。天然苹果酵素发酵过程中乙酸、乳酸及苹果酸变化如图2所示。随着发酵时间的延长,乳酸质量分数由最初值0.004%上升至0.023%,乙酸含量则呈显著上升趋势,质量分数由初值0.018%上升至0.23%,而且从发酵14 d后上升速度较快。这是由于发酵前14 d酵素体系内的醋酸菌只能利用葡萄糖、果糖代谢生成乙酸,而14 d后,由于酵母菌的代谢产生的乙醇含量越来越多,醋酸菌在有葡萄糖、果糖和乙醇的条件下开始大量生成乙酸等代谢产物[20]。苹果酸在发酵14 d上升至(2.45±0.18)g/L后略有下降。苹果酸是苹果中所含的主要有机酸之一,发酵前期会在高渗透压下从苹果中溶至酵素液中,从而使苹果酸含量上升;随着发酵时间延长,苹果酸会被体系中少量的乳酸菌通过苹果酸发酵途径代谢生成乳酸,使苹果酸含量下降[19]。

图2 天然发酵过程中苹果酸、乳酸、乙酸含量变化Fig. 2 Changes in malic acid, lactic acid, acetic acid production during natural fermentation
2.3 天然苹果酵素发酵过程中糖类含量变化
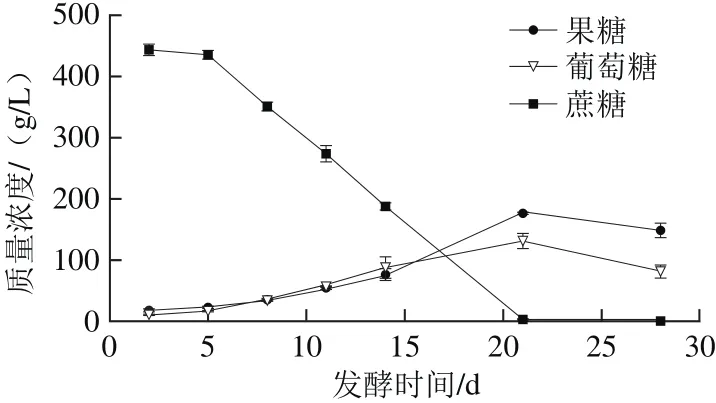
图3 天然发酵过程中蔗糖、葡萄糖、果糖含量变化Fig. 3 Changes in sucrose, glucose and fructose production during natural fermentation
糖类作为天然发酵过程主要碳源,其含量是研究苹果酵素过程微生物代谢变化的核心指标之一。苹果酵素发酵过程中,果糖、葡萄糖、蔗糖随发酵时间变化结果如图3所示。在发酵21 d内,随着发酵时间的延长,发酵液中果糖与葡萄糖含量逐渐增高,而后逐渐下降,且质量浓度在发酵第21天达到最高值(177.2±0.6)、(130.6±12.9)g/L;蔗糖质量浓度随着发酵时间的延长不断下降,且在发酵第28天从初始值(443.2±9.1)g/L降低趋于0g/L。这一过程中的变化趋势可能是发酵过程中蔗糖会被微生物直接代谢利用或被水解酶水解生成果糖和葡萄糖,导致蔗糖含量不断下降[20]。发酵21 d内果糖、葡萄糖含量上升是因为蔗糖水解的生成速率大于二者的消耗速率;发酵21 d后,可能是因为随着发酵时间的延长,苹果酵素中的菌种结构发生变化,酵母菌等优势菌种会优先利用苹果酵素中的果糖、葡萄糖代谢成乙醇,而使二者含量降低。
2.4 苹果酵素天然发酵过程中乙醇含量变化

表1 天然发酵过程中乙醇含量变化Table 1 Change in alcohol production during natural fermentation
由于苹果表面会附带有酵母菌等真菌[21],在对苹果原料预清洗过程中,由于未对苹果进行灭菌操作,因此苹果表明会残留部分酵母菌,天然发酵过程中酵母菌会利用糖代谢生成乙醇等代谢产物。而乙醇含量高低会直接影响液体产品风味口感及质量,因此乙醇是发酵饮料中一个重要指标之一。苹果酵素天然发酵过程中乙醇含量变化如表1所示,发酵前14 d,发酵液中并未检测出乙醇,随着发酵时间延长,乙醇体积分数呈上升趋势,且在第28天达到(6.60±1.27)%。Goh等[22]研究表明,当糖质量浓度高于110 g/L,微生物的生长受到抑制。由于发酵初期,蔗糖质量浓度远高于110 g/L,而高质量浓度蔗糖会抑制酵母菌等微生物的生长代谢。随发酵时间延长,当蔗糖质量浓度低于110 g/L时,酵母菌等微生物利用果糖、葡萄糖生成乙醇[23]。由图3可知,发酵第14天、21天,蔗糖质量浓度分别为197、3.7 g/L,因此可以推测在发酵14~21 d过程中,当蔗糖质量浓度降低至110 g/L以下时,酵母菌等微生物代谢糖生成乙醇。Ghosh等[15]报道印度大米饮料天然发酵过程中酵母菌、霉菌等需氧微生物的数量呈先升后降趋势,双歧杆菌、乳杆菌等厌氧微生物的数量呈不断上升趋势。葡萄糖、果糖等游离糖的存在有利于乳酸菌等厌氧微生物的生长。因此通过天然发酵过程中糖类、有机酸及乙醇含量的变化,可推测苹果酵素天然发酵过程中微生物群落结构也会发生改变,但天然发酵过程中具体微生物种类和数量的变化需进一步研究。
2.5 苹果酵素天然发酵过程中总酚含量变化
苹果中酚类物质种类丰富,是苹果中主要抗氧化物质。苹果酵素天然发酵过程中总酚含量变化如图4所示。随着发酵时间的延长,总酚含量呈先上升后下降趋势,发酵第21天达到最大值(259.4±3.6)mg/L,且具有显著性差异(P<0.05)。因此,发酵过程可以显著提高苹果酵素中的总酚含量。除苹果酵素外,已有报道表明在蓝莓酵素、葡萄酵素天然发酵过程中总酚含量呈逐渐上升趋势,发酵结束后二者的总酚质量浓度分别为1.74、2.31 mg/mL[5-6]。叶盼等[24]研究也表明苹果汁乳酸菌发酵过程中总酚含量呈先降低再升高后缓慢降低的趋势且在发酵第9天其质量浓度达到最高值103.1 mg/L。由此说明,原料种类与发酵体系中的微生物种类均影响发酵过程中酚类物质的积累。总酚含量增加的原因可能是由于体系内高糖浓度所形成的高渗透压体系,使苹果中的酚类物质溶出。此外,Chu Shengche等[25]研究表明发酵过程中微生物会把复杂的大分子酚类物质转换成小分子物质,使酚类含量增加。Ghosh等[26]研究表明乳酸菌产生的酶类及有机酸使大米中酚类物质溶出并呈游离态,导致发酵过程中总酚含量上升。Di Cagno等[27]指出一定浓度的酚类物质会产生抑菌作用,而体系中的优势菌种为维持自身生长会产生降解酚类的物质,使总酚含量降低。因此,发酵过程总酚含量的变化,不仅与发酵原料及发酵条件有关,也与微生物的作用相关。

图4 天然发酵过程中总酚含量变化Fig. 4 Changes in total phenolic compounds during natural fermentation
2.6 苹果酵素天然发酵过程中DPPH自由基清除率变化

图5 天然发酵过程中DPPH自由基清除率变化Fig. 5 Changes in DPPH radical scavenging ability during natural fermentation
由图5可知,苹果酵素DPPH自由基清除率在前8 d从(42.7±3.9)%上升到(85.3±0.3)%,之后略有上升,且在发酵第21天达到最高,清除率为(90.9±2.2)%,且具有显著性差异(P<0.05)。因此,发酵过程可提高苹果酵素的DPPH自由基清除能力。相关研究表明不同的发酵过程可以不同程度地提高发酵产品的DPPH自由基清除能力。叶盼等[24]研究苹果汁发酵过程中DPPH自由基清除率呈先上升后下降趋势,在发酵第9天达到最高值,比未发酵苹果汁高出35.3%。葡萄酵素与蓝莓酵素在天然发酵过程中DPPH自由基清除能力分别提高了12.5%、3.6%[5-6]。发酵过程中导致苹果酵素DPPH自由基清除能力增加的原因较复杂。Karaman等[28]曾报道酚类物质能很容易地给出1 个氢离子,并通过共振杂化而稳定,这是具有高自由基清除能力的主要原因,且酚类物质的增加很可能是DPPH自由基清除能力提高的重要原因。
3 结 论
本研究表明苹果酵素天然发酵过程中乳酸、乙酸含量逐渐增加,苹果酸、葡萄糖、果糖、总酚含量、DPPH自由基清除率呈先上升后下降趋势,且均在发酵第21天达到最大值。发酵14~21 d过程中乙醇生成且呈上升趋势,发酵第28天乙醇体积分数可达(6.6±1.9)%。以上代谢产物不仅丰富了苹果酵素中的营养物质的种类及含量,而且它们在发酵过程中所呈现出的变化规律可清晰地反映出天然发酵过程中营养物质的利用程度及生物活性物质的积累水平。因此可根据发酵过程中有机酸、糖类、总酚等生物活性物质的积累量以及乙醇等风味物质的含量变化来确定天然发酵过程的发酵周期,为天然发酵酵素产品的生产和开发提供一定的技术支撑和理论指导。
[1] 毛建卫, 吴元峰, 方晟. 微生物酵素研究进展[J]. 发酵科技通讯,2010, 39(3): 42-44. DOI:10.3969/j.issn.1674-2214.2010.03.018.
[2] 赵金凤, 宿秀莘, 曲佳乐, 等. 敖东酵素对脾淋巴细胞增殖作用的影响[J]. 食品与发酵科技, 2014, 50(3): 50-53. DOI:10.3969/j.issn.1674-506X.2014.03-013.
[3] 曲佳乐, 赵金凤, 皮子凤, 等. 植物酵素解酒护肝保健功能研究[J].食品科技, 2013, 38(9): 51-54. DOI:10.13684/j.cnki.spkj.2013.09.043.
[4] 中国生物发酵产业协会. 酵素产品分类导则: T/CBFIA 08001—2016[S]. 北京: 中国标准出版社, 2016: 1-5.
[5] 蒋增良, 毛建卫, 黄俊, 等. 蓝莓酵素在天然发酵过程中抗氧化性能的变化[J]. 食品工业科技, 2013, 34(2): 194-197. DOI:10.13386/j.issn1002-0306.2013.02.059.
[6] 蒋增良, 毛健卫, 黄俊, 等. 葡萄酵素在天然发酵过程中体外抗氧化性能的变化[J]. 中国食品学报, 2014, 14(10): 29-33. DOI:10.16429/j.1009-7848.2014.10.015.
[7] 贾丽丽, 冀利, 孙曙光, 等. 冬枣酵素发酵过程中生物学特性和抗氧化活性研究[J]. 食品与发酵科技, 2014, 50(4): 30-33. DOI:10.3969/i.issn.1674-506X.2014.04-008.
[8] 郭爽, 石永伟, 曲佳乐, 等. 敖东酵素对小鼠抗氧化功能的影响[J].食品与发酵科技, 2014, 50(5): 16-19.
[9] KAWAZOE N, OKADA H, FUKUSHI E, et al. Two novel oligosaccharides isolated from a beverage produced by fermentation of a plant extract[J]. Carbohydrate Research, 2008, 343(3): 549-554.DOI:10.1016/j.carres.2007.11.029.
[10] OKADA H, FUKUSHI E, YAMAMORI A, et al. Novel fructopyranose oligosaccharides isolated from fermented beverage of plant extract[J].Carbohydrate Research, 2010, 345(3): 414-418. DOI:10.1016/j.carres.2009.12.003.
[11] OKADA H, FUKUSHI E, YAMAMORI A, et al. Isolation and structural confirmation of the oligosaccharides containing alpha-D-fructofuranoside linkages isolated from fermented beverage of plant extracts[J]. Carbohydrate Research, 2011, 346(16): 2633-2637.DOI:10.1016/j.carres.2011.09.002.
[12] KALINOWSKA M, BIELAWSKA A, LEWANDOWSKASIWKIEWICZ H, et al. Apples: content of phenolic compounds vs. variety, part of apple and cultivation model, extraction of phenolic compounds, biological properties[J]. Plant Physiology and Biochemistry, 2014, 84: 169-188. DOI:10.1016/j.plaphy.2014.09.006.
[13] KRIS-ETHERTON P M, HECKER K D, BONANOME A, et al. Bioactive compounds in foods: their role in the prevention of cardiovascular disease and cancer[J]. American Journal of Medicine,2002, 113(9): 71-88. DOI:10.1016/S0002-9343(01)00995-0.
[14] MOLINA A M, GUADALUPE V, VARELA C, et al. Differential synthesis of fermentative aroma compounds of two related commercial wine yeast strains[J]. Food Chemistry, 2009, 117(2): 189-195.DOI:10.1016/j.foodchem.2009.03.116.
[15] GHOSH K, RAY M, ADAK A, et al. Microbial, saccharifying and antioxidant properties of an Indian rice based fermented beverage[J]. Food Chemistry, 2015, 168: 196-202. DOI:10.1016/j.foodchem.2014.07.042.
[16] SINGLETON V L, ORTHOFER R, LAMUELA-RAVENTOS R M.Methods in enzymology[M]. United States, Elsevier Academic Press Inc, 1999: 152-178.
[17] BRAND-WILLIAMS W, CUVELIER M E, BERSET C. Use of a free radical method to evaluate antioxidant activity[J]. LWT-Food Science and Technology, 1995, 28(1): 25-30. DOI:10.1016/S0023-6438(95)80008-5.
[18] JAYABALAN R, SUBATHRADEVI P, MARIMUTHU S, et al.Changes in free-radical scavenging ability of kombucha tea during fermentation[J]. Food Chemistry, 2008, 109(1): 227-234.DOI:10.1016/j.foodchem.2007.12.037.
[19] XIONG T, PENG F, LIU Y Y, et al. Fermentation of Chinese sauerkraut in pure culture and binary co-culture with Leuconostoc mesenteroides and Lactobacillus plantarum[J]. LWT-Food Science and Technology, 2014, 59(2): 713-717. DOI:10.1016/j.lwt.2014.05.059.
[20] LIU C H, HSU W H, LEE F L, et al. The isolation and identification of microbes from a fermented tea beverage, Haipao, and their interations during Haipao fermentation[J]. Food Microbiology, 1996, 13(6)∶ 407-415. DOI∶10.1006/fmic.1996.0047.
[21] 田卫, 李军, 李新华. 二氧化氯对榨汁苹果表面腐生酵母菌杀菌规律的研究[J]. 食品科学, 2005, 26(7): 74-77. DOI:10.3321/j.issn:1002-6630.2005.07.014.
[22] GOH W N, ROSMA A, KAUR B, et al. Fermentation of black tea broth (Kombucha)∶ I. effects of sucrose concentration and fermentation time on the yield of microbial cellulose[J]. International Food Research Journal, 2012, 19(1)∶ 109-117.
[23] KANG M, KIM J, PARK H J, et al. Application of metabolomics in the analysis of manufacturing type of Pu-erh tea and composition changes with different postfermentation year[J]. Journal of Agricultural and Food Chemistry, 2010, 58(1)∶ 345-352. DOI∶10.1021/jf902818c.
[24] 叶盼, 赵黎明, 蒋丽华, 等. 发酵苹果汁的抗氧化性能变化[J]. 食品与发酵工业, 2016, 42(4): 114-118. DOI:10.13995/j.cnki.11-1802/ts.201604021.
[25] CHU S C, CHEN C. Effects of origins and fermentation time on the antioxidant activities of kombucha[J]. Food Chemistry, 2006, 98(3)∶502-507. DOI∶10.1016/j.foodchem.2005.05.080.
[26] GHOSH K, RAY M, ADAK A, et al. Role of probiotic Lactobacillus fermentum KKL1 in the preparation of a rice based fermented beverage[J]. Bioresource Technology, 2015, 188∶ 161-168.DOI∶10.1016/j.biortech.2015.01.130.
[27] DI CAGNO R, CODA R, DE ANGELIS M, et al. Exploitation of vegetables and fruits through lactic acid fermentation[J]. Food Microbiology, 2013, 33(1)∶ 1-10. DOI∶10.1016/j.fm.2012.09.003.
[28] KARAMAN Ş, TÜTEM E, BAŞKAN K S, et al. Comparison of total antioxidant capacity and phenolic composition of some apple juices with combined HPLC-CUPRAC assay[J]. Food Chemistry, 2010,120(4)∶ 1201-1209. DOI∶10.1016/j.foodchem.2009.11.065.
Changes in Metabolites during Natural Fermentation of Apple into Enzyme Drink
YANG Xiaoxing1, ZHOU Jiachun1, CHEN Qiming1, QIN Zhen1, MA Mingyue2, ZHAO Liming1,*
(1. State Key Laboratory of Bioreactor Engineering, R&D Center of Separation and Extraction Technology in Fermentation Industry,School of Biotechnology, East China University of Science and Technology, Shanghai 200237, China;2. School of Bioinformatics, Chongqing University of Posts and Telecommunications, Chongqing 400065, China)
The objective of this work was to analyze the changes in metabolites during the natural fermentation of apple into an enzyme drink. The pH value, total titrable acid, organic acids (lactic acid, acetic acid, and malic acid), sugars (sucrose,glucose, and fructose), alcohol, total phenolic content and 1,1-diphenyl-2-picryl-hydrazyl (DPPH) radical scavenging ability were investigated. Results showed that pH value decreased from 5.05 to 3.88 while total titratable acidity and lactic acid increased gradually during the fermentation process. Acetic acid was accumulated from 0.018% to 0.23% during the process;malic acid increased from 0.67 g/L to 2.45 g/L during the first 14 days and then decreased slightly. Glucose and fructose increased until reaching their maximum of 130.6 and 177.2 g/L on the 21thday and then decreased, while sucrose kept decreasing to almost 0 g/L during the whole fermentation process. Alcohol was produced from the 14thto 21thday, reaching 6.6% on the 28thday. Both total phenolic content and DPPH radical scavenging ability increased continuously to their maximum values (259.4 mg/L, 90.9 %) on the 21stday followed by a decrease.
fermented apple drink rich in enzyme; natural fermentation process; metabolites; DPPH radical scavenging ability
DOI∶10.7506/spkx1002-6630-201724003
TS201.3
A
1002-6630(2017)24-0015-05
杨小幸, 周家春, 陈启明, 等. 苹果酵素天然发酵过程中代谢产物的变化规律[J]. 食品科学, 2017, 38(24): 15-19.
10.7506/spkx1002-6630-201724003. http://www.spkx.net.cn
YANG Xiaoxing, ZHOU Jiachun, CHEN Qiming, et al. Changes in metabolites during natural fermentation of apple into enzyme drink[J]. Food Science, 2017, 38(24)∶ 15-19. (in Chinese with English abstract) DOI∶10.7506/spkx1002-6630-201724003. http∶//www.spkx.net.cn
2017-03-07
国家自然科学基金面上项目(31371725);重庆邮电大学科研启动基金项目(A2016-87);
中央高校基本科研业务费专项(222201717026)
杨小幸(1991—),女,硕士研究生,研究方向为食品加工技术。E-mail:1391750551@qq.com
*通信作者:赵黎明(1977—),男,教授,博士,研究方向为食品加工技术。E-mail:zhaoliming@ecust.edu.cn
