婴儿粪便长双歧杆菌的分离与多样性分析
2017-12-11张秋雪刘晓婵朱宗涛孙思睿贾芳芳孟祥晨
张秋雪,刘晓婵,朱宗涛,万 峰,孙思睿,贾芳芳,孟祥晨*
婴儿粪便长双歧杆菌的分离与多样性分析
张秋雪,刘晓婵,朱宗涛,万 峰,孙思睿,贾芳芳,孟祥晨*
(东北农业大学 乳品科学教育部重点实验室,黑龙江 哈尔滨 150030)
本研究旨在分析婴儿粪便长双歧杆菌的多样性,采用改良MRS培养基从哈尔滨地区健康婴儿粪便中分离双歧杆菌,采用生理生化实验结合16S rDNA和热应激蛋白60基因(heat-shock protein 60,hsp60)同源性分析鉴定分离株,利用同源性分析及随机扩增多态性DNA(random amplified polymorphism DNA,RAPD)、多位点序列分型(multilocus sequence typing,MLST)技术进一步分析长双歧杆菌多态性。实验从11 个婴儿体内分离得到18 株厌氧的细菌菌株,经形态学分析、生理生化实验、16S rDNA测序及hsp60测序实验发现,其中7 株为长双歧杆菌长亚种,3 株为长双歧杆菌婴儿亚种。RAPD和MLST结果表明:7 株长双歧杆菌长亚种为6 个基因型,3 株长双歧杆菌婴儿亚种为2 个基因型,上述结果说明不同人源婴儿粪便长双歧杆菌基因型差异较大。
长双歧杆菌;热应激蛋白60基因(hsp60);随机扩增多态性DNA(RAPD);多位点序列分型(MLST)
双歧杆菌(Bifidobacterium)作为肠道有益微生物在保持机体健康方面起重要作用[1-2],婴儿出生后,来自出生环境、母乳、后天环境的微生物共同塑造了婴儿肠道菌群[3-5],母乳喂养的婴儿肠道中双歧杆菌占优势,但是不同个体双歧杆菌种类差异较大,双歧杆菌多样性与婴儿健康之间的关系目前还不十分清楚,因此对婴儿肠道双歧杆菌多样性进行分析有利于深入了解双歧杆菌在婴儿健康中的作用。
人源长双歧杆菌(B. longum)包括长双歧杆菌长亚种(B. longum subsp. longum)和长双歧杆菌婴儿亚种(B. longum subsp. infantis)[6]。传统的生理生化和16S rDNA同源性分析对亲缘关系比较近的物种分辨率不高,而高度保守的热应激蛋白60(heat-shock protein,hsp60)基因,在双歧杆菌亲缘物种鉴定方面则可以提供更为准确的信息[7],能弥补16S rDNA同源性分析的不足。随机扩增多态性DNA(random amplified polymorphism DNA,RAPD)是研究多样性经常采用的方法,与之相比多位点序列分型(multilocus sequence typing,MLST)技术可以更为准确地区分分离株的基因型,提供更多的基因信息[8]。一般选择6~8 个编码蛋白的管家基因进行测序,分析等位基因图谱同时进行聚类分析,根据位点序列的不同赋予不同菌株序列类型(sequence typing,ST),达到对菌株进行多位点精确区分[9]。
本研究拟采集3~6 个月纯母乳喂养婴儿粪便,采用纯培养技术分离其中的长双歧杆菌,进一步利用16S rDNA、hsp60、RAPD和MLST技术分析分离得到的长双歧杆菌多样性,为深入研究长双歧杆菌在婴儿健康中的作用和功能提供理论支持。
1 材料与方法
1.1 材料与试剂
1.1.1 微生物菌株
长双歧杆菌长亚种ATCC15707作为标准菌株,购自中国微生物菌种保藏中心。
1.1.2 培养基与试剂
改良MRS(modified MRS,mMRS)培养基(每升添加含0.05% L-半胱氨酸盐酸盐和5%乳糖的MRS培养基) 青岛海博生物技术有限公司。
预还原液:L-半胱氨酸盐酸盐3 g/L,大豆蛋白胨2 g/L,121 ℃灭菌15 min[10]。
粪便稀释液:Na2HPO46 g/L;KH2PO44.5 g/L;L-半胱氨酸盐酸盐0.5 g/L;吐温80 0.5 g/L[11]。
TIANGEN细菌基因组DNA提取试剂盒、DNA Marker、dNTPs、Taq DNA聚合酶 天根生化科技有限公司;引物 吉林省库美生物科技有限公司;L-半胱氨酸盐酸盐 天津光复精细化工研究所;乳糖 天津科密欧化学试剂有限公司;琼脂糖 美国Sigma公司。
1.2 仪器与设备
LJQ-F2厌氧培养罐 自行设计;SPX-150B生化培养箱 上海佳胜实验设备有限公司;BCN1360型生物洁净工作台 北京东联哈尔仪器制造;微量台式离心机美国Beckman公司;光学显微镜 麦克奥迪实业集团有限公司;DYY-10C型电泳仪 北京市六一仪器厂;凝胶成像系统 美国UVP公司。
1.3 方法
1.3.1 粪便采集与菌株的分离纯化
采集哈尔滨地区3~6 个月母乳喂养的健康婴儿的粪便,粪便采集前婴儿均未服用过抗生素类药物,无益生菌服用史,无胃肠病史。取新鲜婴儿粪便立刻放入加有预还原液的无菌取样管中,并放入冰盒内迅速带回实验室进行分离。
将1 g新鲜粪便用粪便稀释液梯度稀释,在10-4、10-5、10-6稀释度下取0.1 µL涂布于mMRS培养基中,37 ℃厌氧培养48~72 h后挑取凸起、光滑、边缘水润的乳白色或白色菌落镜检。将呈V、Y或两端钝圆的杆状形态菌落划线于mMRS培养基中,进行有氧和厌氧培养,剔除需氧和兼性厌氧菌。选取仅厌氧条件生长并且革兰氏染色为阳性的菌落,进一步划线厌氧培养纯化,直至镜检为纯菌。
1.3.2 生理生化实验
将1.3.1节中获得的分离株分别进行过氧化氢酶实验、明胶液化实验、运动性实验、氧化酶实验、吲哚实验、硝酸盐还原实验[12-13]。选择过氧化氢酶、明胶液化、氧化酶实验、吲哚和硝酸盐还原实验结果均为阴性,并且不运动的菌株进行基因同源性分析。
1.3.3 分离菌株基因同源性分析
1.3.3.1 基因组DNA提取
按照细菌基因组DNA提取试剂盒步骤提取分离株基因组DNA。
1.3.3.2 分离菌株16S rDNA同源性分析
16S rDNA扩增反应总体系50 µL:超纯水35.5 µL;5×Taq DNA polymerase buffer(含Mg2+)5 μL;dNTP(2.5 mol/L)4 μL;27F(10 μmol/L)2 μL;1429R(10 μmol/L)2 μL;Taq DNA聚合酶0.5 μL;DNA模板1 μL。其中引物序列27F为5’-AGAGTTTGATCCTGGCTCAG-3’,1492R为5’-GGTTACCTTGTTACGACTT-3’[14]。
16S rDNA扩增反应条件:94 ℃预变性4 min;30 个循环包括:94 ℃变性30 s,53 ℃退火1 min,72 ℃延伸1 min;最后72 ℃延伸7 min。
1.3.3.3 分离菌株hsp60同源性分析
hsp60基因扩增反应体系同16S rDNA基因扩增体系。其中上游引物为hspF3(5’-ATCGCCAAGGAGATCGAGCT-3’),下游引物为hspR4(5’-ATCGCCAAGGAGATCGAGCT-3’)[15]。
hsp60基因扩增反应条件:94 ℃预变性5 min;第1阶段4 个循环包括94 ℃变性60 s,62 ℃退火60 s,72 ℃延伸90 s;第2阶段21 个循环包括94 ℃变性60 s,60 ℃退火60 s,72 ℃延伸90 s;第3阶段15 个循环包括94 ℃变性60 s,58 ℃退火60 s,72 ℃延伸90 s;最后72 ℃延伸7 min[15]。
1.3.3.4 基因扩增产物分析
聚合酶链式反应(polymerase chain reaction,PCR)完毕之后,将PCR产物进行1%的琼脂糖凝胶电泳。电泳后,将凝胶置于紫外灯下进行观察。若16S rDNA扩增产物获得约1 500 bp的条带,hsp60扩增产物获得约650 bp的条带,且条带单一清晰无杂带,扩增产物送吉林省库美生物科技有限公司进行测序。所得序列运用MEGA 6软件,采用Neighbor-Joining方法,自展值分析设置1 000 次重复取样,对菌株构建系统发育进化树。
1.3.4 分离菌株多样性分析
1.3.4.1 RAPD分析
RAPD分析时选择4对引物:A18(5’-AGGTGACCGT-3’)、L16(5’-AGGTTGCAGG-3’)、E14( 5’-CCAAGCTTCC-3’) 、 OPU10(5’-ACCTCGGCAC-3’)。
RAPD反应总体系25 µL:超纯水17 µL;5×Taq DNA polymerase buffer(含Mg2+)3 μL;dNTP(2.5 mol/L)2 μL;引物(10 μmol/L)1 μL;Taq DNA聚合酶1 μL;DNA模板1 μL。
RAPD反应条件:94 ℃预变性3 min;40个循环包括:94 ℃变性1 min,36 ℃退火30 s,72 ℃延伸70 s;最后72 ℃延伸10 min。将PCR产物于1.5%的琼脂糖进行凝胶电泳,在紫外下观察扩增条带图谱[16]。
1.3.4.2 MLST分析
等位基因扩增体系与16S rDNA基因扩增体系相同。其中每个等位基因所用上下游引物信息如表1所示。

表1 长双歧杆菌MLST扩增引物Table 1 MLST primers for Bifidobacterium longum
等位基因扩增条件:95 ℃预变性5 min;30 个循环包括:95 ℃变性30 s,55 ℃或60 ℃退火30 s,72 ℃延伸1 min;最后72 ℃延伸10 min。其中对于等位基因ileS和rpoB退火温度为55 ℃,等位基因clpC、fusA、gyrB、purF、rplB退火温度为60 ℃[17-18]。
PCR完毕之后,将PCR产物进行1%琼脂糖凝胶电泳。电泳后,将凝胶置于紫外灯下进行观察。若clpC、fusA、gyrB、ileS、PurF、rplB、rpoB条带单一清晰无杂带,送检测序。
为提高多位点分型效果的准确性,将等位基因进行双向测序,采用Chromas软件打开测序峰图验证序列的正确性,并去除测序起始端与引物结合不稳定的序列[18]。经测序及数据处理后,用于MLST分型分析的序列长度分别为:clpC:603 bp;fusA:666 bp;gyrB:627 bp;ileS:489 bp;purF:591 bp;rplB:357 bp;rpoB:501 bp[17-18]。
2 结果与分析
2.1 分离菌株形态及生理生化实验结果
2.1.1 分离菌株的菌落菌体形态
从11 个健康母乳喂养的婴儿粪便中分离得到18 株疑似菌株。菌落乳白色或白色、凸起、光滑且边缘水润。18 株菌均为革兰氏染色阳性,菌体排列不规则,菌体形态为杆状,且杆状末端分叉,呈V或Y字、顿圆、哑铃等形态。
2.1.2 生理生化实验结果
18 株分离株均为专性厌氧菌,过氧化氢酶实验、明胶液化实验、氧化酶实验、吲哚实验、硝酸盐还原实验均为阴性,无运动性。
2.2 分离菌株的基因同源性分析
2.2.1 16S rDNA同源性
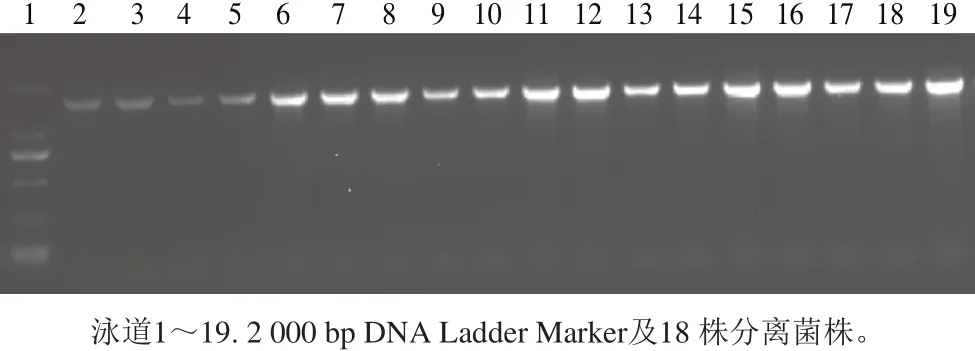
图1 分离菌株16S rDNA 的PCR电泳图谱Fig. 1 Electrophotogram of PCR-amplified 16S rDNA from the isolates
18 株分离株PCR扩增产物经琼脂糖凝胶电泳后,在1500 bp左右处有明亮单一条带(图1),满足测序要求。对18 株分离菌株进行测序,所得序列输入国家国立生物技术信息中心(National Center for Biotechnology Information,NCBI)中进行比对,结果显示有10 株菌与长双歧杆菌的同源性均达到99%。其余8 株分别为两歧双歧杆菌2 株、假小连双歧杆菌1 株、动物双歧杆菌乳酸亚种4 株、短双歧杆菌1 株。
选取16S rDNA同源性99%以上的模式菌株序列,以Micrococcus luteus DSM 20030(GenBank序列号:AJ536198)作为16S rDNA基因进化树的根,对分离得到的长双歧杆菌菌株构建系统发育树(图2)。发现有7 株菌(H3-R1、H9-5、H10-1、H16-2、H20-14、H27-10、H27-13)均与长双歧杆菌长亚种ATCC15707 16S rDNA亲缘关系最近,初步确定为长双歧杆菌长亚种;3 株菌(H5-19、H5-21、H11)与长双歧杆菌婴儿亚种ATCC15697 16S rDNA亲缘关系最近,初步确定为长双歧杆菌婴儿亚种。

图2 基于16S rDNA基因序列构建长双歧杆菌系统发育树Fig. 2 Phylogenetic tree of B. longum based on 16S rDNA gene sequences
2.2.2 hsp60同源性分析
上述10 株长双歧杆菌的hsp60基因PCR扩增后电泳,在650 bp左右处均有明亮单一条(图3),将样品进行测序。
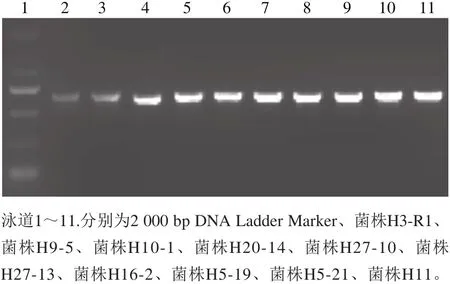
图3 长双歧杆菌hsp60基因的PCR电泳结果Fig. 3 Electrophotogram of PCR-amplified hsp60 gene from the B. longum strains
选取hsp60同源性99%以上的模式菌株序列,根据测序结果构建无根进化树(图4)。同样发现,7 株菌(H3-R1、H9-5、H10-1、H16-2、H20-14、H27-10、H27-13)与长双歧杆菌长亚种JCM1217的亲缘关系最近,并结合以上结果判定为长双歧杆菌长亚种;3 株菌(H5-19、H5-21、H11)与长双歧杆菌婴儿亚种JCM1222的亲缘关系最近,并结合以上结果判定为长双歧杆菌婴儿亚种。
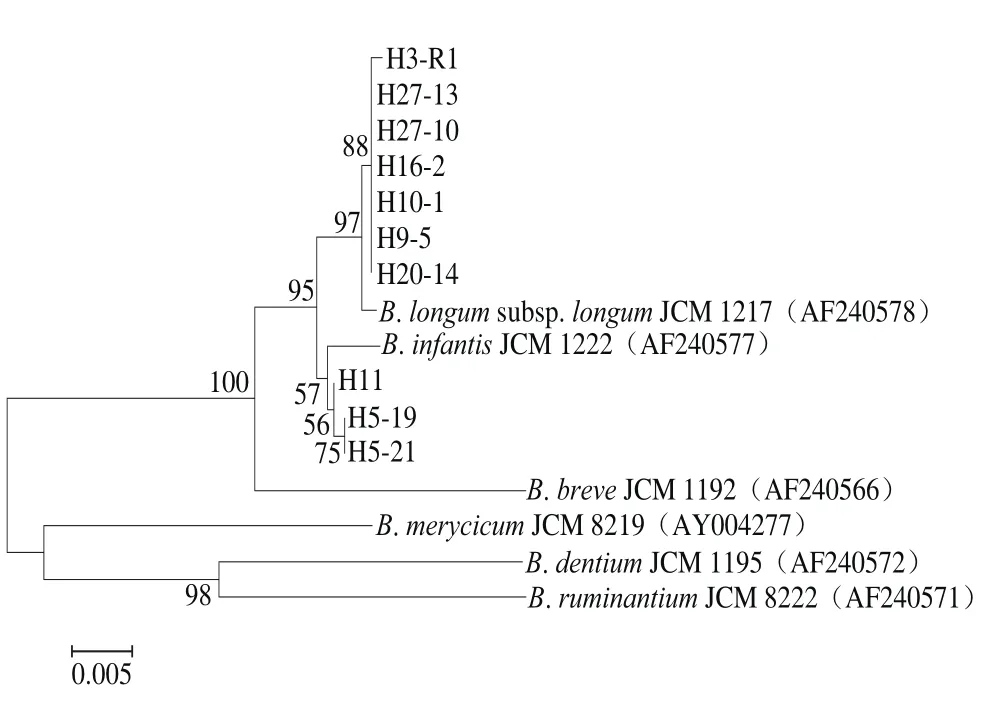
图4 基于hsp60基因序列构建长双歧杆菌系统发育树Fig. 4 Phylogenetic tree of B. longum based on hsp60 gene sequences
2.3 长双歧杆菌多样性的分析
2.3.1 RAPD分析结果
本实验采用4 个随机引物对10株长双歧杆菌的基因组DNA进行扩增,实验重复3 次确保引物具有良好的重复性,以研究其遗传多态性。扩增产物琼脂糖凝胶电泳得到多态性图谱(图5),不同引物的扩增片段数目为1~7 条之间,片段分子质量大小在0~1 kb之间。综合4 个随机引物的扩增图谱可知,长双歧杆菌H3-1、H9-5、H10-1、H20-14、H16-2、H11分别具有差异条带图谱,属于不同株型;H27-10和H27-13、H5-19和H5-21具有相同条带图谱,属于同一株型。


图5 基于引物A18(a)、L16(b)、E14(c)、OPU10(d)的长双歧杆菌基因组的RAPD图谱Fig. 5 RAPD profiles of B. longum genome based on primers A18 (a),L16 (b), E14 (c) and OPU10 (d)
2.3.2 MLST的分析结果
2.3.2.1 等位基因电泳及测序
选取7 个等位基因,运用设计好的等位基因引物对长双歧杆菌等位基因扩增。10 株长双歧杆菌的7 个等位基因均扩增成功,且有明亮单一条带(图6),满足测序要求送样品进行测序。

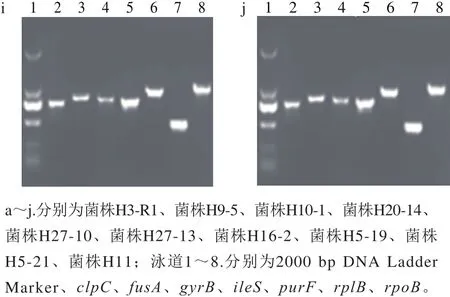
图6 长双歧杆菌菌株MLST基因PCR电泳图Fig. 6 PCR electrophoresis bands of the MLST genes of B. longum
2.3.2.2 长双歧杆菌的等位基因分型
以ATCC15707为参考菌株,运用7 个等位基因对10株长双歧杆菌进行MLST分型。去除两端误差序列,在7 个等位基因的等位点上,赋予每个不同的等位基因以不同的数值,并指定7 个等位点中,每个不同的等位基因模式为一个ST型。最终将10 株长双歧杆菌分为8 个ST型,且均与ATCC15707为不同的ST型。

表2 长双歧杆菌7 个等位基因的MLST分型Table 2 MLST genotyping of B. longum strains based on seven allelic genes
7 个等位基因分型结果如表2所示,7 株长双歧杆菌长亚种分为6 个基因型,其中菌株H3-R1、H9-5、H10-1、H20-14、H16-2分别属于不同ST型,而菌株H27-10和H27-13属于同一ST型。3 株长双歧杆菌婴儿亚种分为2个基因型,其中H5-19和H5-21属于同一ST型,且与H11为不同ST型。
2.3.2.3 长双歧杆菌等位基因系统发育树构建
将10 株菌的7 个等位基因序列连接起来(clpC-fusA-gyrB-ileS-purF-rplB-rpoB),拼接长度约为3 834 bp,对菌株构建联合基因系统发育进化树,结果如图7所示,其结果与RAPD结果一致,相对于RAPD技术,MLST可以通过进化树体现不同株之间进化距离关系。
对所有长双歧杆菌菌株等位基因序列分型结果可以看出,分离于H5婴儿个体的H5-19和H5-21菌株为相同ST型,分离于H27婴儿个体的H27-10和H27-13号菌株为相同ST型。
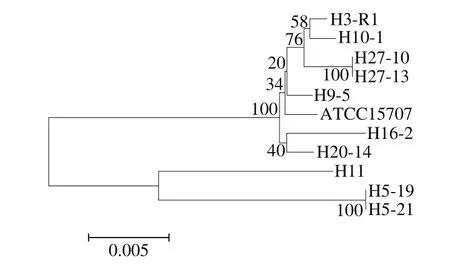
图7 长双歧杆菌菌株等位基因系统发育树Fig. 7 Phylogenetic tree of B. longum based on allelic genes
3 讨 论
本研究在分离菌株分子鉴定中,hsp60基因同源性分析结果与16S rDNA同源性分析结果一致,但hsp60基因同源性更进一步展示出分离株进化距离上的差异[19-20]。从图4可以看出长双歧杆菌长亚种H3-R1与其他分离菌株及JCM1217之间进化距离上存在差异;H5-19、H5-21、H11都在长双歧杆菌婴儿亚种聚类中,但存在进化距离的差异,且H5-19与H5-21进化距离无差异。此结果显示hsp60基因序列分析优于16S rDNA基因分析。已有研究表明保守基因hsp60具有高度保守的结构,可以对双歧杆菌在种或亚种水平上进行鉴定[21],更能有效地揭示出亲缘关系较高菌株之间系统发育的差异[22-23]。
长双歧杆菌RAPD多样性分析发现,长双歧杆菌菌株间扩增图谱存在共有带,也存在特异性条带,扩增出的谱带大小及条数差异可作为区分各长双歧杆菌菌株的依据[24]。如引物L16扩增谱图(图5b)在4 000 bp左右所有长双歧杆菌均有一条明亮条带,该条带可能是长双歧杆菌种内特征性条带,在1 000~2 000 bp之间泳道10和11均有一条其他泳道未出现的特异性条带;引物E14扩增谱图(图5c)显示:泳道6与7、泳道10与11条带相同,除此之外的其余泳道条带均不相同。
长双歧杆菌MLST多样性分析发现,单个等位基因的进化树只能反映物种间进化关系,多个基因系统发育分析才能更好地表现物种之间的关系[25-28]。已有研究结果表明长双歧杆菌在人体中定植的影响因素包括环境和宿主基因型[29],这为解释同一宿主体内定植的长双歧杆菌具有相同的ST型提供了理论依据。同时,不同婴儿个体(H3、H5、H9、H10、H11、H16、H20、H27)的长双歧杆菌形成了8 个不同的ST型,也表明长双歧杆菌之间存在较大的遗传多样性[30]。
综上所述,本研究从11 个健康婴儿体内分离鉴定得到10 株长双歧杆菌,7 株为长双歧杆菌长亚种,3 株为长双歧杆菌婴儿亚种。多态性分析发现:7 株长双歧杆菌长亚种为6 个基因型,3 株长双歧杆菌婴儿亚种为2 个基因型,说明婴儿肠道中长双歧杆菌存在较大的遗传多样性。
[1] BOTTACINI F, VENTURA M, VAN SINDEREN D, et al. Diversity,ecology and intestinal function of bifidobacteria[J]. Microbial Cell Factories, 2014, 13(1)∶ 1. DOI∶10.1186/1475-2859-13-S1-S4.
[2] SIVAN A, CORRALES L, HUBERT N, et al. Commensal Bifidobacterium promotes antitumor immunity and facilitates anti–PDL1 efficacy[J]. Science, 2015, 350(6264)∶ 1084-1089. DOI∶10.1126/science.aac4255.
[3] PATEL R M, DENNING P W. Intestinal microbiota and its relationship with necrotizing enterocolitis[J]. Pediatric Research, 2015,78(3)∶ 232-238. DOI∶10.1038/pr.2015.97.
[4] FLORES G E, CAPORASO J G, HENLEY J B, et al. Temporal variability is a personalized feature of the human microbiome[J].Genome Biology, 2014, 15(12)∶ 1. DOI∶10.1186/s13059-014-0531-y.
[5] SAKWINSKA O, MOINE D, DELLEY M, et al. Microbiota in breast milk of Chinese lactating mothers[J]. PLoS ONE, 2016, 11(8)∶e0160856. DOI∶10.1371/journal.pone.0160856.
[6] MATTARELLI P, BONAPARTE C, POT B, et al. Proposal to reclassify the three biotypes of Bifidobacterium longum as three subspecies∶ Bifidobacterium longum subsp. longum subsp.nov., Bifidobacterium longum subsp. infantis comb. nov. and Bifidobacterium longum subsp. suis comb. nov.[J]. International Journal of Systematic and Evolutionary Microbiology, 2008, 58(4)∶767-772. DOI∶10.1099/ijs.0.65319-0.
[7] JIAN W, ZHU L, DONG X. New approach to phylogenetic analysis of the genus Bifidobacterium based on partial HSP60 gene sequences[J].International Journal of Systematic and Evolutionary Microbiology,2001, 51(5)∶ 1633-1638. DOI∶10.1099/00207713-51-5-1633.
[8] MAIDEN M C J, VAN RENSBURG M J J, BRAY J E, et al. MLST revisited∶ the gene-by-gene approach to bacterial genomics[J].Nature Reviews Microbiology, 2013, 11(10)∶ 728-736. DOI∶10.1038/nrmicro3093.
[9] PÉREZ-LOSADA M, CABEZAS P, CASTRO-NALLAR E, et al. Pathogen typing in the genomics era∶ MLST and the future of molecular epidemiology[J]. Infection, Genetics and Evolution, 2013,16∶ 38-53. DOI:10.1016/j.meegid.2013.01.009.
[10] BEVILACQUA L, OVIDI M, DI MATTIA E, et al. Screening of Bifidobacterium strains isolated from human faeces for antagonistic activities against potentially bacterial pathogens[J]. Microbiological Research, 2003, 158(2)∶ 179-185. DOI:10.1078/0944-5013-00192.
[11] 高鹏飞, 孙志宏, 麻士卫, 等. 蒙古族儿童源益生特性双歧杆菌的筛选及鉴定[J]. 微生物学报, 2009, 49(2)∶ 210-216.
[12] TURRONI F, PEANO C, PASS D A, et al. Diversity of bifidobacteria within the infant gut microbiota[J]. PLoS ONE, 2012, 7(5)∶ e36957.DOI∶10.1371/journal.pone.0036957.
[13] 凌代文, 东秀珠. 乳酸菌的分离鉴定及实验基础[M]. 北京∶ 中国轻工业出版社, 1999∶ 142-143.
[14] MORITA H, NAKANO A, ONODA H, et al. Bifidobacterium kashiwanohense sp. nov., isolated from healthy infant faeces[J].International Journal of Systematic and Evolutionary Microbiology,2011, 61(11)∶ 2610-2615. DOI:10.1099/ijs.0.024521-0.
[15] MODESTO M, MICHELINI S, STEFANINI I, et al. Bifidobacterium aesculapii sp. nov., from the faeces of the baby common marmoset(Callithrix jacchus)[J]. International Journal of Systematic and Evolutionary Microbiology, 2014, 64(8)∶ 2819-2827. DOI:10.1099/ijs.0.056937-0.
[16] 王涛, 孟祥晨. 一株来源于健康成人粪便双歧杆菌的分离及鉴定[J].东北农业大学学报, 2008, 39(7)∶ 107-111.
[17] DELÉTOILE A, PASSET V, AIRES J, et al. Species delineation and clonal diversity in four Bifidobacterium species as revealed by multilocus sequencing[J]. Research in Microbiology, 2010, 161(2)∶ 82-90.DOI:10.1016/j.resmic.2009.12.006.
[18] DAN T, LIU W, SUN Z, et al. A novel multi-locus sequence typing(MLST) protocol for Leuconostoc lactis isolates from traditional dairy products in China and Mongolia[J]. BMC Microbiology, 2014, 14(1)∶ 1.DOI:10.1186/1471-2180-14-150.
[19] TSUCHIDA S, TAKAHASHI S, NGUEMA P P, et al. Bifidobacterium moukalabense sp. nov. isolated from the faeces of wild west lowland gorilla(Gorilla gorilla gorilla)[J]. International Journal of Systematic &Evolutionary Microbiology, 2014, 64(Pt 2)∶ 449-455. DOI:10.1099/ijs.0.055186-0.
[20] KIM M S, ROH S W, BAE J W. Bifidobacterium stercoris sp. nov.,isolated from human faeces[J]. International Journal of Systematic and Evolutionary Microbiology, 2010, 60(12)∶ 2823-2827. DOI:10.1099/ijs.0.019943-0.
[21] CHOI J H, LEE K M, LEE M K, et al. Bifidobacterium faecale sp. nov., isolated from human faeces[J]. International Journal of Systematic and Evolutionary Microbiology, 2014, 64(9)∶ 3134-3139.DOI:10.1099/ijs.0.063479-0.
[22] ZHU L, LI W, DONG X. Species identification of genus Bifidobacterium based on partial HSP60 gene sequences and proposal of Bifidobacterium thermacidophilum subsp. porcinum subsp. nov[J].International Journal of Systematic and Evolutionary Microbiology,2003, 53(5)∶ 1619-1623. DOI:10.1099/ijs.0.02617-0.
[23] BAFFONI L, STENICO V, STRAHSBURGER E, et al. Identification of species belonging to the Bifidobacterium genus by PCR-RFLP analysis of a hsp60 gene fragment[J]. BMC Microbiology, 2013,13(1)∶ 1. DOI:10.1186/1471-2180-13-149.
[24] BUNESOVA V, KILLER J, VLKOVA E, et al. Isolation and characterization of bifidobacteria from ovine cheese[J]. International Journal of Food Microbiology, 2014, 188∶ 26-30. DOI:10.1016/j.ijfoodmicro.2014.07.001.
[25] VENTURA M, CANCHAYA C, DEL CASALE A, et al. Analysis of bifidobacterial evolution using a multilocus approach[J]. International Journal of Systematic and Evolutionary Microbiology, 2006, 56(12)∶2783-2792. DOI:10.1099/ijs.0.64233-0.
[26] UNDERWOOD M A, GERMAN J B, LEBRILLA C B, et al.Bifidobacterium longum subspecies infantis∶ champion colonizer of the infant gut[J]. Pediatric Research, 2014, 77(1/2)∶ 229-235.DOI∶10.1038/pr.2014.156.
[27] GADAGKAR S R, ROSENBERG M S, KUMAR S. Inferring species phylogenies from multiple genes∶ concatenated sequence tree versus consensus gene tree[J]. Journal of Experimental Zoology Part B∶ Molecular and Developmental Evolution, 2005, 304(1)∶ 64-74.DOI:10.1002/jez.b.21026.
[28] WU Y C, RASMUSSEN M D, BANSAL M S, et al. TreeFix∶ statistically informed gene tree error correction using species trees[J]. Systematic Biology, 2013, 62(1)∶ 110-120. DOI:10.1093/sysbio/sys076.
[29] ZHANG M, HANG X, TAN J, et al. The host genotype and environment affect strain types of Bifidobacterium longum subsp. longum inhabiting the intestinal tracts of twins[J]. Applied and Environmental Microbiology,2015, 81(14)∶ 4774-4781. DOI:10.1128/AEM.00249-15.
[30] MAKINO H, KUSHIRO A, ISHIKAWA E, et al. Transmission of intestinal Bifidobacterium longum subsp. longum strains from mother to infant determined by multilocus sequencing typing and amplified fragment length polymorphism[J]. Cancer Letters, 2011, 71(1/2/3)∶ 19-24.DOI:10.1128/AEM.05346-11.
Isolation and Diversity Analysis of Bifidobacterium longum from Infant Faeces
ZHANG Qiuxue, LIU Xiaochan, ZHU Zongtao, WAN Feng, SUN Sirui, JIA Fangfang, MENG Xiangchen*
(Key Laboratory of Dairy Science, Ministry of Education, Northeast Agricultural University, Harbin 150030, China)
The aim of this experiment was to study the diversity of Bifidobacterium longum isolated from infant feces.Using modified MRS medium, bifidobacterial strains were isolated from the feces of healthy infants in Harbin. To identify and analyze the diversity of B. longum strains, we used physiological and biochemical experiments, 16S rDNA homology analysis, heat-shock protein 60 gene (hsp60) homology analysis, random amplified polymorphism DNA (RAPD) and multilocus sequence typing (MLST). Eighteen anaerobic strains were isolated, among which, 7 were identified as B. longum subsp. longum, and 3 as B. longum subsp. infantis according to morphology, physical and biochemical properties, 16S rDNA homology analysis and hsp60 homology analysis. The results of RAPD and MLST showed that the 7 strains of B. longum subsp. longum belonged to 6 genotypes while the 3 strains of B. longum subsp. infantis belonged to 2 genotypes. Overall,these results showed that there were differences in the diversity of B. longum isolated from infant feces.
Bifidobacterium longum; heat-shock protein 60 gene (hsp60); random amplified polymorphism DNA (RAPD);multilocus sequence typing (MLST)
DOI∶10.7506/spkx1002-6630-201724002
TS201.3
A
1002-6630(2017)24-0008-07
张秋雪, 刘晓婵, 朱宗涛, 等. 婴儿粪便长双歧杆菌的分离与多样性分析[J]. 食品科学, 2017, 38(24)∶ 8-14. DOI∶10.7506/spkx1002-6630-201724002. http∶//www.spkx.net.cn
ZHANG Qiuxue, LIU Xiaochan, ZHU Zongtao, et al. Isolation and diversity analysis of Bifidobacterium longum from infant faeces[J]. Food Science, 2017, 38(24)∶ 8-14. (in Chinese with English abstract) DOI∶10.7506/spkx1002-6630-201724002.http∶//www.spkx.net.cn
2016-11-25
国家自然科学基金面上项目(31671917)
张秋雪(1992—),女,硕士研究生,研究方向为食品微生物与生物技术。E-mail:zqx823@163.com
*通信作者:孟祥晨(1970—),女,教授,博士,研究方向为食品微生物与生物技术。E-mail:xchmeng@163.com
猜你喜欢
——和田盘羊
