miR-106b在非小细胞肺癌细胞A549中的表达变化及意义
2017-12-11李磊倪正义汤中文周密
李磊,倪正义,汤中文,周密
(武汉市医疗救治中心,武汉430000)
miR-106b在非小细胞肺癌细胞A549中的表达变化及意义
李磊,倪正义,汤中文,周密
(武汉市医疗救治中心,武汉430000)
目的观察miR-106b在非小细胞肺癌细胞A549中的表达变化,并探讨其对细胞迁移、侵袭的影响及可能机制。方法采用荧光定量PCR法检测非小细胞肺癌细胞A549及正常肺表皮细胞系HPL-1中miR-106b相对表达量。将非小细胞肺癌细胞A549分为miR-106b模拟物组、miR-106b抑制物组和阴性对照组,采用Lipofectamine 2000转染法分别转染miR-106b mimics、miR-106b inhibit及scramble。培养24 h,采用荧光定量PCR法检测miR-106b相对表达量,进行细胞划痕试验、Transwell细胞侵袭试验检测细胞迁移和侵袭能力(分别以划痕愈合率、穿膜细胞数表示),采用荧光定量PCR法和Western blotting法检测墨角藻糖基转移酶6(FUT6)mRNA及蛋白表达。结果非小细胞肺癌细胞A549及正常肺表皮细胞HPL-1中miR-106b相对表达量分别为5.37±0.42、1.00,二者比较P<0.01。miR-106b模拟物组、miR-106b抑制物组及阴性对照组miR-106b相对表达量分别为8.94±0.73、0.21±0.03、1.00,组间两两比较P均<0.05。miR-106b模拟物组、阴性对照组划痕愈合率、穿膜细胞数均高于miR-106b抑制物组,FUT6 mRNA 及蛋白相对表达量均低于miR-106b抑制物组,但miR-106b模拟物组变化更明显(P均<0.05)。结论非小细胞肺癌细胞A549中miR-106b表达升高;过表达miR-106b可能通过下调FUT6表达而促进非小细胞肺癌细胞的迁移与侵袭。
非小细胞肺癌;微小RNA-106b;细胞迁移;细胞侵袭;墨角藻糖基转移酶6
据国际肿瘤研究机构统计,2012年约180万人被诊断为肺癌,占所有恶性肿瘤的13%[1,2]。肺癌可分为小细胞肺癌和非小细胞肺癌,小细胞肺癌主要采用化疗等全身治疗,非小细胞肺癌可采用手术、化疗等综合治疗,目前关于非小细胞肺癌的发病机制仍不十分清楚。微小RNA(miRNA)是一类非编码长链RNA,长度为19~22 nt,可在转录后水平调控靶基因表达[3],广泛参与肿瘤细胞的增殖、凋亡、侵袭及转移等生物学过程[4,5]。miR-106b定位于染色体7q22.1上[6],其在非小细胞肺癌中的作用鲜见报道。2015年5月~2016年5月,本研究观察了miR-106b在非小细胞肺癌细胞中的表达变化及其对细胞迁移、侵袭的影响,并探讨其可能的机制。
1 材料与方法
1.1 材料 细胞:非小细胞肺癌细胞A549及正常肺表皮细胞HPL-1均购自协和医科大学实验中心。主要试剂:DMEM培养基、TRIzol试剂均购自美国Invitrogen公司,实验所需一抗均购自美国BD公司,二抗购自武汉博士德生物科技有限公司。主要仪器:NanoDrop1000紫外分光光度计购自美国Thermo Scientific公司,7900HT荧光定量PCR系统购自美国Applied Biosystems公司,WimScratch在线图像分析系统购于德国Wimasis GmbH公司。miR-106b mimics及scramble质检均由广州锐博生物科技有限公司合成。
1.2 A549细胞及HPL-1细胞miR-106b表达检测 采用荧光定量PCR法。取A549细胞及HPL-1细胞,以1×103个接种于DMEM培养基(添加10% FBS),37 ℃、5% CO2条件下,培养48 h,待细胞长至铺满培养皿后,加入细胞裂解液,TRIzol试剂提取总RNA,采用NanoDrop1000紫外分光光度计检测RNA浓度合格。采用7900HT荧光定量PCR仪进行PCR反应。引物序列:miR-106b正向引物:5′-CCTGCCGGGGCTAAAGTGCT-3′,反向引物:5′-TGCTGGAGCAGCAAGTACCC-3′,引物长度20 bp。内参β-actin正向引物: 5′-TGGCACCCAGCACAATGAA-3′, 反向引物:5′-CTAAGTCATAGTCCGCCTAGAAGCA-3′,引物长度19 bp。PCR反应体系:1×Taq Buffer 2 μL,MgCl21.2 μL,dNTP 0.2 μL,上下游引物各0.4 μL, cDNA模板 1 μL,DEPC水14.7 μL,Taq酶0.1 μL。反应条件:95 ℃预变性10 min,95 ℃变性15 s,60 ℃退火1 min,72 ℃延伸45 s,4 ℃条件下共40个循环。以2-ΔΔCt法计算miR-106b相对表达量。
1.3 A549细胞分组处理 将A549细胞以2×103/孔的密度接种于24孔板(DMEM培养基),置于37 ℃、5% CO2培养箱中,培养48 h后进行传代。将对数生长期的A549细胞随机分为miR-106b模拟物组、miR-106b抑制物组及阴性对照组,采用Lipofectamine 2000脂质体转染试剂盒分别转染miR-106b mimics、miR-106b inhibit及scramble,转染RNA浓度为300 nmol/孔。
1.4 miR-106b表达检测 取处理24 h的三组细胞,采用荧光定量PCR法检测miR-106b相对表达量。具体步骤同1.2。
1.5 细胞迁移能力检测 采用细胞划痕试验。将三组细胞以2×104个/孔接种于6孔板中,培养24 h。待细胞融合至100%后,用灭菌枪头沿直线用力划直线。划痕后即刻及48 h后在显微镜下观察细胞划痕修复情况,使用WimScratch在线图像分析系统检测细胞划痕面积,计算划痕愈合率。划痕愈合率=(划痕后即刻划痕面积-划痕后48 h划痕面积)/划痕后即刻划痕面积×100%。实验重复3次,取平均值。划痕愈合率越高,表示细胞迁移能力越强。
1.6 细胞侵袭能力检测 采用Transwell细胞侵袭试验。将三组细胞以3×104个/孔接种于Transwell小室的碳酸磷脂表面,上室BioCoat TM包被Matrigel基质胶,37 ℃培养24 h。取出上层小室,将膜下面的细胞与1%多聚甲醛混合,用0.2%结晶紫溶液染色15 min。光学显微镜下随机取10个视野,计数进入膜下的细胞数量(下称穿膜细胞数)。实验重复3次,取平均值。
1.7 细胞墨角藻糖基转移酶6(FUT6)mRNA及蛋白表达检测 ① FUT6 mRNA表达:采用荧光定量PCR法。取三组对数生长期细胞,参照1.2的步骤采用荧光定量PCR法检测三组细胞FUT6 mRNA相对表达量。FUT6上游引物:5′-AAGATGAAACAGA-TCTGGAC-3′,下游引物:5′-CACGATGACGAAACTGCAGT-3′;内参GAPDH上游引物:5′-TATGCTCTCCTCATGCATTG-3′,下游引物: 5′-GGGACGACCTTC-GATCTACC-3′。②FUT6蛋白表达:采用Western blotting法。取三组对数生长期细胞,待细胞融合至100%后,加入裂解液提取细胞总蛋白,以每孔30 μg总蛋白上样,常规湿法转膜,5%脱脂奶粉封闭2 h。分别加入FUT6、GAPDH一抗过夜,抗体稀释度均为1∶200;加入二抗山羊抗鼠(1∶1 000)孵育2 h。ECL化学发光,凝胶成像系统显影。采用Quantity One 1-D分析软件对蛋白质印迹条带进行定量。以目的蛋白与GAPDH条带灰度值的比值作为FUT6蛋白相对表达量。
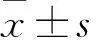
2 结果
2.1 A549细胞及HPL-1细胞miR-106b表达比较 A549细胞及HPL-1细胞miR-106b相对表达量分别为5.37±0.42、1.00,二者比较P<0.01。
2.2 三组miR-106b表达比较 miR-106b模拟物组、miR-106b抑制物组及阴性对照组miR-106b相对表达量分别为8.94±0.73、0.21±0.03、1.00,组间两两比较P均<0.05。
2.3 三组细胞迁移、侵袭能力比较 miR-106b模拟物组、阴性对照组划痕愈合率、穿膜细胞数均高于miR-106b抑制物组,但miR-106b模拟物组升高更明显(P均<0.05)。见表1。
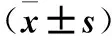
表1 三组划痕愈合率、穿膜细胞数比较
注:与阴性对照组比较,*P<0.05;与miR-106b抑制物组比较,#P<0.05。
2.4 三组FUT6 mRNA及蛋白表达比较 miR-106b模拟物组、阴性对照组FUT6 mRNA 及蛋白相对表达量均低于miR-106b抑制物组,但miR-106b模拟物组降低更明显(P均<0.05)。见表2。
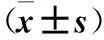
表2 三组FUT6 mRNA及蛋白相对表达量比较
注:与阴性对照组比较,*P<0.05;与miR-106b抑制物组比较,#P<0.05。
3 讨论
肿瘤的发生、发展是多种癌基因与抑制基因突变的结果,包括p53[7]、p21[8]、miRNA[5]等。miRNA属于非编码长链RNA,长度为19~22 nt,可在转录后水平通过与靶基因结合而下调靶基因表达。miRNA广泛参与肿瘤细胞的增殖、凋亡、侵袭及转移等生物学过程[4,5]。miR-106b是miR-106b-25家族中的一员[6],在膀胱癌[9]、肾细胞癌[10]、喉癌[11]、肝细胞癌[12]细胞中表达升高,而在子宫内膜癌[13]细胞中表达降低。肾细胞癌组织miR-106b表达较癌旁正常组织升高,应用miR-106b抑制剂转染肾细胞癌细胞系后,可抑制其增殖、迁移,诱导细胞凋亡[14]。Yang等[15]报道,miR-106b在胃癌细胞中高表达,并可促进胃癌细胞侵袭和迁移,与患者预后密切相关。miR-106b在乳腺癌细胞中呈高表达,与淋巴结转移相关;miR-106b可激活Wnt信号通路,并介导β-链蛋白(β-catenin)入核,进而增强乳腺癌细胞的侵袭和迁移能力[16]。miR-106b还可抑制Smad7蛋白表达,激活转化生长因子α(TGF-α)TGF-α/Smad信号通路,进而诱导乳腺癌细胞发生上皮间质转化[17]。在卵巢癌细胞中,miR-106b呈高表达,并通过靶向结合DAB2基因、促进TGF-α表达而参与卵巢癌细胞迁移[18]。结肠癌细胞miR-106b表达高于正常结肠细胞,miR-106b高表达与结肠癌患者的临床分期及淋巴结转移相关,可能通过靶向结合DLC1基因而促进结肠癌细胞迁移和侵袭[19]。miR-106b在垂体瘤细胞中高表达,双荧光素酶实验显示miR-106b与PTEN 基因的3′-UTR区靶向结合,通过PI3K/AKT信号通路而调控肿瘤细胞的增殖与侵袭[20]。与之相反,miR-106b在甲状腺癌细胞中呈低表达,双荧光素酶实验显示miR-106b可与C1orf24基因靶向结合,并诱导甲状腺癌细胞凋亡、抑制细胞侵袭[21]。以上研究结果提示miR-106b在不同的肿瘤中可能具有不同的作用。
本研究结果显示,A549细胞miR-106b相对表达量明显高于HPL-1细胞,提示miR-106b在非小细胞肺癌细胞中呈高表达,与其在胃癌、乳腺癌、肾细胞癌、卵巢癌、结肠癌及垂体瘤组织中的表达变化一致[14~20]。本研究结果显示,miR-106b模拟物组、阴性对照组划痕愈合率、穿膜细胞数均高于miR-106b抑制物组,但miR-106b模拟物组升高更明显;说明升高miR-106b表达可促进A549细胞的迁移和侵袭,miR-106b在非小细胞肺癌的发生过程中具有促癌基因的作用。FUT6是墨角藻糖基转移酶家族中的一员,在乳腺癌细胞中呈低表达,上调FUT6表达可降低乳腺癌细胞系MDA-MB-231增殖、侵袭和迁移能力[22]。在肝癌细胞系中,siRNA 靶向沉默FUT6可降低肿瘤相关抗原sLeX表达及人肝癌细胞株HepG2的迁移和侵袭能力[23]。本研究结果显示,miR-106b模拟物组、阴性对照组FUT6 mRNA 及蛋白相对表达量均低于miR-106b抑制物组,但miR-106b模拟物组降低更明显;说明升高miR-106b表达可降低A549细胞FUT6表达,FUT6可能是miR-106b的负向靶控基因。
综上所述,A549细胞中miR-106b升高;过表达miR-106b可能通过下调FUT6表达而促进A549细胞的迁移与侵袭。miR-106b可能成为非小细胞肺癌的一个新的治疗靶点,但是其促进A549细胞迁移、侵袭的相关机制以及FUT6是否为miR-106b的靶基因仍需进一步探讨。
[1] Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015,65(2):87-108.
[2] Chen W, Zheng R, Zeng H, et al. The incidence and mortality of major cancers in China, 2012[J]. Chin J Cancer, 2016,35(1):73.
[3] Lee RC, Ambros V. An extensive class of small RNAs in caenorhabditis elegans[J]. Science, 2001,294(5543):862-864.
[4] Krol J, Loedige I, Filipowicz W. The widespread regulation of microRNA biogenesis, function and decay[J]. Nat Rev Genet, 2010,11(9):597-610.
[5] 李振华,黄瑊,胡振红,等.miR-124对非小细胞肺癌细胞迁移和侵袭的影响及机制[J].山东医药,2016,56(22):18-20.
[6] Carvalheira G, Nozima BH, Cerutti JM. microRNA-106b-mediated down-regulation of C1orf24 expression induces apoptosis and suppresses invasion of thyroid cancer[J]. Oncotarget, 2015,6(29):28357-28370.
[7] 张珏,蔡鸿宁,高晗,等.不同卵巢肿瘤组织中KI-67、P53、C23、EGFR 蛋白的表达变化及其意义[J].山东医药,2016,56(19):67-69.
[8] 陈宏伟,王春华,李军良,等.肝细胞肝癌组织中p21 活化蛋白激酶6的表达及意义[J].山东医药,2014,54(20):65-67.
[9] Ratert N, Meyer HA, Jung M, et al. miRNA profiling identifies candidate mirnas for bladder cancer diagnosis and clinical outcome[J]. J Mol Diagn, 2013,15(5):695-705.
[10] Slaby O, Jancovicova J, Lakomy R, et al. Expression of miRNA-106b in conventional renal cell carcinoma is a potential marker for prediction of early metastasis after nephrectomy[J]. J Exp Clin Cancer Res, 2010,29(7):90.
[11] Cai K, Wang Y, Bao X. MiR-106b promotes cell proliferation via targeting RB in laryngeal carcinoma[J]. J Exp Clin Cancer Res, 2011,30(8):73.
[12] Li BK, Huang PZ, Qiu JL, et al. Upregulation of microRNA-106b is associated with poor prognosis in hepatocellular carcinoma[J]. Diagn Pathol, 2014,9(1):226.
[12] Dong P, Kaneuchi M, Watari H, et al. MicroRNA-106b modulates epithelial-mesenchymal transition by targeting TWIST1 in invasive endometrial cancer cell lines[J]. Mol Carcinog, 2014,53(5):349-359.
[14] Li Y, Chen D, Su Z, et al. MicroRNA106b functions as an oncogene in renal cell carcinoma by affecting cell proliferation, migration and apoptosis[J]. Mol Med Rep, 2016,13(2):1420-1426.
[15] Yang TS, Yang XH, Chen X, et al. MicroRNA-106b in cancer-associated fibroblasts from gastric cancer promotes cell migration and invasion by targeting PTEN[J]. FEBS Lett, 2014,588(13):2162-2169.
[16] Gong C, Qu S, Lv XB, et al. BRMS1L suppresses breast cancer metastasis by inducing epigenetic silence of FZD10[J]. Nat Commun, 2014,19(5):5406.
[17] Smith AL, Iwanaga R, Drasin DJ, et al. The miR-106b-25 cluster targets Smad7, activates TGF-α signaling, and induces EMT and tumor initiating cell characteristics downstream of Six1 in human breast cancer[J]. Oncogene, 2012,31(50):5162-5171.
[18] Cheng Y, Guo Y, Zhang Y, et al. MicroRNA-106b is involved in transforming growth factor α1-induced cell migration by targeting disabled homolog 2 in cervical carcinoma[J]. J Exp Clin Cancer Res, 2016,35(1):1.
[19] Zhang G, Li J, Zhou H, et al. MicroRNA-106b promotes colorectal cancer cell migration and invasion by directly targeting DLC1[J]. J Exp Clin Cancer Res, 2015,34(30):73.
[20] Zhou K, Zhang T, Fan Y D, et al. MicroRNA-106b promotes pituitary tumor cell proliferation and invasion through PI3K/AKT signaling pathway by targeting PTEN[J]. Tumor Biol, 2016,37(10):13469-13477.
[21] Carvalheira G, Nozima BH, Cerutti JM. microRNA-106b-mediated down-regulation of C1orf 24 expression induces apoptosis and suppresses invasion of thyroid cancer[J]. Oncotarget, 2015,6(29): 28357-28370.
[22] Li N, Liu Y, Miao Y, et al. MicroRNA‐106b targets FUT6 to promote cell migration, invasion, and proliferation in human breast cancer[J]. IUBMB life, 2016, 68(9):764-775.
[23] 李锦良,陈德,向广阳,等.SiRNA沉默FUT6基因对HepG2细胞侵袭和迁移能力的影响[J].实用医学杂志,2014,30(20):3229-3232.
ExpressionchangesofmiR-106binnon-small-celllungcancercelllineA549
LILei,NIZhengyi,TANGZhongwen,ZHOUMi
(WuhanMedicalTreatmentCenter,Wuhan430000,China)
ObjectiveTo observe the expression changes of miR-106b in non-small-cell lung cancer (NSCLC) cell line A549, and to investigate its effects on cell migration and invasion, as well as the regulatory mechanism.MethodsThe expression level of miR-106b was measured in A549 and HPL-1 cells by the fluorescent quantitative PCR. A549 cells were divided into three groups. The miR-106b mimics group was transfected with miR-106b mimics, the miR-106b inhibition group with miR-106b inhibit, and the control group with scramble. The relative expression level of miR-106b was measured by real-time fluorescent quantitative PCR (qRT-PCR) at 24 h after culture. The migration and invasion abilities in the three groups were measured by Scratch test and Transwell invasion assay. The expression levels of FUT6 mRNA and protein were measured in these three groups by fluorescent quantitative PCR and Western blotting, respectively.ResultsThe expression level of miR-106b in the A549 cells was 5.37±0.42, which was higher than that of HPL-1 cells (1.0),P<0.01. The expression level of miR-106b was 8.94±0.73 in the miR-106b mimics group, 0.21±0.03 in the miR-106b inhibit group and 1.0 in the control group, respectively, and the difference was significant, allP<0.05. The wound healing rate and the number of invasive cells in the miR-106b mimics group and control group were significantly higher than those of the miR-106 inhibition group, while the expression levels of FUT6 mRNA and protein were significantly lower than those in the miR-106b inhibit group, and the change in the miR-106b mimics group was more significance (allP<0.05).ConclusionThe miR-106b is up-regulated in the NSCLC A549 cells and the over-expression of miR-106b promotes the migration and invasion of NSCLC by down-regulating FUT6 expression.
non-small-cell lung cancer; microRNA-106b; cell migration; cell invasion; fucosyltransferase VI
武汉市应用基础研究计划项目。
李磊(1979-),男,主治医师,研究方向为肺癌的基础与临床。E-mail: lileiwuhan899@126.com
周密(1974-),男,副主任医师,研究方向为肺癌的基础与临床。E-mail: mizhou768@126.com
10.3969/j.issn.1002-266X.2017.44.006
R734.2
A
1002-266X(2017)44-0022-04
2017-03-27)
