miR-106b在鼻咽癌组织中表达及对鼻咽癌CNE-2细胞生物学特性的影响
2017-07-01周士霞王海莉王豪勋
周士霞,王海莉,王豪勋
(郑州大学第二附属医院,郑州 450014)
miR-106b在鼻咽癌组织中表达及对鼻咽癌CNE-2细胞生物学特性的影响
周士霞,王海莉,王豪勋
(郑州大学第二附属医院,郑州 450014)
目的 探讨miR-106b在鼻咽癌组织中的表达及其对鼻咽癌CNE-2细胞生物学特性的影响。方法 选取68例份初治鼻咽癌患者的手术切除标本和45例份鼻咽炎患者的鼻咽部活检组织标本,采用实时荧光定量PCR法检测miR-106b表达,分析miR-106b表达与鼻咽癌患者临床病理参数的关系。取体外培养的对数生长期人鼻咽癌细胞株CNE-2分为四组(1×106个/组)。miR-106b模拟物组、miR-106b抑制物组分别转染miR-106b模拟物及miR-106b抑制物序列,阴性对照组转染阴性对照序列,空白对照组不处理;采用实时荧光定量PCR技术检测各组miR-106b表达,MTT法检测各组细胞增殖情况(以吸光度值表示),流式细胞仪检测各组细胞周期,Transwell试验检测各组细胞迁移和侵袭能力。结果 鼻咽癌及鼻咽炎组织miR-106b相对表达量分别为1.57±0.15、1.14±0.12,二者比较P<0.05; miR-106b相对表达量与鼻咽癌患者淋巴结转移、侵犯颈动脉鞘和侵犯颅底有关(P均<0.05)。各组miR-106b相对表达量:miR-106b模拟物组高于miR-106b抑制物组、阴性对照组和空白对照组,miR-106b抑制物组低于阴性对照组和空白对照组,P均<0.05;各组细胞增殖情况:miR-106b模拟物组细胞接种后24、48、72和96 h时吸光度值均高于miR-106b抑制物组、阴性对照组和空白对照组,而miR-106b抑制物组低于阴性对照组和空白对照组,P均<0.05;各组细胞周期:miR-106b模拟物组S期细胞比例高于miR-106b抑制物组、阴性对照组和空白对照组,而miR-106b抑制物组细胞S期比例低于阴性对照组和空白对照组,P均<0.05;各组细胞迁移和侵袭情况:miR-106b模拟物组迁移和侵袭细胞数均高于miR-106b抑制物组、阴性对照组和空白对照组,且miR-106b抑制物组均低于阴性对照组和空白对照组,P均<0.05。结论 miR-106b在鼻咽癌组织中呈高表达; miR-106b过表达可促进鼻咽癌CNE-2细胞增殖、迁移和侵袭能力。
鼻咽癌;微小RNA-106b;CNE-2细胞;细胞增殖;细胞迁移
微小RNA(miRNA)是广泛存在于生物体内的高度保守的短小RNA,在细胞增殖、分化、迁移等多种生物学过程中发展重要作用,且参与了多种恶性肿瘤的发生、侵袭、转移过程[1~3]。miR-106b作为miRNA的重要成员,与原癌基因簇成员miR-17、miR-20有高度同源性,高表达于多种恶性肿瘤[4],且与肿瘤细胞增殖关系密切[5]。但有关miR-106b与鼻咽癌发病的相关性鲜有报道。本研究对鼻咽癌组织中miR-106b表达变化进行分析,并通过转染miR-106b模拟物和抑制物,探讨其对人鼻咽癌细胞株CNE-2增殖、迁移及侵袭能力的影响,以期为鼻咽癌发病机制的研究提供依据。
1 材料与方法
1.1 材料 选取68例份2014年2月有~2016年2月我院初治鼻咽癌患者[男43例、女25例,年龄27~81(47.6±11.5)岁;排除心肝肾等重要脏器严重功能障碍者以及糖尿病、恶性肿瘤患者]手术切除的癌组织标本,经病理学检查确诊。临床分期:Ⅰ~Ⅱ期31例,Ⅲ~Ⅳ期37例;发生颈淋巴结转移51例。选取同期行鼻咽部活检的45例慢性鼻咽炎患者[男29例、女16例,年龄(48.0±12.1)岁]手术切除的正常胃咽部组织标本,经病理学检查确诊。鼻咽癌患者与鼻咽炎患者性别、年龄具有可比性(P均>0.05)。人鼻咽癌细胞株CNE-2购自中科院上海生科院细胞资源中心,FBS、DMEM培养基、Lipofectamine 2000转染试剂盒均购自美国Invitrogen公司,MTT细胞增殖及细胞毒性检测试剂盒购自上海威奥生物公司,Transwell小室购自美国Corning公司,实时荧光定量PCR仪购自美国Bio-rad公司,FACSCalibur流式细胞仪购自美国BD公司。TRIzol总RNA提取试剂盒购自加拿大BBI公司,逆转录试剂盒和PCR试剂盒均购自大连宝生物公司,miR-106b及内参U6引物、miR-106b模拟物、miR-抑制物和阴性对照均由上海生工公司设计合成。
1.2 鼻咽组织miR-106b表达检测 采用实时荧光定量PCR法。取鼻咽癌及慢性鼻咽炎患者鼻咽部活检组织,研磨后加入细胞裂解液进行裂解,用TRIzol总RNA提取试剂盒对总RNA进行提取,并检测其纯度,取A260/A280≥1.80的标本作为合格样品。将总RNA逆转录为模板单链cDNA,以cDNA为模板,用PCR仪进行PCR扩增。PCR反应条件:94 ℃、60 s,92 ℃、30 s,56 ℃、30 s,74 ℃、30 s,连续进行38个循环。每个样品均设置3个平行反应复孔。采用2-ΔΔCt法获得不同组织中miR-106b相对表达量。分析miR-106b表达与鼻咽癌患者临床病理参数的关系。
1.3 miR-106b对CNE-2细胞生物学特性影响的观察
1.3.1 CNE-2细胞培养及分组处理 将CNE-2细胞培养于含100 μg/mL链霉素、100 U/mL青霉素和10% FBS中的DMEM完全培养基中,于5%CO2、37 ℃恒温培养箱中培养,待细胞生长丰度达到80%以上时,胰酶消化后传代培养。取对数生长期的CNE-2细胞,用无血清DMEM培养基重悬后,接种于6孔板,细胞密度5×104/mL,待细胞贴壁生长融合度达到50%以上后,用Lipofectamine 2000转染试剂盒按照操作说明对细胞进行转染。将细胞分成四组(1×106个/组):miR-106b模拟物组:转染miR-106b模拟物序列:5′-TAAAGTGCTGACAGTGCAGAT-3′;miR-106b抑制物组:转染miR-106b抑制物序列:5′-AUCUGCACUGUCAGCACUUUA-3′;阴性对照组:转染阴性对照序列:5′-CAGUACUUUUGUGUAGUACAA-3′;空白对照组:不做任何处理。
1.3.2 miR-106b表达检测 各转染组细胞培养48 h后加入细胞裂解液进行裂解,采用实时荧光定量PCR法检测miR-106b相对表达量。
1.3.3 细胞增殖率的测算 采用MTT法。取转染24 h细胞,胰酶消化后,接种于96孔板内,细胞数2.0×103/孔,分别于接种后12、24、48、72和96 h时,将孔板中液体吸出,加入新鲜培养基和MTT,置于5% CO2、37 ℃恒温箱中培养4 h,加入二甲基亚砜(DMSO),振荡12 min后,用酶标仪进行检测,取490 nm处吸光度(A)值。重复实验3次,取平均值。
1.3.4 细胞周期检测 采用流式细胞仪检测。取各转染组对数生长的细胞,接种于6孔板,细胞数1×105/孔,培养24 h后,胰酶消化后收集细胞,用预冷PBS洗涤3次,用乙醇固定,4 ℃下过夜孵育。加入碘化丙啶避光染色25 min,利用流式细胞仪检测各转染组细胞周期。重复实验3次,取平均值。
1.3.5 细胞迁移能力及侵袭能力检测 采用Transwell试验。细胞迁移能力:取各组转染后培养48 h细胞,胰酶消化后收集细胞,用无血清DMEM培养基重悬,调整细胞浓度为5×105个/mL,取200 μL细胞加入Transwell小室的上室,将含10%胎牛血清的DMEM培养基加入下室,于37 ℃培养箱中培养24 h,用甲醛进行固定,结晶紫染色后,用显微镜进行观察,随机选取5个高倍视野对穿膜细胞数进行计数,取平均数。重复实验3次。细胞侵袭能力:将50 μg的Matrigel胶将Transwell小室底部膜包被,37 ℃成胶30 min,其余步骤同上。重复实验3次,取平均值。
2 结果
2.1 鼻咽癌及鼻咽炎组织miR-106b表达比较 鼻咽癌组织、慢性鼻咽炎鼻咽组织中miR-106b相对表达量分别为1.57±0.15、1.14±0.12,二者比较差异有统计学意义(t=15.433,P<0.05)。miR-106b表达与鼻咽癌患者年龄、性别、临床分期无关(P均>0.05),而与淋巴结转移、侵犯颈动脉鞘和侵犯颅底有关(P均<0.05),详见表1。
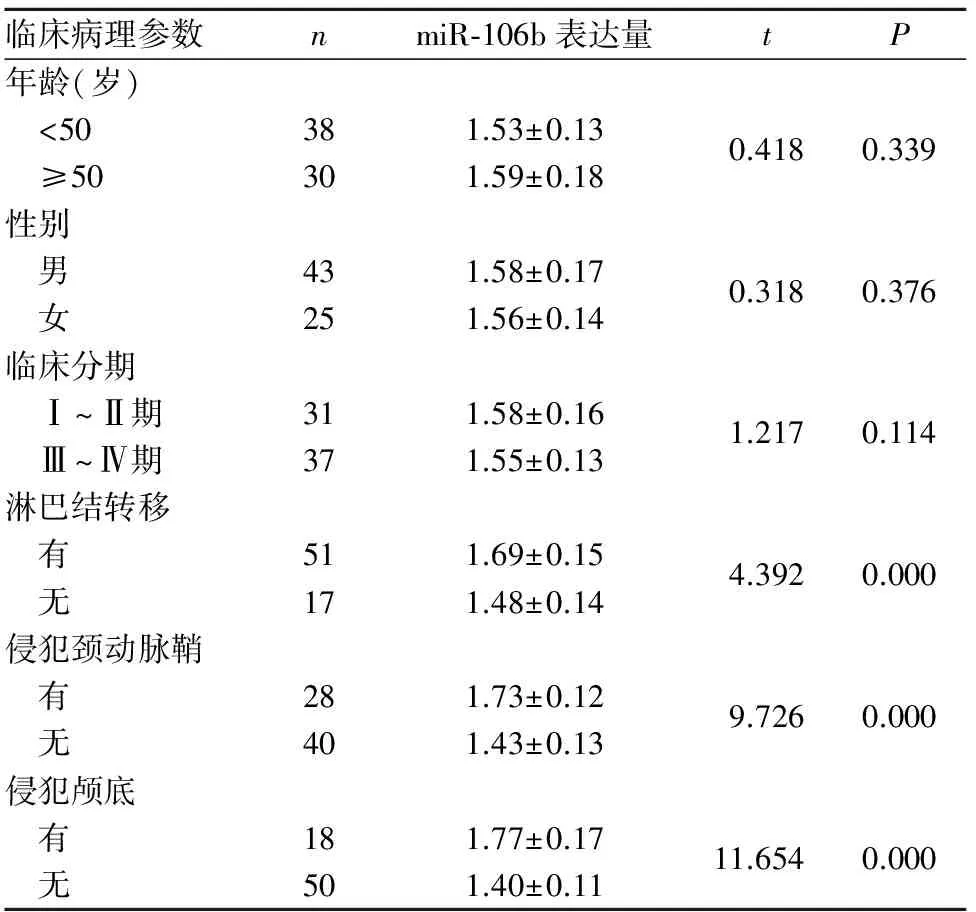
表1 miR-106b表达与鼻咽癌患者临床病理参数的关系
2.2 miR-106b对鼻咽癌细胞生物学特性的影响
2.2.1 各组细胞中miR-106b表达比较 miR-106b模拟物组miR-106b相对表达量为1.82±0.16,显著高于miR-106b抑制物组、阴性对照组和空白对照组,分别为1.07±0.09、1.31±0.13和1.33±0.14,且miR-106b抑制物组低于阴性对照组和空白对照组(P均<0.05)。
2.2.2 各组细胞增殖情况比较 见表2。
2.2.3 各组细胞周期比较 见表3。

表2 各组细胞增殖情况比较
注:与空白对照组相比,*P<0.05;与阴性对照组相比,△P<0.05;与miR-106b抑制物组相比,#P<0.05。
2.2.4 各组细胞迁移和侵袭能力比较 见表4。
3 讨论
miR-106b为miRNA的重要类型,参与了细胞增殖、分化、凋亡过程。研究发现, miR-106b过表达可促进肝细胞肝癌细胞增殖和转移[7];miR-106b高表达于喉鳞状细胞癌,通过负性调控APC基因而促进喉鳞状细胞癌Hep-2细胞增殖[8]。本研究结果显示,鼻咽癌组织中miR-106b相对表达量显著高于慢性鼻咽炎组织,提示miR-106b可能参与了鼻咽癌的发生过程; miR-106b表达量与鼻咽癌患者年龄、 性别、原发灶大小和临床分期无关,而与淋巴结转移、侵犯颈动脉鞘和侵犯颅底有关,提示鼻咽癌患者发生颈淋巴结转移、出现侵犯颈动脉鞘和侵犯颅底时,肿瘤组织中miR-106表达水平显著升高,miR-106b可能与鼻咽癌局部侵袭和淋巴结及远处转移有关。

表3 各组细胞周期情况比较
注:与空白对照组相比,*P<0.05;与阴性对照组相比,△P<0.05;与miR-106b抑制物组相比,#P<0.05。

表4 各组细胞迁移和侵袭能力比较(个
注:与空白对照组相比,*P<0.05;与阴性对照组相比,△P<0.05;与miR-106b抑制物组相比,#P<0.05。
本研究为进一步研究miR-106b对鼻咽癌细胞株CNE-2增殖、迁移及侵袭能力的影响,利用细胞转染技术,特异性上调或抑制细胞中miR-106b表达,结果显示,miR-106b模拟物组细胞中miR-106b相对表达量显著高于miR-106b抑制物组、阴性对照组和空白对照组,且miR-106b抑制物组明显低于阴性对照组和空白对照组,说明转染miR-106b模拟物或抑制物可特异性使细胞中miR-106b表达上调或抑制。miR-106b模拟物组细胞接种后24、48、72和96 h时A值均明显高于miR-106b抑制物组、阴性对照组和空白对照组,而miR-106b抑制物组明显低于阴性对照组和空白对照组,说明上调miR-106b可加速CNE-2细胞增殖,而抑制miR-106b表达则可抑制CNE-2细胞增殖,提示miR-106b参与了CNE-2细胞增殖过程。miR-106b模拟物组细胞S期比例明显高于miR-106b抑制物组、阴性对照组和空白对照组,miR-106b抑制物组细胞S期比例明显低于阴性对照组和空白对照组,说明miR-106b可能通过调控细胞周期而参与细胞增殖过程,与叶敏华等[9]研究结论相同。近年来文献报道,miR-106b调控细胞周期的机制可能与调控了细胞周期中的一些相关因子有关[10]。有研究通过对调控细胞周期的相关基因进行筛选发现,p21/CDKN1A是miR-106b的直接作用靶位[11];miR-106b可通过激活转录因子E2F1而促使G1/S期的转化[12]。本研究结果显示,miR-106b模拟物组迁移细胞数和侵袭细胞数均明显高于miR-106b抑制物组、阴性对照组和空白对照组,且miR-106b抑制物组均低于阴性对照组和空白对照组,说明miR-106b可能参与了CNE-2细胞迁移和侵袭过程,但具体机制尚待进一步研究明确。
综上所述,miR-106b在鼻咽癌组织中呈高表达,过表达miR-106b可促进鼻咽癌CNE-2细胞增殖、迁移和侵袭能力,其机制可能与促进细胞进入S期有关;提示miR-106b有望成为鼻咽癌基因治疗的潜在靶点。
[1] 王盼盼,季明芳,吴标华.鼻咽癌高发区人群患鼻咽癌风险率的动态观察[J].中华肿瘤防治杂志,2014,21(15):1144-1147.
[2] Kim W, Lee WB, Lee J, et al. Traditional herbal medicine as adjunctive therapy for nasopharyngeal cancer: a systematic review and meta-analysis[J]. Integr Cancer Ther, 2015,14(3):212-220.
[3] Mori M, Triboulet R, Mohseni M, et al. Hippo signaling regulates microprocessor and links cell-density-dependent miRNA biogenesis to cancer[J]. Cell, 2014,156(5):893-906.
[4] 董曦,孙桂波,邢小燕,等.Micro RNA-106b-25簇与肿瘤[J].中国药理学通报,2014,30(12):1639-1641.
[5] Tan W, Li Y, Lim SG, et al. miR-106b-25/miR-17-92 clusters: polycistrons with oncogenic roles in hepatocellular carcinoma[J]. World J Gastroenterol, 2014,20(20):5962-5972.
[6] Tian Y, Tian Y, Zhang W, et al. Junctional adhesion molecule-A, an epithelial-mesenchymal transition inducer, correlates with metastasis and poor prognosis in human nasopharyngeal cancer[J]. Carcinogenesis, 2015,36(1):41-48.
[7] 申刚,嘉红云,陈德基,等.miR-106b表达对人肝细胞肝癌细胞增殖能力的影响[J].中华肿瘤杂志,2014,36(7):489-495.
[8] 段继惠,杨磊,王巍,等.微小RNA-106b靶向下调腺瘤性息肉病基因表达促进Hep-2细胞的增殖[J].中华实验外科杂志,2015,32(7):1650-1652.
[9] 叶敏华,张安玲,吴雷,等.反义抑制miR-106b表达对人脑胶质瘤细胞增殖和侵袭的影响[J].中华神经外科杂志,2015,31(1):60-65.
[10] Xiang W, He J, Huang C, et al. miR-106b-5p targets tumor suppressor gene SETD2 to inactive its function in clear cell renal cell carcinoma[J]. Oncotarget, 2015,6(6):4066-4079.
[11] Prasad R, Katiyar SK. Down-regulation of miRNA-106b inhibits growth of melanoma cells by promoting G1-phase cell cycle arrest and reactivation of p21/WAF1/Cip1 protein[J]. Oncotarget, 2014,5(21):10636-10649.
[12] Zhang H, Yan X. Cantharidin modulates the E2F1/MCM7-miR-106b-93/p21- PTEN signaling axis in MCF-7 breast cancer cells[J]. Oncol Lett, 2015,10(5):2849-2855.
Expression of miR-106b in nasopharyngeal carcinoma tissues and its effects on the biological characteristics of nasopharyngeal carcinoma CNE-2 cells
ZHOUShixia,WANGHaili,WANGHaoxun
(TheSecondAffiliatedHospitalofZhengzhouUniversity,Zhengzhou450014,China)
ObjectiveTo investigate the expression of miR-106b in nasopharyngeal carcinoma tissues and its effects on the biological characteristics of nasopharyngeal carcinoma CNE-2 cells.MethodsSixty-eight cases of surgical resection specimens from first treatment patients with nasopharyngeal carcinoma and 45 cases of nasopharyngeal biopsy specimens from patients with chronic nasopharyngitis were selected. The expression of miR-106b was detected by using real-time PCR technology. The relationship between the expression of miR-106b and clinicopathological parameters in patients with nasopharyngeal carcinoma was analyzed. The nasopharyngeal carcinoma CNE-2 cells in the logarithmic growth phase were divided into four groups (1×106cells/group). Cells in the miR-106b mimics group and miR-106b inhibitor group were transected with miR-106b mimics and miR-106 inhibitor, respectively. Cells in the negative control group were transfected with negative control sequence, while cells in the blank control group were not treated. The cell proliferation of each transfected group was tested by using MTT assay. The cell cycle of each transfected group was detected by using flow cytometry. The cell migration and invasion of each transfected group were detected by using Transwell experiment.ResultsThe relative expression levels of miR-106b in the nasopharyngeal carcinoma tissues and chronic nasopharyngitis nasopharyngeal tissues were 1.57±0.15 and 1.14±0.12, respectively,P<0.05. The expression of miR-106b in the nasopharyngeal carcinoma tissues was related with lymph node metastasis, carotid sheath violations, and skull base violations (allP<0.05). The relative expression level in each transfection group: the miR-106b mimic group was significantly higher than the miR-106b inhibitor group, the negative control group and blank control group, and the miR-106b inhibitor group was lower than the negative control group and blank control group, allP<0.05. The proliferation of each transfection group: A values after cell inoculation 24, 48, 72 and 96 h in the miR-106b mimic group were higher than those of the miR-106b inhibitor group, negative control group and blank control group, while the miR-106b inhibitor group was lower than the negative control group and blank control group, allP<0.05. The cell cycle of each transfection group: the proportion of S phase in the miR-106b mimics group was higher than that of the miR-106b inhibitor group, the negative control group and blank control group, while the miR-106b inhibitor group was lower than the negative control group and blank control group, allP<0.05. The cell migration and cell invasion in each transfection group: the number of migration cells and invasion cells in the miR-106b mimics group was higher than that of the miR-106b inhibitor group, negative control group and blank control group, and the miR-106b inhibitor group was lower than the negative control group and blank control group, allP<0.05.ConclusionmiR-106b is highly expressed in nasopharyngeal carcinoma tissue, and the miR-106b overexpression may promote proliferation, migration, and invasion of nasopharyngeal carcinoma CNE-2 cells.
nasopharyngeal carcinoma; miR-106b; CNE-2 cells; cell proliferation; cell migration
河南省科技发展计划(142102310087)。
周士霞(1979-),女,主治医师,主要研究方向为恶性肿瘤的临床及基础研究。E-mail: 1541421042@qq.com
10.3969/j.issn.1002-266X.2017.20.003
R739.6
A
1002-266X(2017)20-0009-04
2016-07-05)
