排卵后给予米非司酮对雌性大鼠动情周期、黄体功能的影响及意义
2017-12-11周伯如戴佳轩徐建亚周惠芳
周伯如,戴佳轩,徐建亚,周惠芳
(南京中医药大学,南京210023)
排卵后给予米非司酮对雌性大鼠动情周期、黄体功能的影响及意义
周伯如,戴佳轩,徐建亚,周惠芳
(南京中医药大学,南京210023)
目的探讨排卵后给予米非司酮对雌性大鼠动情周期、黄体功能的影响及其意义。方法选择具有规律周期性变化、动情周期为4天的雌性大鼠40只,随机分为空白组、单周期组、两周期组及三周期组,每组10只。单周期组、两周期组及三周期组分别于排卵后灌胃给予米非司酮1 mL/100 g,分别用药1、2、3个周期;空白组灌胃给予等体积生理盐水。记录各组给药前后动情后期及动情周期的持续时间,统计出现动情周期紊乱的大鼠数量。末次给药后第2天(给药后D2)及给药后进入下一动情周期的第2天(下一周期D2)采用放射免疫分析法检测血清雌二醇(E2)、孕酮(P)、促卵泡生成素(FSH)、促黄体生成素(LH)水平,处死后计数卵巢组织中生长卵泡、黄体及闭锁卵泡数,采用实时荧光定量PCR法检测子宫组织雌激素受体(ER)、孕激素受体(PR)mRNA表达。结果空白组、单周期组动情周期均保持规律性,两周期组、三周期组中分别有1只(10%)、5只(50%)出现动情周期紊乱。各组给药前后动情周期持续时间无明显变化(P均>0.05);两周期组、三周期组动情后期持续时间均明显短于给药前及空白组、单周期组给药后(P均<0.05)。单周期组、两周期组、三周期组给药后D2、下一周期D2血清E2均高于空白组,且三周期组升高更明显(P均<0.05)。单周期组、两周期组、三周期组给药后D2血清FSH均低于空白组,LH均高于空白组(P均<0.05)。两周期组、三周期组下一周期D2血清FSH均低于空白组与单周期组,血清LH均高于空白组与单周期组(P均<0.05)。各组给药后D2、下一周期D2血清P水平比较差异均无统计学意义(P均>0.05)。单周期组、两周期组及三周期组闭锁卵泡数均多于空白组,黄体数、生长卵泡数均少于空白组(P均<0.05)。两周期组与三周期组生长卵泡数、黄体数及闭锁卵泡数比较均无统计学差异(P均>0.05)。单周期组、两周期组、三周期组子宫组织ER mRNA相对表达量均高于空白组,且两周期组、三周期组升高更明显(P均<0.05)。单周期组、两周期组、三周期组子宫组织PR mRNA相对表达量均高于空白组,且三周期组升高更明显(P均<0.05)。结论雌性大鼠排卵后给予两个周期米非司酮可通过提高子宫组织PR基因表达而缩短其动情后期持续时间并导致黄体功能不全,可用于建立有效、稳定的黄体功能不全大鼠模型。
黄体功能不全;米非司酮;多周期排卵;动情周期;大鼠
米非司酮为高效孕激素拮抗剂,多用于排卵后避孕及早期妊娠的药物流产。女性排卵后单次使用米非司酮不会对月经正常规律造成影响[1],但其生殖内分泌水平已发生变化,可出现黄体功能不全(LPD)等表现[2]。近年来,米非司酮亦被诸多学者用于构建LPD动物模型[3]。前期研究发现,单次排卵后给予米非司酮可使雌性SD大鼠出现LPD的病理学特征与生殖内分泌变化,但存在造模后有效时间较短、给药时间限制较大等缺点[4]。2016年7~8月,本研究观察了多周期排卵后给予米非司酮对雌性大鼠动情周期及黄体功能的影响,旨在为建立稳定的动物模型提供依据。
1 材料与方法
1.1 材料 动物:SPF级雌性SD大鼠50只,8周龄,体质量(200±20)g,购于南京中医药大学实验动物中心。饲养条件:分笼饲养于SPF环境中,室内温度22~25 ℃,相对湿度40%~70%,12 h明暗交替,自由摄食、饮水。药物:米非司酮片(25 mg/片)购于上海新华联制药有限公司,充分研磨后配置成浓度为1 mg/mL的均一混悬液,4 ℃保存备用,给药前复温至25~28 ℃。主要试剂:雌二醇(E2)、孕酮(P)、促卵泡生成素(FSH)、促黄体生成素(LH)放射免疫试剂盒购于北京华英生物技术研究所,RNAiso Plus提取液、cDNA逆转录试剂盒、SYBR Green荧光定量PCR试剂盒均购于日本Takara公司。主要仪器:r-911全自动放免计数仪购于中国科技大学实业总公司,蛋白核酸分析仪购于德国Eppendorf公司,QuantStudio7 Flex实时荧光定量PCR系统购于美国Thermo公司。
1.2 动物分组与干预 雌性SD大鼠适应性喂养1周,每日8:00、15:00、21:00进行阴道脱落细胞涂片(以下称阴道涂片),置于倒置生物显微镜下观察大鼠阴道脱落细胞形态,以明确大鼠动情周期变化。筛选阴道涂片具有规律周期性变化、动情周期为4天的雌性大鼠40只,随机分为空白组、单周期组、两周期组及三周期,每组10只。各组每日8:00进行阴道涂片,发现典型动情期表现的时间即记为D1。按照《人和动物间按体表面积折算的等效剂量比值表》中的方法进行剂量换算,单周期组、两周期组及三周期组D1上午9:00~11:00灌胃给予米非司酮1 mL/100 g,空白组灌胃给予生理盐水1 mL/100 g。单周期组仅在第1个动情周期的D1给予米非司酮,两周期组与三周期组参照上法分别给药2、3个动情周期。
1.3 动情周期检测 各组大鼠给药前及给药后每日进行阴道涂片,参照杨丽娟等[4]的方法记录大鼠完整动情周期及动情后期的持续时间。
1.4 血清E2、P、FSH、LH水平检测 采用放射免疫分析法。末次给药后第2天(记为给药后D2)及给药后进入下一动情周期的第2天(记为下一周期D2)14:00~16:00(相当于人的黄体中期),各组大鼠于眼底静脉丛取血0.5~1 mL,常温静置1~2 h,4 ℃条件下3 000 r/min离心15 min,取血清-20 ℃保存备用。采用放射免疫分析法检测血清E2、P、FSH、LH水平,严格按照试剂盒说明书进行操作。
1.5 子宫、卵巢组织形态学观察 各组血清E2、P、FSH、LH水平检测完成后,给予10%水合氯醛按0.35 mL/100 g行腹腔麻醉,断头处死后迅速取出子宫、卵巢组织。解剖显微镜下观察、分离输卵管等多余组织,滤纸吸净血液。各组随机选择3只大鼠的子宫、卵巢组织(其余组织-80 ℃冻存),4%多聚甲醛固定,常规脱水、透明、浸蜡、包埋、5 μm厚切片。常规行HE染色,奥林巴斯BX40光学显微镜下观察子宫、卵巢组织形态学改变,采用体视学细胞计数系统随机各选择5个视野,计数卵巢组织中的生长卵泡、黄体及闭锁卵泡数,取平均值。
1.6 子宫组织雌激素受体(ER)、孕激素受体(PR)mRNA表达检测 采用实时荧光定量PCR法。取各组冻存的子宫组织,按照RNAiso Plus提取试剂盒说明书采用常规一步法提取子宫组织总RNA,测定RNA样品含量及纯度合格,使用SYBR®Premix Ex TapTMⅡ试剂盒对cDNA样本进行处理,进行实时荧光定量PCR反应。大鼠ER、PR及内参GAPDH引物均由上海生工生物工程股份有限公司设计完成。ER引物序列:上游引物:5′-CGACTATGCCTCTGGCTACC-3′,下游引物:5′-CGATGGTGCATTGGTTTGTA-3′,引物长度:122 bp。PR引物序列:上游引物:5′-CTGCTCTTCTCTCGGTCCTG-3′,下游引物:5′-CTGGGATTTCTGCTTCTTCG-3′,引物长度:131 bp。GAPDH引物序列:上游引物:5′-TGATTCTACCCACGGCAAGTT-3′,下游引物:5′-TGATGGGTTTCCCATTGATGA-3′,引物长度:77 bp。PCR反应条件:95 ℃预变性30 s;95 ℃变性5 s,60 ℃扩增34 s,40个循环。各样本均设3个复孔,实验重复3次。采用QuantStudio7 Flex系统进行数据采集与分析,采用2-ΔΔCt法计算目的基因相对表达量。
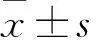
2 结果
2.1 各组动情周期及动情后期持续时间比较 空白组、单周期组动情周期均保持规律性,两周期组、三周期组中分别有1只(10%)、5只(50%)动情周期规律性变化消失(表现为持续性动情间期)。各组给药前后动情周期及动情后期持续时间比较见表1。

表1 各组给药前后动情周期、动情后期持续时间比较
注:与同组给药前比较,*P<0.05;与空白组给药后比较,#P<0.05;与单周期组给药后比较,△P<0.05。
2.2 各组血清E2、P、FSH、LH水平比较 见表2。
2.3 各组子宫、卵巢组织形态学变化 HE染色结果:①子宫:空白组子宫固有层组织疏松,子宫腺体多,间质血管丰富,单周期组、两周期组、三周期组子宫内膜层明显菲薄,腺体数减少,腺腔偏小,间质胶原纤维增多,以三周期组变化更明显。②卵巢:空白组生长卵泡数量较多,黄体发育好,体积大,颗粒细胞层较厚;单周期组、两周期组、三周期组卵巢内闭锁卵泡数量增多,颗粒细胞排列松散,卵母细胞放射冠减少或消失。各组卵巢组织生长卵泡、黄体及闭锁卵泡数量比较见表3。
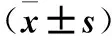
表2 各组给药前后血清E2、P、FSH、LH水平比较
注:与同组给药后D2比较,*P<0.05;与空白组同时间点比较,#P<0.05;与单周期组同时间点比较,△P<0.05;与两周期组同时间点比较,▲P<0.05。
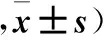
表3 各组卵巢组织生长卵泡、黄体及闭锁卵泡数量比较(个
注:与空白组比较,#P<0.05;与单周期组比较,△P<0.05。
2.4 各组子宫组织ER、PR mRNA表达比较 见表4。
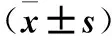
表4 各组子宫组织ER、PR mRNA相对表达量比较
注:与空白组比较,#P<0.05;与单周期组比较,△P<0.05;与两周期组比较,▲P<0.05。
3 讨论
研究证实,米非司酮竞争性拮抗P与其受体结合,其受体亲和力是P的4~5倍,能够显著抑制P的正常生物学效应,对卵泡发育、排卵期LH峰形成以及黄体功能具有抑制作用[5,6]。女性在非孕黄体期一次口服100 mg米非司酮可于1 h内达到血药浓度峰值,消除半衰期为12~24 h,100~800 mg并无明显的血药浓度差异,不易产生蓄积效应[7,8]。由于米非司酮可造成LPD的发生,因此近年来多被应用于LPD动物模型的构建。目前常用的造模方案主要有两种:①根据雌性大鼠妊娠第5天受精卵着床这一特点,在其着床前2~3天使用米非司酮,拮抗孕激素,使其子宫内膜容受性受损以致受精卵无法着床,达到模拟LPD的目的[9];②对未受孕大鼠连续使用米非司酮,造成生殖内分泌水平紊乱,出现卵泡发育障碍,进而影响黄体功能[10]。米非司酮虽然满足了LPD相关实验的需求,但随着研究的深入,以上两种方案均出现了一定的局限性:第一种方案虽能模拟妊娠期黄体功能异常,但临床上绝大多数患者就诊时并未妊娠,其黄体分泌水平与妊娠期有所区别,不能更好地模拟临床;第二种方案则因连续使用米非司酮可抑制大鼠排卵,造成动情周期紊乱,导致造模失败。
研究表明,正常大鼠的动情期、动情后期、动情间期、动情前期平均时长分别为14、18、60、12 h,其动情期末段与动情后期相当于人的黄体中前期,在动情间期中前段黄体萎缩,而下一周期的卵泡发育从动情间期前段即开始。雌性SD大鼠的动情期一般于晚间22时至次日1时出现,排卵发生于动情期出现后的6~8 h[11]。本课题组虽未在夜间对大鼠阴道涂片进行观察(夜间操作有导致大鼠正常节律紊乱的不利影响),但所有在前一日阴道涂片表现为动情前期的大鼠,均于次日8:00出现典型动情期特征。大鼠动情期的阴道涂片可见大量脱落堆叠角化细胞,此时比较容易判断。因此,我们认为对于LPD大鼠模型,在上午8:00阴道涂片发现动情期后2 h内使用米非司酮,既能在黄体形成后对其功能产生影响,又可减小对卵泡发育与排卵产生的直接影响,是较为可靠且便捷的用药方式。本研究结果显示,给予米非司酮可导致大鼠动情后期持续时间缩短,其中以两周期组、三周期组变化更明显。但LPD的前提是有卵泡发育及排卵(排卵后形成黄体),因此动情周期规律性变化消失(表现为长时间动情间期)的大鼠并不符合实验要求。本研究结果显示,空白组、单周期组动情周期均保持规律性,两周期组、三周期组中分别有1只(10%)、5只(50%)动情周期规律性变化消失。以上结果提示,给予两周期米非司酮更符合构建LPD大鼠模型的要求。
研究显示,子宫ER、PR在月经周期中具有规律性变化,其在黄体前、中期的降调是子宫内膜容受性建立的主要标志之一,可反映黄体功能[12,13]。本研究结果显示,单周期组、两周期组、三周期组子宫组织ER mRNA相对表达量均高于空白组,且两周期组、三周期组升高更明显;单周期组、两周期组、三周期组子宫组织PR mRNA相对表达量均高于空白组,这与相关文献报道的LPD变化特征一致[12]。研究表明,米非司酮可抑制FSH的合成与分泌,其机制可能与外周循环中瘦素水平降低有关,瘦素减少可导致雌激素水平升高,引起促性腺激素释放激素(GnRH)分泌,导致LH分泌增加[14,15]。以往认为血清LH水平偏低是LPD的特征之一,但越来越多的研究发现LPD患者黄体期血清LH水平并不一定偏低,FSH/LH可能是影响卵巢分泌功能的重要因素。FSH/LH过高可出现卵巢储备功能下降、卵巢早衰的表现;FSH/LH过低可导致卵巢反应性下降,雌孕激素分泌异常,导致子宫内膜容受性低下,还可引起下一周期卵泡发育障碍、小卵泡排卵,从而导致下一周期黄体发育不良,连续出现LPD[16]。本研究结果显示,两周期组、三周期组下一周期D2血清FSH水平均低于空白组与单周期组,血清LH水平均高于空白组与单周期组,与上述结论基本一致。其原因可能与下丘脑GnRH分泌的脉冲变化密切相关[17,18],而调节GnRH分泌的机制则较为复杂,仍有待于进一步研究。
综上所述,雌性大鼠排卵后给予两个周期米非司酮可导致其动情后期持续时间缩短及黄体功能不全,有助于建立有效、稳定的黄体功能不全大鼠模型。
[1] Agarwal M, Das V, Agarwal A, et al. Evaluation of mifepristone as a once a month contraceptive pill[J]. Am J Obstet Gynecol, 2009,200(5):27-29.
[2] Chen Y, Wang W, Zhuang Y, et al. Effects of low-dose mifepristone administration in two different 14-day regimens on the menstrual cycle and endometrial development: a randomized controlled trial[J]. Contraception, 2011,84(1):64-70.
[3] 李彩文.米非司酮在妇产科的临床应用及研究进展[J].临床合理用药杂志,2015,8(7):174-176.
[4] 杨丽娟,周伯如,周惠芳,等.补肾助孕方对米非司酮构建的LPD模型大鼠性腺轴形态学的影响[J].医学研究生学报,2015,28(10):1012-1016.
[5] 朱达琍,朱长虹,贲亚琍.米非司酮与孕激素受体及糖皮质激素受体结合力的研究[J].山东医药,2005,45(24):1-2.
[6] Caron PL, Fréchette-Frigon G, Shooner C, et al. Transforming growth factor beta isoforms regulation of Akt activity and XIAP levels in rat endometrium during estrous cycle, in a model of pseudopregnancy and in cultured decidual cells[J]. Reprod Biol Endocrinol, 2009(7):80.
[7] Sharma S, El-Refaey H, Mitchel H, et al. Mifepristonevaginally in an early medical abortion regimen: a pilot study[J] . Contraception, 2006,73(6):261-264.
[8] Sarkar NN. Mifepristone: bioavailability, pharmacyokineticsanduse-effectiveness[J]. Eur J Obstet Gynecol Reprod Biol, 2002,101(2):113-120.
[9] 周伯如,戴佳轩,周惠芳,等.补肾助孕方对黄体功能不全大鼠促性腺激素及其关键调控因子的影响[J].医学研究生学报,2016,29(11):1153-1157.
[10] 杨智莺,肖国宏,侯棚钟,等.米非司酮诱导大鼠PCOS动物模型的实验研究[J].现代妇产科进展,2011,20(8):637-640.
[11] 王洁,吴素慧,尚海霞.性成熟雌性SD大鼠动情周期的观察[J].当代医学,2013,19(28):25-26.
[12] 汪宏波,占海英,李红发.黄体功能不全患者着床期子宫内膜雌孕激素受体的表达及超微结构改变[J].中国妇幼保健,2004,19(6):45-47.
[13] Toth B, Scholz C, Ochsenkuhn R, et al. Effects of progesterone and its antagonist mifepristone on progesterone receptor a expression in human umbilical vein endothelial cells[J]. Gynecol Obstet Invest, 2009,67(4):269-274.
[14] Millar RP, Roseweir AK, Tello JA, Kisspeptin antagonists: unraveling the role of kisspeptin in reproductive physiology[J]. Brain Res, 2010,1364(1):81-89.
[15] Witchel SF, Tena-Sempere M. The Kiss1 system and polycystic ovary syndrome: lessons from physiology and putative pathophysiologic implications[J]. Fertil Steril, 2013,100(1):12-22.
[16] 顾玲珠,金怡,张敏青.多囊卵巢综合征患者的超声表现及其与内分泌指标的相关性分析[J].黑龙江医学,2015,39(8):875-877.
[17] Yu B, Ruman J, Christman G. The role of peripheral gonadotropin-releasing hormone receptors in female reproduction[J]. FertilSteril, 2011,95(2):465-473.
[18] 曹晓涵,韩兴发,杜小刚,等.GnRH主动免疫雌性大鼠调控机制研究[J].畜牧兽医学报,2016,47(3):502-508.
国家自然科学基金资助项目(81473713);江苏省自然科学基金资助项目(BK20141463);江苏省普通高校研究生科研创新计划项目(KYLX15_0991);中国和欧洲医疗保健发展合作研究计划(CHETCH)。
周惠芳(E-mail: zhouhuifang201301@163.com)
10.3969/j.issn.1002-266X.2017.44.009
R714.21
A
1002-266X(2017)44-0032-04
2017-01-20)
