大肠杆菌宿主遗传背景对色氨酸生物传感器响应特性的影响
2017-12-06王天民邢新会
王天民,张 翀,2,邢新会,2
(1.清华大学 化学工程系 生物化工研究所 工业生物催化教育部重点实验室,北京 100084;2.清华大学 合成和系统生物学研究中心,北京 100084)
大肠杆菌宿主遗传背景对色氨酸生物传感器响应特性的影响
王天民1,张 翀1,2,邢新会1,2
(1.清华大学 化学工程系 生物化工研究所 工业生物催化教育部重点实验室,北京 100084;2.清华大学 合成和系统生物学研究中心,北京 100084)
生物传感器是一类重要的合成生物学功能元件,目前已经被广泛应用于代谢工程领域的突变文库筛选和进化工程研究中。生物传感器的正交性,即和宿主细胞中其他遗传元件尽可能小的相互作用,对于其在代谢工程领域的成功应用至关重要。然而,对于这一问题缺乏系统性的认识。在本文中,通过分析不同遗传背景的大肠杆菌宿主对于色氨酸生物传感器响应特性的影响,结果发现:trpR调控网络、TnaA裂解酶和色氨酸生物传感器的响应特性具有显著的相互作用。通过一系列的遗传学分析,我们给出了分子水平上介导这一相互作用过程的可能模型。本工作给出了宿主内遗传元件破坏生物传感器正交性的一个案例,对于指导生物传感器在代谢工程领域的应用具有重要意义。
大肠杆菌; 生物传感器;生物传感器正交性; 色氨酸; 代谢工程
小分子生物传感器是一类重要的合成生物学功能元件。经典的小分子生物传感器由响应元件和调控元件两部分组成,响应元件感知细胞内外的目标小分子浓度,并通过相互作用将信号传递给调控元件,改变下游基因的表达水平,从而实现生物传感器的功能[1]。小分子生物传感器典型的响应、调控元件配对包括转录因子(transcription factor)-启动子(promoter)[2-3]、核糖适配体(aptamer)-核糖体结合位点(ribosomal binding site,RBS)[4]等。
小分子生物传感器可以在单细胞水平上监测细胞内代谢物的积累水平,因此引起了代谢工程领域的广泛兴趣[5]。例如,通过在下游耦联易于被检出的功能基因,小分子生物传感器可以被改造成为一种强大的高通量筛选工具,用以从突变文库中快速筛分或者富集过量累积该小分子的突变细胞[6];同时,小分子生物传感器还被用于智能细胞工厂的构建,通过实时感应前体代谢物的累积水平并实时控制下游合成途径的基因表达,所设计的细胞工厂可以最小化资源的浪费以及有毒中间代谢产物的累积[2];最后,由于单细胞水平的基因表达差异,会造成相同遗传背景下的细胞群体分化为不同产能的亚群,通过耦联和生长相关的基因,小分子生物传感器可以抑制低产能亚群的生长,从而提高整体上代谢产物的产量[7]。
小分子生物传感器在代谢工程领域的典型应用路线图包括传感器构建、响应特性测试和生产条件下的应用等步骤。由于生物系统的复杂性,环境条件的微弱改变可能造成宿主细胞基因表达模式的显著差异。由于生物传感器的测试条件和实际应用场景很难保持完全一致,因此其成功应用高度依赖于生物传感器的正交性,即最小化其和宿主细胞内其他元件的相互作用,保持其在不同条件下响应特性的一致。从这一点延伸开,本文中,笔者对宿主遗传背景对于生物传感器正交性的影响进行更系统的研究,以期找出相关的规律。
1 材料与方法
1.1 菌株和培养条件
本文中所涉及E.coliBL21(DE3)(B1)以及B2~B8菌株,来自于笔者实验室保藏[8]。菌株chr-trp46构建自B8,基因型为B8xylA::M1-37-trpEDfbr。将高强度的M1-37启动子(包含RBS序列)[9]克隆到点突变去除反馈抑制位点的trpEDfbr基因[10]上游,并将该表达盒子插入B8菌株染色体的xylA位点。利用RED重组技术敲除chr-trp46中的trpEDfbr表达盒子,得到chr-trp46ΔtrpEDfbr。克隆实验利用的宿主E.coliDH5a来自于BioMed(北京)。对于常规培养,使用LB培养基(10 g/L 蛋白胨,5 g/L酵母提取物,10 g/L NaCl,固体培养基添加1.8%琼脂)37 ℃培养。对于色氨酸发酵实验,在平板上挑取单克隆在LB中过夜培养,种子液以1%体积分数接种至50 mL三角瓶中的10 mL M9YE培养基[10],37 ℃、200 r/min 培养24 h,以液相色谱法测定胞外色氨酸浓度[10]。对于含有pSen或者pSenmCh的菌株,在相应培养基中添加100 mg/L氨苄霉素。
1.2 质粒的构建
PCR线性化本实验室之前报道的色氨酸生物传感器质粒[10],同时克隆质粒pKM154的sacB表达盒子克隆,利用Gibson assembly[11]进行体外组装得到pSen质粒。PCR线性化pSen质粒,同时制备由不同启动子驱动的组成型表达mCherry表达盒子线性片段,利用Gibson assembly[11]进行体外组装,得到包括pSenmCh在内的一系列目标质粒(pSenmCh质粒图谱,参考:https://benchling.com/galacharles/f_/IIIoIUJp-tryptophan-biosensor/)。
1.3 色氨酸生物传感器的表征
在平板上挑取单克隆在LB中(利用24深孔板)过夜培养,将种子液以1%体积分数接种于96孔板内的200 μL M9YE培养基中(后期确定条件后加入0.5 mmol/L IPTG),利用Tecan 2000自动化光度计37 ℃振荡培养(15 min为间隔测定),进行生长曲线和荧光表达的测定。在600 nm处测定细胞浊度(OD600)。 绿色荧光蛋白(GFP)表达及测定:荧光通道,Ex为485 nm,Em为535 nm。红色荧光蛋白(mCherry)表达及测定:荧光通道,Ex为587 nm,Em为615 nm。
每组包括至少3个生物学重复,大部分实验平行性良好,对于误差较小的部分图表,未标出误差线。
1.4 突变文库的构建和筛选
从平板上挑取单克隆LB培养基37 ℃过夜培养,以1%体积分数接种到新鲜的LB培养基中,培养至 OD600为0.8,取10 μL菌液分散于无菌的铁片上,ARTP处理25 s(100 W,氩气流10 L/min(SLM))。将突变后的菌体以LB培养基进行过夜培养,之后转接于含有0.5 mmol/L IPTG的M9YE培养基中、37 ℃、200 r/min 培养4 h后,利用流式细胞仪进行分选(FACS Aria, BD Biosciences)。分选后的菌体以加入氨苄霉素的LB培养基进行收集,离心去上清后涂布于LB平板,挑选单克隆进行后续分析。
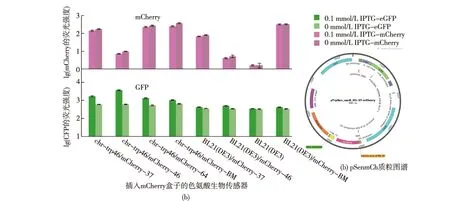
图1 色氨酸生物传感器中插入组成型表达mCherry盒子Fig.1 Screening of tryptophan biosensor inserted by constitutively expressing mCherry cassette
1.5 利用sacB反向筛选去除pSen(mCh)质粒
将单克隆接种至LB培养基,37 ℃过夜培养,以1%体积分数转接至新鲜的M9YE培养基,37 ℃培养至 OD600为0.8,稀释1 000倍,取50 μL涂布含有100 g/L蔗糖的无NaCl的LB平板,30 ℃培养过夜,挑取单菌落进行质粒抗性测试和PCR鉴定确认。
2 结果与讨论
2.1 组成型表达红色荧光蛋白对照的色氨酸生物传感器
在之前的工作中,笔者基于天然的前导肽机制构建了色氨酸生物传感器[10]。该生物传感器的机制[12]如图1所示,在前导肽TnaC的编码基因后克隆了增强型绿色荧光蛋白(eGFP)作为研究的目的基因。在色氨酸不存在的条件下,细胞中的rho因子结合TnaC和GFP之间的识别序列,造成转录的提前终止,从而抑制GFP的表达;在色氨酸存在的条件下,色氨酸和TnaC相互作用,导致TnaC的构象发生变化,使得TnaC前导肽在翻译完成之后不会被核糖体释放,从而抑制了rho因子结合下游的识别序列,导致GFP的正常转录和翻译。生物传感器元件的表达由pTrc启动子控制,故需要IPTG进行诱导,其对于色氨酸的响应范围在0~1.5 mmol/L之间(胞外添加丙氨酸-色氨酸二肽)[10]。
在本文中,笔者着眼于将色氨酸生物传感器应用于高产菌株的高通量筛选,笔者在质粒中添加了sacB基因的表达模块,用以在筛选结束后利用基于sacB催化蔗糖形成有毒产物的致死效应以快速地去除传感器质粒;同时,之前的文献报道表明细胞间的表达异质性(克隆在质粒上的表达元件由于质粒拷贝数在不同细胞间的变化情况更加严重)会造成筛选过程的噪音[13-14],因此,笔者利用组成型表达的红色荧光蛋白(mCherry)作为质粒拷贝数变化的对照,降低筛选过程中细胞异质性噪音的影响。
利用大肠杆菌BL21(DE3)作为不产生色氨酸的阴性对照菌株,利用自行构建的大肠杆菌chr-trp46(用M9YE培养基培养24 h,发酵产量0.46 mmol/L)作为累积色氨酸的阳性对照菌株,笔者构建了一系列组成型表达mCherry的生物传感器质粒(典型质粒图谱如图1所示),并将其分别导入BL21(DE3)和chr-trp46,进行绿色荧光和红色荧光的测定,结果如图1所示。由图1可知:相比于不累积色氨酸的BL21(DE3)菌株,生物传感器下游的GFP在高产色氨酸的chr-trp46菌株中表达量显著提高,且mCherry表达量在两种宿主中十分接近;不添加IPTG条件下的微弱泄露表达也和我们之前的报道一致[10]。因此,选择了mCherry表达量较高的M1-37启动子,并将其对应的生物传感器质粒命名为pSenmCh,用于后续实验;同时,还构建了一个不含有mCherry的生物传感器pSen,比较以绿色荧光蛋白(GFP)荧光和以GFP/mCherry(荧光强度数值之比Ddr) 作为评价指标的异同。
2.2 色氨酸生物传感器诱导条件的优化
为了最大化筛选过程中的不同产量突变体细胞间的荧光差异,降低筛选过程中的假阳性率,笔者优化了色氨酸生物传感器的操作条件。利用大肠杆菌BL21(DE3)作为不产生色氨酸的阴性对照菌株,利用大肠杆菌chr-trp46作为累积色氨酸的阳性对照菌株,分别导入pSen(以GFP与OD600的荧光强度比为评价指标)和pSenmCh质粒(以GFP与mCherry的荧光强度比为评价指标),定义见公式(1)~(2)。

(1)
(2)
如果Ddr值越大,说明累积色氨酸菌株相比于对照菌株传感器响应越强,筛选过程中的假阳性率也会越低。
以Ddr作为主要的优化指标,首先优化了添加诱导剂IPTG的时间(0、4、8、12、24 h)对Ddr的影响的预试验。结果发现:在0时刻加入IPTG可以观察到更大的Ddr,而在8 h之后添加IPTG无法观测到任何的传感器响应(数据未列出)。因此,选定零时刻作为IPTG的添加时间,并进一步优化了其添加量,结果如图2所示。由图2可知:随着诱导剂添加量的提升,传感器的Ddr逐渐增加;当IPTG添加量超过0.5 mmol/L之后,传感器的响应特性不再发生明显变化,证明诱导已经达到饱和。综上所述,选定了在零时刻添加0.5 mmol/L IPTG作为色氨酸生物传感器的操作条件。
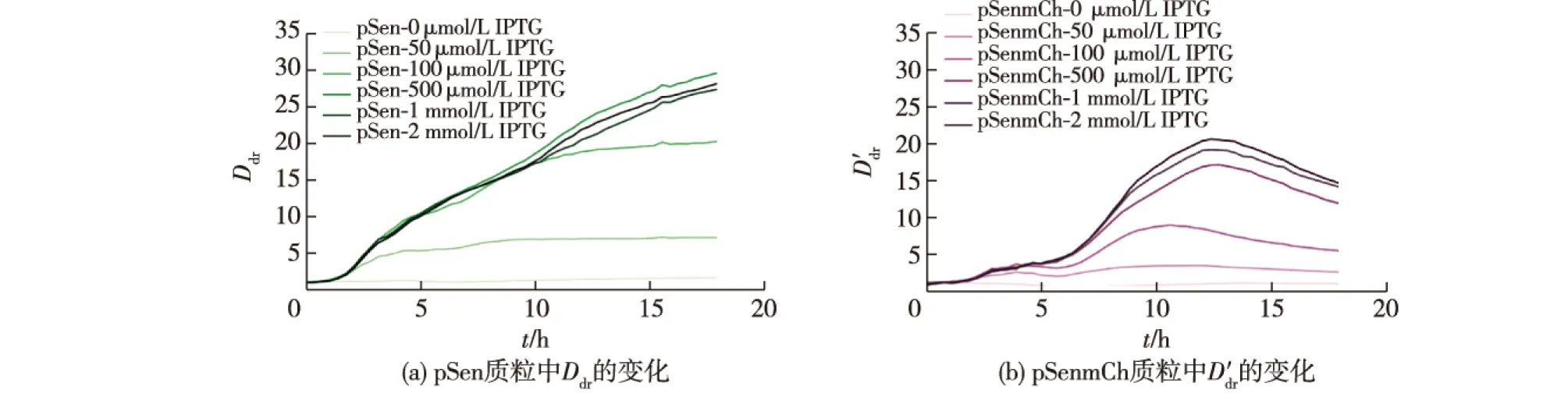
图2 色氨酸生物传感器诱导条件的优化Fig.2 Optimization of induction parameters for tryptophan biosensor
2.3 色氨酸生物传感器筛选的假阳性和分子机制探究
2.3.1 色氨酸生物传感器高通量筛选导致高假阳性率
利用上文构建的色氨酸生物传感器进行了突变文库的高通量筛选。将pSen和pSenmCh生物传感器质粒分别导入具有一定色氨酸产量的chr-trp46作为出发菌株,并利用本实验室发展的常压室温等离子体(ARTP)[15]诱变技术进行了诱变处理。利用流式细胞分选技术,基于GFP荧光强度、GFP荧光强度/前向角数值和GFP荧光强度/mCherry荧光强度这3种指标,并结合上文提到的生物传感器操作条件进行高通量筛选,富集了上述3种指标的高值区域。理论上,诱变后色氨酸产量提高的突变体会诱导更强的GFP表达,从而得到富集。笔者对于每个组别分离得到了16个突变体,利用蔗糖反向筛选技术(sacB)去除生物传感器质粒后进行了发酵表征,结果表明,没有菌株表现出显著的色氨酸产量提升(数据未列出)。
2.3.2 色氨酸生物传感器在不同遗传背景宿主中的响应特性研究
上述异常的假阳性率说明生物传感器在实际操作条件下的响应参数可能和之前的设计值存在很大的变化。因此,笔者对这一问题进行进一步探究。前期的研究表明,以大肠杆菌BL21(DE3)为宿主,色氨酸生物传感器元件响应范围为0~1.5 mmol/L(胞外添加丙氨酸-色氨酸二肽)[10],这一操作范围覆盖了chr-trp46菌株发酵条件下的色氨酸胞外累积产量(M9YE培养基24 h发酵产量0.46 mmol/L),因此,理论上该生物传感器可以被用于chr-trp46突变库的筛选,即产量高于chr-trp46的突变株对应的荧光强度应该更高。考虑到筛选后的高假阳性率,笔者假设chr-trp46遗传背景和BL21(DE3)的不同可能导致了生物传感器操作参数的变化。为了验证这一假设,敲除了chr-trp46菌株中的trpEDfbr表达盒子(chr-trp46ΔtrpEDfbr),其突变株或者BL21(DE3)的色氨酸产量均无法被液相色谱有效检出(数据未列出)。将pSen和pSenmCh分别导入大肠杆菌BL21(DE3)和chr-trp46ΔtrpEDfbr,利用胞外添加丙氨酸-色氨酸二肽的方法测试了色氨酸生物传感器在这两种不同宿主下的响应特性,结果如图3所示。由图3可知:色氨酸生物传感器在BL21(DE3)中的结果和之前的结果吻合,其响应范围以胞外添加丙氨酸-色氨酸二肽计,位于0~2.0 mmol/L;与之形成对比的是,在chr-trp46ΔtrpEDfbr中,其响应上限迅速下降到了0.1 mmol/L以下。该结果表明宿主的遗传背景差异会显著影响生物传感器的响应特性。这种差异使得chr-trp46的胞内色氨酸累积很有可能超过了传感器的操作范围,导致了筛选的失败。

图3 色氨酸生物传感器响应特性在不同宿主遗传背景下的差异Fig.3 Response profile of tryptophan biosensor perturbed by the genetic backgrounds ofdifferent hosts
为了进一步探究其背后的分子机制,笔者进一步分析了chr-trp46菌株的遗传背景。chr-trp46菌株(B8xylA::M1-46-trpED)构建自实验室之前报道的B8菌株[8],而B8菌株为大肠杆菌BL21(DE3)的trpR、pheA和tnaA三敲除突变体。因此,推测trpR、pheA和tnaA中一个或者多个基因的敲除影响了色氨酸生物传感器的响应特性。为了系统地研究该问题,笔者利用之前构建的一系列具有不同基因型的中间突变体B1~B8[8](见材料与方法,基因型如图4所示,其色氨酸发酵胞外累积量均远低于0.01 mmol/L),分别导入pSen和pSenmCh传感器质粒,并测试了其对于胞外添加丙氨酸-色氨酸二肽的响应特性,结果如图4所示。由图4可知:在含有trpR敲除的四株突变体中(B2、B3、B6以及B8),对于胞外添加丙氨酸-色氨酸二肽的响应范围相比于其他菌株下降到了0.2 mmol/L以下。这一特性在11.7 h下尤为显著,而在4.7 h条件下,同时敲除了trpR和tnaA的B6和B8菌株较之只敲除了trpR的B2和B3菌株,该表型更为显著。这一结果表明:trpR对于色氨酸生物传感器响应特性变化起主导作用,同时tnaA对于其动力学特征(形成所需要的时间)具有重要影响。
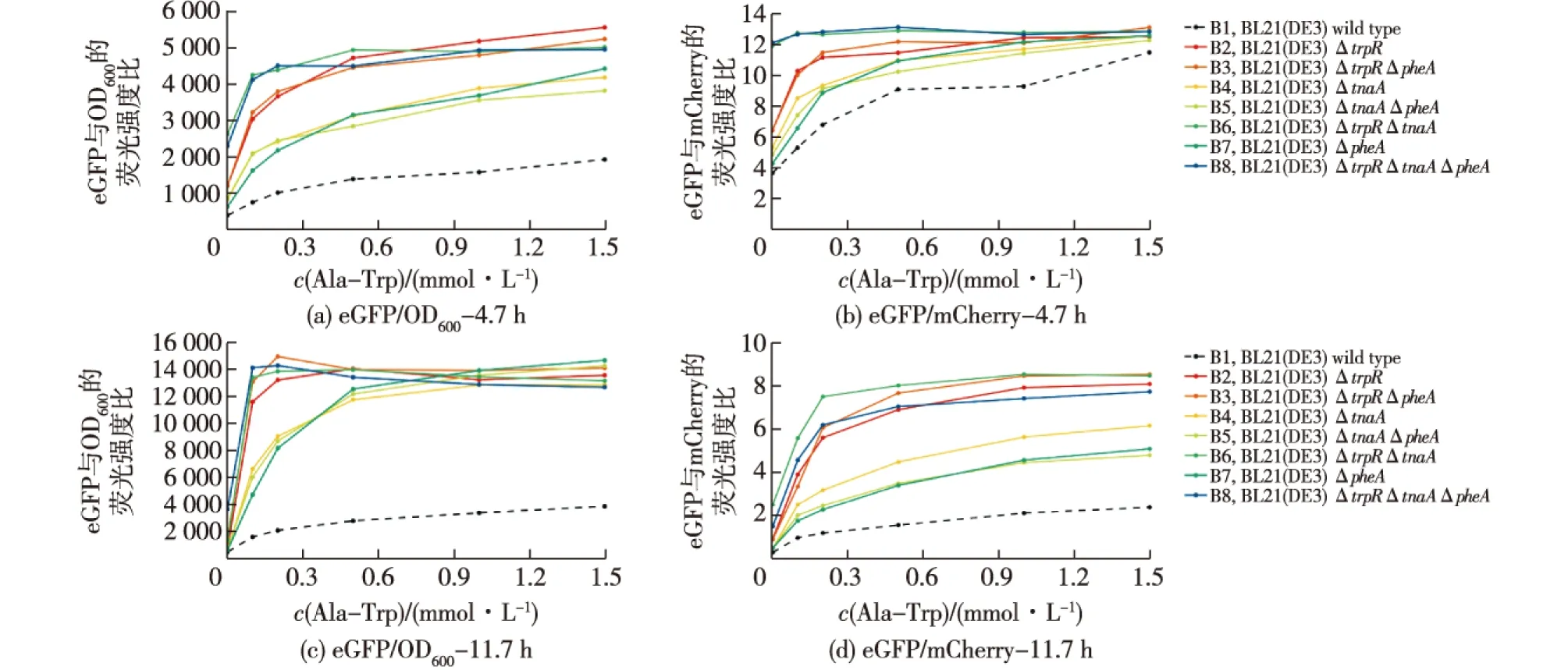
图4 效应物(色氨酸)添加后不同时间以及trpR、pheA和tnaA敲除对于色氨酸生物传感器响应特性的影响Fig.4 Effects of time after tryptophan addition and the knockout of trpR,pheA,and tnaA on the biosensor response profile
结合文献[16]可知,trpR基因编码色氨酸生物合成途径中的关键调控因子蛋白TrpR,TrpR在色氨酸存在的条件下抑制一系列和色氨酸生物合成相关的酶以及转运蛋白的表达;而tnaA基因编码的裂解酶负责将胞内的色氨酸降解为丙酮酸、胺和吲哚。笔者之前的丙氨酸-色氨酸二肽胞外添加实验表明,trpR突变体和野生型宿主中色氨酸生物传感器的响应在相当短的时间尺度内即产生了明显差异(特别是在trpR和tnaA同时被敲除的条件下),加之B1~B8菌株均没有明显的胞外色氨酸累积,因此我们推测色氨酸生物传感器在二者中响应差异的主要贡献者并非色氨酸的生物合成,而是trpRregulon和tnaA共同介导的胞内色氨酸浓度变化。为了进一步阐释其中的分子机制,我们检查了TrpR的regulon[17],其中特别引起我们兴趣的是mtr基因,编码色氨酸跨膜转运蛋白[18]。我们由此推测,mtr编码的转运蛋白将胞外的色氨酸转运到胞内,在trpR被敲除的遗传背景下,胞内色氨酸浓度的提高不能抑制mtr的表达。因此相比于野生型,在相同胞外色氨酸的浓度下,trpR突变体更快地提高了其胞内的色氨酸浓度,从而表现出表观上生物传感器响应范围的缩小。而TnaA裂解酶可以通过分解胞内色氨酸,延缓胞内色氨酸的累积。与该机理吻合的是,在胞外添加效应物4.7 h后,Mtr介导的胞内色氨酸累积过程并未完全压倒TnaA的作用(图4),因此trpR敲除组(B2、B3)和trpR、tnaA双敲除组(B6、B8)显现出不同的表型;到11.7 h,Mtr介导的胞内色氨酸累积过程相较于TnaA,对于色氨酸的分解占据了主导地位,因此,B2、B3、B6和B8突变株的表型近似,即相对于野生型表现出响应范围的显著降低。而在实际的生产宿主中(例如chr-trp46),trpR和tnaA的敲除也会导致胞内色氨酸累积量相比于野生型更快地达到峰值,从而导致筛选过程出现的假阳性。对于以上推测分子机制的进一步确证,需要准确地标定胞外色氨酸添加后不同遗传背景宿主细胞内色氨酸(或者进一步包括丙酮酸)水平随时间的变化以及mtr基因表达量在这一过程中的动力学特征。
2.4 本研究对于小分子生物传感器在代谢工程中应用的启示和建议
需要指出的是,特定生物传感器的响应特性很大程度上是表观的和唯象的,因此受到宿主遗传背景和实际表征条件的影响。理论上,“绝对真实”的生物传感器响应特性曲线应当是胞内代谢产物浓度和下游报告基因表达速度这两个变量的关联函数。一方面,由于胞内代谢物浓度的快速定量相比于胞外定量方法的复杂性,目前几乎全部文献报道的生物传感器响应特性都基于胞外添加效应物的方法(即使少数使用不同产量宿主进行传感器表征的文献,其对于宿主代谢物产量的定义也基于胞外累积量),这有别于“真实的”胞内浓度,而宿主的遗传背景无疑会对胞内外代谢物的浓度关系产生巨大的影响,正如本文所报道的;另一方面,由于报告基因表达速度(微分形式)定量的困难,目前几乎全部文献报道的生物传感器响应特性都是通过报告基因累积量(积分形式)的形式进行,诚然,这一表观联系在某种程度上对于实际体系的应用更加有利(流式细胞术,或者下游遗传线路所对应的变量是报告基因的累积量),但是报告基因表达累积量相比于其表达速度和更多的胞内过程(例如蛋白质的降解)相关联,因此对于不同遗传背景的鲁棒性无疑也会较差,而这一点是目前已知文献中所没有涉及的。
考虑到本文所报道分子机制在原核生物细胞中的普遍存在,结合上文的讨论,笔者认为本文所报道的现象对于生物传感器在高通量代谢工程中的应用具有启示意义。笔者建议:对于生物传感器在新的宿主细胞中的再利用都需要进行响应特征曲线的重新标定;同时对于相应的失败案例,系统考虑实际操作条件(胞内累积)和响应特征曲线标定(胞外)包括时间尺度在内的差异,为设计新的工程化策略提供参考。同时,也期待基于无细胞体系生物传感器高通量表征技术[19]以及对于生物传感器响应计算机模拟技术[20]的发展可以帮助代谢工程学家更好地逼近“真实的”生物传感器响应特性,为其在代谢工程领域的利用提供更加坚实的基础。
3 结论
笔者在分子水平上报道了不同宿主遗传背景下色氨酸生物传感器响应特性的差异以及这种差异对于将该传感器应用于代谢工程高通量筛选中可能带来的问题。我们期待本文所报道的事实和由此提出的建议可以对生物传感器在高通量代谢工程领域的应用产生积极影响。
[1] ZHANG F,KEASLING J D.Biosensors and their applications in microbial metabolic engineering[J].Trends Microbiol,2001,19(7):323-329.
[2] ZHANG F,CAROTHERS J M,KEASLING J D.Design of a dynamic sensor-regulator system for production of chemicals and fuels derived from fatty acids[J].Nat Biotechnol,2012,30(4):354-359.
[3] TANG S Y,CIRINO P C.Design and application of a mevalonate-responsive regulatory protein[J].Angew Chem Int Ed,2011,50(5):1084-1086.
[4] ISAACS F J,DWYER D J,COLLINS J J.RNA synthetic biology[J].Nat Biotechnol,2006,24(5):545-554.
[5] LIU D,EVANS T,ZHANG F.Applications and advances of metabolite biosensors for metabolic engineering[J].Metab Eng,2015,31:15-22.
[6] BINDER S,SCHENDZIELORZ G,STBLER N,et al.A high-throughput approach to identify genomic variants of bacterial metabolite producers at the single-cell level[J].Genome Biol,2012,13(5):R40.
[7] XIAO Y,BOWEN C H,LIU D,et al.Exploiting nongenetic cell-to-cell variation for enhanced biosynthesis[J].Nat Chem Biol,2016,12(5):339-344.
[8] FANG M Y,ZHANG C,QANG S,et al.High crude violacein production from glucose byEscherichiacoliengineered with interactive control of tryptophan pathway and violacein biosynthetic pathway[J].Microb Cell Fact,2015,14:8.
[9] LU J,TANG J,LIU Y,et al.Combinatorial modulation ofgalPandglkgene expression for improved alternative glucose utilization[J].Appl Microbiol Biotechnol,2012,93(6):2455-2462.
[10] FANG M,WANG T,ZHANG C,et al.Intermediate-sensor assisted push-pull strategy and its application in heterologous deoxyviolacein production inEscherichiacoli[J].Metab Eng,2016,33:41-51.
[11] GIBSON D G,YOUNG L,CHUANG R Y,et al.Enzymatic assembly of DNA molecules up to several hundred kilobases[J].Nat Methods,2009,6(5):343-345.
[12] GONG F,YANOFSKY C.Instruction of translating ribosome by nascent peptide[J].Science,2002,297:1864-1867.
[13] RYAN O W,SKERKER J M,MAURER M J,et al.Selection of chromosomal DNA libraries using a multiplex CRISPR system[J].Elife,2014,3:e03703.
[14] TOWNSHEND B,KENNEDY A B,XIANG J S,et al.High-throughput cellular RNA device engineering[J].Nat Methods,2015,12(10):989-994.
[15] ZHANG X,ZHANG X F,LI H P,et al.Atmospheric and room temperature plasma(ARTP) as a new powerful mutagenesis tool[J].Appl Microbiol Biotechnol,2014,98(12):5387-5396.
[16] GUNSALUS R P,YANOFSKY C.Nucleotide sequence and expression ofEscherichiacolitrpR,the structural gene for thetrpaporepressor[J].Proc Natl Acad Sci USA,1980,77(12):7117-7121.
[17] NOVICHKOV P S,KAZAKOV A E,RAVCHEEV D A,et al.RegPrecise 3.0:a resource for genome-scale exploration of transcriptional regulation in bacteria[J].BMC Genomics,2013,14:745.
[18] BROWN K D.Formation of aromatic amino acid pools inEscherichiacoliK-12[J].J Bacteriol,1970,104:177-188.
[19] HALLERAN A,MURRAY R M.Cell-free and in vivo characterization of Lux,Las,and Rpa quorum activation systems inE.coli[J].BioRxiv,2017,doi:10.1101/159988.
[20] ESPAH BORUJENI A,MISHLER D M,WANG J,et al.Automated physics-based design of synthetic riboswitches from diverse RNA aptamers[J].Nucleic Acids Res,2015,44(1):1-13.
(责任编辑 荀志金)
GeneticbackgroundofEscherichiacoliinteractswiththeperformanceofgenetictryptophanbiosensor
WANG Tianmin1,ZHANG Chong1,2,XING Xinhui1,2
(1. Key Laboratory for Industrial Biocatalysis of the Ministry of Education,Institute of Biochemical Engineering,Department of Chemical Engineering,Tsinghua University,Beijing 100084,China; 2. Center for Syntheticand Systems Biology,Tsinghua University,Beijing 100084,China)
Genetically encoded biosensor is a category of important components of synthetic biology functional parts,and used as a powerful tool in metabolic engineering,such as screening of a mutagenesis library or genetic circuit based evolutionary engineering.Biosensor orthogonality,conventionally defined as the minimal interaction with other genetic components in host cell,is paramount to the success of such applications.However,there exist few examples exploring the potential interacting factors of the host cell with biosensor.In this work,based on the analysis of tryptophan biosensor performance in a series ofEscherichiacolihost cells with different genetic backgrounds,we identified that the TrpR regulon as well as TnaA enzyme had significant interaction with the response profile of the tryptophan biosensor.We also gave a proposed molecular model of this interaction.This work presented an example of host genetic component impairing biosensor orthogonality,which can guide us to design better strategy to utilize biosensor in metabolic engineering more reliably.
Escherichiacoli; biosensor; biosensor orthogonality; tryptophan; metabolic engineering
10.3969/j.issn.1672-3678.2017.06.012
2017-09-26
国家自然科学基金(21376137);清华大学自主科研项目(2013Z02-1)
王天民(1990—),男,甘肃民勤人,博士研究生,研究方向:基于高通量方法的基础微生物学、生物物理和代谢工程;张 翀(联系人),副教授,E-mail:chongzhang@mail.thu.edu.cn
TQ922; Q93
A
1672-3678(2017)06-0080-07
