生物催化5-羟甲基糠醛高值化转化进展
2017-12-06李宁
李 宁
(华南理工大学 食品科学与工程学院,广东 广州 510641)
生物催化5-羟甲基糠醛高值化转化进展
李 宁
(华南理工大学 食品科学与工程学院,广东 广州 510641)
5-羟甲基糠醛(HMF)是一个重要的生物基平台化合物。近年来,化学催化其高值化转化受到了广泛关注,并取得了较大进展。尽管生物催化具有反应条件温和、高选择性及环境友好等优点,但是生物催化HMF转化仍处于初步发展阶段。本文中,笔者主要就近年来生物催化HMF氧化、还原、还原氨化、缩合及酯化等方面的研究进行综述,以期为建立高效制备HMF高附加值衍生物的生物催化途径提供参考。
平台化合物;生物催化;5-羟甲基糠醛;氧化还原反应
随着化石资源的日益匮乏和环境问题的加剧,近年来生物基能源和平台化合物的开发与利用越来越受到人们的关注[1]。5-羟甲基糠醛(HMF)是一个重要的生物基平台化合物,位居美国能源部宣布的“Top 10+4”平台化合物之列[2]。该生物基平台化合物可以通过碳水化合物脱水制备得到。HMF分子中有多个活性基团如羟基、醛基等,经化学修饰可转化为各种高附加值中间体(图1)。这些HMF衍生物都是重要的合成中间体,在医药、能源和高分子等领域具有重要的应用价值[3]。
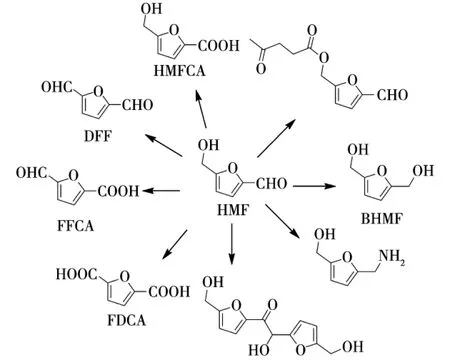
图1 HMF及其衍生物Fig.1 HMF and its derivatives
当前,化学催化仍是HMF高值化转化的主流方法[3]。尽管化学法已取得了长足进展,但化学法通常以重金属为催化剂,环境不友好。此外,部分化学催化剂选择性不理想,容易导致活性羟基或醛基的过度氧化,从而产生大量副产物,影响后续目标产物分离纯化;并且在化学合成过程中通常以毒性较大的吡啶、二甲基亚砜及CH2Cl2等为溶剂。与化学法相比,生物催化具有诸多优势,如反应条件温和、选择性高、工艺简单、无需利用有毒溶剂和催化剂,环境友好[4]。生物催化替代传统的化学工艺已成为未来工业制造的发展趋势。例如,腈水合酶已成功替代Cu2+用于工业生产高纯度丙烯酰胺[5];青霉素酰化酶已成功用于生产β-内酰胺抗生素母核及各种半合成β-内酰胺抗生素[6]。
最近,吴树丽等[7]对生物催化HMF氧化方向的研究进行了较为全面的总结。本文中,笔者除了介绍HMF氧化方向的最新进展外,还对生物催化HMF还原、还原氨化、酯化等方向的研究进行综述,以期为相关研究者提供参考。
1 生物催化HMF氧化
1.1 2,5-二甲酰基呋喃(DFF)合成
最早,Van Deurzen等[8]以过氧化氢(H2O2)为氧化剂,利用氯过氧化物酶催化HMF氧化合成DFF,但选择性最高仅为74%,反应过程中有大量5-羟甲基呋喃-2-羧酸(HMFCA)形成。笔者所在课题组的Qin等[9]发现半乳糖氧化酶在辣根过氧化酶的激活作用下能选择性催化HMF氧化为DFF,96 h后产率达91%。McKenna等[10]报道半乳糖氧化酶突变体M3-5是更优越的生物催化剂,能更高效地将HMF转化为DFF;50 mmol/L HMF反应5 h后,DFF产率即超过90%。
1.2 HMFCA合成
Krystof等[11]在乙酸乙酯-叔丁醇体系中利用脂肪酶催化H2O2氧化乙酸乙酯,原位合成过氧乙酸,进而氧化HMF生成HMFCA,底物转化率为100%,但选择性仅为80%,因为脂肪酶会进一步催化HMFCA与乙酸乙酯进行酯化反应,产生约20%的HMFCA乙酸酯。笔者所在课题组的Qin等[9]发现黄嘌呤氧化酶能高效、高选择性催化HMF氧化为HMFCA,反应7 h后,目标产物产率达到94%。但黄嘌呤氧化酶的底物谱较窄,几乎不能以DFF为底物合成相应的酸。与上述Krystof等报道的HMFCA合成方法相比,Qin等报道的黄嘌呤氧化酶催化途径具有以下优点:①使用空气作为氧化剂,而不是有毒的H2O2;②以绿色、易得的水作为溶剂,不需要使用挥发性有机溶剂;③选择性高;④无副产物;⑤反应时间短。最近,Kumar等[12]发现Baeyer-Villiger单加氧酶能催化HMF氧化为HMFCA,但选择性有待进一步提高,因为在反应过程中伴随着一个未知化合物的形成。最近,Zhou等[13]报道了提高溶氧能极大地增强反应器中全细胞催化糠醛氧化,高效合成糠酸,反应24 h后,目标产物浓度高达341 mmol/L(38.2 g/L),产率为100%。
1.3 5-甲酰基呋喃-2-羧酸(FFCA)合成
笔者所在课题组的Qin等[9]报道了漆酶-四甲基哌啶氮氧化物(TEMPO)体系催化HMF选择性氧化,主要产物为FFCA,产率达82%。而Carro等[14]发现来源于真菌的芳基醇氧化酶能选择性催化HMF(3 mmol/L)转化为FFCA,产率达98%;其反应历程为HMF先转化为DFF,然后再被快速氧化为FFCA。
1.4 2,5-呋喃二羧酸(FDCA)合成
Wierckx等[15]发现CupriavidusbasilensisHMF14能降解木质纤维素水解液中的各种抑制剂如HMF等。随后,Koopman等[16]将该菌中催化HMF转化的基因hmfH引入PseudomonasputidaS12构建重组菌,该重组菌能高效催化HMF转化为FDCA;通过分批流加策略,反应144 h后目标产物浓度为193 mmol/L(30.1 g/L),产率达97%。Yang等[17]报道了1株BurkholderiacepaciaH-2,该菌能将海藻酸水解液中的HMF(16 mmol/L)转化为FDCA,但产率最高仅为50%。最近,Hossain等[18]从土壤中分离得到1株能转化HMF的RaoultellaornithinolyticaBF60,随后作者对该菌进行代谢工程改造,显著提高了其催化效率,100 mmol/L HMF经改造后的工程菌转化170 h后,FDCA产率为89%。
Dijkman等[19]报道了一种来源于Methylovorussp.MP688的HMF氧化酶,该酶能够催化HMF进行三步级联氧化,转化为FDCA,产率达95%(图2)[20];随后,他们解析了HMF氧化酶的晶体结构,并对其进行了突变改造以提高其催化活性[21]。Carro等[14]先利用芳基醇氧化酶将HMF(3 mmol/L)转化为FFCA,然后加入一种非特异性的羟化环氧化酶(peroxygenase)将FFCA氧化为FDCA,但该级联反应效率较低,需反应较长时间(120 h)才能获得高FDCA产率(91%)。而McKenna等[10]利用一锅双酶(半乳糖氧化酶M3-5及醛氧化酶PaoABC)耦联法,以HMF为底物合成了FDCA,产率达74%。Correia等[22]研究发现,醛氧化酶PaoABC是一种独特的黄嘌呤氧化酶,能高效催化DFF转化为FDCA。Qin等[9]利用半乳糖氧化酶和脂肪酶构建双酶级联反应体系,将HMF转化为FDCA,两步反应总产率约为66%。
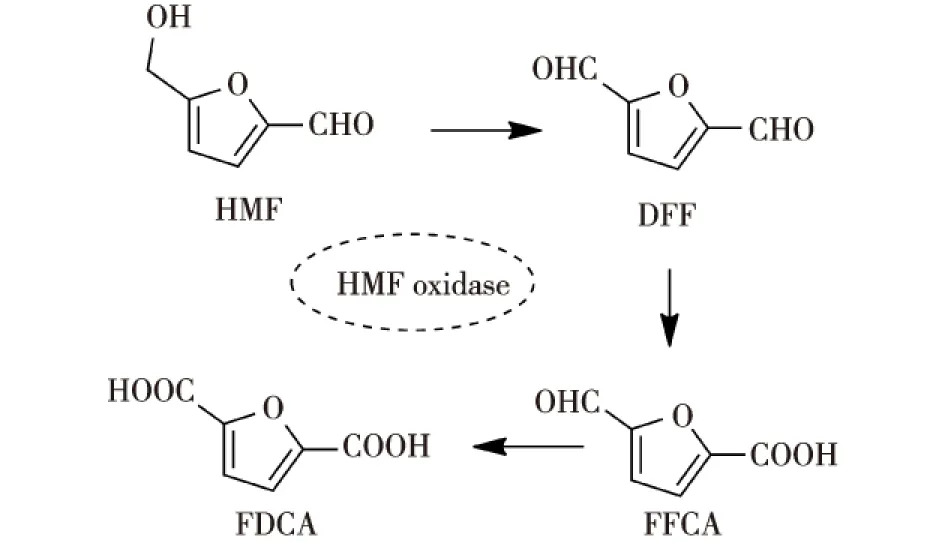
图2 HMF氧化酶催化HMF氧化Fig.2 HMF oxidase-catalyzed oxidation of HMF
2 生物催化HMF还原
在木质纤维素酸水解液生物脱毒中,已有关于微生物细胞催化HMF或/及糠醛还原的报道[23]。但这些微生物远不能满足生物催化HMF还原合成2,5-二羟甲基呋喃(BHMF)的要求(底物浓度高、转化速度快,且反应选择性好等),其原因有:生物脱毒效率仍较低,即微生物转化HMF的速度慢[24-25];微生物可耐受的HMF浓度较低[26-27];微生物催化HMF转化的选择性不高[27]。最近,笔者所在课题组的Li等[28]从土壤中分离得到1株酵母菌MeyerozymaguilliermondiiSC1103,该菌不仅对底物HMF(110 mmol/L)和产物BHMF(200 mmol/L)具有高耐受性,而且能高效、高选择性催化HMF(100 mmol/L)还原合成BHMF,12 h后目标产物产率达86%,选择性>99%;借助底物分批流加策略,24.5 h内产物浓度高达191 mmol/L,生产效率达24 g/(L·d)。He等[29]报道EscherichiacoliCCZU-K14能够高效催化糠醛还原为糠醇,24 h后产率达100%;并构建了一个化学-酶法工艺,由木糖为原料合成糠醇,总产率约为41%。
3 其他反应
哈斯等[30]报道了一个多酶级联反应体系,利用半乳糖氧化酶将HMF氧化为DFF,然后利用ω-转氨酶催化该中间体还原氨化合成了2,5-二氨甲基呋喃,产率>80%。最近,Dunbabin等[31]报道了ω-转氨酶催化HMF及其结构类似物还原氨化,合成了一系列糠胺衍生物,产率最高达到92%。
多个研究小组报道了不同来源的醇腈酶催化糠醛与氢氰酸(HCN)进行加成反应,合成了有用的手性中间体(R)-及(S)-氰醇[32-34]。随后,Purkarthofer等[35]成功将上述反应放大至千克规模,合成了(R)-2-(2-呋喃)-2-羟基乙腈,产率高达95%,对映体过剩值(e.e.)>99%。Donnelly等[36]发现苯甲醛裂合酶能催化糠醛或HMF进行自缩合反应,或催化糠醛与HMF进行异缩合反应合成C10~C12化合物。
HMF酯衍生物在燃油添加剂、高分子、表面活性剂及杀真菌剂等领域具有潜在的应用价值。Krystof等[37]报道了无溶剂体系中脂肪酶催化HMF酯化或转酯化反应,合成了一系列HMF脂肪酸酯及碳酸酯,产率为85%~91%。最近,笔者所在课题组的Qin等[38]在生物基溶剂中借助酶催化将两种重要的生物基平台化合物(乙酰丙酸及HMF)转化为HMF乙酰丙酸酯,并且当HMF浓度高达500 mmol/L时,底物转化率仍可达到72%。
4 结论与展望
尽管生物催化HMF高值化转化处于初步研究阶段,但与化学法相比,生物催化更具吸引力,因为生物催化过程具有绿色环保、反应条件温和及高选择性等优点。然而,HMF对生物催化剂具有较高毒性和抑制作用,故生物催化HMF高值化转化仍颇具挑战。目前,能高效催化HMF选择性转化的生物催化剂仍不多,并且存在底物耐受性差、转化效率低等问题。同时,生物催化反应类型仍非常有限,有待于进一步拓展。因此,挖掘新型、高效、高选择性且对HMF具有高耐受性的生物催化剂是今后该领域研究的一个重要方向。进而,解析酶分子晶体结构并阐明其催化机制,为酶分子的理性设计和改造提供理论指导,避免盲目低效的突变。介质工程及固定化技术等生物催化工程技术能有效地解决反应过程中的各种问题,如底物溶解及抑制、产物抑制及分离、催化剂重复利用等[39]。因此,这些工程技术在生物催化HMF高值化转化中的应用也是另一个重要研究方向,这将极大地提高生物催化剂的催化性能、降低成本,从而推动HMF高值化转化新技术的工业应用。
[1] SHELDON R A.Utilisation of biomass for sustainable fuels and chemicals:molecules,methods and metrics[J].Catal Today,2011,167(1):3-13.
[2] VAN PUTTEN R J,VAN DER WAAL J C,DE JONG E,et al.Hydroxymethylfurfural,a versatile platform chemical made from renewable resources[J].Chem Rev,2013,113(3):1499-1597.
[3] ROSATELLA A A,SIMEONOV S P,FRADE R F,et al.5-Hydroxymethylfurfural (HMF) as a building block platform:biological properties,synthesis and synthetic applications[J].Green Chem,2011,13(4):754-793.
[4] STRAATHOF A J J.Transformation of biomass into commodity chemicals using enzymes or cells[J].Chem Rev,2014,114(3):1871-1908.
[5] YAMADA H,KOBAYASHI M.Nitrile hydratase and its application to industrial production of acrylamide[J].Biosci Biotechnol Biochem,1996,60(9):1391-1400.
[6] WEGMAN M A,JANSSEN M H A,VANRANTWIJK F,et al.Towards biocatalytic synthesis ofβ-lactam antibiotics[J].Adv Syn Catal,2001,343(6/7):559-576.
[7] 吴树丽,刘启顺,谭海东,等.5-羟甲基糠醛的生物催化氧化研究进展[J].生物技术通报,2016,32(9):50-58.
[8] VAN DEURZEN M P J,VAN RANTWIJK F,SHELDON R A.Chloroperoxidase-catalyzed oxidation of 5-hydroxymethylfurfural[J].J Carbohydr Chem,1997,16(3):299-309.
[9] QIN Y Z,LI Y M,ZONG M H,et al.Enzyme-catalyzed selective oxidation of 5-hydroxymethyl-furfural (HMF) and separation of HMF and 2,5-diformylfuran using deep eutectic solvents[J].Green Chem,2015,17(7):3718-3722.
[10] MCKENNA S M,LEIMKUHLER S,HERTER S,et al.Enzyme cascade reactions:synthesis of furandicarboxylic acid (FDCA) and carboxylic acids using oxidases in tandem[J].Green Chem,2015,17(6):3271-3275.
[11] KRYSTOF M,PÉREZ-SNCHEZ M,DOMNGUEZDEMARIA P.Lipase-mediated selective oxidation of furfural and 5-hydroxymethylfurfural[J].ChemSusChem,2013,6(5):826-830.
[12] KUMAR H,FRAAIJE M W.Conversion of furans by Baeyer-Villiger monooxygenases[J].Catalysts,2017,DOI:10.3390/catal7060179.
[13] ZHOU X,ZHOU X,XU Y,et al.Gluconobacteroxydans(ATCC 621H) catalyzed oxidation of furfural for detoxification of furfural and bioproduction of furoic acid[J].J Chem Technol Biotechnol,2017,92(6):1285-1289.
[14] CARRO J,FERREIRA P,RODRGUEZ L,et al.5-Hydroxymethylfurfural conversion by fungal aryl-alcohol oxidase and unspecific peroxygenase[J].FEBS J,2015,282(16):3218-3229.
[15] WIERCKX N,KOOPMAN F,BANDOUNAS L,et al.Isolation and characterization ofCupriavidusbasilensisHMF14 for biological removal of inhibitors from lignocellulosic hydrolysate[J].Microb Biotechnol,2010,3(3):336-343.
[16] KOOPMAN F,WIERCKX N,DE WINDE J H,et al.Efficient whole-cell biotransformation of 5-(hydroxymethyl) furfural into FDCA,2,5-furandicarboxylic acid[J].Bioresour Technol,2010,101(16):6291-6296.
[17] YANG C F,HUANG C R.Biotransformation of 5-hydroxy-methylfurfural into 2,5-furan-dicarboxylic acid by bacterial isolate using thermal acid algal hydrolysate[J].Bioresour Technol,2016,214:311-318.
[18] HOSSAIN G S,YUAN H,LI J,et al.Metabolic engineering ofRaoultellaornithinolyticaBF60 for production of 2,5-furandicarboxylic acid from 5-hydroxymethylfurfural[J].Appl Environ Microbiol,2017,83(1):e02312-16.
[19] DIJKMAN W P,FRAAIJE M W.Discovery and characterization of a 5-hydroxymethylfurfural oxidase fromMethylovorussp.strain MP688[J].Appl Environ Microbiol,2014,80(3):1082-1090.
[20] DIJKMAN W P,GROOTHUIS D E,FRAAIJE M W.Enzyme-catalyzed oxidation of 5-hydroxymethylfurfural to furan-2,5-dicarboxylic acid[J].Angew Chem Int Ed,2014,53(25):6515-6518.
[21] DIJKMAN W P,BINDA C,FRAAIJE M W,et al.Structure-based enzyme tailoring of 5-hydroxymethylfurfural oxidase[J].ACS Catal,2015,5(3):1833-1839.
[22] CORREIA M A S,OTRELO-CARDOSO A R,SCHWUCHOW V,et al.TheEscherichiacoliperiplasmic aldehyde oxidoreductase is an exceptional member of the xanthine oxidase family of molybdoenzymes[J].ACS Chem Biol,2016,11(10):2923-2935.
[24] ZHANG D,ONG Y L,LI Z,et al.Biological detoxification of furfural and 5-hydroxyl methyl furfural in hydrolysate of oil palm empty fruit bunch byEnterobactersp.FDS8[J].Biochem Eng J,2013,72:77-82.
[25] LIU Z L,SLININGER P J,GORSICH S W.Enhanced biotransformation of furfural and hydroxymethylfurfural by newly developed ethanologenic yeast strains[J].Appl Biochem Biotechnol,2005,121-124:451-460.
[26] RAN H,ZHANG J,GAO Q,et al.Analysis of biodegradation performance of furfural and 5-hydroxymethylfurfural byAmorphothecaresinaeZN1[J].Biotechnol Biofuels,2014,7(1):51.
[27] FELDMAN D,KOWBEL D,GLASS N,et al.Detoxification of 5-hydroxymethylfurfural by thePleurotusostreatuslignolytic enzymes aryl alcohol oxidase and dehydrogenase[J].Biotechnol Biofuels,2015,8:63.
[28] LI Y M,ZHANG X Y,LI N,et al.Biocatalytic reduction of HMF to 2,5-bis(hydroxymethyl)furan by HMF-tolerant whole cells[J].ChemSusChem,2017,10(2):372-378.
[29] HE Y C,JIANG C X,JIANG J W,et al.One-pot chemo-enzymatic synthesis of furfuralcohol from xylose[J].Bioresour Technol,2017,238:698-705.
[30] 哈斯 T,普费弗 J C,法贝尔 K,等.酶促氨基化:103635583A[P].2014-03-12.
[31] DUNBABIN A,SUBRIZI F,WARD J M,et al.Furfurylamines from biomass:transaminase catalysed upgrading of furfurals[J].Green Chem,2017,19(2):397-404.
[32] HAN S Q,OUYANG P K,WEI P,et al.Enzymatic synthesis of (R)-cyanohydrins by a novel (R)-oxynitrilase fromViciasativaL[J].Biotechnol Lett,2006,28(23):1909-1912.
[33] CHEN P,HAN S,LIN G,et al.A study of asymmetric hydrocyanation of heteroaryl carboxaldehydes catalyzed by (R)-oxynitrilase under micro-aqueous conditions[J].Tetrahedron:Asymmetry,2001,12(23):3273-3279.
[34] CHEN P,HAN S,LIN G,et al.A practical high through-put continuous process for the synthesis of chiral cyanohydrins[J].J Org Chem,2002,67(23):8251-8253.
[35] PURKARTHOFER T,PABST T,VAN DEN BROEK C,et al.Large-scale synthesis of (R)-2-amino-1-(2-furyl)ethanol via a chemoenzymatic approach[J].Org Process Res Dev,2006,10(3):618-621.
[36] DONNELLY J,MULLER C R,WIERMANS L,et al.Upgrading biogenic furans:blended C10-C12platform chemicals via lyase-catalyzed carboligations and formation of novel C12-choline chloride-based deep-eutectic-solvents[J].Green Chem,2015,17(5):2714-2718.
[37] KRYSTOF M,PÉREZ-SNCHEZ M,DOMNGUEZ DE MARA P.Lipase-catalyzed (trans) esterification of 5-hydroxy-methylfurfural and separation from HMF esters using deep-eutectic solvents[J].ChemSusChem,2013,6(4):630-634.
[38] QIN Y Z,ZONG M H,LOU W Y,et al.Biocatalytic upgrading of 5-hydroxymethylfurfural (HMF) with levulinic acid to HMF levulinate in biomass-derived solvents[J].ACS Sustainable Chem Eng,2016,4(7):4050-4054.
[39] SHELDON R A,PEREIRA P C.Biocatalysis engineering:the big picture[J].Chem Soc Rev,2017,46(10):2678-2691.
(责任编辑 荀志金)
Advancesinbiocatalyticupgradingof5-hydroxymethylfurfural
LI Ning
(School of Food Science and Engineering,South China University of Technology,Guangzhou 510641,China)
5-Hydroxymethylfurfural (HMF) is an important bio-based platform chemical.In recent years,catalytic upgrading of HMF has attracted considerable interest,and significant progress has been achieved.However,biocatalytic valorization of HMF into its valuable derivatives
less attention,in spite of many advantages such as mild reaction conditions,excellent selectivity and environmental friendliness.In this review,we introduced recent advances in biocatalytic HMF oxidation,reduction,reductive amination,condensation,and esterification,to provide useful information for constructing efficient biocatalytic approaches toward value-added chemicals.
platform chemicals;biocatalysis;5-hydroxymethylfurfural;redox reactions
10.3969/j.issn.1672-3678.2017.06.005
2017-06-21
国家自然科学基金(21676103);中央高校基本科研业务费专项资金(2017ZD065)
李 宁(1979—),男,江西抚州人,副教授,博士生导师,研究方向:生物催化,E-mail:lining@scut.edu.cn
Q81
A
1672-3678(2017)06-0034-04
