微生物细胞CO2跨膜转运的研究进展
2017-12-06杨高华姜卫红
张 灿,杨高华,姜卫红,顾 阳
(1. 中国科学院 上海生命科学研究院 植物生理生态研究所,上海 200032;2. 中国科学院 合成生物学重点实验室,上海 200032)
微生物细胞CO2跨膜转运的研究进展
张 灿1,2*,杨高华1,2*,姜卫红1,2,顾 阳1,2
(1. 中国科学院 上海生命科学研究院 植物生理生态研究所,上海 200032;2. 中国科学院 合成生物学重点实验室,上海 200032)
CO2是自然界储量巨大的游离性碳资源。关于CO2的生物转化,除了我们所熟知的植物光合作用外,许多微生物亦具备此能力。微生物利用CO2的首要步骤是完成CO2从细胞外向细胞内的跨膜转运,这也是决定微生物CO2利用效率的重要环节。本文中,笔者对目前微生物CO2跨膜转运的研究进展进行了总结,重点阐述了各类微生物CO2运输元件及其工作的分子机制以及通过优化CO2转运提高微生物利用CO2能力的策略。在此基础上,笔者还提出了今后微生物转化利用CO2的研究重点和关键科学问题,可为未来通过生物路线实现CO2的资源化利用提供借鉴。
微生物;CO2;跨膜运输;转运子;分子机制
长期以来,来源于粮食作物的糖基原料一直是微生物发酵的主要碳源,未来发展趋势是以更为廉价的碳资源结合高效的重组微生物作为生产菌株来实现技术革新。这之中,除了所熟知的木质纤维素原料,以CO2为代表的一碳资源的利用近年来已引起广泛关注。CO2储量丰富且来源广泛,除了是地球大气的主要成分,还广泛存在于石化及冶炼企业排放的废气、含碳物质(如煤、石油、天然气以及生物质等)气化制备的合成气等。因此,发展CO2为代表的一碳资源利用的生物催化路线,将为解决全球资源和能源问题开辟一条新路,对未来工业可持续发展具有重要意义。
固碳微生物可通过生命活动将空气中游离态的碳素直接转变为含碳有机物加以利用,因而在地球生物圈的碳循环中扮演重要角色,其固碳转化功能对于CO2的资源化利用起着重要作用。天然的自养型固碳微生物按能量依赖形式主要分为光能、化能以及电能3种类型。其中,化能固碳微生物以H2或其他还原性化合物作为还原力和能量供体用于吸收固定CO2,比较有代表性的是产乙酸菌(acetogen)[1]。值得一提的是,个别产乙酸菌还能够直接利用电能作为还原力实现CO2的固定[2]。光能固碳微生物,如藻类,可直接利用光能固定CO2,其CO2的固定效率远高于植物[3],且具有遗传背景简单、生长速度快和营养需求低等优势。此外,借助合成生物学手段改造异养型微生物实现其自养固碳也是未来发展的重要方向之一,可为获得新型固碳微生物开辟道路。
作为固碳过程的首要步骤,微生物完成CO2从外部环境转运至胞内的方式主要有被动运输和主动运输两类,其中被动运输中又存在简单扩散和协助扩散两种方式[4-5]。CO2是非极性小分子,通常能以简单扩散的方式直接通过细胞膜,这一跨膜转运的方式和机制在固碳微生物中普遍存在[6]。而其他转运方式,由于需要借助辅助因子,其具体机制在不同微生物中存在一定差异。总体而言,基于主动运输的物质跨膜转运效率比被动运输更高[5]。
目前,关于植物体内CO2传递运输的研究较为全面和深入,且有系统的总结和阐述[7-10];而微生物CO2跨膜转运的研究主要集中于光合固碳的真核藻类和原核蓝藻,在其他自养微生物中的研究较少。本文中,笔者总结和梳理了迄今已发现和报道的微生物CO2跨膜转运方式及其分子机制,并重点介绍近年来该研究领域的新进展以及如何通过对CO2运输途径的代谢工程设计和改造提升微生物的固碳效率。
1 CO2被动运输
被动运输是指通过简单扩散或者协助扩散实现物质由高浓度向低浓度方向的跨膜转运,其转运动力来自于细胞内外物质的浓度梯度或溶质的电化学梯度,不需要消耗细胞自身的能量[11]。其中,疏水小分子或不带电荷的极性分子在跨膜转运中不需要细胞提供能量,也没有膜蛋白的协助,这种方式称为简单扩散;而一些极性分子和无机离子,如氨基酸、核苷酸等,顺着浓度梯度或电化学梯度减小方向的跨膜转运虽然也不需要消耗能量,但需要特异的膜蛋白协助,因而称之为协助扩散[12]。
CO2分子属于非极性小分子,其热运动使CO2分子能以简单扩散的方式通过细胞膜[6],因而这种CO2吸收方式在微生物中普遍存在。此外,CO2的跨膜转运亦一定程度地依赖于协助扩散。目前,CO2的协助扩散研究较多地集中于哺乳动物细胞中,且主要发现了两类协助CO2扩散的转运子,即Rhesus(Rh)蛋白和水通道蛋白[13-14]。相对而言,微生物的CO2协助扩散机制研究较少,且多聚焦于光能自养的藻类。
目前,研究者只在包括绿藻在内的少数真核微生物中发现了类似上述哺乳动物中Rh蛋白协助CO2扩散的转运子[15]。作为铵转运蛋白Amt的同系物,Rh蛋白亦属于通道蛋白[16]。在绿藻属莱茵衣藻中的研究发现,Rh蛋白的同源蛋白Rhl的表达量受到CO2浓度的影响。当衣藻在高浓度CO2(3%)的条件下生长时,Rhl 的表达量较高,而当用空气作为原料气培养时,Rhl 表达水平较低[17]。为了进一步验证绿藻中的Rh1是否参与了CO2的跨膜转运,研究者通过RNA干扰技术降低了衣藻中该蛋白编码基因的表达量,结果表明:在高浓度CO2条件下,突变株的生长速率明显低于原始菌株,而在空气中两者生长情况相近[4],从而证明了衣藻的Rhl蛋白主要在高浓度CO2条件下发挥作用。
水通道蛋白在微生物中分布较为广泛。根据已完成的微生物全基因组序列分析,有26%的原核微生物和67%的真核微生物含有潜在的水通道蛋白[18],主要包括革兰氏阳性的芽孢杆菌属、分枝杆菌属、链球菌属,革兰氏阴性的大肠杆菌、布鲁氏菌、弧菌、假单胞菌以及酵母等[19]。已有研究表明,一些水通道蛋白在微生物抵御环境冷冻胁迫中发挥重要作用[20-22]。但水通道蛋白在微生物中是否也参与CO2跨膜转运尚不得而知,有待进一步的实验验证。
2 CO2主动运输
主动运输是由载体蛋白所介导的物质逆浓度梯度或电化学梯度由浓度低的一侧向浓度高的一侧进行跨膜转运的方式,这一过程需要消耗能量[12]。CO2可以分子或HCO3-的形式通过主动运输的方式被转运至细胞内。这一转运方式是藻类实现CO2浓缩的首要步骤。目前,已知藻类固碳的关键酶——核酮糖-1,5-二磷酸羧化酶/加氧酶(RubisCO)对CO2的亲和力较弱。通过这种主动运输的方式,藻类可以提高羧酶体内CO2浓度,弥补RubisCO对CO2亲和力不足的问题,提高反应效率[5,23]。
2.1 蓝藻
蓝藻又被称为蓝细菌,具有极为高效的CO2浓缩机制。图1展示了蓝藻中的无机碳转运子。蓝藻含有的无机碳转运子主要有以下5种类型:①BCT1。诱导型ATP依赖的HCO3-转运子,对CO2具有较高的亲和力。②SbtA。诱导型的Na+依赖的HCO3-转运子,也对CO2具有较高的亲和力,由sbtA基因编码,在无机碳转运中起重要作用[24]。③BicA。Na+依赖的HCO3-转运子,对HCO3-亲和力较低但转运速率较高,属于SulP家族[25]。④NDH-14。组成型的CO2吸收系统,由NdhD4/NdhF4/CupB(ChpX)组成[26-27]。NDH-14可将通过被动运输进入细胞的CO2再转化为HCO3-。⑤NDH-13。诱导型CO2转运系统,由NdhD3/NdhF3/CupA(ChpY)组成[26],工作机制与NDH-14相似,但对CO2的亲和力要高于NDH-14[27]。
上述高亲和力的HCO3-转运子BCT1属于ABC(ATP binding cassette)型转运蛋白家族,又被称为转运ATPases,通常由ATP提供能量[28]。它是由cmpABCD操纵子编码的4个亚基组成的复合体。目前为止,其功能及工作机制只在聚球藻SynechococcusPCC7942中有所研究。相比蓝藻中另外几种无机碳转运子,该转运子对HCO3-具有较高的光合亲和性[29],在无机碳(CO2和HCO3-)受限或高光胁迫条件下均可被诱导表达[30-32]。
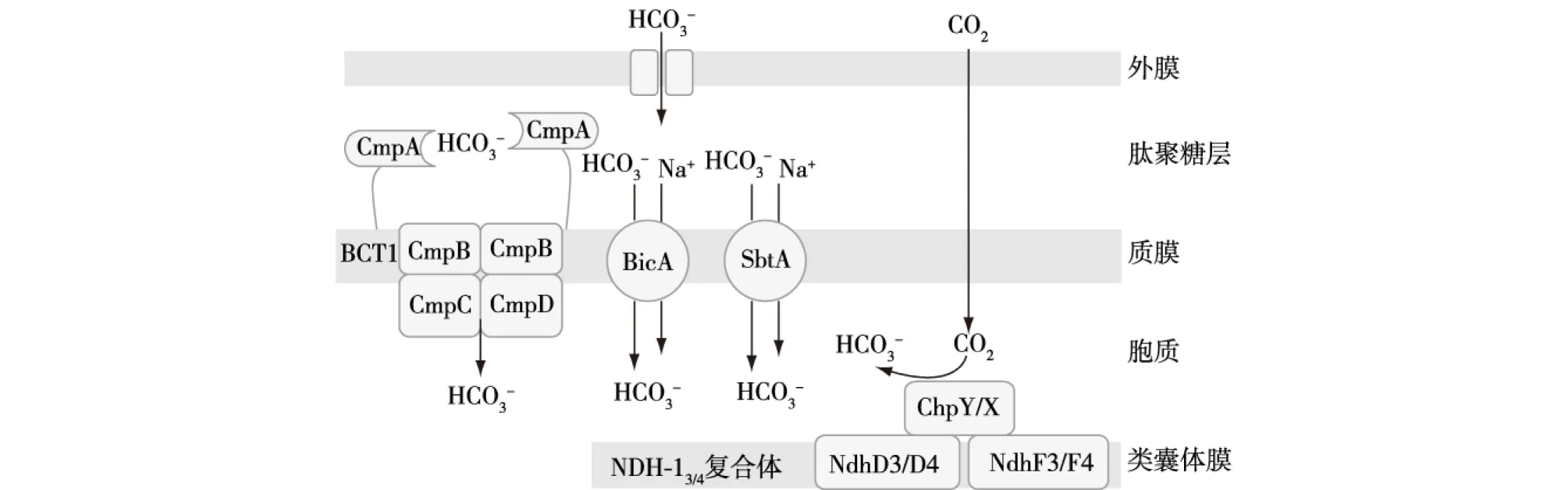
BCT1—转运ATPase,由操纵子CmpABCD编码,包含4种亚基;BicA和SbtA—Na+依赖的 HCO3- 转运子;NDH-13和NDH-14—CO2吸收系统,其中,NDH-13由NdhF3/NdhD3/ChpY构成,NDH-14由NdhF4/NdhD4/ChpX构成图1 蓝藻中无机碳转运子Fig.1 Inorganic carbon transporters in cyanobacteria
SbtA转运子最初是在集胞藻SynechocystisPCC6803中被发现的,它是一种Na+依赖的HCO3-转运子[24]。SbtA发挥转运功能并不消耗ATP,而是依赖于Na+形成的胞内外电化学梯度[33]。关于HCO3-转运对Na+依赖性的解释尚未有定论,一种观点认为是HCO3-在转运过程中通过关联Na+/H+反向运输系统来维持胞内pH的稳定[33]。此外,研究者还发现该转运子在碳限制条件下的蛋白表达水平急剧上升[34],表明它在低浓度CO2时可能发挥重要作用。
BicA转运子是在近海蓝藻聚球藻SynechococcusPCC7002中首先被发现的,是另一种Na+依赖的HCO3-转运子。此后,在SynechococcusWH8102和SynechocystisPCC6803中也发现存在这类转运子[25]。在不同的蓝藻中,该转运子表达方式存在一定差异。研究显示,SynechococcusPCC7002中的BicA在无机碳限制的条件下可被诱导表达,而在高CO2环境中的表达水平却较低;在SynechocystisPCC6803中,BicA的基因可能是组成型表达的[35]。与无机碳转运子SbtA相比,BicA在转运过程中虽然对底物的亲和力较低,但却具有较高的转运速率,从而支撑较高的光合速率[25]。
NDH-13/4都属于修饰过的NADPH脱氢酶(NDH-1)复合物。在组成上,NDH-13和NDH-14复合体分别包含ChpX和ChpY蛋白,这2个蛋白催化细胞质内CO2到HCO3-的转化[27]。复合体NDH-14系统是组成型表达的,而NDH-13则是可被诱导表达的[36]。研究表明,SynechococcusPCC7002的ndhF3/ndhD3/chpY/orf133基因编码高亲和力的NDH-13复合物,而SynechocystisPCC6803的ndhF4/ndhD4/chpX基因编码组成型表达的低亲和性的NDH-14复合物[26-27]。需要指出的是,NDH-13和NDH-14这2种复合体定位于类囊体膜上,而不是像其他几种转运子定位在细胞膜上。目前已知,NDH-13和NDH-14在α和β型蓝藻中均有分布[37-38],但相关的功能研究主要集中于3种β型的蓝藻,即SynechococcusPCC7002、SynechococcusPCC7942和SynechocystisPCC6803[26-27]。
2.2 莱茵衣藻
莱茵衣藻作为一种淡水绿藻,是第1个被用于研究CO2浓缩机制的真核藻类[39]。作为真核藻类,其CO2浓缩机制要比蓝藻复杂,相关研究尚不深入。
图2展示了衣藻中的无机碳转运子。由图2可知:CO2可以直接透过细胞膜进入胞质,也可以在碳酸酐酶(carbonic anhydrase,CA)的催化下生成HCO3-,再通过载体HLA3或LCI1转运进入胞质。胞质中CO2分子和HCO3-进入叶绿体后作为光合作用的原料。研究者已在莱茵衣藻中鉴定了2个位于细胞质膜上可能的无机碳转运子,即HLA3/MRP1和LCI1[40-42]。其中,HLA3最初被发现只在低CO2浓度(0.03%)的条件下才被诱导启动转录[40],且HLA3的表达受到CIA5的调控;后者是一个感应CO2浓度的调控基因,在低CO2浓度时调控HLA3的表达[43]。在缺乏CIA5时,HLA3不能发挥转运功能[44]。有研究者在低浓度CO2条件下通过RNAi的方式干扰HLA3的表达,从而降低了衣藻对无机碳的亲和性,显著影响了衣藻的生长[45],从而证明了HLA3确实在衣藻光合固碳中发挥着作用。近年来,研究者发现定位于叶绿体上的LCIA也能影响HLA3的表达[46]。LCIA的缺失导致HLA3的表达水平降低,从而影响无机碳的转运。但是,当环境中CO2水平到达或者高于空气中CO2浓度时,LCIA和HLA3均被抑制,这时CO2的吸收主要由LCIB完成[47]。此外,值得一提的是,与上述蓝藻BCT1类似,HLA3也是一个ABC(ATP binding cassette)类型的转运蛋白,属于MRP蛋白家族。MRP家族蛋白在动物和植物中广泛存在,其具有广泛的底物谱[48]。所不同的是,BCT1是多聚体,而HLA3则是单体蛋白。
衣藻中另一种无机碳转运子LCI1可在低浓度CO2条件下被诱导表达[49],它的表达受到调控基因CIA5和LCR1的共同控制[41-42]。有研究者通过软件(iPSORT)预测了LCI1转运子中含有一个信号肽,并定位于细胞质膜上[50]。目前,LCI1的功能以及生理学意义尚不十分清楚,有待进一步研究。
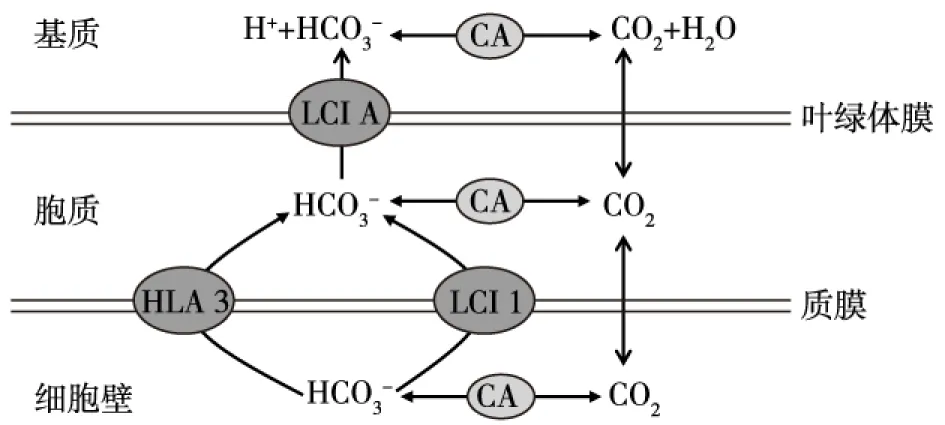
图2 衣藻中无机碳转运子Fig.2 Inorganic carbon transporters in Chlamydomonas
2.3 金藻和硅藻
金藻中的颗石藻(coccolithophores)是一种单细胞藻类,能够利用石颗藻泡(coccolith vesicle)富集CO2和Ca2+并转化为CaCO3,并将产生的CaCO3分泌到细胞表面,从而在自然界的碳循环中发挥作用。颗石藻中的HCO3-转运子AEL1(anion exchanger like 1)属于solute carrier 4(SLC4)蛋白家族,是一类重要的HCO3-转运子。在低碳浓度的环境中,CO2浓缩相关的基因表达量上调[51],从而可有效吸收CO2作为光合作用和形成CaCO3的原料,同时也对细胞内pH起到调节作用[52]。这一主动运输机制使藻类能在低CO2浓度的水体环境中获得足量的碳源以维持生长。
在对硅藻的模式菌株,即PhaeodactylumtricornutumCCAP 1055/1和ThalassiosirapseudonanaCCMP1335的基因组分析中,发现硅藻的HCO3-转运蛋白主要归属于两类蛋白家族——SLC4和SLC26[53]。这两类转运蛋白在原核和真核生物中广泛分布[54],其中,蓝藻的BicA转运子属于SLC26家族[55]。随后,有研究者对SLC4和SLC26的功能进行了解析。Nakajima等[56]发现在Phaeodactylumtricornutum中,SLC4家族的PtSLC4-2蛋白可定位于细胞质膜上,且能利用Na+浓度梯度向胞内泵入HCO3-;Matsuda等[57]则通过亚细胞定位的方法发现SLC4蛋白在叶绿体膜上也有分布,对HCO3-从胞质中运输进入叶绿体起到重要作用。
图3简要概括了上述金藻和硅藻的CO2转运方式和相关分子元件。主要通过SLC4和SLC26蛋白转运并富集HCO3-,并在叶绿体中被碳酸酐酶(CA)催化为CO2,用于碳水化合物(CH2O)的合成。

图3 金藻和硅藻无机碳转运系统Fig.3 Inorganic carbon transport system inChrysophyta and Bacillariophyta
2.4 化能自养细菌
化能自养细菌的CO2主动运输可通过HCO3-转运的方式完成,目前已发现HCO3-转运蛋白在这类细菌中广泛存在。一方面,HCO3-能协同Na+运输,维持细胞的渗透压和容量;另一方面,CO2/HCO3-/CO32-之间的切换也是维持细胞pH稳定的有效缓冲体系[58]。例如,在自养硫细菌Phreagenaokutanii中已发现了可编码SLC4家族蛋白的基因 (slc4co1、slc4co2和slc4co4)和碳酸酐酶基因(mcaco1和mcaco2),意味着该菌存在着HCO3-摄入机制[59]。在另一类化能自养细菌——氨氧化古菌中也存在着CO2的主动运输机制,其所含的SBT家族转运子具备在低碳环境中摄取无机碳的功能,但若菌体处于高CO2的环境中,该转运蛋白则不能发挥无机碳主动转运的作用[60]。
3 微生物CO2跨膜转运的遗传改造
CO2作为气态物质,其被微生物利用的过程涉及诸多关键节点,包括气液传质效率、细胞跨膜转运以及后续固碳转化过程等。其中,气液传质效率的提高主要依靠生物反应装置的设计和优化,以促进含碳气体向液态培养基的溶解[61-62]。而跨膜转运作为微生物固碳过程的首要环节,对于固碳效率亦具有决定作用,因而是遗传改造的重要靶点。
研究者在蓝藻Synechocystissp.PCC6803中用强诱导型启动子过表达BicA转运子,使得工程菌在CO2浓度为0.5% 和5%条件下的生长速度和生物量的积累达到野生型菌株的2倍[63]。此外,在衣藻Chlamydomonasreinhardtii中,研究者使用dTALE技术激活其自身的HCO3-转运子HLA3的表达,提高了衣藻在低碳条件下的碳利用率和光合作用效率[47]。
改造异养微生物实现其对CO2的固定和转化利用亦是近年来的研究热点。例如,有研究者将来源于6种蓝藻(Synechococcussp.WH5701、Cyanobiumsp.PCC7001、Cyanobiumsp.PCC6307、SynechococcuselongatusPCC7942、Synechocystissp.PCC6803和Synechococcussp.PCC7002)的CO2转运蛋白SbtA分别在大肠杆菌中进行表达,并运用同位素标记的方法观察到了大肠杆菌胞内无机碳含量的显著提升,从而证明了蓝藻来源的SbtA转运子可在大肠杆菌中得到有效表达,且发挥CO2跨膜转运的功能[64]。大肠杆菌经过人工筛选和工程改造可以用于固碳,且高效地生产琥珀酸[65],在此基础上,研究者通过在上述大肠杆菌工程菌中表达SynechocystisPCC6803来源的CO2转运子SbtA和BicA,提高其CO2的转运效率,使得琥珀酸的产量得到进一步提高[66]。
此外,CO2完成跨膜转运进入细胞后,其后续固定及代谢过程涉及多步反应,可以预见,其中会存在限速步骤。例如,最普遍的卡尔文循环中的固碳酶RubisCO,由于其对CO2的亲和力较低,因而是固碳途径遗传改造的重要靶点[67]。鉴于本文主要关注的是微生物CO2跨膜转运,对于固碳代谢途径的研究进展在此不作详细阐述。
4 结语
CO2跨膜转运是微生物代谢利用这一游离性碳资源的首要步骤。目前,在光合固碳藻类中已经鉴定了若干参与介导CO2吸收的转运子,并解析了相关的分子机制。但对于其他两种能量形式(化能和电能)的固碳微生物而言,CO2跨膜转运的研究比较薄弱,亟待跟进。
近年来,随着分子技术的快速发展,深入解析固碳微生物的CO2吸收及转化利用机制并开展高效的代谢工程设计和改造的研究迎来了契机。可以预见的是,未来的CO2生物转化利用将依托于光、化和电这3种能量形式,呈现多元化发展的局面,并致力于解决以下一些关键科学问题:①发掘和鉴定新型CO2转运子以及下游固碳途径的酶基因,充实和完善现有的固碳元件库和知识库;②固碳相关新基因的功能解析,认识和理解其工作机制;③提出重塑策略,包括优化能量吸收、CO2转运和转化效率、引入和强化CO2浓缩机制等,构建新型固碳细胞工厂;④以固碳微生物为底盘细胞创建新产物合成途径,代谢重编程以提高目标产物流量;⑤创建新型固碳底盘细胞,即改造现有的工业异养微生物(如大肠杆菌)成为自养微生物,建立基于CO2等一碳资源利用的新产业,实现“多源化”的生物制造。
致谢:上海交通大学陶飞博士对综述的撰写提出了诸多宝贵建议,在此表示感谢。
[1] LIEW F M,MARTIN M E,TAPPEL R C,et al.Gas fermentation:a flexible platform for commercial scale production of low-carbon-fuels and chemicals from waste and renewable feedstocks[J].Front Microbiol,2016,7:694.
[2] NEVIN K P,WOODARD T L,FRANKS A E,et al.Microbial electrosynthesis:feeding microbes electricity to convert carbon dioxide and water to multicarbon extracellular organic compounds[J].MBio,2010,1(2):542-546.
[3] WANG B,LI Y,WU N,et al.CO2bio-mitigation using microalgae[J].Appl Microbiol Biotechnol,2008,79(5):707-718.
[4] SOUPENE E,INWOOD W,KUSTU S.Lack of the Rhesus protein Rh1 impairs growth of the green algaChlamydomonasreinhardtiiat high CO2[J].Proc Natl Acad Sci USA,2004,101(20):7787-7792.
[5] MILLER A G,ESPIE G S,CANVIN D T.Physiological aspects of CO2and HCO3-transport by cyanobacteria:a review[J].Can J Bot,1990,68(6):1291-1302.
[6] JACOBS M H.The production of intracellular acidity by neutral and alkaline solutions containing carbon dioxide[J].Am J Physiol,1920,53(3):457-463.
[7] 姜忠义,张宁,黄彤,等.二氧化碳跨生物膜的传递机制研究进展[J].化工进展,2016,35(6):1845-1851.
[8] 刘迪秋,王继磊,葛锋,等.植物水通道蛋白生理功能的研究进展[J].生物学杂志,2009,26(5):63-66.
[9] 冉昆,魏树伟,王宏伟,等.22种植物水孔蛋白理化性质及其结构特征的生物信息学分析[J].植物生理学报,2015(1):97-104.
[10] 王晶,桑建利.水通道蛋白的基本结构与特异性通透机理[J].生物学通报,2011,46(2):19-22.
[11] LUNDEGARDH H.Mechanisms of absorption,transport,accumulation,and secretion of ions[J].Annu Rev Plant Physiol,1955,6(1):1-24.
[12] DANIELLI J F.The present position in the field of facilitated diffusion and selective active transport[J].Proc Symp Colston Res Soc,1954,7:1-14.
[13] ENDEWARD V,CARTRON J P,RIPOCHE P,et al.RhAG protein of the Rhesus complex is a CO2channel in the human red cell membrane[J].FASEB J,2008,22(1):64-73.
[14] UEHLEIN N,LOVISOLO C,SIEFRITZ F,et al.The tobacco aquaporin NtAQP1 is a membrane CO2pore with physiological functions[J].Nature,2003,425:734-737.
[15] SOUPENE E,KING N,FEILD E,et al.Rhesus expression in a green alga is regulated by CO2[J].Proc Natl Acad Sci USA,2002,99(11):7769-7773.
[16] BENJELLOUN F,BAKOUH N,FRITSCH J,et al.Expression of the human erythroid Rh glycoprotein(RhAG) enhances both NH3and NH4+transport in HeLa cells[J].Pflügers Arch,2005,450(3):155-167.
[17] KUSTU S,INWOOD W.Biological gas channels for NH3and CO2:evidence that Rh(Rhesus) proteins are CO2channels[J].Transfus Clin Biol,2006,13(1):103-110.
[18] KAYINGO G,BILL R M,CALAMITA G,et al.Microbial water channels and glycerol facilitators[J].Curr Topics Membranes,2001,51:335-370.
[19] TANGHE A,VAN D P,THEVELEIN J M.Why do microorganisms have aquaporins?[J].Trends Microbiol,2006,14(2):78-85.
[20] TANGHE A,KAYING G,PRIOR B A,et al.Heterologous aquaporin(AQY2-1) expression strongly enhances freeze tolerance ofSchizosaccharomycespombe[J].J Mol Microbiol Biotechnol,2005,9(1):52-56.
[21] FAY J C,MCCULLOUGH H L,SNIEGOWSK P D,et al.Population genetic variation in gene expression is associated with phenotypic variation inSaccharomycescerevisiae[J].Genome Biol,2004,5(4):R26.
[22] TANGHE A,CARBREY J M,AGRE P,et al.Aquaporin expression and freeze tolerance inCandidaalbicans[J].Appl Environ Microbiol,2005,71(10):6434-6437.
[23] RAE B D,LONG B M,BADGER M R,et al.Functions,compositions,and evolution of the two types of carboxysomes:polyhedral microcompartments that facilitate CO2fixation in cyanobacteria and some proteobacteria[J].Microbiol Mol Biol Rev,2013,77(3):357-379.
[24] SHIBATA M,KATOH H,SONODA M,et al.Genes essential to sodium-dependent bicarbonate transport in cyanobacteria[J].J Biol Chem,2002,277(21):18658-18664.
[25] PRICE G D,WOODGER F J,BADGER M R,et al.Identification of a SulP-type bicarbonate transporter in marine cyanobacteria[J].Proc Natl Acad Sci USA,2004,101(52):18228-18233.
[26] SHIBATA M,OHKAWA H,KANEKO T,et al.Distinct constitutive and low-CO2-induced CO2uptake systems in cyanobacteria:genes involved and their phylogenetic relationship with homologous genes in other organisms[J].Proc Natl Acad Sci USA,2001,98(20):11789-11794.
[27] MAEDA S,BADGER M R,PRICE G D.Novel gene products associated with NdhD3/D4-containing NDH-1 complexes are involved in photosynthetic CO2hydration in the cyanobacterium,Synechococcussp.PCC7942 [J].Mol Microbiol,2002,43(2):425-435.
[28] HIGGINS C F.ABC transporters:physiology,structure and mechanism:an overview[J].Res Microbiol,2001,152(3):205-210.
[29] OMATA T,TAKAHASHI Y,YAMAGUCHI O,et al.Structure,function and regulation of the cyanobacterial high-affinity bicarbonate transporter,BCT1[J].Funct Plant Biol,2002,29(3):151-159.
[30] MCGINN P J,PRICE G D,MALESZKA R,et al.Inorganic carbon limitation and light control the expression of transcripts related to the CO2-concentrating mechanism in the cyanobacteriumSynechocystissp.strain PCC6803[J].Plant Physiol,2003,132(2):218-229.
[31] MCGINN P J,PRICE G D,BADGER M R.High light enhances the expression of low-CO2-inducible transcripts involved in the CO2-concentrating mechanism inSynechocystissp.PCC6803[J].Plant Cell Environ,2004,27(5):615-626.
[32] REDDY K J,MASAMOTO K,SHERMAN D M,et al.DNA sequence and regulation of the gene (cbpA) encoding the 42-kilodalton cytoplasmic membrane carotenoprotein of the cyanobacteriumSynechococcussp.strain PCC7942[J].J Bacteriol,1989,171(6):3486-3493.
[33] ESPIE G S,KANDASAMY R A.Monensin inhibition of Na+-dependent HCO3-transport distinguishes it from Na+-independent HCO3-transport and provides evidence for Na+/HCO3-symport in the cyanobacteriumSynechococcusUTEX 625[J].Plant Physiol,1994,104(10):1419-1428.
[34] PRICE G D,BADGER M R,WOODGER F J,et al.Advances in understanding the cyanobacterial CO2-concentrating-mechanism (CCM):functional components,Ci transporters,diversity,genetic regulation and prospects for engineering into plants[J].J Exp Bot,2007,59(7):1441-1461.
[35] WANG H L,POSTIER B L,BUMAP R L.Alterations in global patterns of gene expression inSynechocystissp.PCC6803 in response to inorganic carbon limitation and the inactivation ofndhR,a LysR family regulator[J].J Biol Chem,2004,279(7):5739-5751.
[36] OHKAWA H,SONODA M,KATOH H,et al.The use of mutants in the analysis of the CO2-concentrating mechanism in cyanobacteria[J].Can J Bot,1998,76(6):1035-1042.
[37] BADGER M R,PRICE G D,LONG B M,et al.The environmental plasticity and ecological genomics of the cyanobacterial CO2concentrating mechanism[J].J Exp Bot,2006,57(2):249-265.
[38] BADGER M R,PRICE G D.CO2concentrating mechanisms in cyanobacteria:molecular components,their diversity and evolution[J].J Exp Bot,2003,54(383):609-622.
[39] BADGER M R,KAPLAN A,BERRY J A.Internal inorganic carbon pool ofChlamydomonasreinhardtii[J].Plant Physiol,1980,66(3):407-413.
[40] IM C S,GROSSMAN A R.Identification and regulation of high light-induced genes inChlamydomonasreinhardtii[J].Plant J,2002,30(3):301-313.
[41] MIURA K,YAMANO T,YOSHIOKA S,et al.Expression profiling-based identification of CO2-responsive genes regulated by CCM1 controlling a carbon-concentrating mechanism inChlamydomonasreinhardtii[J].Plant Physiol,2004,135(3):1595-1607.
[42] YOSHIOKA S,TANIGUCHI F,MIURA K,et al.The novel Myb transcription factor LCR1 regulates the CO2-responsive geneCah1,encoding a periplasmic carbonic anhydrase inChlamydomonasreinhardtii[J].Plant Cell,2004,16(6):1466-1477.
[43] XIANG Y B,ZHANG J,WEEKS D P.TheCia5 gene controls formation of the carbon concentrating mechanism inChlamydomonasreinhardtii[J].Proc Natl Acad Sci USA,2001,98(9):5341-5346.
[44] FUKUZAWA H,MIURA K,ISHIZAKI K,et al.Ccm1,a regulatory gene controlling the induction of a carbon-concentrating mechanism inChlamydomonasreinhardtiiby sensing CO2[J].Proc Natl Acad Sci USA,2001,98(9):5347-5352.
[45] DUANMU D,MILLER A R,HORKEN K M,et al.Knockdown of a limiting-CO2-inducible geneHLA3 decreases HCO3-transport and photosynthetic Ci affinity inChlamydomonasreinhardtii[J].Proc Natl Acad Sci USA,2009,106(14):5990-5995.
[46] YAMANO T,SATO E,IGUCHI H,et al.Characterization of cooperative bicarbonate uptake into chloroplast stroma in the green algaChlamydomonasreinhardtii[J].Proc Natl Acad Sci USA,2015,112(23):7315-7320.
[47] GAO H,WANG Y,FEI X,et al.Expression activation and functional analysis of HLA3,a putative inorganic carbon transporter inChlamydomonasreinhardtii[J].Plant J,2015,82(1):1-11.
[48] GAEDEKE N,KLEN M,KOLUKISAOGLU U H,et al.TheArabidopsisthalianaABC transporterAtMRP5 controls root development and stomata movement[J].EMBO J,2001,20(8):1875-1887.
[49] BUROW M D,CHEN Z Y,MOUTON T M,et al.Isolation of cDNA clones of genes induced upon transfer ofChlamydomonasreinhardtiicells to low CO2[J].Plant Mol Biol,1996,31(2):443-448.
[50] SPALDING M H.Microalgal carbon-dioxide-concentrating mechanisms:Chlamydomonasinorganic carbon transporters[J].J Exp Bot,2007,59(7):1463-1473.
[51] BACH L T,MACKINDER L,SCHULZ K G,et al.Dissecting the impact of CO2and pH on the mechanisms of photosynthesis and calcification in the coccolithophoreEmilianiahuxleyi[J].New Phytol,2013,199(1):121-134.
[52] RICHIER S,FIORINI S,KERROS M E,et al.Response of the calcifying coccolithophoreEmilianiahuxleyito low pH/high pCO2:from physiology to molecular level[J].Marine Biol,2011,158(3):551-560.
[53] SHEN C,DUPONT C L,HOPKINSON B M.The diversity of carbon dioxide-concentrating mechanisms in marine diatoms as inferred from their genetic content[J].J Exp Bot,2017:erx163.
[54] ROMERO M F,CHEN A P,PARKER M D,et al.The SLC4 family of bicarbonate transporters[J].Mol Aspects Med,2013,34(2):159-182.
[55] SHEIDEN M C,HOWITT S M,PRICE G D.Membrane topology of the cyanobacterial bicarbonate transporter,BicA,a member of the SulP (SLC26A) family[J].Mol Membr Biol,2010,27(1):12-22.
[56] NAKAJIMA K,TANAKA A,MATSUDA Y.SLC4 family transporters in a marine diatom directly pump bicarbonate from seawater[J].Proc Natl Acad Sci USA,2013,110(5):1767-1772.
[57] MATSUDA Y,NAKAJIMA K,TACHIBANA M.Recent progresses on the genetic basis of the regulation of CO2acquisition systems in response to CO2concentration[J].Photosynth Res,2011,109:191-203.
[58] FAN Y,HU H,LIU H.Sustainable power generation in microbial fuel cells using bicarbonate buffer and proton transfer mechanisms[J].Environ Sci Technol,2007,41(23):8154-8158.
[59] HONGO Y,IKUTA T,TAKAKI Y,et al.Expression of genes involved in the uptake of inorganic carbon in the gill of a deep-sea vesicomyid clam harboring intracellular thioautotrophic bacteria[J].Gene,2016,585(2):228-240.
[60] OFFRE P,KEROU M,SPANG A,et al.Variability of the transporter gene complement in ammonia-oxidizing archaea[J].Trends Microbiol,2014,22(12):665-675.
[61] SHEN Y W,Brown R,Wen Z Y.Enhancing mass transfer and ethanol production in syngas fermentation ofClostridiumcarboxidivoransP7 through a monolithic biofilm reactor[J].Bioresour Technol,2014,136:68-76.
[62] SHEN Y W,Brown R,Wen Z Y.Syngas fermentation ofClostridiumcarboxidivoranP7 in a hollow fiber membrane biofilm reactor:evaluating the mass transfer coefficient and ethanol production performance[J].Biochem Eng J,2014,85:21-29.
[63] KANENNAYA N A,AHN S E,PARK H,et al.Installing extra bicarbonate transporters in the cyanobacteriumSynechocystissp.PCC6803 enhances biomass production[J].Metab Eng,2015,29:76-85.
[64] DU J,FORSTER B,ROURKE L,et al.Characterisation of cyanobacterial bicarbonate transporters inE.colishows that SbtA homologs are functional in this heterologous expression system[J].PLoS ONE,2014,9(12):e115905.
[65] ZEIKUS J G,JAIN M K,ELANKOVAN P.Biotechnology of succinic acid production and markets for derived industrial products[J].Appl Microbiol Biotechnol,1999,51(5):545-552.
[66] ZHU L W,ZHANG L,WEI L N,et al.Collaborative regulation of CO2transport and fixation during succinate production inEscherichiacoli[J].Sci Rep,2015,5:17321.
[67] HAWKINS A S,MCTERNAN P M,LIAN H,et al.Biological conversion of carbon dioxide and hydrogen into liquid fuels and industrial chemicals[J].Curr Opin Biotechnol,2013,24(3):376-384.
(责任编辑 管珺)
ResearchprogressesinmicrobialtransmembranetransportofCO2
ZHANG Can1,2,YANG Gaohua1,2,JIANG Weihong1,2,GU Yang1,2
(1. Institute of Plant Physiology and Ecology,Shanghai Institutes for Biological Sciences,Chinese Academy of Sciences,Shanghai 200032,China; 2.Key Laboratory of Synthetic Biology,Chinese Academy of Sciences,Shanghai 200032,China)
CO2is the free carbon resource with large reserves in the nature.Besides the well-known plant photosynthesis,many microorganisms can fix and utilize CO2,where the first step is the transmembrane transportation of CO2into cells.Here,we summarized the current research progresses in microbial CO2transportation,especially focusing on CO2transporters and the related molecular mechanisms,as well as the strategies to improve microbial CO2utilization via engineering CO2transport.On this basis,we further proposed key scientific problems and research emphasis in this area,to provide a reference to the biological uses of CO2in the future.
microorganism; CO2; transmembrane transport; transporter; molecular mechanism
10.3969/j.issn.1672-3678.2017.06.001
2017-07-31
国家自然科学基金(31630003、31421061) ;上海市科学技术委员会科研计划(17JC1404800);国家高技术研究发展计划(863计划)(2015AA020202);中国科学院青年创新促进会优秀会员人才专项经费
张 灿(1993—),女,山东烟台人,研究方向:微生物代谢调控;*为同等贡献,共同第一作者;姜卫红(联系人),研究员,E-mail:whjiang@sibs.ac.cn;顾 阳(联系人),研究员,E-mail:ygu02@sibs.ac.cn
TK6
A
1672-3678(2017)06-0001-08
