碳一气体生物利用进展
2017-12-06胡礼珍朱佛代傅容湛
胡礼珍,王 佳,袁 波,朱佛代,费 强,傅容湛
(1.西安交通大学 化学工程与技术学院,陕西 西安 710049;2.西北大学 化工学院,陕西 西安 710069)
碳一气体生物利用进展
胡礼珍1,王 佳1,袁 波1,朱佛代1,费 强1,傅容湛2
(1.西安交通大学 化学工程与技术学院,陕西 西安 710049;2.西北大学 化工学院,陕西 西安 710069)
近年来,随着经济的快速发展和人们对于资源需求的增长,化石燃料的使用越来越多,这一方面加剧了能源的过度消耗,另一方面导致了环境污染和温室效应加重。为了在保护环境的同时有效地利用资源,越来越多的研究集中在通过细胞工厂平台进行能源和化学品的生物合成。利用特定的微生物(如嗜甲烷菌、微藻和梭菌等)可以将温室气体和合成气中的碳一成分通过发酵过程转化为能源和化学品。本文中,笔者详细讨论了不同微生物转化3种碳一气体(CH4、CO2和CO)的生物代谢途径、关键合成酶、最终代谢产物和生物转化过程的优化及放大。
碳一气体利用;生物固碳;细胞工厂;节能减排;生物转化
随着分子生物学技术和细胞工厂平台的迅速发展,人们已广泛开展了对大气废气、工业尾气和温室气体的生物开发和利用。炼钢产业中的尾气以及气化作用获得的合成气中都含有大量的CO,而温室气体(greenhouse gases,GHGs)主要包括CO2和CH4。近年来,温室气体排放量的大幅增加导致了环境的改变,为人类和其他物种带来了巨大的危害[1]。研究表明,人口和经济的增长加大了对能源的消耗,预计到21世纪中叶,消耗量将至少是目前的两倍[2]。当前,已有大量研究成果表明化石能源消耗、温室气体排放与全球环境变化之间的关系,相关结果同时指出环境变化对社会和经济等各个方面造成的影响不容忽视[3]。除此之外,煤深加工、页岩气和天然气开采、工业生产和生物质气化过程中产生的合成气被排放或低效利用,也导致了环境的变化和资源的浪费。
碳一气体(CH4、CO2和CO)的生物利用(生物固碳)是一项极具潜力和竞争力的技术,主要体现在:一方面,利用碳一气体的生物转化技术已经实现了一系列生物燃料和化学品生物合成,例如乙酸盐、异丁醇、乙醇、乙酸、单细胞蛋白和类异戊二烯烃等[4-6]。目前,基因工程菌株的研究促进了碳一气体向生物燃料和化学品的转化,降低了生产成本,部分产品已经通过了商业化生产的开发阶段(实验室阶段)。Straub等[7]对乙酸发酵菌株Acetobacteriumwoodii进行基因改造,使其在自养条件下选择性地产生乙酸盐,通过Wood-Ljungdahl 途径提升了CO2固定效率,最终乙酸盐的质量浓度达到了50 g/L,该项目由瓦克化学股份有限公司(慕尼黑,德国)和联邦教育与研究部(柏林,德国)共同赞助,隶属于生物技术2021计划(项目编号为0315192);另一方面,碳一气体的生物利用正处于发展期,从传统的菌种选育到纯培养和代谢调控、从基因工程技术的引入到气体发酵平台的搭建和优化、从实验室小试初探到产业化大规模生产等一系列重要的技术手段和方法仍需探索和改进。
本文中,笔者将对微生物转化碳一气体生物合成生物燃料和化学品的相关技术进行介绍和分析,重点讨论不同微生物转化上述3种碳一气体(CH4、CO2和CO)的生物代谢途径、关键合成酶和生物转化过程的优化及其技术经济可行性。
1 碳一气体的生物利用
1.1 CH4的生物转化
CH4是全球碳循环中一个重要组成部分,是最具开发潜力的温室气体之一。研究表明,致使全球变暖的温室气体中,CH4的比例达到了20%[8],而以20年期计算,CH4的全球变暖潜值是CO2的86倍。CH4的来源广泛(图1[9]),垃圾填埋厂厌氧降解、秸秆与粪便微生物发酵、采煤过程中都会产生CH4,而来源于天然气和石油开采的CH4占据CH4总排放量的1/3[10]。近年来,随着页岩气的发展,天然气成本显著降低。与其他高成本的碳源相比,利用天然气(CH4)生物合成燃料和化学品成为较理想的选择[11]。嗜甲烷菌(methanotrophic bacteria)则可以通过其特有的合成酶和生物代谢途径利用CH4作为其生长的碳源和能源物质,合成燃料和化学品[12-13]。
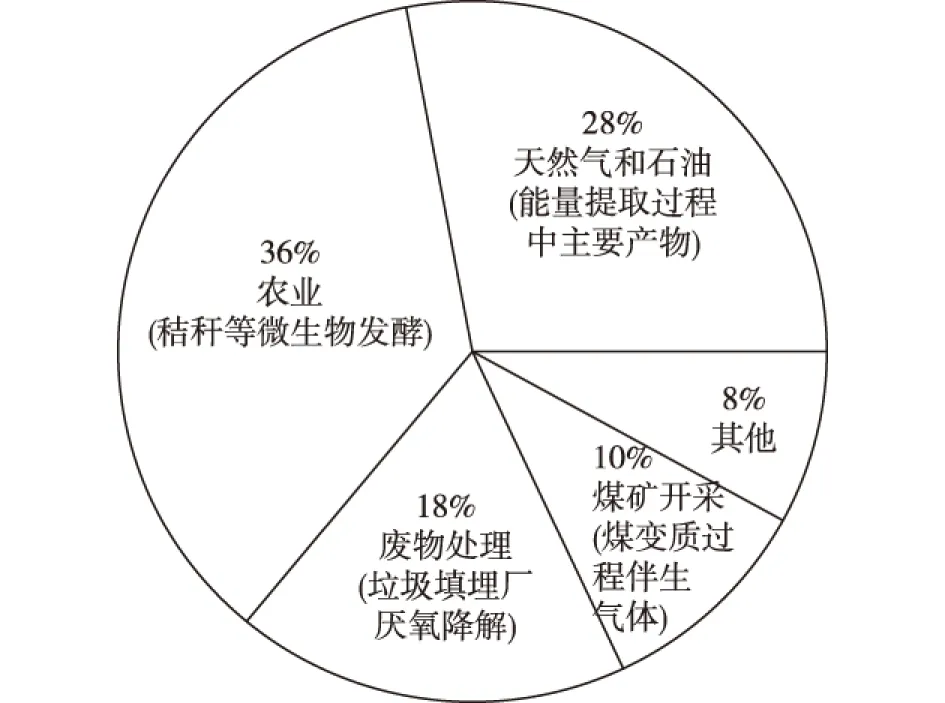
图1 美国甲烷排放来源及比例Fig.1 Methane emissions in the United States
嗜甲烷菌广泛存在于农田[14]、森林[15]、垃圾填埋场[16]、沼泽、湖泊、地下水和海洋[17]中。依据甲醛同化途径的不同,嗜甲烷菌可以分为Ⅰ型和Ⅱ型嗜甲烷菌[18]。Ⅰ型嗜甲烷菌采用核酮糖单磷酸途径(ribulose monophosphate pathway,RuMP)同化甲醛(图2[19]),Ⅱ型嗜甲烷菌则采用丝氨酸途径同化甲醛(图3[11])。

HPS—3-己酮糖-6-磷酸合酶;PHI—6-磷酸-3-己酮糖激酶图2 嗜甲烷菌核酮糖单磷酸途径(RuMP)Fig.2 Formaldehyde ribulose monophosphatepathway in bacteria
RuMP途径主要包括3个阶段:1)在3-己酮糖-6-磷酸合酶(3-hexulose-6-phosphate synthase,HPS)作用下,甲醛与5-磷酸核酮糖(ribulose 5-P,Ru5P)缩合产生6-磷酸己酮糖(hexulose 6-P,Hu6P),6-磷酸-3-己酮糖激酶(6-phospho-3-hexuloisomerase,PHI)催化Hu6P异构化产生6-磷酸果糖(fructose 6-P,F6P)[19];2)F6P断裂形成3-磷酸甘油醛(glyceraldehyde 3-P,GAP)和磷酸二羟丙酮(dihydroxyacetone phosphate,DHAP),DHAP进入细胞中心途径合成细胞组分[19];3)GAP和F6P在转酮醇酶催化下反应生成5-磷酸木酮糖(xylulose 5-P,Xu5P)和4-磷酸赤藓糖(erythrose 4-P,E4P),E4P在转醛醇酶催化下和另一个F6P反应生成7-磷酸景天庚酮糖(septulose 7-P,S7P)和GAP[19]。第三阶段的产物S7P和GAP通过醛缩酶的催化作用生成Xu5P和5-磷酸核糖(ribose 5-P,Ri5P),Xu5P和Ri5P分别在磷酸核酮糖3-差向异构酶和5-磷酸核糖异构酶的催化作用下再生成Ru5P[19]。由于RuMP途径的所有反应均是放能的,所以同化甲醛的效率比丝氨酸途径或核酮糖二磷酸途径高[20]。
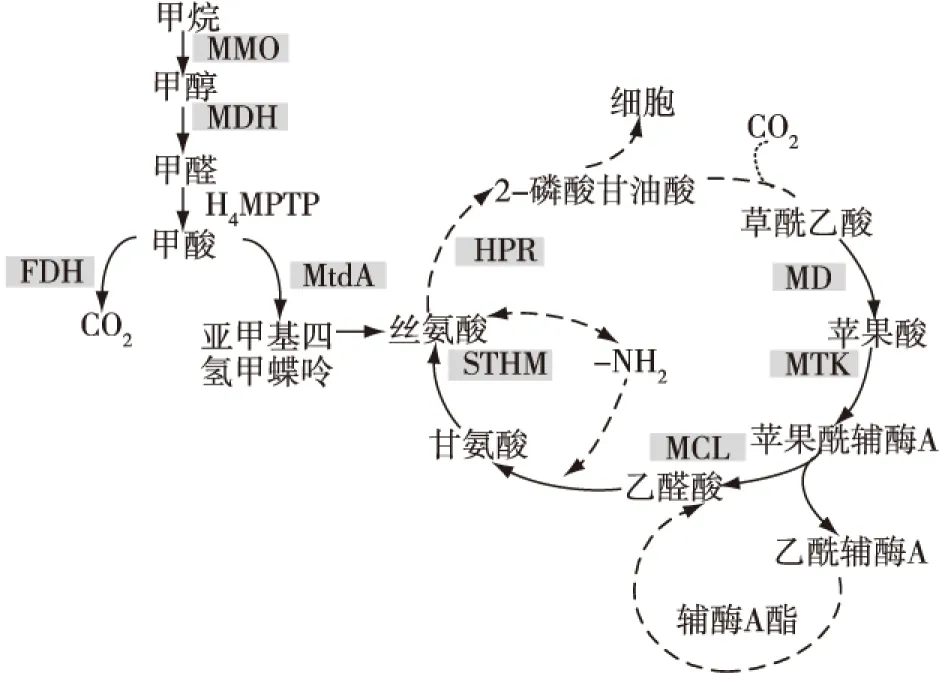
虚线箭头表示用于生物合成反应代谢物可能的出口点,带阴影英文缩写为关键酶。MDH—甲醇脱氢酶;H4MPTP—亚甲基四氢;MtdA—亚甲基四氢甲蝶呤脱氢酶;FDH—甲酸脱氢酶;STHM—丝氨酸羟甲基转移酶;HPR—羟丙酮酸还原酶;MD—苹果酸脱氢酶;MTK—苹果酸硫激酶;MCL—苹果酰辅酶A裂解酶图3 丝氨酸途径同化甲醛Fig.3 Serine pathway for formaldehyde assimilation
丝氨酸循环开始于亚甲基四氢叶酸的羟基化反应及甘氨酸合成丝氨酸的反应[21],丝氨酸进一步转化生成2分子2-磷酸甘油酸,其中1分子被同化进入细胞,1分子转化生成磷酸烯醇丙酮酸,后者通过羧化作用产生草酰乙酸,接着生成苹果酸和苹果酰辅酶A,在苹果酰辅酶A裂解酶的作用下,苹果酰辅酶A生成乙醛酸和乙酰-辅酶A。乙酰-辅酶A通过乙丙基甲酰亚胺途径的氧化作用完成了这一氧化过程[22]。
嗜甲烷菌中的特定酶——甲烷单加氧酶(methane monooxygenases,MMO)具有催化甲烷氧化生成甲醇的作用(图4[23])。MMO具有2种不同的类型:存在于细胞质中可溶性的单加氧化酶(soluble methane monooxygenases,sMMO)以及与膜结合颗粒状的单加氧化酶(particulate methane m o n o o x y g e n a s e s,pMMO)[24]。目前,许多研究集中在甲烷单加氧化酶的结构与功能上,探讨其活性位点及代谢机制[25-27]。不同的单加氧化酶具有不同的最适反应条件,包括温度、pH和溶液中离子的种类等。Culpepper等[25]研究发现,如果铜离子的浓度较高,则pMMO的活性将会占主导地位,而sMMO只有在低铜离子浓度时才能高效表达。但需要注意的是,MMO催化甲烷氧化生成甲醇的过程具有O2依赖性。Hakemian等[26]研究发现:在O2受限的条件下,嗜甲烷菌生长不受影响,同时会促进甲烷向其他产品和H2的转化(图5[26])。嗜甲烷菌具有独特的代谢途径和关键合成酶系可以利用CH4作为唯一碳源合成生物燃料及化学品,为实现高效碳一气体工业生物转化提供新策略。
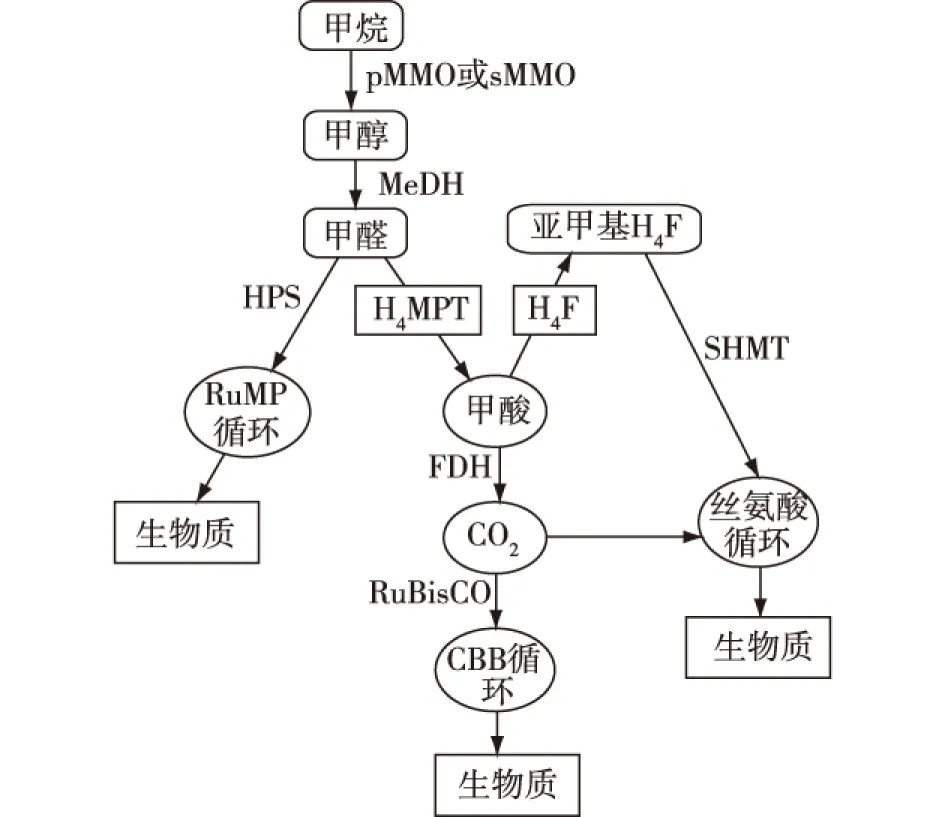
H4F—四氢叶酸通路;H4MPT—四氢青opter素途径;MeDH—甲醇脱氢酶;RuBisCO—核酮糖1,5-二磷酸羧化酶图4 甲烷催化氧化过程概述Fig.4 Overview of methane oxidation
1.2 CO2的生物转化
随着人口和经济的快速增长,产生和排放到大气中的CO2数量在不断地上升[28],其中绝大部分来源于化石燃料的燃烧。当前,化石燃料燃烧释放的CO2总量可以达到7×109t,而大气中所含的CO2年均浓度推测值在2016年已超过400×10-6(每百万400单位)[10]。若CO2的排放量按照当前的速度继续上升,到2050年其释放量会是现在的2倍[10]。温室效应已导致全球温度上升、冰川融化、生物栖息地毁灭和海平面上升,未来将直接对人类和其他生物的生存造成威胁。
藻类含有叶绿体和光合色素,可以通过光合作用固定CO2(图6)。微藻具有较高的产油能力,因此在生产第三代生物燃料方面具有很大的应用潜力[29]。微藻产油主要利用光合作用,代谢CO2作为碳源转化为油脂,最后通过物理或化学方法将细胞内的油脂提取并精炼加工成生物燃料[30]。微藻油脂中还富含多不饱和脂肪酸,是许多生物生长必需的营养物质,比如二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)在水产养殖方面可以促进鱼、虾和双壳类动物的生长发育[31]。
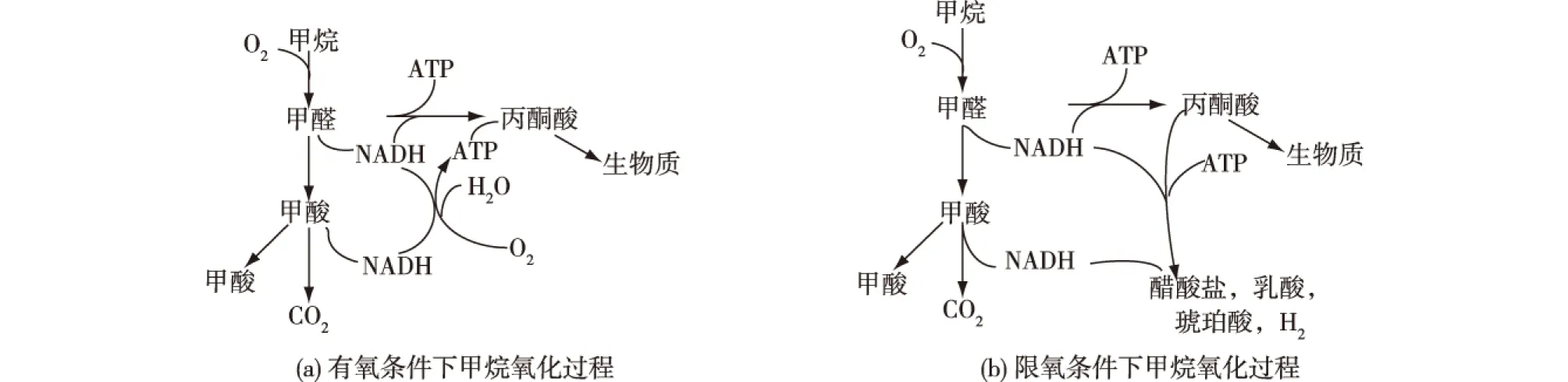
图5 M. alcaliphilum 20Z的甲烷氧化过程Fig.5 Methane oxidation process in M. alcaliphilum 20Z
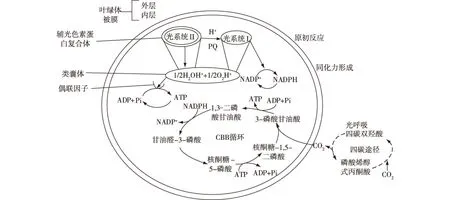
NADP+—辅酶Ⅱ;NADPH—还原辅酶Ⅱ;ADP—二磷酸腺苷;ATP—三磷酸腺苷;Pi—磷酸盐图6 光合作用各阶段与叶绿体结构联系示意Fig.6 Photosynthesis and the structure of chloroplast
光合作用的光反应阶段(Hill reaction,希尔反应),首先发生的是原初反应,吸收和传递光能到由光合色素组成的光反应中心。随后光反应中心的光系统I(PSI)和光系统II(PSII)区域进行电子传递,进而在与光合磷酸化偶联的过程中产生能量,光反应的终产物包括O2、NADPH和ATP等。在暗反应阶段(卡尔文循环,Calvin-Benson-Bassham,CBB),固定CO2并利用光反应阶段的产物NADPH和ATP,通过草酰乙酸(C4)循环生成糖。
在CBB循环中,核酮糖-1,5-二磷酸羧化酶(ribulose-1,5-bisphosphate carboxylase/o x y g e nase,RuBP羧化酶)是该反应的关键酶,是催化反应的起始。核酮糖-1,5-二磷酸易分解成2个3-磷酸甘油酸(PGA),PGA接着形成甘油醛-3-磷酸(glyceraldehyde-3-phosphate,G3P),G3P通过一系列的反应实现核酮糖-1,5-二磷酸的再生。CO2与磷酸烯醇丙酮酸在磷酸烯醇丙酮酸羧化酶(phosphoenolpyruvate carboxylase,PEPC)作用下转化成C4,后者在维管束鞘细胞中又可释放出CO2,循环供给RuBP羧化酶利用。C4循环的目的是通过控制CO2储存与释放,保证光合作用效率最大。
1.3 合成气的生物转化
除炼钢厂产生的尾气外,秸秆等生物质的气化过程也可以产生大量以CO为主要成分的合成气[32]。合成气中的CO通常占30%~60%,而随着气化条件的不同,也会伴随着CO2和CH4等碳一气体的生成。部分微生物如梭状芽孢杆菌则可以利用合成气中的碳一气体作为碳源合成乙醇和高级醇等化学品[33]。微生物代谢合成气生物合成乙醇为厌氧气体发酵过程,与化学方法相比,生物转化合成气生产乙醇发酵具有节能、节耗、产物纯度高和生产安全性好等特点[34-35]。此外,生物转化合成气生产乙醇与原先尾气燃烧发电相比,效益明显提高。而生物乙醇作为一种清洁能源,在欧美等国家被广泛用作汽车燃料。但我国出于粮食安全原因,已停止玉米提炼生物乙醇的新项目。因此,合成气合成乙醇,不仅节约了粮食资源,同时也降低了生产成本。
嗜温性微生物比如梭菌属(芽孢杆菌科的一种)可以将合成气发酵生成生物燃料和化学品,该类型微生物的最适生长温度在37 ℃左右,pH偏中性。除此之外,一些嗜热性微生物比如Moorellathemoacetica,可以将CO转化成乙酸,该类型微生物生长温度在55~80 ℃。
梭状芽孢杆菌(Clostridiumljungdahlii)可以通过Wood-Ljungdahl 途径(亦称乙酰-辅酶A途径)生物转化合成气生成乙醇、乙酸、丁醇和丁酸[36]。如图7[36-37]所示,CO2在甲酸脱氢酶(FDH)作用下形成甲酸,甲酸在甲酰四氢叶酸合成酶(CDDP)的作用下形成甲酰四氢叶酸。后者在甲酰基四氢叶酸环化水解酶(FDF)的作用下,形成亚甲基四氢叶酸,接着在亚甲基四氢叶酸脱氢酶(DHC)和亚甲基四氢叶酸还原酶(MTHFR)的作用下形成甲基四氢叶酸。甲基基团在甲基转移酶(SHMT)的作用下,被转移到1个含有类咕啉协同因子、铁硫簇和类咕啉铁硫蛋白的蛋白上。甲基类咕啉铁硫蛋白和CO在一氧化碳脱氢酶(CODH)或乙酰辅酶A脱羧酶(ACC)作用下生成乙酰辅酶A。后者在磷酸乙酰转移酶(PTA)和乙酸激酶(ACK)的作用下形成乙酸,NADH将乙酸还原成乙醛,乙醛还原成乙醇。
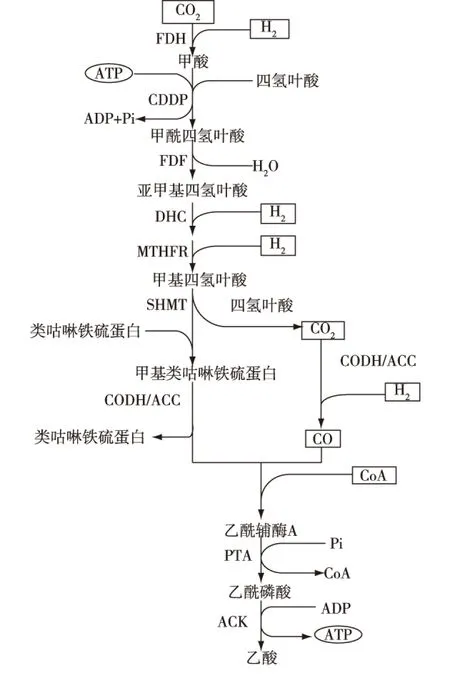
图7 Wood-Ljungdahl 代谢途径Fig.7 Wood-Ljungdahl synthetic pathway
2 科研进展、工业化程度及相关难点
2.1 微生物的改造
利用微生物(如微藻、梭菌和嗜甲烷菌)合成生物燃料和化学品已成为解决能源和环境问题的方法之一。目前,许多研究人员通过分子生物学和基因工程技术改造微生物,实现碳一气体向生物能源和化学品的高效转化[38]。
基因工程方法主要包括密码子优化、启动子选择和载体构建等,目的是提高相关合成酶的表达量及活性,充分提升酶在微生物发酵过程中的催化效率。Henard等[39]在嗜甲烷菌中合成磷酸转酮酶基因,使磷酸转酮酶在嗜甲烷菌中过表达,间接提高了生物合成途径的关键中间体乙酰辅酶A的生成量,为CH4转化生成生物能源和化学品提供了一种经济可行的途径[39]。微藻生物技术的发展促进了转基因微藻工业的应用,许多公司已通过微藻细胞工厂平台生产出一些有价值的代谢物,如脂肪酸和药物蛋白[40]。
2.2 工艺优化
发酵过程需要综合考虑众多因素的影响:底物发酵效率的影响、气液生物质的转移对发酵速率的影响以及温度、pH和溶氧对发酵过程的影响。培养条件的选择是优化生物转化平台的有效方法之一,有利于微生物的生长和最终产物的合成[41]。培养条件主要涉及pH、温度和培养时间等多个方面。不同微生物生长的最适pH不同,M.buryatense5G能够在pH在6.8~10.5范围内生长,最适pH为9.5;M.alcaliphilum20Z 生长的最适pH为9.0~9.5[11]。pH也是调节底物代谢、改变生理参数和膜电位的重要参数之一[42]。相关研究表明,C.carboxidivorans通过Wood-Ljungdahl途径将合成气转化生成乙醇和高级醇,发酵过程中,pH 在4.75~6.00时可以促进酸的积累和增长,同时提高醇的生产率[32];微生物培养温度也是一个关键的参数,温度会影响菌体生长的速度、碳一气体利用效率和产物的积累。 除此之外,微生物生长过程中代谢产物可能会影响最终产物的积累,因此消除代谢产物的副效应也是优化生物转化过程的一种重要方法。过高的溶解氧抑制微藻的生长,Bilanovic等[43]将硝化细菌与微藻共培养,消除了O2的抑制作用,使得最终油脂的生产量提高了23%。
气体生物反应器的优化可以促进碳一气体高效转化为生物燃料和化学品,提高最终产物浓度。反应器的设计通常遵循两大基本准则:第一,实现单位发酵体积的高密度发酵;第二,保证较高细胞密度的前提下提高传质效率。为了最大限度提高气体的利用和转化效率,作为碳源的气体分子必须转移到气-液界面,然后通过细胞膜扩散至细胞内,从而进行代谢反应。而气液传质效率低是碳一气体高效利用和转化的主要挑战之一[11]。在利用合成气发酵过程中,气液传质速率是影响发酵效率的一个关键因素,Lee等[44]利用中空纤维素膜从每单位发酵体积所用膜面积(A/V)、水流速率(VL)和气体传输速率(Vg)3个方面优化了传质速率,CO最大的传质系数为385 L/h,最终以较低的气体供应率实现较高的传质系数。
2.3 经济分析
第一代生物炼制过程中,微生物所需碳源大多来自于可食用的农作物,而农作物作为碳源导致了食物价格的上升,最终形成食物和燃料之间的竞争关系。目前,可用的替代碳源原料包括木质纤维素或以废气为主的原料,它们作为碳源并不会产生食物燃料之间的竞争困境[32,45]。微生物发酵过程中,碳源的成本约占总成本的60%以上,因此,利用低成本的碳源(碳一气体)并提高其利用率,最终完成能源与化学品高效合成,对实现生物过程产业化有着至关重要的作用[32]。当前,利用碳一气体生物合成生物燃料和化学品的研究较多,如表1[4]所示,许多天然和重组工程产品都已在不同碳一利用微生物体内通过的厌氧和好氧发酵平台实现生物合成。
碳一气体为微生物发酵过程提供了廉价而丰富的碳源,降低了工业生产的成本。除此之外,还可以通过优化培养方案、反应器设计和提高转化效率等方面降低工业生产的总成本[44,69]。Cui等[69]采用曲面响应法(RSM)对影响油脂合成的温度、pH和甘油浓度这3个关键参数进行了研究,考察这些关键参数之间的相互效应,优化了Cryptococcuscurvatus合成油脂的培养条件,使最终油脂含量达到了38.53%。
3 结论与展望
本文主要通过介绍碳一气体的生物利用进展以及利用微生物(嗜甲烷菌、微藻和梭菌等)固定碳一气体合成能源和化学品的前沿技术,着重讨论了不同微生物的典型代谢途径、关键合成酶、最终理想产物和生产工艺的优化与放大,最后展望了碳一生物利用的经济性和发展方向。21世纪,随着工业生物制造业的崛起,开发新颖的生物转化平台和降低生产成本已成为其是否能持续发展的当务之急[70]。微生物固定碳一气体合成生物燃料和化学品还会面临如原料的收集、微生物的改造、代谢路径的选择、发酵条件的优化等多个技术方面的挑战。从生物工程的角度来看,新型合成酶的发现与设计、微生物代谢途径的优化和碳一生物转化平台改良,将会促进碳一气体合成生物燃料和化学品相关研究的进一步发展。
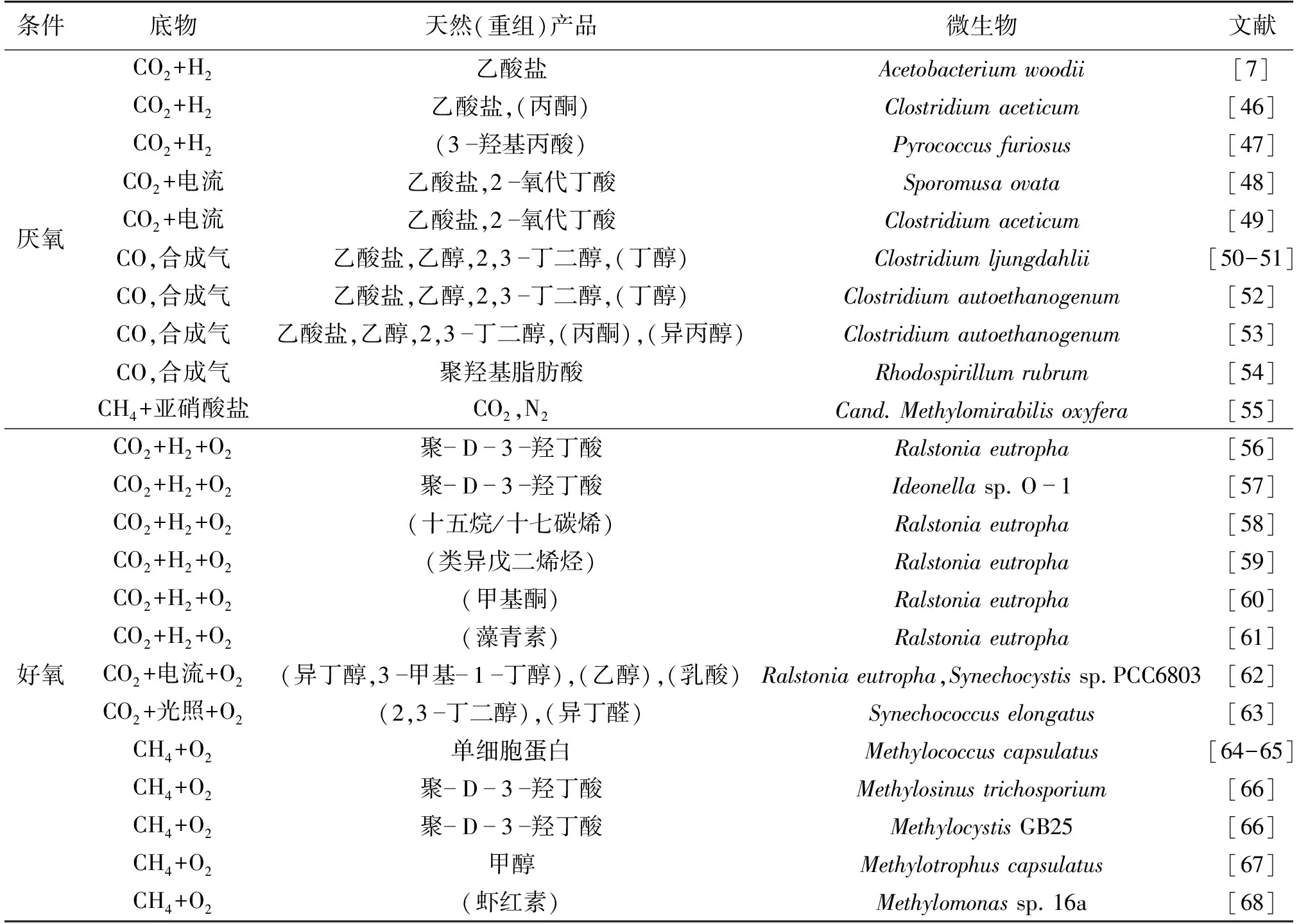
表1 碳一气体生产生物燃料和化合物
[1] HANSEN J,SATO M,KHARECHA P,et al.Climate change and trace gases[J].Philos Trans A Math Phys Eng Sci,2007,365:1925-1954.
[2] LEWIS N S,NOCERA D G.Powering the planet:chemical challenges in solar energy utilization[J].Proc Natl Acad Sci USA,2006,103(43):15729-15735.
[3] CAMPEAU A,DEL GIORGIO P A.Patterns in CH4and CO2concentrations across boreal rivers:major drivers and implications for fluvial greenhouse emissions under climate change scenarios[J].Glob Chang Biol,2014,20(4):1075-1088.
[4] DURRE P,EIKMANNS B J.C1-carbon sources for chemical and fuel production by microbial gas fermentation[J].Curr Opin Biotechnol,2015,35:63-72.
[5] DUAN C,LUO M,XING X.High-rate conversion of methane to methanol byMethylosinustrichosporiumOB3b[J].Bioresour Technol,2011,102(15):7349-7353.
[6] HAN B,SU T,WU H,et al.Paraffin oil as a "methane vector" for rapid and high cell density cultivation ofMethylosinustrichosporiumOB3b[J].Appl Microbiol Biotechnol,2009,83(4):669-677.
[7] STRAUB M,DEMLER M,WEUSTER-BOTZ D,et al.Selective enhancement of autotrophic acetate production with genetically modifiedAcetobacteriumwoodi[J].J Biotechnol,2014,178:67-72.
[8] YVON-DUROCHER G,ALLEN A P,BASTVIKEN D,et al.Methane fluxes show consistent temperature dependence across microbial to ecosystem scales[J].Nature,2014,507:488-491.
[9] 《中外能源》编辑部.美国开始出台减少甲烷排放的战略计划[J].中外能源,2014,19(7):100.
[10] LIAO J C,MI L,PONTRELLI S,et al.Fuelling the future:microbial engineering for the production of sustainable biofuels[J].Nat Rev Microbiol,2016,14(5):288-304.
[11] FEI Q,GUARNIERI M T,TAO L,et al.Bioconversion of natural gas to liquid fuel:opportunities and challenges[J].Biotechnol Adv,2014,32(3):596-614.
[12] BORGWARDT R H.Biomass and natural gas as co-feedstocks for production of fuel for fuel-cell vehicles[J].Biomass Bioenergy,1997,12(5):333-345.
[13] 蔡朝阳,何崭飞,胡宝兰.甲烷氧化菌分类及代谢途径研究进展[J].浙江大学学报(农业与生命科学版),2016,42(3):273-281.
[14] ELLER G,FRENZEL P.Changes in activity and community structure of methane-oxidizing bacteria over the growth period of rice[J].Appl Environ Microbiol,2001,67(6):2395-2403.
[15] BOURNE D G,MCDONALD I R,MURRELL J C.Comparison of pmoA PCR primer sets as tools for investigating methanotroph diversity in three Danish soils[J].Appl Environ Microbiol,2001,67(9):3802-3809.
[16] WISE M G,MCARTHUR J V,SHIMKETS L J.Methylosarcinafibratagen.nov.,sp.nov.andMethylosarcinaquisquiliarumsp.nov.,novel type 1 methanotrophs[J].Int J Syst Evol Microbiol,2001,51(2):611-621.
[17] DE ANGELIS M A,BAROSS J A,LILLEY M D.Enhanced microbial methane oxidation in water from a deep-sea hydrothermal vent field at simulated in situ hydrostatic pressures[J].Limnol Oceanogr,1991,36(3):565-570.
[18] KHADEM A F,POL A,WIECZOREK A,et al.Autotrophic methanotrophy in verrucomicrobia:MethylacidiphilumfumariolicumSolV uses the Calvin-Benson-Bassham cycle for carbon dioxide fixation[J].J Bacteriol,2011,193(17):4438-4446.
[19] 宋中邦,陈丽梅,李昆志,等.细菌的核酮糖单磷酸途径与甲醛同化作用[J].微生物学报,2007,7(1):168-172.
[20] KATO N,YURIMOTO H,THAUER R K.The physiological role of the ribulose monophosphate pathway in bacteria and archaea[J].Biosci Biotechnol Biochem,2006,70(1):10-21.
[21] 金晶,吴婉欣,陈雯雯,等.微生物甲醛代谢途径的研究进展[J].吉林农业(学术版),2011(4):70-72.
[22] SCHNEIDER K,PEYRAUD R,KIEFER P,et al.The ethylmalonyl-CoA pathway is used in place of the glyoxylate cycle byMethylobacteriumextorquensAM1 during growth on acetate[J].J Biol Chem,2012,287(1):757-766.
[23] KALYUZHNAYA M G,PURI A W,LIDSTROM M E.Metabolic engineering in methanotrophic bacteria[J].Metab Eng,2015,29:142-152.
[24] SIRAJUDDIN S,ROSENZWEIG A C.Enzymatic oxidation of methane[J].Biochemistry,2015,54(14):2283-2294.
[25] CULPEPPER M A,ROSENZWEIG A C.Architecture and active site of particulate methane monooxygenase[J].Crit Rev Biochem Mol Biol,2012,47(6):483-492.
[26] HAKEMIAN A S,ROSENZWEIG A C.The biochemistry of methane oxidation[J].Annu Rev Biochem,2007,76:223-241.
[27] KALYUZHNAYA M G,YANG S,ROZOVA O N,et al.Highly efficient methane biocatalysis revealed in a methanotrophic bacterium[J].Nat Commun,2013,4:2785.
[28] HUNT A J,SIN E H,MARRIOTT R,et al.Generation,capture,and utilization of industrial carbon dioxide[J].ChemSusChem,2010,3(3):306-322.
[29] CHEN C Y,YEH K L,AISYAH R,et al.Cultivation,photobioreactor design and harvesting of microalgae for biodiesel production:a critical review[J].Bioresour Technol,2011,102(1):71-81.
[30] MCGINN P J,DICKINSON K E,BHATTI S,et al.Integration of microalgae cultivation with industrial waste remediation for biofuel and bioenergy production:opportunities and limitations[J].Photosynth Res,2011,109(1/2/3):231-247.
[31] 吴云辉,林武杰.海洋微藻多不饱和脂肪酸研究进展[J].渔业研究,2013,35(1):78-82.
[32] FERNANDEZ-NAVEIRA A,ABUBACKAR H N,VEIGA M C,et al.Production of chemicals from C1 gases(CO,CO2) byClostridiumcarboxidivorans[J].World J Microbiol Biotechnol,2017,33(3):43.
[33] HENSTRA A M,SIPMA J,RINZEMA A,et al.Microbiology of synthesis gas fermentation for biofuel production[J].Curr Opin Biotechnol,2007,18(3):200-206.
[34] KLASSON K T,ACKERSON M D,CLAUSEN E C,et al.Bioconversion of synthesis gas into liquid or gaseous fuels[J].Enzyme Microb Technol,1992,14(8):602-608.
[35] RAGAUSKAS A J,WILLIAMS C K,DAVISON B H,et al.The path forward for biofuels and biomaterials[J].Science,2006,311:484-489.
[36] 张兰波,刘继开,李东,等.合成气乙醇发酵的微生物研究[J].可再生能源,2007,25(3):27-30.
[37] DANIELL J,K PKE M,SIMPSON S.Commercial biomass syngas fermentation[J].Energies,2012,5(12):5372-5417.
[38] LAN E I,LIAO J C.Microbial synthesis ofn-butanol,isobutanol,and other higher alcohols from diverse resources[J].Bioresour Technol,2013,135:339-349.
[39] HENARD C A,SMITH H K,GUARNIERI M T.Phosphoketolase overexpression increases biomass and lipid yield from methane in an obligate methanotrophic biocatalyst[J].Metab Eng,2017,41:152-158.
[40] COURCHESNE N M,PARISIEN A,WANG B,et al.Enhancement of lipid production using biochemical,genetic and transcription factor engineering approaches[J].J Biotechnol,2009,141(1/2):31-41.
[41] FAN J,YAN C,ANDRE C,et al.Oil accumulation is controlled by carbon precursor supply for fatty acid synthesis inChlamydomonasreinhardtii[J].Plant Cell Physiol,2012,53(8):1380-1390.
[42] MOHAMMADI M,NAJAFPOUR G D,YOUNESI H,et al.Bioconversion of synthesis gas to second generation biofuels:a review[J].Renew Sustainable Energy Rev,2011,15(9):4255-4273.
[43] BILANOVIC D,HOLLAND M,STAROSVETSKY J,et al.Co-cultivation of microalgae and nitrifiers for higher biomass production and better carbon capture[J].Bioresour Technol,2016,220:282-288.
[44] LEE P H,NI S Q,CHANG S Y,et al.Enhancement of carbon monoxide mass transfer using an innovative external hollow fiber membrane(HFM) diffuser for syngas fermentation:experimental studies and model development[J].Chem Eng J,2012,184:268-277.
[45] ZHANG W,ZHANG T,WU S,et al.Guidance for engineering of synthetic methylotrophy based on methanol metabolism in methylotrophy[J].RSC Adv,2017,7(7):4083-4091.
[46] BECKER U,GRUND G,ORSCHEL M,et al.Zellen und verfahren zur herstellung von aceton:DE,102009002583[P].2010-10-28.
[47] KELLER M W,SCHUT G J,LIPSCOMB G L,et al.Exploiting microbial hyperthermophilicity to produce an industrial chemical,using hydrogen and carbon dioxide[J].Proc Natl Acad Sci USA,2013,110(15):5840-5845.
[48] NEVIN K P,WOODARD T L,FRANKS A E,et al.Microbial electrosynthesis:feeding microbes electricity to convert carbon dioxide and water to multicarbon extracellular organic compounds[J].MBio,2010,1(2):e00103-10.
[49] NEVIN K P,HENSLEY S A,FRANKS A E,et al.Electrosynthesis of organic compounds from carbon dioxide is catalyzed by a diversity of acetogenic microorganisms[J].Appl Environ Microbiol,2011,77(9):2882-2886.
[50] KOEPKE M,HELD C,HUJER S,et al.Clostridiumljungdahliirepresents a microbial production platform based on syngas[J].Proc Natl Acad Sci USA,2010,107(29):13087-13092.
[51] KOPKE M,MIHALCEA C,LIEW F,et al.2,3-Butanediol production by acetogenic bacteria,an alternative route to chemical synthesis,using industrial waste gas[J].Appl Environ Microbiol,2011,77(15):5467-5475.
[52] KOEPKE M,LIEW F.Production of butanol from carbon monoxide by a recombinant microorganism:WO,2012053905[P].2012-04-26.
[53] SIMPSON S D,KOPKE M,LIEW F,et al.Recombinant microorganisms and uses therefore:WO,2012115527[P].2013-01-10.
[54] DO Y S,SMEENK J,BROER K M,et al.Growth ofRhodospirillumrubrumon synthesis gas:conversion of CO to H2and poly-β-hydroxyalkanoate[J].Biotechnol Bioeng,2007,97(2):279-286.
[55] ETTWIG K F,BUTLER M K,LE PASLIER D,et al.Nitrite-driven anaerobic methane oxidation by oxygenic bacteria[J].Nature,2010,464:543-548.
[56] VOLOVA T G,TRUSOVA M Y,KALACHEVA G S,et al.Physiological-biochemical properties and the ability to synthesize polyhydroxyalkanoates of the glucose-utilizing strain of the hydrogen bacteriumRalstoniaeutrophaB8562[J].Appl Microbiol Biotechnol,2006,73(2):429-433.
[57] TANAKA K,MIYAWAKI K,YAMAGUCHI A,et al.Cell growth and P(3HB) accumulation from CO2of a carbon monoxide-tolerant hydrogen-oxidizing bacterium,Ideonellasp.O-1[J].Appl Microbiol Biotechnol 2011,92:1161-1169.
[58] BI C,SU P,MULLER J,et al.Development of a broad-host synthetic biology toolbox forRalstoniaeutrophaand its application to engineering hydrocarbon biofuel production[J].Microb Cell Fact,2013,12:107.
[59] KHAN N E,MYERS J A,TUERK A L,et al.A process economic assessment of hydrocarbon biofuels production using chemoautotrophic organisms[J].Bioresour Technol,2014,172:201-211.
[60] MULLER J,MACEACHRAN D,BURD H,et al.Engineering ofRalstoniaeutrophaH16 for autotrophic and heterotrophic production of methyl ketones[J].Appl Environ Microbiol,2013,79(14):4433-4439.
[61] LUTTE S,POHLMANN A,ZAYCHIKOV E,et al.Autotrophic production of stable-isotope-labeled arginine inRalstoniaeutrophastrain H16[J].Appl Environ Microbiol,2012,78(22):7884-7890.
[62] LI H,OPGENORTH P H,WERNICK D G,et al.Integrated electromicrobial conversion of CO2to higher alcohols[J].Science,2012,335:1596.
[63] GAO Z,ZHAO H,LI Z,et al.Photosynthetic production of ethanol from carbon dioxide in genetically engineered cyanobacteria[J].Energy Environ Sci,2012,5:9857-9865.
[64] ATSUMI S,HIGASHIDE W,LIAO J C.Direct photosynthetic recycling of carbon dioxide to isobutyraldehyde[J].Nat Biotechnol,2009,27(12):1177-1180.
[65] OLIVER J W,MACHADO I M,YONEDA H,et al.Cyanobacterial conversion of carbon dioxide to 2,3-butanediol[J].Proc Natl Acad Sci USA,2013,110(4):1249-1254.
[66] KHOSRAVI-DARANI K,MOKHTARI Z B,AMAI T,et al.Microbial production of poly(hydroxybutyrate) from C1carbon sources[J].Appl Microbiol Biotechnol,2013,97(4):1407-1424.
[67] HWANG I Y,LEE S H,CHOI Y S,et al.Biocatalytic conversion of methane to methanol as a key step for development of methane-based biorefineries[J].J Microbiol Biotechnol,2014,24(12):1597-1605.
[68] TAO L,SEDKOVA N,YAO H,et al.Expression of bacterial hemoglobin genes to improve astaxanthin production in a methanotrophic bacteriumMethylomonassp.[J].Appl Microbiol Biotechnol,2007,74(3):625-633.
[69] CUI Y,BLACKBURN J W,LIANG Y.Fermentation optimization for the production of lipid byCryptococcuscurvatus:use of response surface methodology[J].Biomass Bioenergy,2012,47:410-417.
[70] CLOMBURG J M,CRUMBLEY A M,GONZALEZ R.Industrial biomanufacturing:the future of chemical production[J].Science,2017,355:aag0804.
(责任编辑 荀志金)
ProductionofbiofuelsandchemicalsfromC1gasesbymicroorganisms:statusandprospects
HU Lizhen1,WANG Jia1,YUAN Bo1,ZHU Fodai1,FEI Qiang1,FU Rongzhan2
(1.School of Chemical Engineering and Technology,Xi'an Jiaotong University,Xi′an 710049,China;2.School of Chemical Engineering,Northwest University,Xi′an 710069,China)
With the rapid economic development and the growth in demand for resources,the combustion of fossil fuels has resulted in an increase in greenhouse gases (GHGs),that are closely associated with environmental pollution and global warming.Greenhouse gases (CH4and CO2) and syngas (CO) can be used effectively for the production of biofuels and chemicals by microorganisms.In this review,we discuss various microorganisms including methanotroph,microalgae,and clostridium capable of converting C1 gaseous substrates (CH4,CO2and CO) into biofuels and chemicals.We also outline multiple biological and metabolic pathways as well as the optimization of bioconversion processes.A preliminary economic analysis presents a great potential of bioconversion of C1 gaseous substrates into biofuels and chemicals in terms of production cost and greenhouse gas emission reduction.
C1 gases utilization;carbon biofixation;cell factory;greenhouse gases emission reduction;bioconversion
10.3969/j.issn.1672-3678.2017.06.003
2017-09-03
陕西省重点研发计划(2017GY-146)
胡礼珍(1989—),女,江苏宿迁人,博士研究生,研究方向:生物固碳;费 强(联系人),教授,博士生导师,E-mail:feiqiang@xjtu.edu.cn
Q819; X701
A
1672-3678(2017)06-0017-09
